
中国海洋湖沼学会主办。
文章信息
- 孙伟恒, 孙志宾, 王新安, 马爱军, 李迎娣, 苟冬惠, 于宏, 李昊喆, Vorathep Muthuwan, 曲江波, 洪宜展. 2024.
- SUN Wei-Heng, SUN Zhi-Bin, WANG Xin-An, MA Ai-Jun, LI Ying-Di, GOU Dong-Hui, YU Hong, LI Hao-Zhe, Vorathep Muthuwan, QU Jiang-Bo, HONG Yi-Zhan. 2024.
- 眼斑双锯鱼(Amphiprion ocellaris)发育中体色花纹时序发生的色素细胞变化和控制基因表达的分析Ⅰ. 胚胎时期
- ANALYSIS OF PIGMENT CELL CHANGES AND CONTROL GENES EXPRESSION IN THE DEVELOPMENT OF BODY COLOR PATTERN OF AMPHIPRION OCELLARIS: Ⅰ. EMBRYONIC PERIOD
- 海洋与湖沼, 55(2): 489-498
- Oceanologia et Limnologia Sinica, 55(2): 489-498.
- http://dx.doi.org/10.11693/hyhz20230900194
文章历史
-
收稿日期:2023-09-26
收修改稿日期:2024-01-04
2. 海水养殖生物育种与可持续产出全国重点实验室 中国水产科学研究院黄海水产研究所 中国-东盟海水养殖技术"一带一路"联合实验室(青岛) 山东青岛 266071;
3. 布拉帕大学海洋科学研究所 泰国春武里 20131;
4. 烟台开发区天源水产有限公司 山东烟台 264006;
5. 海南省展渔生物科技有限公司 海南乐东 572536
2. National Key Laboratory of Mariculture Biobreeding and Sustainable Goods, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, China-ASEAN Belt and Road Joint Laboratory on Mariculture Technology (Qingdao), Qingdao 266071, China;
3. The Institute of Marine Science, Burapha University, Chonburi 20131, Thailand;
4. Yantai Tianyuan Aquatic Co., Ltd., Yantai 264006, China;
5. Hainan Zhanyu Biotechnology Co., Ltd., Ledong 572536, China
鱼类体色和花纹的不同色素模式对鱼类的环境适应具有重要意义, 影响着鱼类的聚集、躲避敌害、警告猎食者或竞争者及性选择(Hubbard et al, 2010)。鱼类中已发现6种色素细胞: 黑色素细胞、红色素细胞、黄色素细胞、虹彩细胞、白色素细胞以及蓝色素细胞等(Kelsh, 2004)。鱼类体表色素细胞出现的时期和发育过程在不同的鱼类中存在很大差异: 锦鲤、泥鳅的胚胎期未观察到色素细胞的出现, 红黑锦鲤在出膜8 d后才开始出现黑色素细胞(殷浩然等, 2019); 红色锦鲤刚出膜的仔鱼呈现无色透明状态, 后期逐渐出现黑色素细胞、黄色素细胞、红色素细胞, 最终发育成红色表型(田雪等, 2017); 泥鳅在孵化22 h后才观察到眼黑色素细胞, 1日龄后观察到体表出现黑色素细胞(盛斌, 2022); 而红色鲫鱼在胚胎时期就观察到黑色素细胞的出现(张永勤, 2018)。在前期研究中, 我们发现小丑鱼色素细胞的发生时期不同于其他鱼类, 在胚胎的体节期就开始出现黑色素细胞, 黑色素细胞的数量随着生长发育逐渐增多, 少量的红色素细胞和虹彩色素细胞在胚胎发育后期出现(李迎娣, 2022)。
鱼类的色素细胞来源于神经嵴细胞, 其在控制基因的调控下迁移分化形成各种色素细胞前体, 最终发育成各种色素细胞而形成不同的体色(Barrallo-Gimeno et al, 2004)。在神经嵴细胞迁移发育成色素细胞的过程中, 存在一系列信号调节过程, 例如WNT/β-catenin信号通路(Dorsky et al, 2000)、Mc1r/α-MSH信号通路(王天柱等, 2020)、EDN3/EDNRB信号通路(Baynash et al, 1994)等都被证明与神经嵴细胞向色素细胞分化相关。根据已有的研究, 我们发现色素细胞相关基因在胚胎发育过程中的表达量是不断变化的, 通过分析表达量的变化可以初步推测基因的功能和不同基因之间的相互作用关系, 周康奇等(2019)发现mclr基因在橘色双冠丽鱼胚胎发育的9个时期表达量逐渐减少, 推测在胚胎发育的早期阶段该基因的基础表达水平即可启动参与体色细胞形成的腺苷酸循环; Sox10基因介导神经嵴细胞的迁移, 参与Wnt信号通路的负调控(Dutton et al, 2001); Pax3基因在胚胎发育过程中起重要作用, 参与神经嵴细胞的分化(张华, 2012); 而TYR、Dct、Aim1、Ednrb、Tbx2b等基因参与黑色素细胞的形成、分化和迁移(王成辉, 2012; 孟超等, 2020); Fms基因又称为csf1r (colony stimulating factor 1 receptor)基因, 是黄色素前体细胞的标记基因(Yamanaka et al, 2014); Foxd3和Ltk基因被证明参与虹彩色素细胞的合成(Lopes et al, 2008; Zhang et al, 2017)。
小丑鱼(Amphiprioninae)是鲈形目雀鲷科双锯鱼属鱼类的统称, 是重要的热带珊瑚礁观赏鱼类, 因其艳丽的体色和可爱的外表, 深受水族爱好者的喜爱, 具有很高的观赏价值和经济价值(Marcionetti et al, 2018)。近年来有研究报道小丑鱼不同体色和花纹与色素细胞相关基因的表达有直接的关系(何丽斌等, 2022)。在小丑鱼胚胎发育的过程中, 色素细胞的形态和数量一直在变化(李迎娣, 2022), 但不同发育时期的各种色素细胞的动态变化以及色素细胞控制基因的表达情况等仍不明确。因此, 本研究选取眼斑双锯鱼(Amphiprion ocellaris)作为研究对象, 观察了眼斑双锯鱼胚胎时期色素细胞变化, 并分析了对应时期色素细胞控制基因的表达变化, 探索了眼斑双锯鱼胚胎发育过程中色素细胞变化与相关基因表达之间的关系。研究结果将为揭示眼斑双锯鱼胚胎时期的色素细胞变化的调控机制提供参考, 同时也为下一步系统地理解眼斑双锯鱼仔稚幼鱼的体色发生机制提供研究基础。
1 材料与方法 1.1 实验用鱼选取健康状况良好的野生眼斑双锯鱼(Amphiprion ocellaris)作为实验亲鱼, 经过配对后, 饲养在小型循环水观赏鱼养殖系统中的玻璃缸(50×50×45 cm)内, 光照时间设置为12D : 12L, 水温控制在27.0~28.0 ℃之间, 盐度控制在30左右, pH维持在8.1~8.4之间。每天投喂两次人工饲料。每周定期清理鱼缸中的残饵和粪便, 更换三分之一新鲜的人工海水。当亲鱼达到性成熟以后, 缸内放置瓦罐用于亲鱼产卵。
1.2 胚胎观察及样品收集首先使用显微镜(Nikon Eclipse Ci-L)观察胚胎整体在不同时间的形态, 确认胚胎的发育时期, 以及各时期的色素细胞变化, 然后选取色素细胞变化较明显的卵裂期、体节期、翻转期、血管形成期、器官形成期和孵化期6个时期的胚胎, 使用显微镜配套的VIHENT显微镜相机(VTS1000)对不同时期的胚胎进行拍照, 使用图像处理软件VistarImage v4.0对照片进行处理。每个时期取25个胚胎作为一个生物学重复(3个重复), 置于RNA保护液中, 冻存在–80 ℃冰箱, 以备后续实验使用。
1.3 体色控制基因的表达分析采用RNA提取试剂盒(TIANGEN DP419)根据操作说明书提取样品RNA, 通过1%琼脂糖凝胶电泳和Nanodrop2000检测RNA质量和浓度, 随后利用逆转录试剂盒(TransGenAT311-03)将提取的总RNA逆转录得到cDNA, 每份稀释5倍之后用实时定量PCR仪(StepOnePlus)检测基因的表达量。
根据相关报道, 选择体色控制相关的10个基因Sox10、Pax3、Ednrb、Tbx2b、TYR、Dct、Aim1、Fms、Ltk、Foxd3 (表 1), 从NCBI数据库中搜索到眼斑双锯鱼中对应的基因序列, 然后用Primer Premier 5.0设计出用于眼斑双锯鱼qPCR检测的引物(表 2)。
| 基因 | 基因名称 | 作用 |
| Sox10 | SRY-box containing gene 10 | 指示早期神经母细胞的分化(Dutton et al, 2001) |
| Pax3 | paired box 3 | 参与神经嵴细胞分化, 影响黑色素母细胞的分化和迁移(张华, 2012) |
| Ednrb | endothelin receptor type b | 促使黑色素前体细胞的增加(边芳芳, 2019) |
| Tbx2b | T-box transcription factor 2b | 调控黑色素细胞的迁移(Liu et al, 2013) |
| TYR | Tyrosinase | 调控黑色素生成(蒋燕玲等, 2016) |
| Dct | dopachrome tautomerase | 参与真黑素的合成(古珍珍, 2016) |
| Aim1 | absent in melanoma 1 | 转运蛋白, 调控黑色素的合成(Xu et al, 2013) |
| Fms | colony stimulating factor-1, csf1 | 影响黄色素前体细胞的分化(Yamanaka et al, 2014) |
| Ltk | Leukocyte tyrosine kinas | 虹彩色素细胞的标记基因(Lopes et al, 2008) |
| Foxd3 | forkhead box D3 | 调控虹彩色素细胞的分化(Zhang et al, 2017) |
| 基因 | 引物序列(5’~3’) | Tm/℃ |
| Aim1 | F: GAGGCTGAGAGGACCACAAC R: GCCGAGTATCAGCGTGAAGA |
58 |
| Dct | F: CAGACGGACAACTGGAGGAATCAG R: CGTTGGCCGCAGAGTGAGAC |
59 |
| TYR | F: TGGTTCCCTTCTTCCCTCTC R: GGTTACGCTTCCACTTCCTTC |
58 |
| Ednrb | F: GCTATTTTCTACACCCTGATGACC R: CACGAGTTGACTGACGCCA |
58 |
| Sox10 | F: CTTGATGATGAGGGACCACCG R: CCACCACCCCAAAGACAGA |
58 |
| Fms | F: AAACACGACCAACCCGAATC R: GCCACCTGAAAACTGTAGCAAA |
58 |
| Foxd3 | F: CCAGAGCCCGCAGAAAAA R: GGGGTCCAGGGTCCAGTAGTT |
60 |
| Tbx2b | F: GAGAGCAGGCACAGGAAGGA R: TGGACCACGAGAGGGGAGAA |
59 |
| Ltk | F: TAGGAGAGGATGAGGGCTTCACTTG R: GACGCAGACCAACCACAGGAATC |
57 |
| Pax3 | F: GCCCCAAAGCGACTATGCCATC R: GGTGAGACCCTCCAGACCCTTG |
57 |
| 18s | F: CGGTCGGCGTCCAACTTCTTAG R: TCTCGGCGAAGGGTAGACACAC |
60 |
以眼斑双锯鱼胚胎RNA样品逆转录得到的cDNA混合液为模板, 以挑选出的10种体色控制相关基因做普通PCR, 检测引物的特异性, 并将产物送由生工测序。根据这10对体色控制基因的引物, 以18S作为内参基因(李迎娣等, 2022), 利用qPCR技术对每个基因在不同样品中的表达量进行检测, 采用2–∆∆Ct方法对得到的Ct值进行数据分析。
1.4 统计分析利用SPSS Statistics (IBM, USA)进行单因素方差分析(ANOVA)和Dunnett方法多重比较, 结果用平均值表示(P > 0.05为差异不显著, P < 0.05为差异显著, P < 0.01为差异极显著)。
1.5 相关性分析利用Data Processing System软件对胚胎时期各体色控制基因之间的相对表达量进行相关性分析, 分析基因之间的相关性。
2 结果 2.1 眼斑双锯鱼胚胎不同发育时期色素细胞的变化观察本研究肉眼观察发现透明卵膜包裹下的胚胎整体呈现出由橙黄、暗红、黑红、黑色到最终透明一系列颜色的阶段性变化; 挑选出卵裂期、体节期、翻转期、血管形成期、器官形成期和孵化期6个色素细胞变化较为明显的时期进行显微观察, 发现眼斑双锯鱼整个胚胎发育过程中色素细胞的种类和数量是动态变化的, 其中主要是黑色素细胞(melanocyte)的形态以及数量变化较为明显, 首先观察到幼体黑色素细胞(larval melanocyte)形成, 随着生长发育幼体黑色素数量逐渐变多; 血管形成期之后幼体黑色素数量逐渐减少, 成体黑色素细胞开始出现, 呈雪花状, 规则的排列在鱼体两侧。除黑色素细胞外, 仅发现少量红色素细胞(erythrophore)和虹彩细胞(iridophore)。
受精后的胚胎在33 h内处于卵裂期(图 1a), 卵裂期时, 橘黄色卵黄约占胚胎60% (图 2), 卵黄颜色明亮含有大量油球, 此时期胚胎呈现卵黄的颜色, 整体表现为橙黄色, 卵膜无色透明。
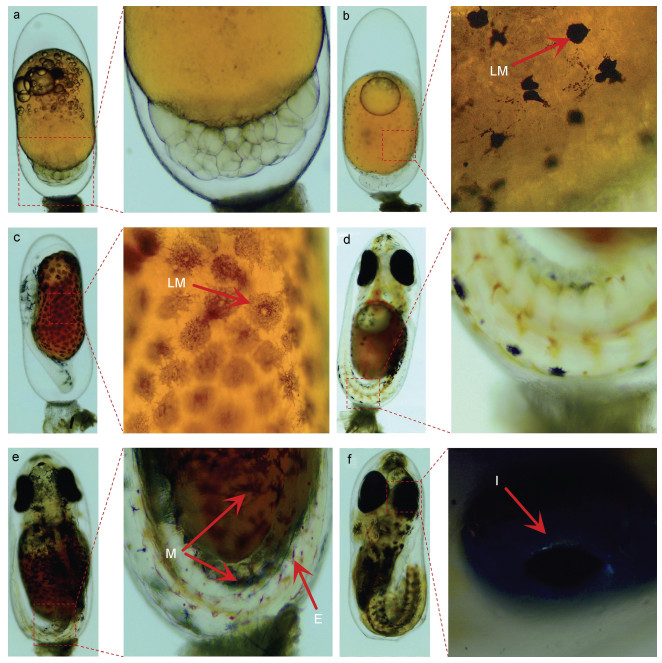 |
| 图 1 眼斑双锯鱼胚胎的不同发育时期 Fig. 1 Different embryonic development stages of A. ocellaris 注: a. 卵裂期; b. 体节期; c. 翻转期; d. 血管形成期; e. 器官形成期; f. 孵化期。M表示黑色素细胞(melanocyte), LM表示幼体黑色素细胞(larval melanocyte); E表示红色素细胞(erythrophore); I表示虹彩色素细胞(iridophore) |
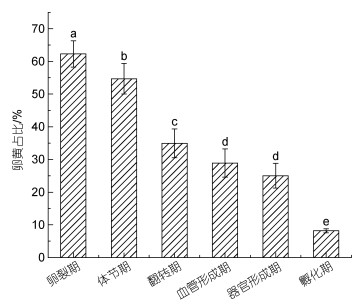 |
| 图 2 不同发育时期胚胎卵黄占比变化 Fig. 2 Changes of yolk proportion of embryos at different developmental stages |
约在产卵受精后第33 h (hours post fertilization, hpf)从卵裂期进入体节期(图 1b), 此时期幼体黑色素细胞开始出现, 主要集中在卵黄囊表面, 量较少, 呈点状, 整体的颜色呈现橙黄色, 卵黄略有缩小, 约占整个胚胎体积的55% (图 2)。
在53 hpf时, 胚胎开始发育出眼睛和尾巴, 此时处于翻转期(图 1c), 此时期黑色素细胞大量出现, 鱼体表面也开始出现黑色素细胞, 整体卵的颜色为暗红色, 卵黄约占整个胚胎的34% (图 2)。
81 hpf胚胎进入血管形成期(图 1d), 此时期卵黄囊表面幼体黑色素细胞数量不断减少, 成体黑色素细胞开始出现, 黑色素细胞大部分集中在眼睛上, 少量分布在身体上, 此时胚胎的颜色整体呈黑红色, 卵黄约占胚胎的29% (图 2), 头部到尾部血液流动迅速, 血管逐渐清晰。
在器官形成期(图 1e), 器官形成阶段发育期长, 大约需要3~4 d时间, 这一阶段需要卵黄提供大量能量, 体积明显变小, 此时眼睛发育逐渐完善, 尾部开始出现红色素细胞。显微镜下观察, 胚胎在105 hpf时可以观察到心脏跳动, 黑色素颗粒面积继续扩大使整个卵黄囊呈现黑色, 且鱼体表面上也出现了大量成体黑色素细胞, 有规则地排列在身体两侧, 卵黄约占整个胚胎的25%左右(图 2)。
眼斑双锯鱼从受精卵到孵化大约需要200 h, 进入孵化期(图 1f), 整体卵的颜色呈透明状, 卵黄中的营养物质不断被吸收, 直至全部被鱼体吸收, 黑色素细胞数量也较前几个时期明显减少, 基本集中到鱼体表面及眼睛上, 在鱼的眼睛和腹部出现大量虹彩色素细胞, 在灯光的照射下出现反光现象。
2.2 各发育时期体色控制基因的表达 2.2.1 引物特异性检测利用1%的琼脂糖凝胶电泳对普通PCR的产物进行检测, 发现这10个体色控制相关基因的引物与cDNA模板结合之后均能扩增得到单一的条带, 没有引物二聚体(图 3), 送测序公司测序后比对发现均为所需基因片段, 说明引物特异性好。
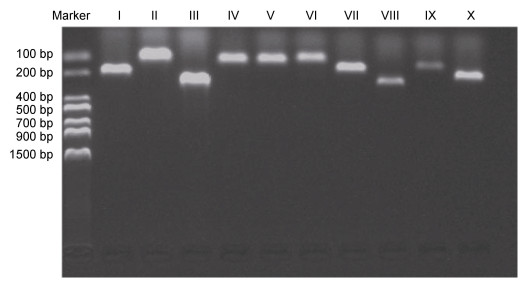 |
| 图 3 十种体色控制基因PCR产物电泳图 Fig. 3 Electrophoretic result of PCR products of ten body color-related genes 注: Ⅰ. Aim1; Ⅱ. Dct; Ⅲ. Ednrb; Ⅳ. Tbx2b; Ⅴ. Pax3; Ⅵ. Fms; Ⅶ. Sox10; Ⅷ. TYR; Ⅸ. Ltk; Ⅹ. Foxd3 |
通过对眼斑双锯鱼胚胎发育的各个时期色素细胞变化观察, 筛选出6个关键时期: 卵裂期、体节期、翻转期、血管形成期、器官形成期、孵化期, 检测10个基因在这些时期的表达情况。荧光定量PCR结果(图 4)显示, 在眼斑双锯鱼胚胎发育过程中, Sox10基因、Foxd3基因的相对表达量未出现明显变化, 其他8种体色相关基因均呈现先上升后下降的趋势(图 5); 卵裂期体色控制基因基本不表达(图 4a); 进入体节期, TYR基因、Ednrb基因的表达量显著高于其他基因(P < 0.05), Tbx2b基因的表达量极显著高于其他基因(P < 0.01) (图 4b); 翻转期时, Dct基因极显著高于其他基因, Pax3基因显著高于其他基因(图 4c); 血管形成期, Dct基因极显著高于其他基因, Tbx2b基因、Fms基因显著高于其他基因, Pax3基因表达量维持在较高水平(图 4d); 器官形成期, Ltk基因极显著高于其他基因, Aim1基因、Dct基因显著高于其他基因(图 4e); 孵化期各基因表达量均较低, 不具有差异显著性(图 4f)。
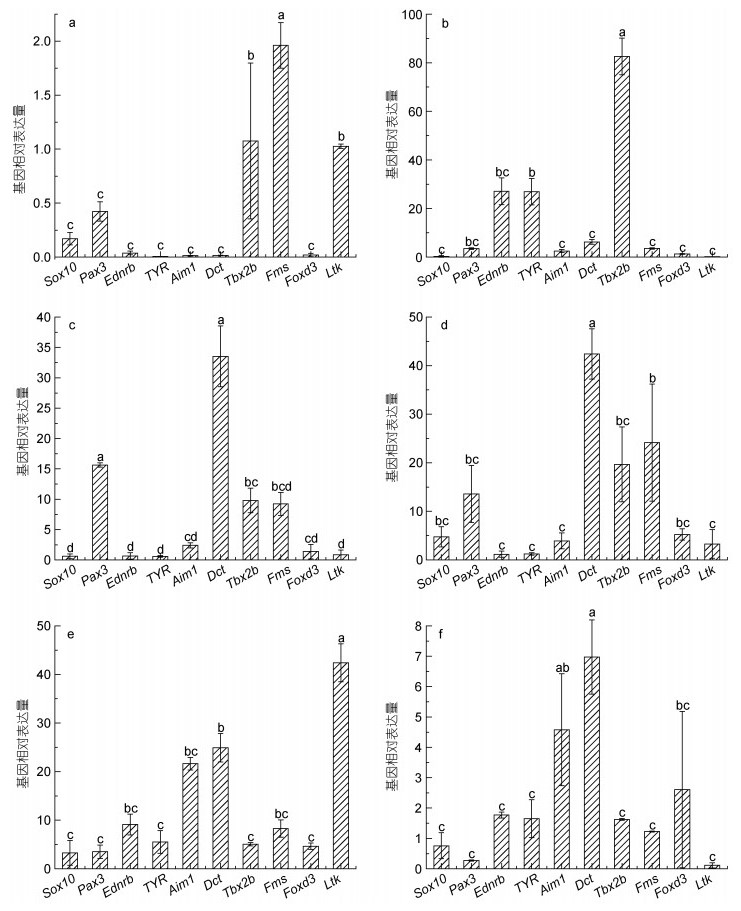 |
| 图 4 胚胎发育不同时期体色控制基因的相对表达量 Fig. 4 The relative expression of body color-related genes at different stages of embryonic development 注: a. 卵裂期; b. 体节期; c. 翻转期; d. 血管形成期; e. 器官形成期; f. 孵化期 |
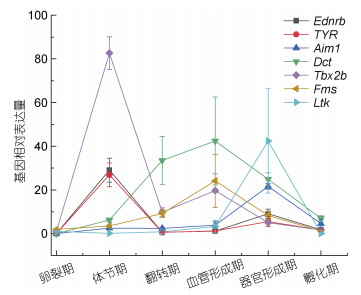 |
| 图 5 胚胎发育不同时期体色控制基因的相对表达变化趋势 Fig. 5 Trend of relative expression of body color-related genes at different stages of embryonic development 注: 图中仅列出相对表达量具有显著变化的基因 |
对眼斑双锯鱼胚胎时期各体色控制基因表达量进行相关性分析, 获得各基因之间表达量的相关系数如表 3所示。胚胎时期Sox10基因与Ednrb、TYR、Tbx2b基因呈现负相关, 与其他7种基因呈现正相关, 其中与Foxd3基因的正相关性最高; Pax3基因与Ednrb、TYR、Aim1、Tbx2b、Ltk呈现负相关, 与其他基因呈现正相关, 其中与Dct基因的正相关性最高; Ednrb基因与Dct、Fms、Fxod3、Ltk基因呈现负相关, 与其他基因呈现正相关, 其中与TYR和Tbx2b基因的正相关性较高; TYR基因与Aim1、Dct、Fms、Foxd3、Ltk基因呈现负相关, 与其他基因呈现正相关, 其中与Tbx2b基因的正相关性较高; Aim1基因与Tbx2b基因呈现负相关, 与其他基因呈现正相关, 其中与Ltk和TYR基因相关性较高; Dct基因与Tbx2b基因呈现负相关, 与其他基因呈现正相关, 其中与Fms基因的正相关性较高; Tbx2b基因与Fms、Foxd3、Ltk基因呈现负相关性, 与其他基因呈现正相关性, 其中与Pax3基因的正相关性最高; Fms基因与Foxd3、Ltk基因呈现正相关, 整体相关系数较低; Foxd3基因与Ltk基因呈现正相关性。
| 因素 | Sox10 | Pax3 | Ednrb | TYR | Aim1 | Dct | Tbx2b | Fms | Foxd3 |
| Pax3 | 0.409 970 6 | ||||||||
| Ednrb | –0.200 821 2 | –0.256 767 6 | |||||||
| TYR | –0.254 117 8 | –0.229 471 1 | 0.990 704 3 | ||||||
| Aim1 | 0.495 043 6 | –0.147 558 1 | 0.110 462 0 | –0.022 864 5 | |||||
| Dct | 0.755 964 4 | 0.885 194 3 | –0.307 394 4 | –0.329 136 6 | 0.246 812 0 | ||||
| Tbx2b | –0.180 734 4 | –0.007 462 5 | 0.916 357 8 | 0.955 060 2 | –0.222 868 3 | –0.172 268 6 | |||
| Fms | 0.865 414 5 | 0.756 316 1 | –0.251 706 8 | –0.249 799 5 | 0.082 414 7 | 0.891 215 7 | –0.046 889 3 | ||
| Foxd3 | 0.940 684 2 | 0.302 980 1 | –0.115 036 6 | –0.181 447 7 | 0.627 137 0 | 0.695 603 9 | –0.166 798 7 | 0.722 296 2 | |
| Ltk | 0.471 842 5 | –0.153 059 7 | 0.086 476 9 | –0.049 054 5 | 0.979 574 2 | 0.218 666 4 | –0.246 056 4 | 0.076 619 1 | 0.546 544 0 |
眼斑双锯鱼的胚胎具有10个完整的发育时期: 卵裂前期、卵裂期、囊胚期、原肠期、神经胚期、体节期、翻转期、血管形成期、器官形成期和孵化期(张薇等, 2018), 本研究观察到胚胎的颜色从最初橙黄, 逐渐发育成暗红、黑红、黑色到最终透明, 进而选取了色素细胞变化较明显的卵裂期、体节期、翻转期、血管形成期、器官形成期和孵化期6个时期的胚胎进行显微观察, 研究发现胚胎这一系列颜色的变化主要是黑色素细胞的动态变化引起的。鱼类色素细胞的出现的时期各不相同, 瓯江彩鲤(余陆伟等, 2020)、锦鲤(田雪等, 2017)等观赏鱼都是孵化后仔鱼时期体表才开始出现色素细胞变化, 而眼斑双锯鱼体节期就能观察到黑色素细胞, 此时黑色素细胞数量和体积均较小, 随着生长发育不断进行, 黑色素细胞的数量逐渐增多, 体积逐渐增大, 整个胚胎的颜色逐渐变黑。已有研究表明, 鱼类黑色素不仅与体色形成密切相关, 还与鱼类的生长、生存相关(Braasch et al, 2008), 眼斑双锯鱼的鱼卵是黏附型卵, 我们推测这种发育初期即迅速产生黑色素细胞形成保护色的机制与其适应色彩斑斓的珊瑚礁环境有很大的关系, 通过黑色素来遮盖卵黄的橙黄色, 有利于躲避敌害, 从而更好地生存。
3.2 眼斑双锯鱼不同胚胎发育时期体色控制基因的表达分析本研究发现在眼斑双锯鱼整个胚胎发育过程中, 色素细胞的出现模式与相关基因的表达有着密切的关系。眼斑双锯鱼卵裂期胚胎未观察到黑色素细胞, 此时影响神经嵴细胞迁移分化的Sox10基因和Pax3基因(Cheng et al, 2000)未出现明显表达, 而体节期与黑色素形成相关的Tbx2b基因、Ednrb基因和TYR基因的相对表达量明显升高, 同时观察到卵黄囊表面出现了明显的幼体黑色素细胞, 我们推测眼斑双锯鱼中体节期卵黄表面出现的幼体黑色素细胞是由外胚层中的神经嵴细胞直接分化而来的, 而不需要经过迁移过程(Salis et al, 2021)。有研究表明Tbx2b不单是体色控制基因, 也是早期心脏发育的关键基因(赵霞等, 2021), 眼斑双锯鱼体节期Tbx2b基因的表达量极显著升高, 随后在翻转期我们观察到眼斑双锯鱼心脏的出现, 说明卵裂期Tbx2b基因相对表达量升高不仅与幼体黑色素细胞形成相关, 与眼斑双锯鱼心脏形成也有密切关系, Tbx2b基因在两个方面上都具有重要的作用。Ednrb信号通路对神经嵴来源的黑色素前体细胞的增殖、存活以及黑色素细胞的分化有重要作用(Lee et al, 2003; Lahav, 2005), 在眼斑双锯鱼的胚胎时期Ednrb基因仅在体节期黑色素细胞形成初期出现了较高的表达, 而后逐渐趋于稳定, 这说明Ednrb基因参与调节神经嵴细胞向幼体色素细胞的增殖分化过程, 有研究表明G蛋白偶联Ednrb受体及其配体Et3与胚胎色素细胞及幼体色素细胞向成体色素细胞的转变有关(王成辉, 2012), 这说明眼斑双锯鱼胚胎时期卵黄囊表面的幼体色素细胞是在Ednrb基因的控制下由神经嵴细胞分化形成, 与Sox10和Pax3基因无关。TYR基因在黑色素细胞形成的过程中发挥着重要的作用, 其表达量的高低影响酪氨酸酶的合成, 进而影响黑色素的合成从而导致生物的体色发生变化(王成辉等, 2018)。本研究中, TYR基因在眼斑双锯鱼胚胎发育过程中的体节期开始出现幼体黑色素细胞时相对表达量显著增加(P < 0.05), 而后表达量逐渐减小并趋于稳定, 说明在黑色素细胞开始出现时, TYR基因基因就参与了黑色素细胞的合成以及体色的调控。
在胚胎翻转期, 控制神经嵴细胞向黑色素细胞分化的Pax3基因表达量出现明显的升高, 随后, 与黑色素形成相关的Dct、Aim1、Tbx2b基因的表达量都出现了明显的升高, 此时期鱼体表面开始出现成体黑色素细胞, 呈放射状。Dct作为TYR基因调控黑色素合成通路上的下游基因, 参与真黑色素的合成(古珍珍, 2016), 在眼斑双锯鱼胚胎发育过程中, TYR基因的相对表达量在体节期出现高表达后逐渐降低, 下游Dct基因的相对表达量逐渐升高, 且在多个时期均有表达, 于血管形成期达到最大值, 此时胚胎黑色素细胞的体积也逐渐增长至最大, 这说明Dct作为黑色素形成的下游基因, 其相对表达量与胚胎黑色素细胞的数量和发育程度有密切的关系。Aim1基因作为黑色素细胞合成过程中的转运调控基因(Koga et al, 1995), 与黑色素细胞在鱼体表面规则分布有关系。
有研究表明红色素细胞与黄色素细胞的分化来源可能均为黄色素前体细胞, 不同点在于前者中类胡萝卜素的含量要高于蝶酸色素的含量(刘晓东等, 2008), 在眼斑双锯鱼的器官形成期观察到红色素细胞开始出现, 在整个胚胎发育过程中黄色素形成相关基因Fms基因(Parichy et al, 2000)都有一定表达, 于血管形成期达到最大, 说明Fms基因参与红色素细胞的形成; 虹彩色素细胞的标记基因Ltk基因(Lopes et al, 2008)、调控虹彩色素细胞分化的Foxd3基因(张永勤, 2018)在血管形成期之后开始出现表达, 两种基因的相对表达量分别在器官形成期、孵化期达到最大, 孵化期眼斑双锯鱼的眼睛观察到明显的虹彩色素细胞, 说明这两种基因的表达是导致孵化期眼睛发亮的主要原因。
通过将胚胎显微观察结果和qPCR结果联合分析, 我们发现体色控制基因的表达与色素细胞的形成具有密切的联系。基因的表达具有提前性, 本研究先在未观察到黑色素细胞的胚胎发育时期检测到黑色素细胞形成相关基因显著表达, 在之后发育时期的胚胎中才观察到黑色素细胞的变化, 实验结果表明眼斑双锯鱼胚胎时期的色素细胞形成是受相关基因程序性控制的。
3.3 眼斑双锯鱼不同发育时期体色控制基因表达相关性分析通过DPS分析发现眼斑双锯鱼色素细胞形成相关基因各时期的相对表达量之间存在相关性, 这说明各种色素细胞形成相关基因之间存在一定的相互作用。胚胎时期, Pax3基因与黑色素形成相关基因的相对表达量呈现正相关性, 而与虹彩色素、黄色素形成相关基因的相对表达量呈现负相关性, 这证实Pax3基因在黑色素母细胞分化迁移进而发育成黑色素细胞的过程中起到重要作用(张华, 2012)。黑色素形成相关基因基本与虹彩色素基因的表达量呈现负相关性, 本研究也证实了虹彩色素细胞合成相关的Foxd3基因对黑色素细胞的形成有抑制作用(Stewart et al, 2006)。而几种黑色素形成相关的基因之间相对表达量也存在负相关的情况, Dct基因是TYR基因的下游基因, TYR基因的相对表达量出现高表达之后表达量逐渐下降, Dct基因相对表达量才逐渐上升, 两者之间也存在负相关的关系。
4 结论本研究细致观察了眼斑双锯鱼胚胎时期色素细胞变化, 结合qPCR结果分析了10种体色控制基因与体表色素细胞动态变化之间的联系。通过对色素细胞变化以及基因相对表达量的分析, 发现在眼斑双锯鱼早期胚胎发育阶段, 主要是黑色素细胞变化较为明显, 这种机制可能与环境适应有关系, 其中Ednrb、TYR、Tbx2b基因与幼体黑色素细胞的形成有密切关系, 而Pax3、Dct、Aim1基因调控成体黑色素的合成以及黑色素细胞的生长; 研究还发现, 色素细胞的动态变化与基因相对表达量的变化密切相关, 且不同的基因之间可能存在相互作用。
王天柱, 吴庆, 张宁, 等, 2020. 鱼类黑色素合成及信号通路的研究进展[J]. 中国生物工程杂志, 40(5): 84-93. |
王成辉, 2012. 鱼类体色变异的遗传基础研究进展简述[J]. 上海海洋大学学报, 21(5): 737-742. |
王成辉, 陈红林, 杜金星, 等, 2018. 瓯江彩鲤的体色变异的遗传基础研究[C] // 2018中国遗传学会第十次全国会员代表大会暨学术讨论会论文摘要汇编. 南京: 中国遗传学会: 160.
|
古珍珍, 2016. 瓯江彩鲤4个体色相关基因的选择压力分析与2种体色类型的生长配套效果研究[D]. 上海: 上海海洋大学: 55.
|
田雪, 庞小磊, 王良炎, 等, 2017. MITFa及TYR基因在红色锦鲤体色发生不同阶段的表达分析[J]. 水产科学, 36(2): 197-201. |
边芳芳, 2019. 细锯脂鲤三种表型的体色特征和转录组比较分析[D]. 武汉: 华中农业大学: 77.
|
刘晓东, 陈再忠, 2008. 七彩神仙鱼皮肤色素细胞观察及类胡萝卜素组分分析[J]. 上海水产大学学报, 17(3): 339-343. |
李迎娣, 2022. 双锯鱼属(Amphiprion)不同鱼种早期发育过程中体色的发生及相关基因的表达分析[D]. 上海: 上海海洋大学.
|
李迎娣, 孙志宾, 马爱军, 等, 2022. 双锯鱼(Amphiprion)胚胎不同发育阶段和成鱼不同组织中内参基因的筛选及应用[J]. 海洋与湖沼, 53(1): 150-160. |
何丽斌, 黄镇, 吴水清, 等, 2022. 基于转录组测序技术对调控毕加索小丑鱼(Picassoclownfish)白化体征关键基因的研究[J]. 海洋学报, 44(2): 67-76. |
余陆伟, 曹思雨, 王军, 等, 2020. 两种体色瓯江彩鲤黑色素形成比较[J]. 上海海洋大学学报, 29(4): 481-488. |
张永勤, 2018. 红鲫体色发育的分子调控机制研究[D]. 长沙: 湖南师范大学: 117.
|
张华, 2012. MITF、PAX3和SOX10基因突变致Waardenburg综合征发病的分子机制研究[D]. 长沙: 中南大学: 236.
|
张薇, 孙志宾, 马爱军, 等, 2018. 双锯鱼属(Amphiprion)四种鱼种比较胚胎学研究和进化探讨[J]. 海洋与湖沼, 49(3): 671-681. |
周康奇, 宋红梅, 潘贤辉, 等, 2019. 橘色双冠丽鱼体色相关基因mc1r的组织表达分析[J]. 动物学杂志, 54(1): 45-56. |
孟超, 徐皓, 黄超, 等, 2020. 鱼类体色相关功能基因的研究进展[J]. 湖南文理学院学报(自然科学版), 32(3): 30-35. |
赵霞, 朱哲, 祖尧, 2021. 斑马鱼tbx2b调控心脏房室间隔发育的功能研究[J]. 中国生物工程杂志, 41(8): 1-7. |
殷浩然, 罗明坤, 王兰梅, 等, 2019. 锦鲤早期发育过程中色素代谢相关酶的活性和基因表达变化[J]. 南方水产科学, 15(5): 109-117. |
盛斌, 2022. 鄱阳湖泥鳅黑色素细胞发育规律及其体色调控相关基因挖掘[D]. 南昌: 南昌大学.
|
蒋燕玲, 宋红梅, 刘奕, 等, 2016. 橘色双冠丽鱼TYR基因的克隆及其发育时序和组织表达分析[J]. 农业生物技术学报, 24(5): 697-707. |
BARRALLO-GIMENO A, HOLZSCHUH J, DRIEVER W, et al, 2004. Neural crest survival and differentiation in zebrafish depends on mont blanc/tfap2a gene function[J]. Development, 131(7): 1463-1477. DOI:10.1242/dev.01033 |
BAYNASH A G, HOSODA K, GIAID A, et al, 1994. Interaction of endothelin-3 with endothelin-B receptor is essential for development of epidermal melanocytes and enteric neurons[J]. Cell, 79(7): 1277-1285. DOI:10.1016/0092-8674(94)90018-3 |
BRAASCH I, VOLFF J N, SCHARTL M, 2008. The evolution of teleost pigmentation and the fish-specific genome duplication[J]. Journal of Fish Biology, 73(8): 1891-1918. DOI:10.1111/j.1095-8649.2008.02011.x |
CHENG Y C, CHEUNG M, ABU-ELMAGD M M, et al, 2000. Chick sox10, a transcription factor expressed in both early neural crest cells and central nervous system[J]. Developmental Brain Research, 121(2): 233-241. DOI:10.1016/S0165-3806(00)00049-3 |
DORSKY R I, RAIBLE D W, MOON R T, 2000. Direct regulation of nacre, a zebrafish MITF homolog required for pigment cell formation, by the Wnt pathway[J]. Genes & Development, 14(2): 158-162. |
DUTTON K A, PAULINY A, LOPES S S, et al, 2001. Zebrafish colourless encodes sox10 and specifies non-ectomesenchymal neural crest fates[J]. Development, 128(21): 4113-4125. DOI:10.1242/dev.128.21.4113 |
HUBBARD J K, UY J A C, HAUBER M E, et al, 2010. Vertebrate pigmentation: from underlying genes to adaptive function[J]. Trends in Genetics, 26(5): 231-239. DOI:10.1016/j.tig.2010.02.002 |
KELSH R N, 2004. Genetics and evolution of pigment patterns in fish[J]. Pigment Cell Research, 17(4): 326-336. DOI:10.1111/j.1600-0749.2004.00174.x |
KOGA A, INAGAKI H, BESSHO Y, et al, 1995. Insertion of a novel transposable element in the tyrosinase gene is responsible for an albino mutation in the medaka fish, Oryzias latipes[J]. Molecular and General Genetics MGG, 249(4): 400-405. DOI:10.1007/BF00287101 |
LAHAV R, 2005. Endothelin receptor B is required for the expansion of melanocyte precursors and malignant melanoma[J]. The International Journal of Developmental Biology, 49(2/3): 173-180. |
LEE H O, LEVORSE J M, SHIN M K, 2003. The endothelin receptor-B is required for the migration of neural crest-derived melanocyte and enteric neuron precursors[J]. Developmental Biology, 259(1): 162-175. DOI:10.1016/S0012-1606(03)00160-X |
LIU F, CAO J X, LV J H, et al, 2013. TBX2 expression is regulated by PAX3 in the melanocyte lineage[J]. Pigment Cell & Melanoma Research, 26(1): 67-77. |
LOPES S S, YANG X Y, MÜLLER J, et al, 2008. Leukocyte tyrosine kinase functions in pigment cell development[J]. PLoS Genetics, 4(3): e1000026. DOI:10.1371/journal.pgen.1000026 |
MARCIONETTI A, ROSSIER V, BERTRAND J A M, et al, 2018. First draft genome of an iconic clownfish species (Amphiprion frenatus)[J]. Molecular Ecology Resources, 18(5): 1092-1101. DOI:10.1111/1755-0998.12772 |
PARICHY D M, RANSOM D G, PAW B, et al, 2000. An orthologue of the kit-related gene fms is required for development of neural crest-derived xanthophores and a subpopulation of adult melanocytes in the zebrafish, Danio rerio[J]. Development, 127(14): 3031-3044. DOI:10.1242/dev.127.14.3031 |
SALIS P, LEE S H, ROUX N, et al, 2021. The real Nemo movie: Description of embryonic development in Amphiprion ocellaris from first division to hatching[J]. Developmental Dynamics, 250(11): 1651-1667. DOI:10.1002/dvdy.354 |
STEWART R A, ARDUINI B L, BERGHMANS S, et al, 2006. Zebrafish foxd3 is selectively required for neural crest specification, migration and survival[J]. Developmental Biology, 292(1): 174-188. DOI:10.1016/j.ydbio.2005.12.035 |
XU X, DONG G X, HU X S, et al, 2013. The genetic basis of white tigers[J]. Current Biology, 23(11): 1031-1035. DOI:10.1016/j.cub.2013.04.054 |
YAMANAKA H, KONDO S, 2014. In vitro analysis suggests that difference in cell movement during direct interaction can generate various pigment patterns in vivo[J]. Proceedings of the National Academy of Sciences of the United States of America, 111(5): 1867-1872. |
ZHANG Y Q, LIU J H, PENG L Y, et al, 2017. Comparative transcriptome analysis of molecular mechanism underlying gray-to-red body color formation in red crucian carp (Carassius auratus, red var.)[J]. Fish Physiology and Biochemistry, 43(5): 1387-1398. DOI:10.1007/s10695-017-0379-7 |
 2024, Vol. 55
2024, Vol. 55


