中国海洋湖沼学会主办。
文章信息
- 陈林杰, 沈斌, 张建设. 2024.
- CHEN Lin-Jie, SHEN Bin, ZHANG Jian-She. 2024.
- 中华乌塘鳢(Bostrychus sinensis)白细胞介素8基因的克隆及免疫应答表达分析
- MOLECULAR CLONING AND EXPRESSION ANALYSES OF THE INTERLEUKIN-8 GENE FROM BOSTRYCHUS SINENSIS IN RESPONSE TO IMMUNE STIMULATION
- 海洋与湖沼, 55(2): 499-508
- Oceanologia et Limnologia Sinica, 55(2): 499-508.
- http://dx.doi.org/10.11693/hyhz20231200278
文章历史
-
收稿日期:2023-12-27
收修改稿日期:2024-01-16
趋化因子(chemokines)是一类由细胞分泌的、分子量约8~12 kDa的小分子量细胞因子。根据半胱氨酸残基在结构中的排列位置不同, 趋化因子可以分为CXC、CC、C和CX3C四个亚家族(Hughes et al, 2018)。白细胞介素8 (Interleukin-8, IL-8)又称趋化因子8 (CXCL8), 是哺乳动物中首个被鉴定的C-X-C类趋化因子亚家族成员(Larsen et al, 1989), 其N端具有Glu-Leu-Arg (ELR)特征基序(Murphy et al, 2009)。IL-8主要由单核细胞分泌, 能够通过与G蛋白偶联受体CXCR1和CXCR2结合, 发挥募集中性粒细胞等炎症细胞到达感染部位触发细胞毒性作用的功能(Kendrick et al, 2014)。此外, IL-8还可以通过诱导细胞呼吸暴发、溶酶体外排、储存蛋白颗粒释放等方式参与多种机体病理过程(Wang et al, 2019)。
鱼类IL-8基因最早是在七鳃鳗(Lampetra fluviatiles) (Najakshin et al, 1999)中被鉴定到的。截至目前, 学者们已经对包括鲤鱼(Cyprinus carpio) (Huising et al, 2003)、花鲈(Lateolabrax japonicus) (陈吉刚等, 2010)、大黄鱼(Larimichthys crocea) (Mu et al, 2015)、鳜鱼(Siniperca chuatsi) (Wang et al, 2017)等在内的几十种鱼类的IL-8基因开展了鉴定和研究。鱼类IL-8蛋白同样具有N端信号肽序列、SCY结构域和CXC基序。除了黑线鳕(Melanogrammus aeglefinus) (Corripio-Miyar et al, 2007)、大头鳕(Gadus macrocephalus) (Chen et al, 2021)、大西洋鳕(G. morhua) (Seppola et al, 2008)等少数几种鱼类外, 绝大多数鱼类IL-8均缺乏ELR基序(Alejo et al, 2011)。相关研究表明, poly (I: C)、LPS、细菌、病毒等免疫刺激或感染均能显著诱导鱼类IL-8基因的表达(Li et al, 2013; Wang et al, 2017; Joo et al, 2022), 表明IL-8在鱼类抗细菌和病毒免疫应答方面发挥重要作用。
中华乌塘鳢(Bostrychus sinensis)是我国东南沿海地区重要的海水经济养殖鱼类之一(钟爱华等, 2002)。随着养殖面积和养殖规模的不断扩大, 由细菌、寄生虫等感染引起的各类养殖疾病相继出现(何志章, 1995; 沈斌等, 2019), 给中华乌塘鳢养殖业的可持续健康发展造成严重威胁。目前, 已有学者对中华乌塘鳢一些重要的免疫基因开展了克隆鉴定和功能研究(Wei et al, 2020; Shen et al, 2021; 丁浪等, 2022)。然而, 目前国内外尚未见关于BsIL-8基因方面的研究报道。本研究对BsIL-8基因开展了克隆鉴定, 并研究了BsIL-8基因在病原感染免疫应答中的表达变化情况, 以期为后续BsIL-8基因功能的深入研究提供借鉴。
1 材料与方法 1.1 样品采集本研究所用中华乌塘鳢购自浙江省台州市某水产养殖场, 平均体重约50 g, 平均体长约15 cm。选择个体相近的健康中华乌塘鳢, 根据沈斌等(2019)的方法, 在实验室暂养至少一周后, 用于后续研究。随机选择健康无明显病变的中华乌塘鳢3尾, 处死后快速采集头肾、肝脏、脾脏、肠、肌肉、外周血、脑、鳃、心脏和皮肤组织样本装入冻存管中, 迅速放入液氮中冷冻, 并放至–80 ℃冰箱保存, 备用。
取聚肌胞苷酸poly (I: C) (Aldrich)溶解于PBS缓冲液, 经0.22 μm滤膜(Millipore)过滤, 配制1 mg/mL无菌poly (I︰C)溶液。取上述暂养一周的健康中华乌塘鳢60尾均分为两组, 对照组和实验组各30尾。取实验组中华乌塘鳢个体, 每尾腹腔注射0.2 mL poly (I: C)溶液; 对照组鱼类个体腹腔注射相同体积的无菌PBS缓冲液。在poly (I: C)注射后0、3、6、12、24和48 h, 分别选取至少3个个体, 处死后快速采集外周血、脾脏、肝脏和头肾组织, 放入冻存管, 液氮冷冻后保存于–80 ℃冰箱, 备用。
取实验室分离保存的副溶血弧菌菌株(Vibrio parahaemolyticus TZ-01) (沈斌等, 2019), 接种至TSB液体培养基, 28 ℃过夜培养至对数中期。取细菌培养液离心, 重悬至PBS缓冲液, 调整菌悬液浓度至1×106 CFU/mL, 备用。同样取暂养一周的健康中华乌塘鳢70尾, 均分成两组, 对照组和实验组各35尾。取实验组中华乌塘鳢个体, 每尾各取0.2 mL上述菌悬液进行腹腔注射; 对照组腹腔注射等体积无菌PBS。在副溶血弧菌感染后0、3、6、12、24、48和72 h, 分别选取至少3个个体, 处死后同样快速采集外周血、脾脏、肝脏和头肾组织, 放入冻存管, 经液氮冷冻后保存于–80 ℃冰箱, 备用。
1.2 BsIL-8基因cDNA序列的分子克隆从副溶血弧菌感染中华乌塘鳢脾脏转录组文库(Wei et al, 2020)中挖掘到长度为1 244 bp的IL-8基因cDNA序列, 其预测开放阅读框(open reading frame, ORF)序列长度为312 bp。取–80 ℃冻存的健康中华乌塘鳢脾脏组织, 利用TRIzolTM Reagent试剂(Invitrogen)进行总RNA提取, 并利用Primer ScriptTM RT reagent Kit with gDNA Eraser试剂盒(TaKaRa)逆转录成cDNA。根据基因序列设计相应引物(序列见表 1), 以脾脏cDNA为模板, 对中华乌塘鳢IL-8基因的ORF序列开展PCR扩增。将PCR产物进行克隆测序, 并对其ORF序列进行验证。最终得到中华乌塘鳢IL-8基因(命名为BsIL-8)的cDNA序列, 并用于后续相关分析。
| 引物名称 | 引物序列 | 实验目的 |
| BsIL-8-F | 5’-ACCGTGTCCTGTGACTATCTCCTG-3’ | BsIL-8 ORF序列PCR扩增 |
| BsIL-8-R | 5’-ACAACCAGCCATTTCCTGACCAC-3’ | |
| BsIL-8-RT-F | 5’-CTGTGCGTGGTGGTGATG-3’ | BsIL-8荧光定量 |
| BsIL-8-RT-R | 5’-AGGACGACTGCGGGTTC-3’ | |
| Bs-β-Actin-F | 5’-GACCCAGATTATGTTTGAGA-3’ | 内参基因荧光定量 |
| Bs-β-Actin-R | 5’-CGTGGTGGTGAATGAGTAG-3’ | |
| M13-F | 5’-TGTAAAACGACGGCCAGT-3’ | 菌液PCR鉴定 |
| M13-R | 5’-GAGGAAACAGCTATGACC-3’ |
使用ExPasy ProtParam tool在线软件(https://web.expasy.org/protparam/) (Wilkins et al, 1999)对BsIL-8开展蛋白分子量和理论等电点预测。利用SMART软件(https://smart.embl.de/) (Letunic et al, 2021)对BsIL-8蛋白中的潜在信号肽序列及蛋白功能结构域进行预测分析。通过SWISS-MODEL在线软件(https://swissmodel.expasy.org/) (Waterhouse et al, 2018)对BsIL-8蛋白的三级结构进行同源建模。利用MEGA11软件(Tamura et al, 2021)对BsIL-8及其他物种IL-8的氨基酸序列开展多序列比对。利用EMBOSS Needle (https://www.ebi.ac.uk/Tools/psa/emboss_needle/)在线网站(Madeira et al, 2022), 分析BsIL-8及其他物种IL-8氨基酸序列的相似性和一致性。利用MEGA11软件的邻接法(Neighbor-joining, NJ)开展IL-8氨基酸序列的系统发育树构建分析(选取JTT模型, 5000次bootstrap)。
1.4 BsIL-8基因的组织表达分布分析取上述采集冻存的健康中华乌塘鳢10个组织样本, 分别提取总RNA并逆转录成cDNA。使用Primer Premier 5.0软件设计BsIL-8和内参基因β-actin的荧光定量引物(表 1)。利用TB Green Premix Ex Taq II (Tli RNaseH Plus)荧光定量试剂盒(TaKaRa), 在ABI 7500 Fast Real-time PCR系统上对BsIL-8基因在上述10个中华乌塘鳢器官组织中的表达分布情况进行检测。选取3个中华乌塘鳢个体作为生物学重复。利用2–△△Ct方法(Livak et al, 2001)计算BsIL-8基因的相对表达量。利用单因素方差分析(one-way ANOVA)对基因表达量进行统计学检验(P < 0.05为差异有显著性)。
1.5 BsIL-8基因在免疫应答反应中的表达特征分析分别取poly (I︰C)免疫刺激和副溶血弧菌感染的中华乌塘鳢脾脏、肝脏、外周血和头肾器官组织, 按照1.2中的实验步骤提取总RNA并逆转录得到cDNA。按照1.4中相同的实验步骤, 使用ABI 7500 Fast Real-time PCR系统分析BsIL-8基因在感染胁迫后的肝脏、脾脏、头肾和外周血中的差异表达情况。同样选取3个中华乌塘鳢个体作为生物学重复。基因相对表达量利用2–△△Ct方法进行计算。利用Student’s t检验对基因表达差异进行统计学检验(*P < 0.05和**P < 0.01)。
2 结果 2.1 BsIL-8基因序列分析本研究通过PCR扩增和克隆测序获得了中华乌塘鳢IL-8基因cDNA序列, 将其命名为BsIL-8 (GenBank登录号: OR909490)。BsIL-8基因的cDNA序列全长为1 244 bp, 包含576 bp的5’端非编码区序列(5’-UTR), 312 bp的开放阅读框序列(ORF)和356 bp的3’端非编码区序列(3’-UTR) (图 1a)。BsIL-8基因共编码103个氨基酸(图 1a), 预测蛋白分子量为11.38 kDa, 理论等电点为9.30。BsIL-8蛋白序列包含1个由18个氨基酸组成的N端信号肽和1个由62个氨基酸组成的SCY结构域(图 1a)。其中, SCY结构域包含1个CXC基序(Cys30-Arg31-Cys32)以及4个保守的半胱氨酸残基(Cys30、Cys32、Cys57和Cys73) (图 1a)。蛋白3D结构预测结果表明, BsIL-8含有3个α-螺旋和3个β-折叠(图 1b)。BsIL-8蛋白序列中的Cys30和Cys57形成二硫键, 而Cys32则和Cys73形成二硫键(图 1b)。
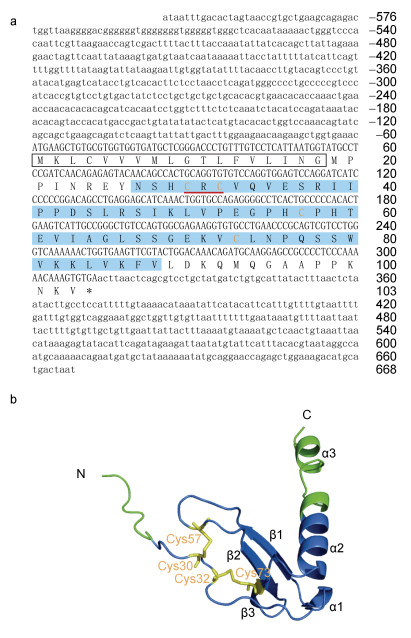 |
| 图 1 BsIL-8核苷酸和氨基酸序列 Fig. 1 The nucleotide and deduced amino acid sequences of BsIL-8 注: a. BsIL-8核苷酸和氨基酸序列。信号肽用黑色方框标注, SCY结构域用蓝色标注, CXC基序用红色下划线标注, 4个半胱氨酸残基用黄色字体标注。b. BsIL-8蛋白3D结构。4个半胱氨酸位点、α螺旋和β折叠如图标注 |
通过对BsIL-8和其他物种IL-8开展序列分析发现, 脊椎动物IL-8序列具有较高的进化保守性(图 2), 均含有N端信号肽、SCY结构域和CXC基序, 以及4个保守的半胱氨酸残基(图 2)。与绝大多数硬骨鱼类IL-8一样, BsIL-8同样缺乏ELR基序(图 2)。对选取的IL-8序列开展分析表明, BsIL-8与鲈形目鱼类IL-8的同源性最高, 其中BsIL-8与大弹涂鱼(Boleophthalmus pectinirostris) IL-8具有最高的序列相似性(92.4%)和一致性(86.4%), 其次为条石鲷(Oplegnathus fasciatus) IL-8 (序列相似性和一致性分别为92.3%和80.0%) (表 2)。BsIL-8与人类IL-8的序列相似性和一致性则分别为57.3%和28.4% (表 2)。
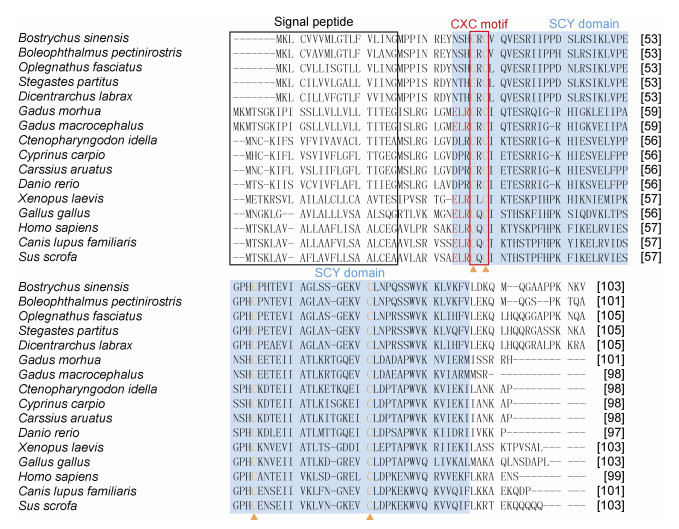 |
| 图 2 BsIL-8与其他物种IL-8氨基酸序列比对 Fig. 2 Alignment of amino acid sequence of BsIL-8 with other homologues 注: 预测的信号肽用黑色方框表示, CXC基序用红色方框表示, 半胱氨酸用黄色字体和三角形标记, ELR基序用红色字体标记, SCY结构域用蓝色标记 |
| 物种 | 登录号 | 相似性/% | 一致性/% |
| Bostrychus sinensis | OR909490 | — | — |
| Boleophthalmus pectinirostris | XM020936462 | 92.4 | 86.4 |
| Oplegnathus fasciatus | KC522965 | 92.3 | 80.0 |
| Stegastes partitus | XM_008286393 | 91.4 | 76.2 |
| Dicentrarchus labrax | KM225777 | 91.4 | 75.2 |
| Danio rerio | XM009306855 | 56.3 | 33.0 |
| Carassius auratus | KC184490 | 54.4 | 32.1 |
| Cyprinus carpio | XM019099675 | 53.4 | 34.9 |
| Ctenopharyngodon idella | JN255694 | 52.4 | 31.8 |
| Gadus macrocephalus | MH392034 | 54.4 | 27.9 |
| Gadus morhua | AY614593 | 52.4 | 25.2 |
| Homo sapiens | NM000584 | 57.3 | 28.4 |
| Canis lupus familiaris | NM001003200 | 51.5 | 28.0 |
| Sus scrofa | NM213867 | 53.4 | 24.3 |
| Gallus gallus | DQ393272 | 55.3 | 33.6 |
| Xenopus laevis | JF412665 | 60.2 | 29.9 |
从GenBank数据库下载了15个已公开的IL-8序列, 采用NJ法开展了基于氨基酸序列的系统发育树构建。结果表明, 所研究的IL-8序列分成硬骨鱼类、两栖类、鸟类和哺乳类4个类群(图 3)。所分析的11个鱼类IL-8序列聚类形成硬骨鱼类枝系(图 3), 其中BsIL-8首先与大弹涂鱼IL-8发生聚类(99% NJ置信度), 然后再与条石鲷等其他3个鲈形目鱼类IL-8发生聚类(100% NJ置信度) (图 3)。
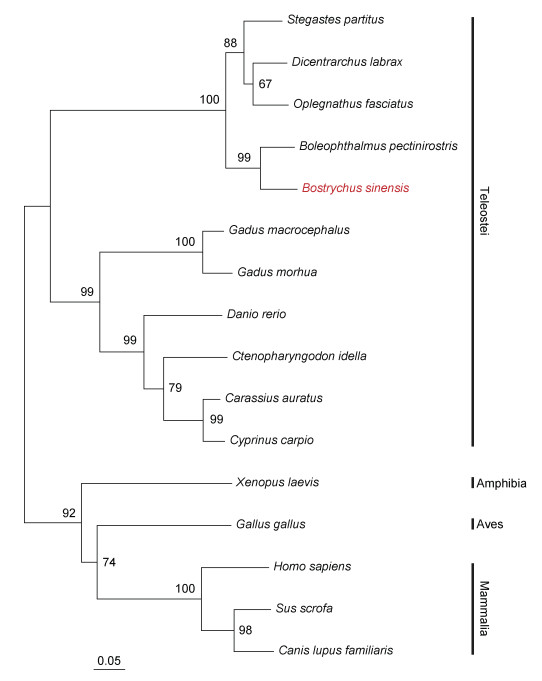 |
| 图 3 基于IL-8氨基酸序列构建的系统发育树 Fig. 3 Neighbor-joining tree based on amino acids of IL-8 homologues 注: 中华乌塘鳢用红色字体标记, 节点上数字表示代表枝系聚类NJ置信度 |
利用荧光定量PCR方法研究了BsIL-8在中华乌塘鳢肝脏、头肾、肠、脾脏、肌肉、脑、外周血、鳃、皮肤和心脏等10个器官组织中的表达分布情况。结果表明, BsIL-8在所检测的10个器官组织中呈泛在性表达, 其中头肾中的基因表达量最高(为肌肉组织的28倍), 肝脏中表达量次之(为肌肉组织的2.8倍), 外周血中表达量最低(图 4)。
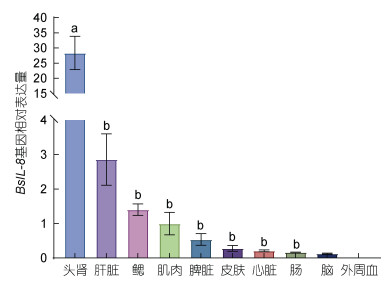 |
| 图 4 BsIL-8基因在中华乌塘鳢各器官组织中的表达分布情况 Fig. 4 Expression of BsIL-8 in various organs of B. sinensis 注: 不同字母表示显著性差异(P < 0.05) |
利用荧光定量PCR方法分别研究了BsIL-8在poly (I︰C)免疫刺激下和副溶血弧菌感染后的中华乌塘鳢肝脏、脾脏、外周血和头肾器官组织中的表达变化情况, 分析BsIL-8基因在机体抗感染免疫应答反应中的表达特征。结果显示, poly (I︰C)免疫刺激后, BsIL-8基因在中华乌塘鳢4种重要免疫器官中的表达量均发生了显著变化(图 5a)。在肝脏中, BsIL-8基因的表达量在poly (I: C)处理后3 h和6 h时一直处于较低水平, 而在12 h时急剧上调至最高(为对照组的5.3倍, P < 0.01); 随后, 在处理后24 h时BsIL-8表达量开始下调, 并在48 h时趋于对照水平(图 5a)。在脾脏中, BsIL-8基因的表达量在poly (I: C)处理后3 h时即发生显著上调, 且达到最高(为对照组的2.5倍, P < 0.01); 随后, 在处理后6 h时BsIL-8表达量下调至正常水平, 并一直维持到处理后48 h时(图 5a)。在头肾中, BsIL-8基因的表达量在poly (I: C)处理后3 h时即发生显著上调, 在24 h时达到最高(为对照组的3倍, P < 0.01), 随后在48 h时下调至对照水平(图 5a)。在外周血中, BsIL-8基因的表达量在poly (I: C)处理后3 h时即发生快速显著上调(为对照组的3.7倍, P < 0.01), 同样在24 h时达到最高(为对照组的7.6倍, P < 0.01), 随后在48 h时下调至对照水平(图 5a)。
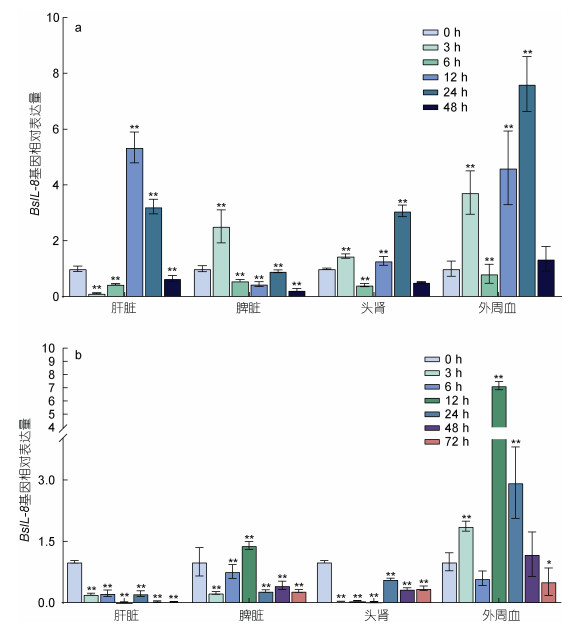 |
| 图 5 BsIL-8基因的表达分析 Fig. 5 The expression analyses of BsIL-8 注: a. Poly (I: C) 免疫刺激后BsIL-8基因在中华乌塘鳢4个重要免疫器官中的表达量变化情况。b. 副溶血弧菌感染后BsIL-8基因在中华乌塘鳢4个重要免疫器官中的表达量变化情况。结果用平均值±标准差表示, *表示P < 0.05, **表示P < 0.01 |
副溶血弧菌感染后, BsIL-8表达量在4种重要免疫器官中均发生了显著变化(图 5b)。在脾脏中, BsIL-8基因的表达量在细菌感染后3 h和6 h时均发生显著下调, 随后在12 h时开始上调并达到最高(为对照组的1.4倍, P < 0.01) (图 5b)。在外周血中, BsIL-8基因的表达量在副溶血弧菌感染后3 h时即快速上调(为对照组的1.9倍, P < 0.01), 在感染后12 h时上调至最高(为对照组的7.2倍, P < 0.01), 随后, 外周血中的BsIL-8基因表达量开始逐渐下调, 在感染后48 h时下调至对照水平(图 5b)。在肝脏中, BsIL-8基因的表达量在副溶血弧菌感染3 h后即发生显著下调(为对照组的0.2倍, P < 0.01), 且这种显著下调的表达特征一直维持至感染后72 h (仅为对照组的0.03倍, P < 0.01) (图 5b)。BsIL-8基因的表达量在头肾中的变化情况与在肝脏中的类似(图 5b)。在头肾中, 副溶血弧菌感染3 h后, BsIL-8基因的表达量发生快速显著下调(仅为对照组的0.03倍, P < 0.01) (图 5b)。细菌感染24 h后, 头肾中的BsIL-8基因表达量虽稍有回调, 但仍显著低于对照水平(为对照组的0.58倍, P < 0.01) (图 5b), 且这种表达特征一直维持至细菌感染后72 h (为对照组的0.35倍, P < 0.01) (图 5b)。
3 讨论本研究从中华乌塘鳢脾脏转录组中获得BsIL-8基因的cDNA序列, 并开展了序列验证和抗感染免疫应答表达分析。蛋白序列预测结果显示, BsIL-8同样含有位于N端的信号肽序列(图 1a), 表明BsIL-8与其他脊椎动物IL-8一样, 均属于分泌蛋白(Baggiolini et al, 1992)。此外, BsIL-8同样包含保守的SCY结构域和CXC特征基序(图 1a), 表明BsIL-8在氨基酸序列以及蛋白功能结构域方面均具有很高的进化保守性。与大弹涂鱼(李健等, 2019)、草鱼(Ctenopharyngodon idellus) (王婷婷, 2012)等大部分鱼类IL-8一样, BsIL-8序列同样缺乏ELR基序(为NSH, 图 1a), 表明BsIL-8属于ELR-CXC趋化因子(Vandercappellen et al, 2008)。对哺乳动物IL-8开展的研究表明, IL-8蛋白的ELR基序在结合受体、发挥趋化活性等方面起重要作用(Clark-Lewis et al, 1991)。然而对鱼类IL-8开展的相关研究表明, ELR基序缺失并未对鱼类IL-8蛋白的趋化活性产生影响(Cai et al, 2009; Sun et al, 2011)。序列同源性和系统发育分析结果表明, BsIL-8与大弹涂鱼、条石鲷等鲈形目鱼类IL-8具有极高的同源相似性, 这与其他鲈形目鱼类IL-8的研究结果相一致(胡云凤等, 2010; Li et al, 2013)。
BsIL-8基因的组织表达分布研究结果表明, BsIL-8在所检测的主要器官组织中呈泛在性表达, 其中在头肾和肝脏中的表达量较高(图 4)。研究表明, IL-8蛋白主要由单核细胞、巨噬细胞、淋巴细胞等分泌产生(Matsushima et al, 1992)。大多数硬骨鱼类头肾主要为淋巴髓样组织, 其中含有大量的淋巴细胞、单核细胞和各种粒细胞, 是鱼类造血、免疫的重要器官(卢全章, 1998)。而肝脏同样含有大量的淋巴细胞、巨噬细胞等免疫细胞(Gao et al, 2008)。对西伯利亚鲟(Acipenser baeri Brandt)开展的研究表明, 该物种的IL-8基因同样在头肾和肝脏中具有很高的表达量(Wang et al, 2019)。对大黄鱼(Li et al, 2013)、半滑舌鳎(Cynoglossus semilaevis) (Sun et al, 2011)和细鳞肥脂鲤(Piaractus mesopotamicus) (Carriero et al, 2020)等鱼类开展的研究表明, 这些鱼类的IL-8基因均在肝脏中具有最高的组织表达量。许氏平鲉(Sebastes schlegeli) IL-8基因在脾脏中的表达量最高(Herath et al, 2016)。褐牙鲆(Paralichthys olivaceus) IL-8基因则在鳃组织中的表达量最高(Kim et al, 2019)。而对大弹涂鱼开展的研究表明, 其IL-8基因在脑组织中的表达量最高, 推测可能与该鱼类适应复杂的滩涂环境有关(李健等, 2019)。以上研究结果表明, 鱼类IL-8基因主要在头肾、肝脏、脾脏、鳃等重要的免疫器官组织中高表达, 但也在个别鱼类中发生了与环境适应等有关的组织特异性表达。
基因表达分析结果表明, 双链RNA类似物poly (I︰C)免疫刺激可以显著诱导BsIL-8基因在重要免疫器官中的表达量发生变化(图 5a)。经poly (I︰C)处理后, 脾脏BsIL-8表达量在3 h时达到最高, 肝脏在12 h时达到最高, 而头肾和外周血则均在24 h时达到峰值(图 5a)。这些结果提示, BsIL-8基因在脾脏中对poly (I︰C)免疫刺激的应答反应速度要快于其他几个器官组织。大黄鱼脾脏IL-8基因对poly (I︰C)免疫刺激的应答反应速度也快于头肾等其他器官组织, 并同样在3 h时达到表达量峰值(Li et al, 2013)。大弹涂鱼脾脏IL-8基因表达量在poly (I︰C)免疫刺激后12 h时达到最高, 而肝脏则在36 h时达到最高(李健等, 2019)。但是对许氏平鲉开展的相关研究表明, 其脾脏和血液中的IL-8基因表达量均在poly (I︰C)处理后6 h时达到最高(Herath et al, 2016)。而在VHSV病毒感染的褐牙鲆中, 其鳃组织IL-8基因表达量于病毒感染后6 h时达到峰值, 要明显早于脾脏、肾脏、肝脏等器官(Kim et al, 2019)。
副溶血弧菌广泛分布于海水环境中, 是引起海水养殖鱼类、虾类、贝类等弧菌病的主要致病菌之一(吴后波等, 2001)。本研究利用从患病中华乌塘鳢体内分离到的副溶血弧菌菌株(沈斌等, 2019)人工感染健康中华乌塘鳢, 并分析了BsIL-8基因在副溶血弧菌感染条件下的免疫应答表达特征。BsIL-8基因表达量在脾脏和外周血中均在细菌感染后12 h时上调至最大值(图 5b)。注射灭活的副溶血弧菌后, 大黄鱼脾脏IL-8表达量同样在免疫刺激后12 h时达到最高(Li et al, 2013)。许氏平鲉经海豚链球菌(Streptococcus iniae)感染后, 其脾脏IL-8基因表达量也在12 h时达到峰值(Herath et al, 2016)。对细鳞肥脂鲤开展的研究同样发现, 经达卡气单胞菌(Aeromonas dhakensis)感染后, 该鱼类脾脏中IL-8表达量在12 h时达到最高(Carriero et al, 2020)。经停乳链球菌(S. dysgalactiae)感染后, 军曹鱼(Rachycentron canadum)脾脏IL-8基因表达量也在12 h时上调至最大值(Nguyen et al, 2017)。西伯利亚鲟(Wang et al, 2019)和大弹涂鱼(李健等, 2019)分别经嗜水气单胞菌(A. hydrophila)和鳗弧菌(V. anguillarum)感染后, 脾脏IL-8基因表达量均在72 h时达到最高。利用免疫激动剂脂多糖(LPS)进行免疫刺激后, 大黄鱼IL-8基因在脾脏中的表达量则在6 h时达到最高(Li et al, 2013)。而许氏平鲉血液IL-8基因表达量则在海豚链球菌感染后6 h时快速上调并达到峰值(Herath et al, 2016)。
与脾脏和外周血不同的是, 肝脏和头肾BsIL-8表达量均在副溶血弧菌感染后发生显著下调(图 5b)。对大黄鱼IL-8基因开展的研究也报道了类似的现象, 经LPS免疫刺激和副溶血弧菌感染后, 大黄鱼肝脏IL-8基因表达量均发生了显著下调(Li et al, 2013)。经达卡气单胞菌感染后, 细鳞肥脂鲤肝脏IL-8基因的表达量也发生了显著的下调(Carriero et al, 2020)。细菌感染引起的IL-8基因表达量下调, 很可能与这些鱼类通过激活抗炎症途径来减轻由细菌感染引起的组织炎症损伤有关(Carriero et al, 2020)。有相关报道指出, 组织中的单核细胞、巨噬细胞等能够通过产生抗炎性细胞因子来抑制包括IL-8等在内的促炎性细胞因子的表达, 进而减轻急性炎症反应对机体造成的组织炎症损伤(de Waal Malefyt et al, 1991; Fiorentino et al, 1991)。而西伯利亚鲟(Wang et al, 2019)和大弹涂鱼(李健等, 2019)肝脏IL-8基因的表达量则均在细菌感染后发生显著上调, 且均于感染后12 h时达到最大值。军曹鱼肝脏IL-8基因表达量则在停乳链球菌感染后72 h时上调至最大值(Nguyen et al, 2017)。对鳗利斯顿氏菌(Listonella anguillarum)感染的半滑舌鳎IL-8基因表达特征开展分析发现, 其头肾中的IL-8基因表达量在细菌感染后4 h时达到峰值(Sun et al, 2011)。西伯利亚鲟(Wang et al, 2019)、细鳞肥脂鲤(Carriero et al, 2020)和军曹鱼(Nguyen et al, 2017)头肾中的IL-8基因表达量均在细菌感染后显著上调, 且均在12 h时达到最高。这些研究结果表明, 鱼类IL-8基因的免疫应答表达特征与器官组织类型、物种差异以及免疫刺激物类型密切相关。
4 结论本研究成功克隆获得BsIL-8基因cDNA序列并开展了同源性比对、系统发育树构建等序列分析。利用荧光定量PCR技术分析了BsIL-8基因的组织表达分布以及抗感染免疫应答表达特征。结果表明, BsIL-8基因在机体主要器官组织中呈泛在性表达, 且在头肾和肝脏中具有最高的表达量。聚肌胞苷酸poly (I: C)免疫刺激和副溶血弧菌感染均能够引起BsIL-8基因在机体主要免疫器官中的表达量发生显著变化, 表明BsIL-8参与了中华乌塘鳢抗感染免疫应答过程。研究结果可以为后续BsIL-8基因功能的深入研究提供理论参考。
丁浪, 夏立萍, 沈斌, 等, 2022. 中华乌塘鳢(Bostrychus sinensis)GPx7和GPx8基因的克隆、表达与酶活性分析[J]. 海洋与湖沼, 53(3): 697-709. DOI:10.11693/hyhz20211100268 |
王婷婷, 2012. 草鱼(Ctenopharyngodon idella)白细胞介素-8的克隆与鉴定[D]. 苏州: 苏州大学: 29-39.
|
卢全章, 1998. 草鱼头肾免疫细胞组成和数量变化[J]. 动物学研究, 19(1): 11-16. |
李健, 孟繁星, 黎明, 等, 2019. 大弹涂鱼白细胞介素-8基因分子进化及不同病原体刺激对其表达的影响[J]. 水产学报, 43(11): 2290-2303. |
吴后波, 潘金培, 2001. 弧菌属细菌及其所致海水养殖动物疾病[J]. 中国水产科学, 8(1): 89-93. |
何志章, 1995. 中华乌塘鳢养成期的病害防治[J]. 广西水产科技(S1): 36-37.
|
沈斌, 魏可, 殷小龙, 等, 2019. 养殖中华乌塘鳢致病性弧菌的分离鉴定[J]. 浙江海洋大学学报(自然科学版), 38(5): 387-394. |
陈吉刚, 杜海韬, 熊娟, 等, 2010. 鲈鱼白细胞介素-8 cDNA序列的克隆与原核表达[J]. 上海海洋大学学报, 19(4): 447-451. |
胡云凤, 孙军, 林小涛, 等, 2010. 斜带石斑鱼白细胞介素8基因的克隆与表达分析[J]. 暨南大学学报(自然科学版), 31(3): 324-330. |
钟爱华, 李明云, 2002. 中华乌塘鳢的生物学特性及人工育苗研究进展[J]. 浙江海洋学院学报(自然科学版), 21(3): 269-272. |
ALEJO A, TAFALLA C, 2011. Chemokines in teleost fish species[J]. Developmental & Comparative Immunology, 35(12): 1215-1222. |
BAGGIOLINI M, CLARK-LEWIS I, 1992. Interleukin-8, a chemotactic and inflammatory cytokine[J]. FEBS Letters, 307(1): 97-101. DOI:10.1016/0014-5793(92)80909-Z |
CAI Z H, GAO C P, ZHANG Y, et al, 2009. Functional characterization of the ELR motif in piscine ELR+CXC-like chemokine[J]. Marine Biotechnology, 11(4): 505-512. DOI:10.1007/s10126-008-9165-y |
CARRIERO M M, HENRIQUE-SILVA F, MEIRA C M, et al, 2020. Molecular characterization and gene expression analysis of the pro-inflammatory cytokines IL-1β and IL-8 in the South American fish Piaractus mesopotamicus challenged with Aeromonas dhakensis[J]. Genetics and Molecular Biology, 43(4): e20200006. DOI:10.1590/1678-4685-gmb-2020-0006 |
CHEN J, YANG X, XU H, et al, 2021. Molecular characterization and expression profiles of two interleukin genes IL-8 and IL-10 in Pacific cod (Gadus macrocephalus)[J]. Aquaculture Reports, 21: 100788. DOI:10.1016/j.aqrep.2021.100788 |
CLARK-LEWIS I, SCHUMACHER C, BAGGIOLINI M, et al, 1991. Structure-activity relationships of interleukin-8 determined using chemically synthesized analogs. Critical role of NH2-terminal residues and evidence for uncoupling of neutrophil chemotaxis, exocytosis, and receptor binding activities[J]. Journal of Biological Chemistry, 266(34): 23128-23134. DOI:10.1016/S0021-9258(18)54472-0 |
CORRIPIO-MIYAR Y, BIRD S, TSAMOPOULOS K, et al, 2007. Cloning and expression analysis of two pro-inflammatory cytokines, IL-1β and IL-8, in haddock (Melanogrammus aeglefinus)[J]. Molecular Immunology, 44(6): 1361-1373. DOI:10.1016/j.molimm.2006.05.010 |
DE WAAL MALEFYT R, ABRAMS J, BENNETT B, et al, 1991. Interleukin 10(IL-10) inhibits cytokine synthesis by human monocytes: an autoregulatory role of IL-10 produced by monocytes[J]. Journal of Experimental Medicine, 174(5): 1209-1220. DOI:10.1084/jem.174.5.1209 |
FIORENTINO D F, ZLOTNIK A, MOSMANN T R, et al, 1991. IL-10 inhibits cytokine production by activated macrophages[J]. The Journal of Immunology, 147(11): 3815-3822. DOI:10.4049/jimmunol.147.11.3815 |
GAO B, JEONG W I, TIAN Z G, 2008. Liver: an organ with predominant innate immunity[J]. Hepatology, 47(2): 729-736. |
HERATH H M L P B, ELVITIGALA D A S, GODAHEWA G I, et al, 2016. Molecular characterization and comparative expression analysis of two teleostean pro-inflammatory cytokines, IL-1β and IL-8, from Sebastes schlegeli[J]. Gene, 575(2): 732-742. DOI:10.1016/j.gene.2015.09.082 |
HUGHES C E, NIBBS R J B, 2018. A guide to chemokines and their receptors[J]. The FEBS Journal, 285(16): 2944-2971. DOI:10.1111/febs.14466 |
HUISING M O, STOLTE E, FLIK G, et al, 2003. CXC chemokines and leukocyte chemotaxis in common carp (Cyprinus carpio L.)[J]. Developmental & Comparative Immunology, 27(10): 875-888. |
JOO M S, CHOI K M, KANG G, et al, 2022. Red sea bream interleukin (IL)-1β and IL-8 expression, subcellular localization, and antiviral activity against red sea bream iridovirus (RSIV)[J]. Fish & Shellfish Immunology, 128: 360-370. |
KENDRICK A A, HOLLIDAY M J, ISERN N G, et al, 2014. The dynamics of interleukin-8 and its interaction with human CXC receptor I peptide[J]. Protein Science, 23(4): 464-480. DOI:10.1002/pro.2430 |
KIM K H, KIM H C, PARK C J, et al, 2019. Interleukin-8 (IL-8) expression in the olive flounder (Paralichthys olivaceus) against viral hemorrhagic septicemia virus (VHSV) challenge[J]. Development and Reproduction, 23(3): 231-238. DOI:10.12717/DR.2019.23.3.231 |
LARSEN C G, ANDERSON A O, OPPENHEIM J J, et al, 1989. Production of interleukin-8 by human dermal fibroblasts and keratinocytes in response to interleukin-1 or tumour necrosis factor[J]. Immunology, 68(1): 31-36. |
LETUNIC I, KHEDKAR S, BORK P, 2021. SMART: recent updates, new developments and status in 2020[J]. Nucleic Acids Research, 49(D1): D458-D460. DOI:10.1093/nar/gkaa937 |
LI C, YAO C L, 2013. Molecular and expression characterizations of interleukin-8 gene in large yellow croaker (Larimichthys crocea)[J]. Fish & Shellfish Immunology, 34(3): 799-809. |
LIVAK K J, SCHMITTGEN T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method[J]. Methods, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
MADEIRA F, PEARCE M, TIVEY A R N, et al, 2022. Search and sequence analysis tools services from EMBL-EBI in 2022[J]. Nucleic Acids Research, 50(W1): W276-W279. DOI:10.1093/nar/gkac240 |
MATSUSHIMA K, BALDWIN E T, MUKAIDA N, 1992. Interleukin-8 and MCAF: novel leukocyte recruitment and activating cytokines[J]. Chemical Immunology, 51: 236-265. |
MU Y N, WANG K R, AO J Q, et al, 2015. Molecular characterization and biological effects of a CXCL8 homologue in large yellow croaker (Larimichthys crocea)[J]. Fish & Shellfish Immunology, 44(2): 462-470. |
MURPHY P M, TIFFANY H L, 2009. Cloning of complementary DNA encoding a functional human interleukin-8 receptor. Science. 1991.253: 1280-1283[J]. Journal of Immunology, 183(5): 2898-2901. |
NAJAKSHIN A M, MECHETINA L V, ALABYEV B Y, et al, 1999. Identification of an IL-8 homolog in lamprey (Lampetra fluviatilis): early evolutionary divergence of chemokines[J]. European Journal of Immunology, 29(2): 375-382. DOI:10.1002/(SICI)1521-4141(199902)29:02<375::AID-IMMU375>3.0.CO;2-6 |
NGUYEN T T T, NGUYEN H T, WANG P C, et al, 2017. Identification and expression analysis of two pro-inflammatory cytokines, TNF-α and IL-8, in cobia (Rachycentron canadum L.) in response to Streptococcus dysgalactiae infection[J]. Fish & Shellfish Immunology, 67: 159-171. |
SEPPOLA M, LARSEN A N, STEIRO K, et al, 2008. Characterisation and expression analysis of the interleukin genes, IL-1beta, IL-8 and IL-10, in Atlantic cod (Gadus morhua L.)[J]. Molecular Immunology, 45: 887-897. DOI:10.1016/j.molimm.2007.08.003 |
SHEN B, WEI K, YANG J J, et al, 2021. Molecular characterization and functional analyses of a hepcidin gene from Bostrychus sinensis[J]. Aquaculture, 544: 737114. DOI:10.1016/j.aquaculture.2021.737114 |
SUN J S, ZHAO L, SUN L, 2011. Interleukin-8 of Cynoglossus semilaevis is a chemoattractant with immunoregulatory property[J]. Fish & Shellfish Immunology, 30(6): 1362-1367. |
TAMURA K, STECHER G, KUMAR S, 2021. MEGA11: molecular evolutionary genetics analysis version 11[J]. Molecular Biology and Evolution, 38(7): 3022-3027. DOI:10.1093/molbev/msab120 |
VANDERCAPPELLEN J, VAN DAMME J, STRUYF S, 2008. The role of CXC chemokines and their receptors in cancer[J]. Cancer Letters, 267(2): 226-244. DOI:10.1016/j.canlet.2008.04.050 |
WANG G L, WANG M C, ZHANG X W, et al, 2017. Molecular cloning, biological effect, and tissue distribution of interleukin-8 protein in mandarin fish (Siniperca chuasti) upon Flavobacterium columnare infection[J]. Fish & Shellfish Immunology, 66: 112-119. |
WANG X W, MA G Q, ZHANG R, et al, 2019. Molecular characterization and biological functioning of interleukin-8 in Siberian sturgeon (Acipenser baeri)[J]. Fish & Shellfish Immunology, 90: 91-101. |
WATERHOUSE A, BERTONI M, BIENERT S, et al, 2018. SWISS-MODEL: homology modelling of protein structures and complexes[J]. Nucleic Acids Research, 46(W1): W296-W303. DOI:10.1093/nar/gky427 |
WEI K, DING Y H, YIN X L, et al, 2020. Molecular cloning, expression analyses and functional characterization of a goose-type lysozyme gene from Bostrychus sinensis (family: Eleotridae)[J]. Fish & Shellfish Immunology, 96: 41-52. |
WILKINS M R, GASTEIGER E, BAIROCH A, et al, 1999. Protein identification and analysis tools in the ExPASy server [M] // LINK A J. 2-D Proteome Analysis Protocols. Totowa: Humana Press: 531-552.
|
 2024, Vol. 55
2024, Vol. 55


