
中国海洋湖沼学会主办。
文章信息
- 邓远, 李振通, 苏金枝, 黎琳琳, 邱弈树, 丁小雨, 段鹏飞, 王心怡, 王林娜, 刘阳, 马文辉, 赵侠, 李胜忠, 田永胜. 2024.
- DENG Yuan, LI Zhen-Tong, SU Jin-Zhi, LI Lin-Lin, QIU Yi-Shu, DING Xiao-Yu, DUAN Peng-Fei, WANG Xin-Yi, WANG Lin-Na, LIU Yang, MA Wen-Hui, ZHAO Xia, LI Sheng-Zhong, TIAN Yong-Sheng. 2024.
- 金虎杂交斑三倍体血细胞特征及染色体核型分析
- BLOOD CELL CHARACTERISTICS AND CHROMOSOMAL KARYOTYPE ANALYSIS OF TRIPLOID HYBRID GROUPER
- 海洋与湖沼, 55(2): 509-516
- Oceanologia et Limnologia Sinica, 55(2): 509-516.
- http://dx.doi.org/10.11693/hyhz20231100243
文章历史
-
收稿日期:2023-11-16
收修改稿日期:2024-01-08
2. 农业农村部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 山东青岛 266071;
3. 中国水产科学研究院海南创新研究院 海南三亚 572000;
4. 莱州明波水产有限公司 山东莱州 261400
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs; Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Hainan Innovation Research Institute, Chinese Academy of Fishery Sciences, Sanya 572000, China;
4. Mingbo Aquatic Co., Ltd., Laizhou 261400, China
多倍体诱导一直是鱼类遗传育种研究的热点之一, 不育三倍体鱼在生长和肉质方面具有显著优势(Piferrer et al, 2009)。通过研究杂交种三倍体诱导培育, 可以深入了解杂交种倍性变化的遗传特性和基因效应, 有助于发展更有效的遗传改良策略(Castro et al, 2003)。目前国内外已经在黄颡鱼(Pelteobagrus fulvidraco) (宋立民等, 2009)、大西洋鲑(Salmo salar) (Lincoln et al, 1974)、团头鲂(Megalobrama amblycephala) (张新辉等, 2013)、乌鳢(Ophiocephalus argus) (邹远超等, 2017)、虹鳟(Oncorhynchus mykiss) (Aydın et al, 2021)等多种鱼类中成功诱导了三倍体。并且在湘云鲫[Carassius auratus xiang-yun (Triploid)]、异育银鲫(Carassius auratus gibelio)等鱼类建立了完善的三倍体育种技术体系, 三倍体品种获得了规模化推广养殖(刘少军等, 2010; 黄进等, 2023)。
目前, 国内石斑鱼育种主要以杂交育种为主, 已经培育出“虎龙杂交斑”、“云龙石斑鱼”和“金虎杂交斑”3个新品种(张海发等, 2018; 田永胜等, 2017, 2022), 杂交种在养殖产业占比达70%以上; 但是杂交种的广泛养殖有可能发生原种遗传资源基因渐渗的情况, 杂交种三倍化诱导培育可以克服这一缺点, 既可以保持杂交后代优良的生长性状, 同时可以避免杂交后代继续繁育产生后代。“金虎杂交斑”是棕点石斑鱼♀×蓝身大斑石斑鱼♂的杂交子代, 具有生长速度快、耐低温、耐低氧等优点(田永胜等, 2019), 其性腺发育与母本棕点石斑相比相对滞后(邱弈树等, 2023)。利用“金虎杂交斑”开展三倍体诱导将为石斑鱼杂交种遗传改良开辟新的途径。本团队采用静水压诱导方法培育出金虎杂交斑三倍体群体, 为石斑鱼三倍体生物学研究提供了丰富材料。本研究通过DNA含量测定鉴定出三倍体金虎杂交斑, 对三倍体金虎杂交斑红细胞的大小、形态以及染色体核型进行了比较, 以了解不同倍性金虎杂交斑红细胞的特征及染色体核型的变化。为生产上快速准确的确定多倍体金虎杂交斑倍性及合理利用杂交种三倍体种质资源提供遗传参数。
1 材料与方法 1.1 材料蓝身大斑石斑鱼亲鱼来自莱州明波水产有限公司, 为工厂化条件下培育的成熟雄性亲鱼, 在5~8月性成熟季节采集雄鱼精子, 利用精子冷冻保存液ELs-3冷冻保存精子(Tian et al, 2015), 建立冷冻精子库。棕点石斑鱼亲鱼来自海南省乐东黎族自治县养殖场, 在3~10月份每月初产卵期人工采集成熟卵子。
在繁殖季节将蓝身大斑石斑鱼冷冻精子运输到海南, 与采集的棕点石斑鱼卵进行人工授精, 授精后将受精卵平均分成4份, 1份作为对照组, 3份经过静水压力处理, 处理起始时间为受精后5 min, 压强为60 MPa, 持续时间为5 min, 作为诱导组。将受精卵运输到莱州明波水产有限公司工厂化循环水养殖车间人工孵化, 进行苗种培育和养殖, 养殖条件为: 水体体积40 m3, 水温21~26 ℃, 盐度28~30, 溶解氧6~9 mg/L, 投喂人工配合饲料(三通生物工程有限公司), 育苗期每天投喂2次, 后期根据鱼苗生长规格调整饲料和投喂量。随机抽取3月龄二倍体和三倍体诱导组金虎杂交斑各100尾, 二倍体平均体重为(34.43±12.71) g, 平均体长为(10.00±1.32) cm, 三倍体诱导组平均体重为(53.90±9.58) g, 平均体长为(12.13±0.68) cm, 抽取尾静脉血用于DNA含量测定。
1.2 方法 1.2.1 血液采集采用尾静脉抽血的方式, 首先抽取的0.5 mL血液, 不加抗凝剂, 置于加了电镜固定液的1.5 mL离心管中, 4 ℃保存。在载玻片上滴一滴未抗凝的血直接用于血涂片制备。用EDTA-2K配制抗凝剂, 按抗凝剂和血液1︰1的比例抽血0.4 mL置于离心管中, 4 ℃保存, 用于测定DNA相对含量。
1.2.2 DNA含量测定将每尾鱼的抗凝血, 使用移液枪从底部吸取35 μL血液, 加入到1 mL 0.01 mol/L的PBS缓冲溶液中, 混匀, 洗涤细胞, 离心3 min (3 000 r/min), 弃上清, 加入0.5 mL PBS溶液, 混匀。吸管取单细胞悬液, 滴入1.5 mL –20 ℃预冷的无水乙醇中, 4 ℃固定3 h以上。将固定后的细胞悬液离心3 min (6 000 r/min), 弃上清液, PBS洗涤2次, 加入50 μg/mL的RNA酶10 μL, 30 min后再加入1 g/L的PI染液20~50 μL, 置于4 ℃冰箱中染色30 min, 300目筛绢网过滤后, 使用流式细胞仪(Beckman CytoFlex, China)测定DNA含量, 所测得的流式峰值图像, 使用ModFit软件分析数据。
1.2.3 血涂片制备取一滴血置于干净的显微镜载玻片上, 用盖玻片轻轻涂抹血, 涂片后用甲醇固定, 空气中干燥, 用10%吉姆萨染色剂将涂片染色15 min后。用双蒸水适当清洗涂片上过量的吉姆萨染色剂。使载玻片再次干燥, 然后用二苯乙烯增塑剂和二甲苯(DPX)和盖玻片封片。在Olympus CX43正置显微镜油镜下观察拍照, 将每个片子红细胞划分为五个不同的区域, 每个区域测量10个红细胞。测量红细胞长轴A、短轴B以及细胞核长轴a、短轴b, 根据公式: 表面积S=πAB/4、体积V=A2B/1.91, 计算红细胞和细胞核的表面积与体积(张庆飞等, 2021)。
1.2.4 头肾-PHA注射法制备染色体取三倍体和二倍体金虎杂交斑各3尾, 向实验鱼胸腔内注射植物凝集素(PHA)溶液6 μg/g (北京索莱宝科技有限公司)。12 h后, 向其胸腔同一位置内注射秋水仙素溶液10 μg/g (上海吉至生化科技有限公司)。2 h后用麻醉剂MS-222 (20 g/mL)将实验鱼麻醉, 并取出头肾用于染色体制备。在等渗NaCl溶液(0.9%)中适当清洗肾脏, 去除多余的血液, 碎片放入1.5 mL离心管中, 加0.5 mL生理盐水研磨碎后离心。加入提前预热的1 mL 0.075 mol/L的KCl溶液, 37 ℃低渗处理30 min。在低渗处理完的细胞悬液中加入0.5 mL新鲜配制预冷的卡诺氏固定液, 在4 ℃冰箱中预固定10 min。将预固定后的细胞悬液离心3 min (6 000 r/min), 取沉淀, 加1 mL固定液混匀, 室温下固定30 min; 重复上述操作3次, 第4次离心后, 向细胞沉淀中加入1 mL卡诺氏固定液, 放入4 ℃冰箱中待用。将干净的载玻片在盛有蒸馏水的烧杯中, 70 ℃恒温水域预热30 min, 吸取细胞悬液以一定高度滴1~2滴在载玻片上, 使细胞破碎展开, 室温下自然晾干, 晾干后用10%吉姆萨染液染色30 min, 之后用蒸馏水冲洗, 在室温下自然干燥。
1.2.5 核型分析利用Olympus CX43正置显微镜的油镜观察拍照, 选取200个图像清晰、数目完整的分裂相计数, 利用Image J、Photo-shop等软件处理图像。根据Levan等(1964)提出的染色体类型划分标准选取5个形态清晰、分散良好的分裂相进行参数测量分析, 制备染色体核型图。
1.3 数据处理实验数据用采用SPSS27.0软件进行T-test统计检验分析(张庆飞等, 2021), P < 0.01为差异极显著。
2 结果与分析 2.1 红细胞DNA相对含量以二倍体金虎杂交斑的DNA含量为对照, 用流式细胞仪对诱导实验组(三倍体)的DNA含量进行测定, 如图 1所示。X轴表示荧光含量, Y轴表示细胞数目, 图 1a为二倍体金虎杂交斑的DNA峰值图, 荧光含量为40.9; 图 1b为金虎杂交斑三倍体的DNA峰值图, 荧光含量为59.25, 二倍体和三倍体的荧光含量比为1︰1.45, 接近于1︰1.5的理论值。经检测的100尾金虎杂交斑诱导组中, 有60尾三倍体金虎杂交斑, 三倍体率为60%。
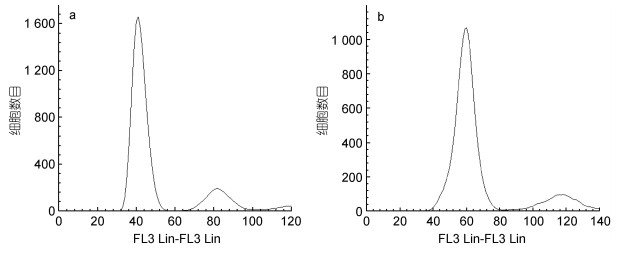 |
| 图 1 二倍体金虎杂交斑(a)和三倍体金虎杂交斑(b)红细胞DNA相对含量测量峰图 Fig. 1 Peak chromatograms of relative DNA content measurements in red blood cells of diploid hybrid grouper (a) and triploid hybrid grouper (b) |
在显微镜下和扫描电镜下均可以观察到经流式细胞仪检测出的三倍体金虎杂交斑红细胞更狭长。2种倍性金虎杂交斑血细胞测量结果见表 1, 结果显示: 三倍体金虎杂交斑红细胞与二倍体相比, 三倍体细胞长轴、短轴、细胞表面积、细胞体积分别为二倍体的1.34、1.14、1.54、2.07倍(P < 0.01), 这些指标中尤以细胞长轴、细胞表面积、细胞体积最为突出。三倍体金虎杂交斑的细胞核长轴、细胞核短轴、细胞核表面积、细胞核体积分别为二倍体的1.22、1.05、1.29、1.57倍(P < 0.01)。
| 项目 | 三倍体 | 二倍体 | 三倍体/二倍体 |
| 细胞长轴/μm | 16.78±1.35** | 12.49±0.91 | 1.34 |
| 细胞短轴/μm | 8.64±0.70** | 7.56±0.72 | 1.14 |
| 细胞核长轴/μm | 6.88±0.65** | 5.62±0.56 | 1.22 |
| 细胞核短轴/μm | 3.69±0.45** | 3.50±0.44 | 1.05 |
| 细胞表面积/μm2 | 113.67±11.68** | 73.98±7.25 | 1.54 |
| 细胞体积/μm3 | 1 278.64±207.72** | 618.23±89.60 | 2.07 |
| 细胞核表面积/μm2 | 19.85±2.54** | 15.45±2.43 | 1.29 |
| 细胞核体积/μm3 | 91.57±17.17** | 58.48±13.40 | 1.57 |
| 注: 表中**代表差异极显著(P < 0.01) | |||
三倍体金虎杂交斑和二倍体金虎杂交斑的血涂片在Olympus CX43正置显微镜的油镜下观察拍照, 血细胞形态如图 2所示, 显示了红细胞及其核的大小和形状的变化。在形态上三倍体和二倍体金虎杂交斑血细胞均呈圆形或椭圆形, 其形状无明显差别, 但其大小有较大差异。由于多倍体倍性的增加导致异形红细胞出现概率增大, 在红细胞扫描电镜图中发现三倍体金虎杂交斑红细胞(图 2a)相较于二倍体金虎杂交斑(图 2b)更为扁平, 边缘不整齐, 有锯齿。三倍体金虎杂交斑血涂片中发现较高比例的异形红细胞, 大致可分为两种类型的异形红细胞: 一类是红细胞胞质异形, 另一类是红细胞核异形。如图 2c、图 2d中为红细胞胞质异形(白箭头所示), 图 2e中为红细胞核异形(蓝色箭头所示), 而在二倍体金虎杂交斑图 2f中几乎没有观察到异形红细胞。
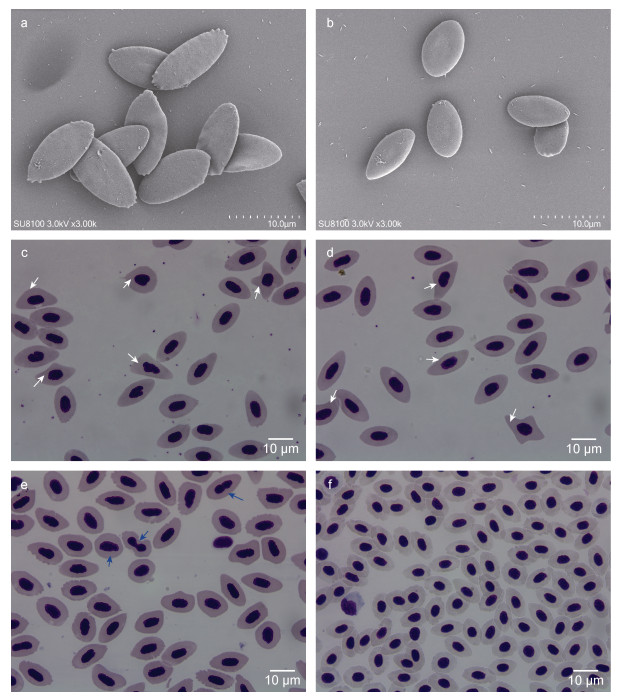 |
| 图 2 金虎杂交斑三倍体、二倍体红细胞 Fig. 2 Triploid and diploid red blood cells of the hybrid grouper 注: a. 三倍体红细胞表面结构; b. 二倍体红细胞表面结构; c. 三倍体细胞质异形红细胞; d. 三倍体细胞质异形红细胞; e. 三倍体细胞核异形红细胞; f. 二倍体红细胞。白色箭头表示红细胞胞质异形; 蓝色箭头表示红细胞核异形 |
金虎杂交斑三倍体的染色体数目在60以下的细胞数目为15, 占比7.5%; 在61~64的细胞数目为27, 占比13.5%; 在65~69的细胞数目51, 占比为25.5%; 70~72的有103个细胞, 占比51.5%; 大于72的细胞数目为4, 占比2% (表 2)。完整的中期分裂相大部分数目在70~72条, 染色体数目分布范围广泛, 但是在这个范围内72条染色体有57个细胞占55.3%, 因此确定染色体众数为72。
| 项目 | 染色体数目 | ||||
| ≤60 | 61~64 | 65~69 | 70~72 | > 72 | |
| 细胞数目 | 15 | 27 | 51 | 103 | 4 |
| 百分比/% | 7.5 | 13.5 | 25.5 | 51.5 | 2 |
进行精细的核型分析表明静水压诱导组中存在两种倍性的金虎杂交斑, 三倍体金虎杂交斑的染色体数目为72 (图 3a), 二倍体金虎杂交斑的染色体数目为48 (图 3b), 三倍体金虎杂交斑包括69条端部着丝粒(t)、2条亚中部着丝粒(sm)、1条中部着丝粒(m), 染色体臂指数(NF)为75, 其核型公式为3n=72=1m+ 2sm+69t, NF=75。染色体的大小范围为3.26~5.16 μm (表 3)。金虎杂交斑二倍体有46条端部着丝粒染色体(t), 2条亚中部着丝粒染色体(sm), 核型公式为2n= 48=2sm+46t, NF=50。另外, 在金虎杂交斑二倍体和三倍体的染色体中未发现性染色体及次缢痕, 也未发现随体。
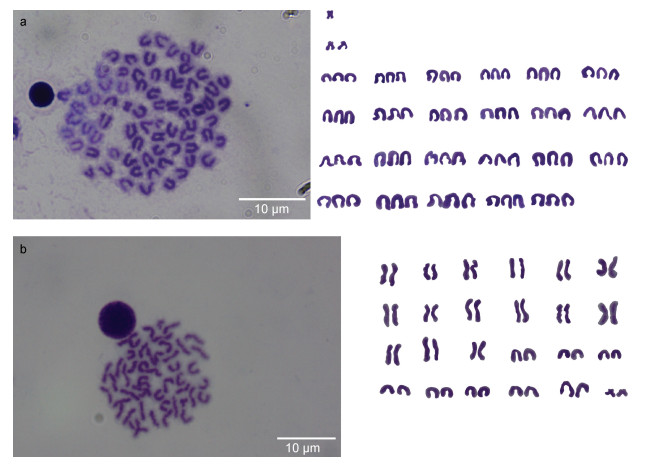 |
| 图 3 三倍体金虎杂交斑(a)和二倍体金虎杂交斑(b)中期分裂相及核型图 Fig. 3 The metaphase and karyotype of the triploid hybrid grouper (a) and diploid hybrid grouper (b) |
| 序号 | 染色体长度(M ± SD) | 染色体臂比(M ± SD) | 染色体类型 |
| 1 | 5.16±0.13 | ∞ | t |
| 2 | 4.92±0.04 | ∞ | t |
| 3 | 4.77±0.04 | ∞ | t |
| 4 | 4.66±0.02 | ∞ | t |
| 5 | 4.57±0.03 | ∞ | t |
| 6 | 4.5±0.02 | ∞ | t |
| 7 | 4.42±0.02 | ∞ | t |
| 8 | 4.35±0.01 | ∞ | t |
| 9 | 4.29±0.03 | ∞ | t |
| 10 | 4.23±0.02 | ∞ | t |
| 11 | 4.18±0.02 | ∞ | t |
| 12 | 4.13±0.01 | ∞ | t |
| 13 | 4.1±0.01 | ∞ | t |
| 14 | 4.07±0.02 | ∞ | t |
| 15 | 4.03±0.01 | ∞ | t |
| 16 | 3.97±0.01 | ∞ | t |
| 17 | 3.92±0.02 | ∞ | t |
| 18 | 3.86±0.02 | ∞ | t |
| 19 | 3.8±0.03 | ∞ | t |
| 20 | 3.72±0.04 | ∞ | t |
| 21 | 3.63±0.02 | ∞ | t |
| 22 | 3.54±0.03 | ∞ | t |
| 23 | 3.26±0.11 | ∞ | t |
| 24 | 4.1±0.78 | 1.63±0.26 | m |
| 24 | 3.57±0.14 | 2.14±0.02 | sm |
| 24 | 3.38±0.18 | 2.64±0.30 | sm |
流式细胞术是一种测量细胞DNA含量的技术, 因为它能在短时间内敏感测量大量染色核的荧光强度, 提供统计上精度高、客观性强的可重复性结果(Sari et al, 1999)。对大量荧光染色细胞核进行流式细胞分析已被证明是倍性测定的理想工具, 在鱼类中的应用越来越广泛(Lynch et al, 2000; Peruzzi et al, 2003)。如大黄鱼(郑春静等, 2006); 黄姑鱼(卢磊等, 2023)、虹鳟(陈落落等, 2019)、乌蒙山金线鲃(华泽祥等, 2022)、团头鲂(张新辉等, 2013)等鱼类二倍体和三倍体鉴定; 此外, 流式细胞术在菊芋(赵孟良等, 2021)、棉花(王娅丽等, 2022)、油茶(叶天文等, 2021)等多种植物中也被广泛应用。证明流式细胞术在DNA相对含量测定和倍性分析方面的可靠性, 可以应用于大量样品的倍性测定分析。在本研究中利用流式细胞术测定了金虎杂交斑三倍体和二倍体的红细胞DNA相对含量, 三倍体为二倍体的1.45倍, 与染色体计数和红细胞测量的结果是一致的, 证明利用静水压法可诱导培育出三倍体金虎杂交斑。
3.2 红细胞大小、形态的比较不同倍性鱼的红细胞在形态和大小上存在差异(朱蓝菲等, 1992; 刘巧等, 2004; 邹曙明等, 2006)。因此, 鱼类红细胞核体积之比可以用于鱼类倍性的鉴定。理论值推测鱼类三倍体与二倍体红细胞核体积比为1.5︰1 (楼允东, 1999), 不同鱼类细胞核体积比不同, 乌鳢三倍体与二倍体的细胞核体积之比为1.6︰1 (邹远超等, 2017); 黄颡鱼三倍体细胞核体积是二倍体的1.45倍(刘金兰等, 2014); 乌克兰鳞三倍体的细胞核体积为二倍体的1.62︰1 (王金雨, 2010)。本实验中, 金虎杂交斑三倍体与二倍体的细胞核体积比为1.57︰1, 细胞核表面积之比为1.28︰1, 接近于理论值1.5︰1和1.3︰1 (楼允东, 1984)。由于三倍体鱼增加了一组染色体, 三倍体的红细胞形态发生了变化, 细胞形态和细胞大小的变化被认为细胞质对核体积变化的调节(刘少军等, 2003), Benfey(1999)发现三倍体红细胞的细胞长轴比细胞短轴显著增大。本研究中, 金虎杂交斑三倍体与二倍体的红细胞长轴有极显著差异, 在三倍体的虹鳟(韩英等, 2007)、黄颡鱼(宋立民等, 2009)、大黄鱼(林琪等, 2004)等鱼类中也观察到这一现象。因此, 利用红细胞比较测量法鉴定金虎杂交斑二倍体与三倍体具有一定的参考价值。同时在金虎杂交斑三倍体中观察到一定比例的异常红细胞, 如红细胞不规则不对称、凹陷或中间凸起、胞核偏离中心、弯曲变形等, 并发现少量的葫芦状、哑铃状、念珠状细胞核, 这种异形现象在三倍体的乌鳢(邹远超等, 2017)、虹鳟(陈侠君等, 2010)、黄颡鱼(刘金兰等, 2014)、团头鲂(邹曙明等, 2006)等鱼类血细胞研究中都有类似的发现, 因而这一异形现象也可以作为判断倍性的依据。
3.3 染色体数目及核型分析染色体组核型分析广泛应用于动植物染色体数目、结构变异分析和倍性鉴定(谭俊杰, 2019)。关于金虎杂交斑二倍体染色体核型已有报道, 吴玉萍等(2021)的研究表明二倍体金虎杂交斑的染色体数目为48条, 核型公式是2n=48=2sm+46t, 本研究与其结果一致。目前对三倍体石斑鱼染色体核型的研究仅见于染色体数目倍性鉴定(Huang et al, 2016a; Zhang et al, 2023), 而详细核型分析比较少。本文首次对三倍体金虎杂交斑的染色体核型进行详细分析, 与大部分二倍体石斑鱼的核型分类一样, 在核型中有大量的端部着丝粒染色体(t), 少部分为中部着丝粒染色体(m)和亚中部着丝粒染色体(sm)。三倍体金虎杂交斑的核型公式为3n=72=1m+2sm+69t, 理论上三倍体应具有来自母本的两组染色体和来自父本的一组染色体(Qin et al, 2014), 但本实验只存在一条中部着丝粒染色体(m)。这可能是因为在细胞的生长发育过程中, 染色体呈现周期性变化, 有丝分裂中期虽然是观察染色体的最好时期, 但仍受外界环境影响。例如, 制备染色体过程中秋水仙素的浓度、培养温度等因素会导致染色体缩短, 细胞状态、低渗液种类及处理时间、固定液比例、滴片高度、冷热滴片法等因素会影响染色体的形态, 实验方法的不同以及测量误差等都可能导致实验结果出现误差(谭俊杰等, 2019)。二倍体和三倍体金虎杂交斑的染色体数目分别为48和72, 比值为1︰1.5, 与理论值相符。这与点带石斑鱼♀×鞍带石斑鱼♂杂交三倍体(E. coioides♀×E. lanceolatus♂) (Huang et al, 2016b)、冷休克诱导的棕点石斑鱼♀×鞍带石斑鱼♂ (E. fuscoguttatus♀×E. lanceolatus♂)杂交三倍体(Zhang et al, 2023)的研究结果一致。表明核型分析是鉴定多倍体及追踪染色体亲缘关系的有效方法。
4 结论综上所述, 本研究采用流式细胞仪、扫描电镜、染色体核型分析, 鉴定了金虎杂交斑三倍体和二倍体细胞的DNA含量、红细胞形态和染色体核型。发现金虎杂交斑三倍体和二倍体DNA含量比为1.45︰1; 三倍体红细胞长短轴、细胞核长短轴、细胞表面积、细胞体积、细胞核表面积、细胞核体积均大于二倍体; 三倍体染色体核型为3n=72=1m+2sm+69t, NF=75, 二倍体染色体核型为2n=48=2sm+46t, NF=50。研究结果表明, 采用静水压诱导可以产生金虎杂交斑三倍体, 同时为三倍体石斑鱼种质培育和鉴定提供了丰富的生物学基础。
王金雨, 2010. 乌克兰鳞鲤二、三倍体部分生物学性状的比较研究[D]. 天津: 天津农学院: 44-47.
|
王娅丽, 周利利, 王娜, 等, 2022. 利用流式细胞仪快速鉴定棉花倍性的方法比较[J]. 生物技术通报, 38(12): 144-148. |
卢磊, 陈睿毅, 杨阳, 等, 2023. 黄姑鱼三倍体的诱导、鉴定及其性腺发育特征[J]. 水生生物学报, 47(2): 290-297. |
叶天文, 袁德义, 李艳民, 等, 2021. 海南油茶的倍性鉴定[J]. 林业科学, 57(7): 61-69. |
田永胜, 王林娜, 李振通, 等, 2022. 石斑鱼杂交新种质"金虎石斑鱼"培育及产业化应用[J]. 中国科技成果, 23(6): 3-4. |
田永胜, 陈张帆, 段会敏, 等, 2017. 鞍带石斑鱼冷冻精子与云纹石斑鱼杂交家系建立及遗传效应[J]. 水产学报, 41(12): 1817-1828. |
田永胜, 唐江, 马文辉, 等, 2019. 蓝身大斑石斑鱼冷冻精子(♂)与棕点石斑鱼(♀)杂交后代发育及生长特征分析[J]. 渔业科学进展, 40(6): 36-47. |
朱蓝菲, 桂建芳, 梁绍昌, 等, 1992. 人工同源和异源三倍体鲢的红细胞观察[J]. 水生生物学报, 16(1): 84-86. |
华泽祥, 郗啟文, 陈俊, 等, 2022. 冷休克法诱导乌蒙山金线鲃三倍体及其生长分析[J]. 淡水渔业, 52(5): 32-36. |
刘少军, 王静, 罗凯坤, 等, 2010. 淡水养殖新品种——湘云鲫2号[J]. 当代水产, 35(1): 62-63. |
刘少军, 孙远东, 周工健, 等, 2003. 异源四倍体鲫鲤成熟性腺和红细胞超微结构观察[J]. 自然科学进展, 13(2): 194-197. |
刘巧, 王跃群, 刘少军, 等, 2004. 不同倍性鲫鲤鱼血液及血细胞的比较[J]. 自然科学进展, 14(10): 1111-1117. |
刘金兰, 董少杰, 孙学亮, 等, 2014. 二、三倍体黄颡鱼红细胞及部分血液学指标比较研究[J]. 淡水渔业, 44(2): 97-100. |
吴玉萍, 田永胜, 李振通, 等, 2021. 棕点石斑鱼(♀)与蓝身大斑石斑鱼(♂)杂交子代核型分析[J]. 广东海洋大学学报, 41(1): 119-123. |
邱弈树, 丁小雨, 李振通, 等, 2023. 杂交种"金虎石斑鱼"与棕点石斑鱼卵巢发育及性类固醇激素水平比较[J]. 中国水产科学, 30(4): 457-467. |
邹远超, 李中, 李艳, 等, 2017. 乌鳢三倍体诱导及其生长[J]. 动物学杂志, 52(1): 75-84. |
邹曙明, 李思发, 蔡完其, 等, 2006. 团头鲂同源四倍体、倍间三倍体与二倍体红细胞的形态特征比较[J]. 中国水产科学, 13(6): 891-896. |
宋立民, 袁立来, 刘肖莲, 等, 2009. 2种鉴定黄颡鱼三倍体个体方法的比较[J]. 华中农业大学学报, 28(2): 207-209. |
张庆飞, 郭青松, 虞炯莹, 等, 2021. 彭泽鲫♀×兴国红鲤♂杂交四倍体子代倍性鉴定及染色体核型分析[J]. 淡水渔业, 51(4): 49-57. |
张海发, 刘晓春, 张勇, 等, 2018. 虎龙杂交斑[J]. 中国水产, (2): 75-78. |
张新辉, 罗伟, 高泽霞, 等, 2013. 团头鲂三倍体的诱导及其鉴定[J]. 水产科学, 32(9): 503-508. |
陈侠君, 王炳谦, 刘奕, 等, 2010. 二倍体和三倍体虹鳟外周血细胞的比较研究[J]. 东北农业大学学报, 41(1): 86-92. |
陈落落, 温海深, 李吉方, 等, 2019. 不同倍性虹鳟红细胞规格及血液学指标的比较[J]. 中国海洋大学学报, 49(3): 138-145. |
林琪, 吴建绍, 2004. 三倍体大黄鱼的诱导及其对生长、性腺发育的影响[J]. 水产学报, 28(6): 728-732. |
郑春静, 吴雄飞, 刘东海, 等, 2006. 用流式细胞仪检测大黄鱼三倍体[J]. 细胞生物学杂志, 28(2): 253-256. |
赵孟良, 任延靖, 田闵玉, 等, 2021. 基于流式细胞仪鉴定菊芋倍性方法的建立及应用[J]. 西北农林科技大学学报(自然科学版), 49(3): 138-146. |
黄进, 邓希海, 陈云, 2023. 异育银鲫中科5号苗种培育试验示范[J]. 异育银鲫中科5号苗种培育试验示范, (9): 66-71. |
韩英, 王琨, 张澜澜, 等, 2007. 二倍体与三倍体虹鳟(Oncorhynchus mykiss)红细胞及部分血液指标的比较[J]. 淡水渔业, 37(6): 52-55. |
楼允东, 1984. 国外对鱼类多倍体育种的研究[J]. 水产学报, 8(4): 343-356. |
楼允东, 1999. 鱼类育种学[M]. 北京: 中国农业出版社, 89.
|
谭俊杰, 2019北民湖野生鲫倍性鉴定研究[D]. 长沙: 湖南农业大学.
|
谭俊杰, 刘科均, 吕丽刚, 等, 2019. 基于微卫星标记的洞庭青鲫倍性鉴定[J]. 水产学报, 43(7): 1549-1559. |
AYDIN İ, KÜÇÜK E, POLAT H, et al, 2021. Growth and feed conversion ratio of diploid and triploid induced juvenile turbot reared at different water temperatures[J]. Aquaculture, 543: 736981. DOI:10.1016/j.aquaculture.2021.736981 |
BENFEY T J, 1999. The physiology and behavior of triploid fishes[J]. Reviews in Fisheries Science, 7(1): 39-67. DOI:10.1080/10641269991319162 |
CASTRO J, BOUZA C, SÁNCHEZ L, et al, 2003. Gynogenesis assessment using microsatellite genetic markers in turbot (Scophthalmus maximus)[J]. Marine Biotechnology, 5(6): 584-592. DOI:10.1007/s10126-003-0004-x |
HUANG W, LIU Q Z, XIE J F, et al, 2016a. Characterization of triploid hybrid groupers from interspecies hybridization (Epinephelus coioides ♀ × Epinephelus lanceolatus ♂)[J]. Aquaculture Research, 47(7): 2195-2204. DOI:10.1111/are.12672 |
HUANG W, QIN Q B, YANG H R, et al, 2016b. Formation of diploid and triploid hybrid groupers (hybridization of Epinephelus coioides ♀ × Epinephelus lanceolatus ♂) and their 5S gene analysis[J]. BMC Genetics, 17(1): 136. DOI:10.1186/s12863-016-0443-9 |
LEVAN A, FREDGA K, SANDBERG A A, 1964. Nomenclature for centromeric position on chromosomes[J]. Hereditas, 52(2): 201-220. |
LINCOLN R F, AULSTAD D, GRAMMELTVEDT A, 1974. Attempted triploid induction in Atlantic salmon (Salmo salar) using cold shocks[J]. Aquaculture, 4: 287-297. DOI:10.1016/0044-8486(74)90041-6 |
LYNCH M, FORCE A G, 2000. The origin of interspecific genomic incompatibility via gene duplication[J]. The American Naturalist, 156(6): 590-605. DOI:10.1086/316992 |
PERUZZI S, CHATAIN B, 2003. Induction of tetraploid gynogenesis in the European sea bass (Dicentrarchus labrax L.)[J]. Genetica, 119(2): 225-228. DOI:10.1023/A:1026077405294 |
PIFERRER F, BEAUMONT A, FALGUIÈRE J C, et al, 2009. Polyploid fish and shellfish: Production, biology and applications to aquaculture for performance improvement and genetic containment[J]. Aquaculture, 293(3/4): 125-156. |
QIN Q B, WANG Y D, WANG J, et al, 2014. The autotetraploid fish derived from hybridization of Carassius auratus red var. (female) × Megalobrama amblycephala (male)[J]. Biology of Reproduction, 91(4): 93, 1-11. |
SARI N, ABAK K, PITRAT M, 1999. Comparison of ploidy level screening methods in watermelon: Citrullus lanatus (Thunb.) Matsum. and Nakai[J]. Scientia Horticulturae, 82(3/4): 265-277. |
TIAN Y S, JIANG J, WANG N, et al, 2015. Sperm of the giant grouper: cryopreservation, physiological and morphological analysis and application in hybridizations with red-spotted grouper[J]. Journal of Reproduction and Development, 61(4): 333-339. DOI:10.1262/jrd.2014-087 |
ZHANG W W, FU S Y, FAN X, et al, 2023. Triploid production and performance in hybrid grouper (Epinephelus fuscoguttatus ♀ × Epinephelus lanceolatus ♂)[J]. Aquaculture, 563: 738891. DOI:10.1016/j.aquaculture.2022.738891 |
 2024, Vol. 55
2024, Vol. 55


