
中国海洋湖沼学会主办。
文章信息
- 郭怡彤, 江兴龙, 林茂, 翟少伟. 2024.
- GUO Yi-Tong, JIANG Xing-Long, LIN Mao, ZHAI Shao-Wei. 2024.
- 虾青素对饲料组胺胁迫下美洲鳗鲡(Anguilla rostrata)幼鱼生长性能、血清生化、肠道自由基水平及肠道菌群的影响
- EFFECTS OF ASTAXANTHIN ON GROWTH PERFORMANCE, SERUM BIOCHEMISTRY, INTESTINAL FREE RADICAL LEVEL AND INTESTINAL FLORA OF JUVENILE AMERICAN EEL (ANGUILLA ROSTRATA) UNDER DIETARY HISTAMINE STRESS
- 海洋与湖沼, 55(2): 526-535
- Oceanologia et Limnologia Sinica, 55(2): 526-535.
- http://dx.doi.org/10.11693/hyhz20230900196
文章历史
-
收稿日期:2023-09-27
收修改稿日期:2023-12-05
鳗鲡(Anguilla spp.), 俗称河鳗, 又称白鳝、青鳝等, 属鳗鲡目(Anguilliformes)、鳗鲡科(Anguillidae)鱼类, 其肉质鲜美, 营养丰富, 具有一定药膳价值, 是公认的水产珍品, 享有“水中人参”的美誉(王晓娟等, 2010)。自20世纪90年代中期以来, 鳗鲡一直是我国重要的水产养殖种类(张翔等, 2022), 也是我国养殖鱼类中唯一未解决人工繁殖的品种, 苗种完全依靠天然捕捞。当前, 我国鳗鲡的养殖品种以日本鳗鲡(Anguilla japonica)和美洲鳗鲡(Anguilla rostrata)为主(叶翚等, 2019); 其中日本鳗鲡主要在广东养殖, 美洲鳗鲡主要在福建、江西、浙江等地养殖。欧洲鳗鲡(Anguilla anguilla)曾是我国主要鳗鲡养殖品种之一, 但该品种属于《濒危野生动植物种国际贸易公约》CITES附录Ⅱ的濒危保护物种, 目前国内鳗苗进口量较少, 养殖数量极少(Mordenti et al, 2012)。鳗鲡属于肉食性鱼类, 对饲料蛋白质需求量及饲料原料的品质要求都很高, 多以高品质鱼粉, 尤其是优质白鱼粉为主要蛋白源(王晓娟等, 2010; 卢文麒, 2022)。近年来由于优质白鱼粉资源稀缺、价格攀升, 为降低鳗鲡养殖过程中饲料成本, 红鱼粉在鳗鲡饲料中的使用比例逐渐升高。鳗鲡饲料中红鱼粉的大量使用带来饲料组胺影响鳗鲡健康及生长的问题日趋严重(卢文麒, 2022)。研究表明, 饲料中组胺水平过高使鱼体易产生氧化应激、炎症反应、降低机体非特异性免疫能力, 进而诱发一系列危害, 影响鳗鲡生长及机体健康(何英霞, 2019; 许琪娅, 2021; 陈如男, 2023)。从饲料组胺产生危害的作用途径来看, 导致鱼体氧化应激可能是最根本原因(Zhai et al, 2020)。目前, 为缓解鱼类养殖中不同种类胁迫因子导致的氧化应激, 通过饲料中添加可在体内发挥抗氧化作用的添加剂成为主要的技术措施之一(Zhai et al, 2020; 黄春红等, 2022)。已有饲料中添加300 mg/kg原花青素通过发挥体内抗氧化作用, 有效缓解534 mg/kg饲料组胺导致美洲鳗鲡幼鱼产生氧化应激、改善肝肠健康、促进生长的报道(何英霞, 2019)。而目前自然界中抗氧化能力最强物质是虾青素, 其缓解饲料组胺胁迫的效果也未见报道, 但可缓解高脂饲料胁迫下大口黑鲈(Micropterus salmoides) (Xie et al, 2020)、虹鳟(Oncorhynchus mykiss) (Zhao et al, 2023)、卵形鲳鲹(Trachinotus ovatus) (Fang et al, 2021), 饲料镉胁迫下卵形鲳鲹(Fang et al, 2022), 拥挤胁迫和水环境氨氮胁迫下黄颡鱼(Pelteobagrus fulvidraco) (Liu et al, 2016; 樊玉文等, 2022)等鱼类氧化应激, 改善生长性能。因此, 本试验在导致美洲鳗鲡幼鱼产生氧化应激的高组胺饲料中添加不同水平虾青素, 通过生长性能、血清生化、肠道自由基水平及肠道菌群等指标的变化, 评价虾青素对美洲鳗鲡幼鱼饲料组胺胁迫的缓解效果, 为其在鳗鲡饲料中的应用提供参考。
1 材料与方法 1.1 试验动物与试验设计试验动物为美洲鳗鲡幼鱼, 购自福建省福清市渔溪鳗场。将暂养7周后的400尾初始均重为(25.01±0.17) g/尾的试验鱼随机分为4个处理组, 即对照组、H组、H+Ast 4组和H+Ast 8组, 分别饲喂基础饲料、高组胺饲料及在高组胺饲料基础上添加4 mg/kg和8 mg/kg虾青素的饲料。H组饲料组胺水平设置参考以往研究中导致美洲鳗鲡幼鱼肠道氧化损伤最严重的饲料组胺水平为650 mg/kg (许琪娅, 2021), 基础饲料和高组胺饲料中的组胺水平分别为132 mg/kg和662 mg/kg (饲料组胺水平采用比色酶法测定, 试剂盒购自日本Kikkoman公司); 虾青素添加水平主要参考虹鳟(Zhao et al, 2023)、大口黑鲈(Xie et al, 2020)、卵形鲳鲹(Fang et al, 2021)在胁迫条件下添加2~10 mg/kg虾青素提高机体抗氧化能力的试验结果。每组4个重复, 每个重复25尾鱼。试验期为70 d。
1.2 试验饲料与饲养管理基础饲料为福清市海美生物科技有限公司生产的黑仔鳗粉状商业饲料, 主要由白鱼粉、红鱼粉、预糊化淀粉、膨化大豆、维生素和矿物元素组成。基础饲料的主要营养成分为: 粗蛋白46.14%、粗脂肪5.17%、灰分14.99%、水分5.44%。高组胺饲料通过在基础饲料中添加500 mg/kg组胺配制, 将组胺粉碎过120目筛, 与基础饲料采用逐级扩大法混匀, 再放入搅拌机中均匀搅拌20 min制成。组胺由上海源叶生物科技有限公司提供, 有效含量98%。H+Ast 4组和H+Ast 8组饲料通过在高组胺饲料中分别添加4 mg/kg和8 mg/kg虾青素配制, 将虾青素按剂量与高组胺饲料采用逐级扩大法混匀, 再放入搅拌机中均匀搅拌20 min制成。虾青素由厦门昶科生物科技有限公司提供, 有效含量0.30%。
养殖试验在集美大学水产试验场进行, 试验开始前将1 000尾试验鱼暂养在两个PVC养殖缸(直径1.1 m, 高0.8 m)中, 暂养期间每天早晚(6:00和18:00)将基础饲料与水按1︰1.1混合并搓揉成团状定时对试验鱼饱食投喂, 定时监测水质情况, 保持水温25~27 ℃, pH 7.2~7.7, 溶解氧7.8~9.2 mg/L, 氨氮浓度 < 0.2 mg/L。暂养7周后, 选出规格接近的400尾试验鱼随机分到16个具有循环水装置的圆柱形养殖桶(直径0.7 m, 高1.2 m, 体积为360 L, 注水量约300 L)中, 随机分为4组分别饲喂配制的饲料。试验期间每日投喂两次(6:00和18:00), 每次投饵1 h后收集桶底残饵, 详细记录每缸的投料量及残饵重, 并根据鳗鱼生长状况、养殖温度和水质的变化调整投喂量。试验鱼如有死亡, 立即捞出称重、记录。正式试验期间的水质与暂养期间一致。
1.3 样品采集与处理正式试验结束后, 美洲鳗鲡幼鱼禁食24 h, 称取并记录每组试验鱼重量, 每个重复随机取6尾鱼, 麻醉5~10 min后捞出(麻醉剂为丁香酚与无水乙醇按1︰9体积配制, 稀释后的丁香酚含量为100 mg/L), 用无菌纱布擦干鱼体表面水分和黏液, 每尾鱼尾静脉采血, 采集的血液样品在4 ℃冰箱静置24 h后3 000 r/min离心10 min, 离心后取上清保存于–80 ℃冰箱。采血后的鳗鲡用灭菌剪刀解剖, 剥离肠道, PBS缓冲液冲洗, 每个重复随机取4个肠道样品置于冻存管中经液氮速冻后保存于–80 ℃冰箱用于肠道自由基水平测定。每个重复随机取2尾鱼的肠道用于肠道菌群多样性分析, 分析工作由北京奥维森基因科技有限公司进行。
1.4 测定指标及方法 1.4.1 生长性能生长性能指标计算公式如下:
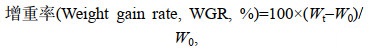 (1)
(1) (2)
(2) (3)
(3)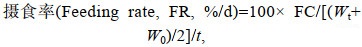 (4)
(4)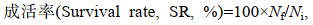 (5)
(5)式中, Wt(g)为平均每尾鱼终末体重(Final body weight, FBW), W0(g)为平均每尾鱼初始体重(Initial body weight, IBW), t(d)为饲喂天数, FC(g)为平均每尾鱼摄食总饲料量(Feed consumption) (风干样重), Nf为试验结束时鱼尾数, Ni为试验开始时鱼尾数。
1.4.2 血清生化指标酸性磷酸酶(ACP)和碱性磷酸酶(AKP)活性, 补体3(C3)、免疫球蛋白M(IgM)水平均使用南京建成生物工程研究所生产的试剂盒按照说明书步骤进行测定。
1.4.3 肠道自由基水平过氧化氢(H2O2)、一氧化氮(NO)、抗超氧阴离子能力(ASA)、抑制羟自由基能力(AHA)均使用南京建成生物工程研究所生产的试剂盒, 按照说明书步骤进行测定。
1.4.4 肠道菌群将保存于–80 ℃的肠道样品在冰上解冻, 经0.86%的生理盐水清洗后每条肠道约取0.05 g左右的样品, 加入725 μL 4 ℃的SLX-Mlus缓冲液, 然后冰水浴匀浆5 min, 得到的匀浆取上清液按照DNA Kit (Omega Bio-tek, Norcross, GA, U.S)操作手册要求进行所有肠道样品总DNA的提取, 之后再利用1%琼脂糖凝胶电泳检测抽提的DNA, 检验合格的样品由北京奥维森基因科技有限公司利用Illumina Mi Seq平台进行16S rDNA高通量测序, 测试原始数据下机后, 通过QIIME (v1.8.0)软件进行序列拼接、过滤及去嵌合体, 将优化后的序列进行OTU聚类及注释, 与Silva数据库对比并利用Mothur (version 1.31.2)软件进行Alpha多样性分析。检测具体操作步骤与数据分析过程与Shi等(2020)的研究一致。
1.5 统计分析美洲鳗鲡幼鱼生长性能、血清生化、肠道自由基水平等试验结果均使用平均值±标准差(Mean±SD)表示, 使用SPSS 25.0统计软件进行单因素方差分析(One-way ANOVA), 采用Duncan’s法作多重检验, P < 0.05表示差异显著。肠道菌群测序的原始数据经过进一步筛选得到有效数据, 通过QIIME Version v.1.9.0软件对Alpha多样性指标进行分析, 使用Pythonv2.7软件对肠道属水平差异菌进行Lefse分析, LDA Score筛选值为3.0, P < 0.05。Lefse分析是一种用于发现和解释高维度生物标识的分析工具, 通常可以进行两个或多个分组之间的比较, 同时分组内部进行亚组比较分析, 从而找到组间在丰度上有显著差异的物种。
2 结果 2.1 美洲鳗鲡幼鱼的生长性能由表 1可以看出, 与对照组相比, H组美洲鳗鲡幼鱼FBW、WGR、SGR、FE和FR均降低(P < 0.05); H+Ast组美洲鳗鲡幼鱼FBW、WGR、SGR、FE和FR均显著高于H组(P < 0.05), 与对照组无显著差异(P > 0.05)。H+Ast组之间各生长指标无显著差异(P > 0.05); 不同处理组SR无显著差异(P > 0.05)。
| 项目 | 对照组 | H组 | H+Ast4组 | H+Ast8组 |
| IBW/(g/尾) | 24.89±0.05 | 25.01±0.17 | 24.99±0.32 | 25.01±0.25 |
| FBW/(g/尾) | 38.27±3.30b | 35.32±0.77a | 38.78±1.31b | 39.45±0.21b |
| WGR/% | 59.76±4.03b | 43.70±1.76a | 55.20±4.44b | 57.74±3.35b |
| SGR/(%/d) | 0.67±0.07b | 0.52±0.02a | 0.63±0.04b | 0.65±0.01b |
| FE/% | 50.61±3.02b | 40.30±2.28a | 49.16±1.93b | 48.81±2.45b |
| FR/(%/d) | 1.33±0.03b | 1.22±0.02a | 1.32±0.05b | 1.31±0.04b |
| SR/% | 100 | 97.78±1.73 | 100 | 99.00±1.73 |
| 注: 表内数据为平均值±标准差, 同行上标不同字母表示差异显著(P < 0.05)。下同 | ||||
由表 2可以看出, H组C3和IgM水平显著低于对照组和H+Ast组(P < 0.05); H+Ast8组IgM水平显著高于其他三组(P < 0.05), 对照组和H+Ast4组之间无显著差异(P > 0.05)。H组AKP和ACP活性显著低于对照组和H+Ast组(P < 0.05), 对照组和H+Ast组间无显著差异(P > 0.05)。
| 项目 | 对照组 | H组 | H+Ast4组 | H+Ast8组 |
| ACP/(金氏单位/100 mL) | 10.75±0.72b | 7.98±1.25a | 9.95±1.22b | 10.39±1.31b |
| AKP/(金氏单位/100 mL) | 2.79±0.09b | 1.86±0.13a | 2.76±0.21b | 2.75±0.27b |
| C3/(mg/L) | 978.26±18.89b | 495.93±27.28a | 884.26±86.09b | 1 003.93±89.14b |
| IgM/(g/L) | 1 580.99±29.04b | 1 241.97±37.39a | 1 561.19±27.67b | 1 653.27±36.40c |
由表 3可以看出, 与对照组相比, H组肠道H2O2和NO水平显著升高(P < 0.05)。H+Ast组肠道H2O2和NO水平显著低于H组(P < 0.05), 对照组和H+Ast组肠道中H2O2和NO水平无显著差异(P > 0.05)。与对照组相比, H组肠道中ASA和AHA水平显著降低(P < 0.05)。H+Ast组肠道ASA和AHA水平显著高于H组(P < 0.05), 与对照组无显著差异(P > 0.05)。
| 项目 | 对照组 | H组 | H+Ast4组 | H+Ast8组 |
| H2O2/(mmol/g prot) | 5.38±0.53a | 11.84±0.96b | 5.11±1.18a | 4.60±0.59a |
| NO/(μmol/g prot) | 0.17±0.02a | 0.89±0.04b | 0.18±0.03a | 0.14±0.04a |
| ASA/(U/g prot) | 486.16±9.51b | 278.91±12.69a | 468.22±1.52b | 471.03±11.35b |
| AHA/(U/g prot) | 176.59±11.08b | 134.54±6.79a | 171.16±13.33b | 179.09±12.77b |
由图 1可以看出, 与对照组相比, H组和H+Ast组的Chao1指数、observed_species和PD_whole_tree呈逐渐降低的趋势。
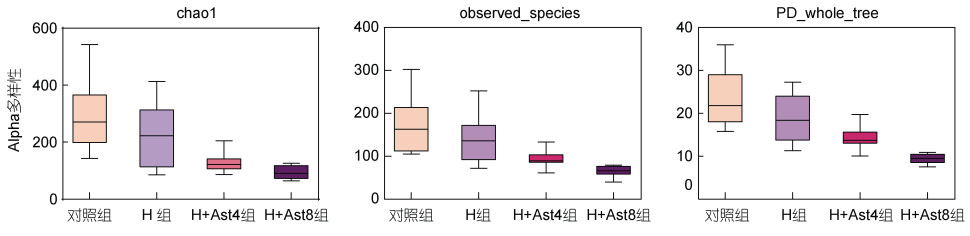 |
| 图 1 不同处理组美洲鳗鲡幼鱼的肠道菌群Alpha多样性 Fig. 1 The alpha diversity indexes of intestinal bacteria of juvenile American eels in different groups |
由图 2可以看出, 美洲鳗鲡幼鱼肠道菌群在门水平上的优势菌门主要为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和梭杆菌门(Fusobacteriota)。其中, H组厚壁菌门的相对丰度低于对照组和H+Ast组, 变形菌门的相对丰度高于其他三个组; H+Ast组的梭杆菌门相对丰度高于对照组和H组。
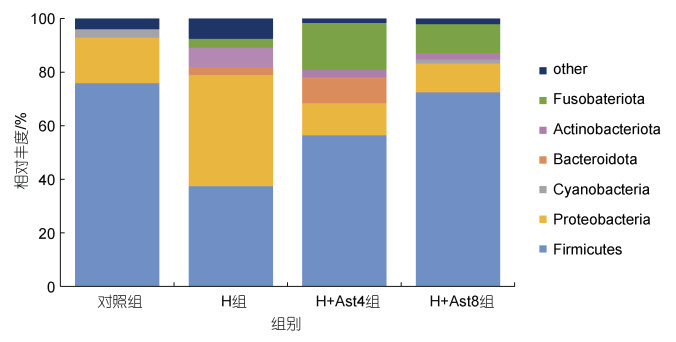 |
| 图 2 不同处理组美洲鳗鲡幼鱼的门水平肠道菌群组成 Fig. 2 Composition of the microflora in the intestine of juvenile American eels in different treatment groups at the phylum level |
由图 3可以看出, 对照组双歧杆菌属(Bifidobacterium)、拟杆菌属(Bacteroides)和柯林氏菌属(Collinsella)相对丰度显著高于其他组(P < 0.05); H组黄杆菌属(Flavobacterium)和hgcl_clade属相对丰度显著高于其他组(P < 0.05); H+Ast4组鲸杆菌属(Cetobacterium)和红杆菌属(Rhodobacter)相对丰度显著高于其他组(P < 0.05); H+Ast8组短波单胞菌属(Brevundimonas)、微小杆菌属(Exiguobacterium)、Cohnella属、无色杆菌属(Achromobacter)和窄食单胞菌属(Stenotrophomonas)相对丰度显著高于其他组(P < 0.05)。
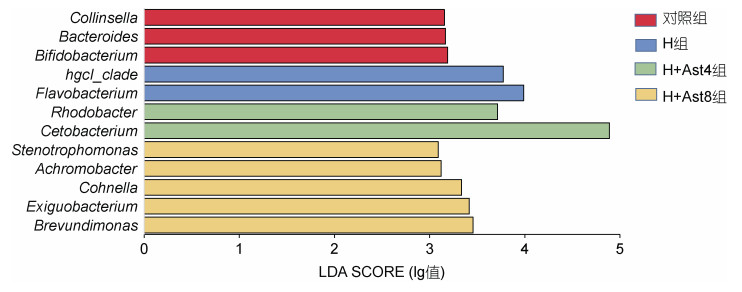 |
| 图 3 不同处理组美洲鳗鲡幼鱼的属水平肠道菌群Lefse分析 Fig. 3 The Lefse analysis of intestinal microflora of juvenile American eels in different treatment groups at the genus level |
本试验中, H组美洲鳗鲡幼鱼的WGR、SGR和FE均显著低于对照组, 说明饲料中高水平组胺具有抑制美洲鳗鲡幼鱼生长的作用, 这与美洲鳗鲡幼鱼试验中200~650 mg/kg饲料组胺显著降低生长性能的结果类似(何英霞, 2019; 胡家财等, 2019; 许琪娅, 2021)。H+Ast组美洲鳗鲡幼鱼的WGR、SGR和FE高于H组, 与对照组接近。说明添加虾青素有效缓解了高水平饲料组胺导致的美洲鳗鲡幼鱼生长抑制。这与饲料中添加5~15 mg/kg虾青素, 添加50、80 mg/kg虾青素产品提高高脂饲料胁迫下大口黑鲈(Xie et al, 2020)、虹鳟(Zhao et al, 2023)、卵形鲳鲹(Fang et al, 2021)、脂多糖胁迫下乌鳢(Channa argus) (Zhu et al, 2020)及高温胁迫下暗纹东方鲀(Takifugu obscurus) (Cheng et al, 2018)生长性能的结果类似。此外, 在试验中无胁迫条件下的大口黑鲈饲料中添加10 mg/kg虾青素(许长峰等, 2023)、大鳞副泥鳅饲料中添加2~4 mg/kg虾青素(姚金明, 2016)、乌鳢饲料中添加100 mg/kg虾青素产品(李美鑫等, 2021)及高体鳑鲏(Rhodeus ocellatus)饲料中添加150~200 mg/kg虾青素产品(王新等, 2022)也表现出明显的促生长作用。可见, 在有无胁迫条件下将虾青素添加在上述鱼类饲料中均可显著提高鱼类生长性能, 这可能与虾青素具有提高鱼体抗氧化能力, 改善鱼体健康状况的功能有关。详细作用机制还有待于将来的研究进一步查明。
3.2 饲料组胺胁迫下添加虾青素对美洲鳗鲡幼鱼血清生化的影响ACP和AKP是吞噬溶酶体酶的重要组成部分, 在免疫反应中发挥重要作用(孙学亮等, 2020)。C3和IgM是由细胞产生、参与体液免疫反应的大分子蛋白质, 可以通过补体经典激活途径和旁路激活途径参与免疫应答, 与病原体结合发生非特异性免疫反应(韩晨鹏等, 2019; 侯冬强等, 2023)。本试验中, H组血清中ACP、AKP活性及IgM、C3水平显著降低, 与300~650 mg/kg饲料组胺降低美洲鳗鲡幼鱼血清免疫能力(何英霞, 2019; Zhai et al, 2020; 许琪娅, 2021)、240 mg/kg和480 mg/kg饲料组胺显著降低线纹鳗鲶(Plotosus lineatus)血清补体水平(Liu et al, 2022)的研究结果类似。H+Ast组血清中ACP、AKP活性及IgM、C3水平高于H组, 而与对照组接近, 说明添加虾青素提高了饲料组胺胁迫下美洲鳗鲡幼鱼的血清非特异性免疫能力。这与在脂多糖胁迫下的乌鳢饲料中添加100 mg/kg虾青素产品提高了血清补体水平(Zhu et al, 2020)的结果类似。此外, 在试验中无胁迫条件下的鲫(Carassius auratus)饲料中添加200~ 800 mg/kg虾青素产品提高了血清免疫能力(Wu et al, 2021a)、豹纹鳃棘鲈(Plectropomus leopardus)饲料中添加100 g/kg虾青素产品提高了血清补体水平(Zhu et al, 2022)。上述研究的结果说明, 虾青素在胁迫和非胁迫条件下均能够提高机体非特异性免疫能力, 其原因可能是: (1) 虾青素可以通过淬灭自由基, 防止淋巴细胞和中性粒细胞内氧化还原反应失衡, 恢复免疫细胞正常吞噬功能(Guerra et al, 2012)。(2) 虾青素可通过刺激T细胞和B细胞有丝分裂原诱导的PBMC增殖, 促进产生抗体的外周B淋巴细胞分化, 从而增强机体消灭外源病原体侵袭的能力(Nakanishi et al, 2015; Ashfaq et al, 2019)。
3.3 饲料组胺胁迫下添加虾青素对美洲鳗鲡幼鱼肠道自由基水平的影响机体内的常见的自由基主要有超氧阴离子自由基(·O2–)、过氧化氢(H2O2)、羟自由基(·OH)和一氧化氮(NO)等(Li et al, 2021; 李澜等, 2022)。其中NO、H2O2可直接测定其水平, ·O2–和·OH通过ASA和AHA能力的高低反映其水平的情况, ASA能力越高意味着·O2–的水平越低, AHA能力越高意味着·OH的水平越低(黄林鑫等, 2019)。当机体发生氧化应激时, 产生的自由基超过机体抗氧化剂的清除能力而在体内大量蓄积, 自由基积累过多会对机体内的蛋白质、核酸和脂质等造成损伤, 从而引发细胞的结构被破坏, 甚至引发细胞的突变(石宝明等, 2021)。本试验中, H组美洲鳗鲡幼鱼肠道H2O2和NO水平显著升高, ASA与AHA能力显著降低, 说明饲料中高水平组胺提高了肠道自由基水平。以往研究中, 300 mg/kg饲料组胺即可显著降低美洲鳗鲡幼鱼肠道中SOD、CAT等抗氧化酶活性(何英霞, 2019; Zhai et al, 2020; 许琪娅, 2021), 使肠道清除自由基能力下降, 导致自由基水平升高, 与本试验结果接近。H+Ast组美洲鳗鲡幼鱼肠道H2O2和NO水平显著低于H组, ASA与AHA能力显著高于H组, 而与对照组接近, 说明虾青素降低了肠道自由基水平。关于胁迫条件下添加虾青素提高自由基清除能力的研究较少, 但无胁迫条件时在虹鳟饲料中添加100 mg/kg虾青素产品可降低血清、肌肉和肝脏自由基水平(张春燕等, 2021)、在克氏原螯虾(Procambarus clarkii)饲料中添加50 mg/kg虾青素产品可降低肠道自由基水平(周一凡等, 2022)。上述研究的结果说明, 虾青素降低肠道过多自由基水平效果突出, 其原因可能是: (1) 虾青素分子两端的紫罗兰酮环上的不饱和酮基和羟基均具有较活泼的电子效应, 可以吸引自由基或者向自由基提供电子, 直接清除自由基, 从而提高机体抗氧化能力(Naguib, 2000; Dose et al, 2016; 马骏等, 2018)。(2) 虾青素通过激活Nrf2的核转运介导的PI3K/Akt通路中Ⅱ期酶NQO1、HO-1、GCLM和GCLC的表达, 激活内源性抗氧化系统, 调控SOD、CAT等抗氧化酶合成加速, 从而更快地清除自由基(Li et al, 2013; 高金伟等, 2022)。
3.4 饲料组胺胁迫下添加虾青素对美洲鳗鲡幼鱼肠道菌群的影响Alpha多样性指数用于评价肠道菌群物种丰富度和多样性, Chao1指数用于表示物种的丰富度; Observed_species表示随着测序深度的增加, 观察到的OTU数量; PD_whole_tree是指观察到的物种数量, 反映了菌种的丰度(Xu et al, 2019)。本试验中, 与对照组相比, H组美洲鳗鲡幼鱼肠道菌群Chao1指数、observed_species和PD_whole_tree指数呈降低的趋势, 说明饲料中高水平组胺降低了美洲鳗鲡幼鱼肠道菌群物种多样性和丰富度, 这与300~650 mg/kg饲料组胺降低美洲鳗鲡幼鱼肠道菌群物种多样性和丰富度的结果类似(何英霞, 2019; 许琪娅, 2021)。H+Ast组的Chao1指数、observed_species和PD_whole_tree指数低于H组和对照组, 目前还未见到胁迫条件下有关虾青素调节肠道菌群多样性的研究, 在无胁迫条件下, 在秦岭细鳞鲑(Brachymystax lenok tsinlingensis)饲料中添加虾青素提高了肠道菌群丰富度和多样性(Ma et al, 2022), 在斑节对虾(Penaeus monodon)饲料中添加虾青素对肠道菌群丰富度和多样性无显著影响(Wang et al, 2021)。虾青素可能通过增加有益菌丰度和减少有害菌丰度来改变肠道菌群的多样性, 从而起到对肠道菌群的调控作用(Chen et al, 2021)。
变形菌门的丰度增加可能导致生物出现功能障碍, 增加患病风险, 研究表明, 大部分病原菌(如霍乱弧菌、大肠杆菌、幽门螺杆菌、沙门氏菌等)都属于变形菌门(Shin et al, 2015; 陈燕等, 2022)。厚壁菌门是许多淡水鱼类肠道中的优势菌门, 可以分泌蛋白酶(Da et al, 2016)。其中的部分细菌能够促进多糖的消化和吸收, 刺激鱼类肠道脂肪酸的吸收和代谢, 共同促进宿主能量的吸收和储存(Ni et al, 2014; Zhou et al, 2018)。梭杆菌门的微生物能够分泌丁酸, 丁酸是一种短链脂肪酸, 是碳水化合物发酵的最终产物, 具有促进肠道黏液分泌和抗炎的作用(Larsen et al, 2014; Elsheshtawy et al, 2021)。此外, 丁酸还能够抑制淡水鱼类常见病原体, 对鱼鳃具有保护作用(Reverter et al, 2017)。本试验中, 与对照组相比, H组厚壁菌门丰度降低而变形菌门丰度升高, 说明饲料高水平组胺可能提高了鱼体感染疾病的风险。与300~650 mg/kg饲料组胺水平下美洲鳗鲡幼鱼肠道菌群门水平变化情况相同(许琪娅, 2021)。与H组相比, H+Ast组厚壁菌门和梭杆菌门相对丰度升高, 与对照组的厚壁菌门和梭杆菌门相对丰度接近。在生长速度较快的花鳗鲡(王悦等, 2021)和大黄鱼(李英英等, 2017)肠道菌群结构中也观察到类似的结果, 说明相对丰度较高的厚壁菌门和梭杆菌门可能对美洲鳗鲡幼鱼的生长产生有益作用。此外, 在添加0.025%虾青素的豹纹鳃棘鲈肠道中也报道厚壁菌门相对丰度升高而变形菌门相对丰度降低(陈燕等, 2022), 这与本试验结果一致。
根据属水平上美洲鳗鲡幼鱼肠道菌群Lefse分析结果, 其中属于肠道有益菌的有: 双歧杆菌属、鲸杆菌属、红杆菌属、短波单胞菌属、微小杆菌属、无色杆菌属、Cohnella属和窄食单胞菌属; 属于潜在致病菌的有: 黄杆菌属、柯林氏菌属、拟杆菌属和hgcI_clade属。作为鱼类肠道中常见的有益菌, 双歧杆菌属、鲸杆菌属、红杆菌属、短波单胞菌属、微小杆菌属、Cohnella属、无色杆菌属和窄食单胞菌属已被广泛报道具有免疫调节、分泌营养因子、参与肠道代谢、提高抗氧化能力、抑制致病菌增殖等功能(Lushchak et al, 2006; Hidalgo-Cantabrana et al, 2017; Villasante et al, 2019; Lim et al, 2020; Elsheshtawy et al, 2021; Wu et al, 2021b)。黄杆菌属、柯林氏菌属和拟杆菌属中一些菌株为鱼类病原体, 可引起鱼类细菌性冷水病, 并诱发机体炎症, 破坏肠道屏障(Steimle et al, 2019; Liu et al, 2020; 柴静茹, 2021; Kang et al, 2022; Wang et al, 2022; 杨浩等, 2022)。hgcI_clade属在淡水鱼中的报道较少, 目前仅在暗纹东方鲀(Takifugu obscurus) (邱楚雯等, 2021)肠道中被检测到, 其在美洲鳗鲡幼鱼肠道中的作用及生物学功能还有待于进一步研究。在H组中黄杆菌属和hgcI_clade属相对丰度显著高于其他组, 说明饲料中高水平组胺增加了试验鱼肠道有害菌的种类和丰度, 增加了鱼体感染疾病的风险。在对照组中双歧杆菌属、拟杆菌属和柯林氏菌属相对丰度升高, 而在H+Ast组中鲸杆菌属、红杆菌属、短波单胞菌属、微小杆菌属、Cohnella属、无色杆菌属和窄食单胞菌属相对丰度高于其他组, 上述研究的结果说明虾青素提高了试验鱼肠道中有益菌群的丰度和种类, 这可能是其缓解饲料组胺胁迫对美洲鳗鲡幼鱼肠道造成危害的途径之一。从肠道菌群属水平相对丰度变化总体来看, 高组胺饲料中添加虾青素改变了美洲鳗鲡幼鱼肠道潜在益生菌群的组成, 降低了潜在致病菌的丰度, 这可能是由于虾青素能够破坏细胞膜的通透性, 对微生物的生物膜起到抑制作用, 阻碍微生物的生长繁殖从而发挥抑菌作用(Jeyachandran et al, 2020; 李念等, 2021)。
本试验中, 在美洲鳗鲡幼鱼高组胺饲料中添加4、8 mg/kg虾青素对饲料组胺胁迫的缓解效果接近, 这可能是由于4 mg/kg虾青素已最大程度缓解了饲料中662 mg/kg组胺对鱼体造成的不利影响, 进一步添加虾青素改善程度较小所致, 具体原因还有待查明。
4 结论本试验中, 添加4 mg/kg虾青素即可缓解饲料组胺胁迫导致的美洲鳗鲡幼鱼生长抑制, 提高血清非特异性免疫能力, 降低肠道自由基水平, 提高肠道有益菌群丰度; 添加8 mg/kg虾青素对美洲鳗鲡幼鱼上述指标无进一步的改善效果。该饲料组胺胁迫下虾青素适宜添加水平有待进一步研究。
马骏, 李勇, 张静, 等, 2018. 3种非营养性抗氧化剂在水产动物中的研究进展[J]. 水产科学, 37(3): 414-420. |
王晓娟, 艾春香, 2010. 鳗鲡的营养需求研究与配合饲料质量评价[J]. 饲料工业, 31(10): 47-51. |
王悦, 赵盼月, 陈学豪, 等, 2021. 精养池模式下不同生长速度花鳗鲡的肠道菌群比较研究[J]. 饲料工业, 42(4): 48-52. |
王新, 刘文钊, 王建国, 等, 2022. 不同剂量虾青素对高体鳑鲏生长、体色和抗氧化功能的影响[J]. 饲料研究, 45(24): 52-56. |
石宝明, 迟子涵, 2021. 自由基对动物的危害及消除技术研究进展[J]. 饲料工业, 42(9): 1-6. |
卢文麒, 2022. 二级红鱼粉、荚膜甲基球菌蛋白替代美洲鳗鲡幼鱼饲料中白鱼粉的初步研究[D]. 厦门: 集美大学: 1-2.
|
叶翚, 钟传明, 池宝兴, 2019. 福建鳗鲡产业发展形势分析[J]. 中国水产, (4): 56-61. |
许长峰, 王海丽, 宫彬彬, 2023. 虾青素对鲈鱼生长性能、抗氧化及非特异性免疫能力的影响[J]. 饲料研究, 46(3): 52-55. |
许琪娅, 2021. 饲料组胺对美洲鳗鲡幼鱼毒性效应的初步研究[D]. 厦门: 集美大学: 5-7.
|
孙学亮, 杨树元, 陈书奇, 等, 2020. 复方中草药对白点鲑和亚东鲑抗氧化、非特异性免疫及消化酶指标的影响[J]. 水产学杂志, 33(3): 7-12. |
李英英, 陈曦, 宋铁英, 2017. 不同生长速度的大黄鱼肠道菌群结构的差异[J]. 大连海洋大学学报, 32(5): 509-513. |
李念, 陈露珠, 汪之和, 2021. 虾青素-羧甲基壳聚糖复合涂膜对罗氏沼虾保鲜效果的影响[J]. 食品与发酵工业, 47(16): 166-172. |
李美鑫, 刘曦澜, 许世峰, 等, 2021. 虾青素对乌鳢生长、抗氧化和免疫功能的影响[J]. 饲料工业, 42(16): 51-57. |
李澜, 杨佳琦, 刘耀权, 等, 2022. 氧化应激与奶牛常见疾病关系研究进展[J]. 动物医学进展, 43(8): 98-101. |
杨浩, 张裕祥, 王烨, 等, 2022. Collinsella aerofaciens对高脂饮食小鼠糖脂代谢及肠道菌群的影响[J]. 中国微生态学杂志, 34(11): 1262-1268. |
邱楚雯, 施永海, 王韩信, 2021. 暗纹东方鲀不同养殖模式下的微生物群落结构[J]. 水产学报, 45(2): 209-220. |
何英霞, 2019. 不同条件下原花青素对鳗鲡幼鱼生长性能、血清生化指标及肠道健康的影响[D]. 厦门: 集美大学: 14-15.
|
张春燕, 文登鑫, 姚文祥, 等, 2021. 不同来源虾青素对虹鳟生长性能、肉色和抗氧化能力的影响[J]. 动物营养学报, 33(2): 1008-1019. |
张翔, 叶翚, 王虹人, 等, 2022. 中国鳗鲡产业发展情况探析[J]. 中国水产, (11): 40-45. |
陈如男, 2023. 博落回散对饲喂高组胺饲料美洲鳗鲡幼鱼生长及肝肠健康的影响[D]. 厦门: 集美大学: 16-22.
|
陈燕, 王湘君, 陈文, 等, 2022. 虾青素对豹纹鳃棘鲈体色、肌肉组织结构和肠道微生物的影响[J]. 饲料工业, 43(24): 23-31. |
周一凡, 孙存鑫, 刘波, 等, 2022. 饲料中茶树油与虾青素对克氏原螯虾生长性能、抗氧化能力及免疫相关基因表达的影响[J]. 中国水产科学, 29(8): 1147-1159. |
胡家财, 马德英, 陈学豪, 等, 2019. 饲料组胺对美洲鳗鲡生长及肌肉品质的影响[J]. 饲料研究, 42(6): 34-37. |
侯冬强, 李培佳, 赵红霞, 等, 2023. 饲料添加三丁酸甘油酯对黄颡鱼幼鱼生长性能、血清生化指标、免疫功能和抗氧化能力的影响[J]. 动物营养学报, 35(1): 505-513. |
姚金明, 2016. 虾青素对大鳞副泥鳅生长、体色及抗氧化功能的影响[D]. 长春: 吉林农业大学: 12-13.
|
柴静茹, 2021. 虹鳟源嗜冷黄杆菌的生物学特性及其致病性研究[D]. 上海: 上海海洋大学: 9-11.
|
高金伟, 王洪柱, 周文礼, 2022. 虾青素在观赏鱼养殖中的应用研究进展[J]. 经济动物学报, 26(4): 342-350. |
黄林鑫, 卢俊姣, 陈学豪, 等, 2019. 葡萄籽原花青素对饲料镉胁迫下吉富罗非鱼血清生化指标和肠道自由基水平的影响[J]. 饲料研究, 42(1): 30-33. |
黄春红, 陈蕴, 王攀, 等, 2022. 基于营养与环境因素的鱼类氧化应激研究现状[J]. 饲料研究, 45(13): 131-136. |
韩晨鹏, 徐清芳, 张美华, 2019. 血清补体C3、C4水平变化与肺炎支原体感染患儿病情程度的关联性及临床意义[J]. 实验与检验医学, 37(3): 496-498. |
樊玉文, 张木子, 黎明, 等, 2022. 饲料中添加雨生红球藻对黄颡鱼生长、抗氧化酶活性、免疫应答及氨氮耐受的影响[J]. 水产学报, 46(11): 2168-2176. |
ASHFAQ H, SOLIMAN H, SALEH M, et al, 2019. CD4: a vital player in the teleost fish immune system[J]. Veterinary Research, 50(1): 1. DOI:10.1186/s13567-018-0620-0 |
CHEN Y L, ZHAO S W, JIAO D Y, et al, 2021. Astaxanthin alleviates ochratoxin A-induced cecum injury and inflammation in mice by regulating the diversity of cecal microbiota and TLR4/MyD88/NF-κB signaling pathway[J]. Oxidative Medicine and Cellular Longevity, 2021: 8894491. |
CHENG C H, GUO Z X, YE C X, et al, 2018. Effect of dietary astaxanthin on the growth performance, non-specific immunity, and antioxidant capacity of pufferfish (Takifugu obscurus) under high temperature stress[J]. Fish Physiology and Biochemistry, 44(1): 209-218. DOI:10.1007/s10695-017-0425-5 |
DA CRUZ RAMOS G F, RAMOS P L, PASSARINI M R Z, et al, 2016. Cellulolytic and proteolytic ability of bacteria isolated from gastrointestinal tract and composting of a hippopotamus[J]. AMB Express, 6(1): 17. DOI:10.1186/s13568-016-0188-x |
DOSE J, MATSUGO S, YOKOKAWA H, et al, 2016. Free radical scavenging and cellular antioxidant properties of astaxanthin[J]. International Journal of Molecular Sciences, 17(1): 103. DOI:10.3390/ijms17010103 |
ELSHESHTAWY A, CLOKIE B G J, ALBALAT A, et al, 2021. Characterization of external mucosal microbiomes of Nile tilapia and grey mullet co-cultured in semi-intensive pond systems[J]. Frontiers in Microbiology, 12: 773860. DOI:10.3389/fmicb.2021.773860 |
FANG H H, NIU J, 2022. Diet supplementation of astaxanthin mitigates cadmium induced negative effects on oxidative, inflammatory and non-specific immune responses, and the intestinal morphology in Trachinotus ovatus[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 260: 109407. |
FANG H H, XIE J J, ZHAO W, et al, 2021. Study supplementation of astaxanthin in high-fat diet on growth performance, antioxidant ability, anti-inflammation, non-specific immunity and intestinal structure of juvenile Trachinotus ovatus[J]. Aquaculture Nutrition, 27(6): 2575-2586. DOI:10.1111/anu.13386 |
GUERRA B A, BOLIN A P, MORANDI A C, et al, 2012. Glycolaldehyde impairs neutrophil biochemical parameters by an oxidative and calcium-dependent mechanism-Protective role of antioxidants astaxanthin and vitamin C[J]. Diabetes Research and Clinical Practice, 98(1): 108-118. DOI:10.1016/j.diabres.2012.07.004 |
HIDALGO-CANTABRANA C, DELGADO S, RUIZ L, et al, 2017. Bifidobacteria and their health-promoting effects[J]. Microbiology Spectrum, 3(5): 28643627. |
JEYACHANDRAN S, KIYUN P, IHN‐SIL K, et al, 2020. Identification and characterization of bioactive pigment carotenoids from shrimps and their biofilm inhibition[J]. Journal of Food Processing and Preservation, 44(10): e14728. |
KANG S, LEE J Y, HAN J E, et al, 2022. Description of Flavobacterium cyclinae sp. nov. and Flavobacterium channae sp. nov., isolated from the intestines of Cyclina sinensis (Corb shell) and Channa argus (Northern snakehead)[J]. Journal of Microbiology, 60(9): 890-898. DOI:10.1007/s12275-022-2075-2 |
LARSEN A M, MOHAMMED H H, ARIAS C R, 2014. Characterization of the gut microbiota of three commercially valuable warmwater fish species[J]. Journal of Applied Microbiology, 116(6): 1396-1404. DOI:10.1111/jam.12475 |
LI Z R, DONG X, LIU H L, et al, 2013. Astaxanthin protects ARPE-19 cells from oxidative stress via upregulation of Nrf2-regulated phase Ⅱ enzymes through activation of PI3K/Akt[J]. Molecular Vision, 19: 1656-1666. |
LI H, ZHANG Y F, LI R, et al, 2021. Effect of seasonal thermal stress on oxidative status, immune response and stress hormones of lactating dairy cows[J]. Animal Nutrition, 7(1): 216-223. DOI:10.1016/j.aninu.2020.07.006 |
LIM H J, SHIN H S, 2020. Antimicrobial and immunomodulatory effects of Bifidobacterium strains: a review[J]. Journal of Microbiology and Biotechnology, 30(12): 1793-1800. DOI:10.4014/jmb.2007.07046 |
LIU Y, FU X L J, HUANG H J, et al, 2022. High dietary histamine induces digestive tract oxidative damage in juvenile striped catfish (Pangasianodon hypophthalmus)[J]. Antioxidants, 11(11): 2276. DOI:10.3390/antiox11112276 |
LIU Z G, IQBAL M, ZENG Z B, et al, 2020. Comparative analysis of microbial community structure in the ponds with different aquaculture model and fish by high-throughput sequencing[J]. Microbial Pathogenesis, 142: 104101. DOI:10.1016/j.micpath.2020.104101 |
LIU F, SHI H Z, GUO Q S, et al, 2016. Effects of astaxanthin and emodin on the growth, stress resistance and disease resistance of yellow catfish (Pelteobagrus fulvidraco)[J]. Fish & Shellfish Immunology, 51: 125-135. |
LUSHCHAK V I, BAGNYUKOVA T V, 2006. Effects of different environmental oxygen levels on free radical processes in fish[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 144(3): 283-289. DOI:10.1016/j.cbpb.2006.02.014 |
MA F, MA R L, ZOU Y L, et al, 2022. Effect of astaxanthin on the antioxidant capacity and intestinal microbiota of Tsinling lenok trout (Brachymystax lenok tsinlingensis)[J]. Marine Biotechnology, 24(6): 1125-1137. DOI:10.1007/s10126-022-10175-3 |
MORDENTI O, DI BIASE A, SIRRI R, et al, 2012. Induction of sexual maturation in wild female European eels (Anguilla anguilla) in darkness and light conditions[J]. Israeli Journal of Aquaculture-Bamidgeh, 64: 726. |
NAGUIB Y M A, 2000. Antioxidant activities of astaxanthin and related carotenoids[J]. Journal of Agricultural and Food Chemistry, 48(4): 1150-1154. DOI:10.1021/jf991106k |
NAKANISHI T, SHIBASAKI Y, MATSUURA Y, 2015. T cells in fish[J]. Biology, 4(4): 640-663. DOI:10.3390/biology4040640 |
NI J J, YAN Q Y, YU Y H, et al, 2014. Factors influencing the grass carp gut microbiome and its effect on metabolism[J]. FEMS Microbiology Ecology, 87(3): 704-714. DOI:10.1111/1574-6941.12256 |
REVERTER M, SASAL P, TAPISSIER-BONTEMPS N, et al, 2017. Characterisation of the gill mucosal bacterial communities of four butterflyfish species: a reservoir of bacterial diversity in coral reef ecosystems[J]. FEMS Microbiology Ecology, 93(6): fix051. |
SHI Y, MA D Y, ZHAI S W, 2020. Revealing the difference of intestinal microbiota composition of cultured European eels (Anguilla anguilla) with different growth rates[J]. Israeli Journal of Aquaculture - Bamidgeh, 72: 1-12. |
SHIN N R, WHON T W, BAE J W, 2015. Proteobacteria: microbial signature of dysbiosis in gut microbiota[J]. Trends in Biotechnology, 33(9): 496-503. DOI:10.1016/j.tibtech.2015.06.011 |
STEIMLE A, MICHAELIS L, DI LORENZO F, et al, 2019. Weak agonistic LPS restores intestinal immune homeostasis[J]. Molecular Therapy, 27(11): 1974-1991. DOI:10.1016/j.ymthe.2019.07.007 |
VILLASANTE A, RAMÍREZ C, RODRÍGUEZ H, et al, 2019. In-depth analysis of swim bladder-associated microbiota in rainbow trout (Oncorhynchus mykiss)[J]. Scientific Reports, 9(1): 8974. DOI:10.1038/s41598-019-45451-1 |
WANG W L, LIU M T, FAWZY S, et al, 2021. Effects of dietary Phaffia rhodozyma astaxanthin on growth performance, carotenoid analysis, biochemical and immune-physiological parameters, intestinal microbiota, and disease resistance in Penaeus monodon[J]. Frontiers in Microbiology, 12: 762689. DOI:10.3389/fmicb.2021.762689 |
WANG C, XIAO Y, YU L L, et al, 2022. Protective effects of different Bacteroides vulgatus strains against lipopolysaccharide-induced acute intestinal injury, and their underlying functional genes[J]. Journal of Advanced Research, 36: 27-37. DOI:10.1016/j.jare.2021.06.012 |
WU S J, XU B, 2021a. Effect of dietary astaxanthin administration on the growth performance and innate immunity of juvenile crucian carp (Carassius auratus)[J]. 3 Biotech, 11(3): 151. DOI:10.1007/s13205-021-02700-3 |
WU Z B, ZHANG Q Q, LIN Y Y, et al, 2021b. Taxonomic and functional characteristics of the gill and gastrointestinal microbiota and its correlation with intestinal metabolites in NEW GIFT strain of farmed adult Nile tilapia (Oreochromis niloticus)[J]. Microorganisms, 9(3): 617. DOI:10.3390/microorganisms9030617 |
XIE S W, YIN P, TIAN L X, et al, 2020. Dietary supplementation of astaxanthin improved the growth performance, antioxidant ability and immune response of juvenile largemouth bass (Micropterus salmoides) fed high-fat diet[J]. Marine Drugs, 18(12): 642. DOI:10.3390/md18120642 |
XU G L, XING W, LI T L, et al, 2019. Comparative study on the effects of different feeding habits and diets on intestinal microbiota in Acipenser baeri brandt and Huso huso[J]. BMC Microbiology, 19(1): 297. DOI:10.1186/s12866-019-1673-6 |
ZHAI S W, WANG Y, HE Y X, et al, 2020. Oligomeric proanthocyanidins counteracts the negative effects of high level of dietary histamine on American eel (Anguilla rostrata)[J]. Frontiers in Marine Science, 7: 549145. DOI:10.3389/fmars.2020.549145 |
ZHAO W, YAO R, WEI H L, et al, 2023. Astaxanthin, bile acid and chlorogenic acid attenuated the negative effects of high-fat diet on the growth, lipid deposition, and liver health of Oncorhynchus mykiss[J]. Aquaculture, 567: 739255. DOI:10.1016/j.aquaculture.2023.739255 |
ZHU X W, HAO R J, ZHANG J P, et al, 2022. Dietary astaxanthin improves the antioxidant capacity, immunity and disease resistance of coral trout (Plectropomus leopardus)[J]. Fish & Shellfish Immunology, 122: 38-47. |
ZHOU M, LIANG R S, MO J F, et al, 2018. Effects of brewer's yeast hydrolysate on the growth performance and the intestinal bacterial diversity of largemouth bass (Micropterus salmoides)[J]. Aquaculture, 484: 139-144. DOI:10.1016/j.aquaculture.2017.11.006 |
ZHU X M, LI M Y, LIU X Y, et al, 2020. Effects of dietary astaxanthin on growth, blood biochemistry, antioxidant, immune and inflammatory response in lipopolysaccharide-challenged Channa argus[J]. Aquaculture Research, 51(5): 1980-1991. DOI:10.1111/are.14550 |
 2024, Vol. 55
2024, Vol. 55


