文章信息
- 李红艳, 王璇璇, 李晓, 刘天红, 姜晓东, 孙元芹, 纪蕾, 王颖. 2018.
- LI Hong-yan, WANG Xuan-xuan, LI Xiao, LIU Tian-hong, JIANG Xiao-dong, SUN Yuan-qin, JI Lei, WANG Ying. 2018.
- 鼠尾藻中岩藻黄素的提取工艺研究
- Optimization of fucoxanthin extraction from Sargassum thunbergii
- 海洋科学, 42(2): 71-77
- Marine Sciences, 42(2): 71-77.
- http://dx.doi.org/10.11759/hykx20171024001
-
文章历史
- 收稿日期:2017-10-24
- 修回日期:2017-12-12
2. 中国海洋大学 海洋生命学院, 山东 青岛 266003
2. College of Marine Life Science, Ocean University of China, Qingdao 266003, China
岩藻黄素(fucoxanthin)是一种海洋类胡萝卜素, 主要存在于藻类、海洋浮游植物和水生贝壳类动物等生物组织内[1], 其中以褐藻中含量最高[2]。据报道, 岩藻黄素具有抗氧化[3]、抗炎[4]、抗肥胖[5-6]、抗糖尿病[7-8]、抗癌[9-10]等多种生物学活性, 在食品、医药、美容等领域具有广阔的开发前景。
鼠尾藻(Sargassum thunbergii)是一种在亚洲海岸东北潮间带最常见且分布最广泛的褐藻, 是潮间带大型藻类的主要优势种[11]。目前鼠尾藻除生态应用于抑制藻华[12]和修复潮间带[13]外, 主要作为海参饲料应用于水产养殖中[14]。据报道, 鼠尾藻中岩藻黄素含量高于海黍子和海带[15], 但目前国内提取岩藻黄素大都采用海带、裙带菜等[16-18], 少见从鼠尾藻中提取的报道, 且岩藻黄素工业化生产的信息也不多见。本研究以鼠尾藻为原料, 利用有机溶剂提取法, 对岩藻黄素的提取工艺进行优化, 不仅为鼠尾藻的开发利用提供新方向, 也为高效制备岩藻黄素提供理论依据和技术支持。
1 材料与方法 1.1 材料与仪器鼠尾藻, 2015年5月采自荣成海域, 自来水清洗, 45℃烘干后用粉碎机粉碎, 过80目筛, 得到鼠尾藻干粉。岩藻黄素标准品, sigma公司; 甲醇、乙醇、氯仿、丙酮、乙酸乙酯、正己烷均为分析纯。
UV2450 分光光度计 日本岛津公司; FMN10010-RO 纯水机 青岛富勒姆科技有限公司; FA1604N 电子分析天平 上海精密仪器有限公司; DF-101S 集热式恒温磁力搅拌器 巩义市予华仪器有限公司。
1.2 方法 1.2.1 单因素实验 1.2.1.1 提取溶剂的筛选根据相似相溶原理提取鼠尾藻中的岩藻黄素, 本实验选择了6种不同极性的有机溶剂(乙醇、甲醇、氯仿、丙酮、乙酸乙酯、正己烷)进行浸提实验。分别称取3 g鼠尾藻粉末, 加入60 mL无水乙醇、甲醇、氯仿、丙酮、乙酸乙酯、正己烷, 50℃避光浸提3 h, 浸提液过滤, 滤液稀释一定倍数, 在448 nm下测定其吸光度。
1.2.1.2 甲醇浓度对岩藻黄素提取率的影响使用不同浓度的甲醇(60%、70%、80%、90%、100%)作为提取溶剂, 料液比1︰20, 温度50℃下避光浸提3 h, 浸提液过滤、稀释后测448 nm下的吸光值。
1.2.1.3 料液比对岩藻黄素提取率的影响使用90%甲醇作为提取溶剂, 控制不同料液比(1︰10、1︰20、1︰30、1︰40、1︰50), 温度50℃下避光浸提3 h, 浸提液过滤、稀释后测448 nm下的吸光值。
1.2.1.4 提取温度对岩藻黄素提取率的影响使用90%甲醇溶液作为提取溶剂, 料液比为1︰30, 在不同的温度(20、30、40、50、60℃)下, 避光浸提3 h, 浸提液过滤、稀释后测448 nm下的吸光值。
1.2.1.5 提取时间对岩藻黄素提取率的影响使用90%甲醇作为提取溶剂, 料液比为1︰30, 温度为60℃时, 避光浸提不同时间(1、2、3、4 h), 浸提液过滤、稀释后测448 nm下的吸光值。
1.2.2 岩藻黄素提取响应面实验在单因素实验的基础上, 对岩藻黄素提取料液比、温度和时间三个因素, 按照Box-Bohnken设计法, 每个因素取三个水平, 以(–1, 0, 1)编码进行实验, 以提取率为响应值, 借助design expert8.0软件进行数据分析并建立二次响应面经验模型, 从而寻找最佳提取条件。共有17个实验, 其中12个为析因点, 5个为零点以估计误差。实验因素水平设计如表 1所示。
| 因素 | 水平 | ||
| –1 | 0 | 1 | |
| A提取温度(℃) | 40 | 50 | 60 |
| B液料比 | 20 | 30 | 40 |
| C提取时间(h) | 2 | 3 | 4 |
称取一定量的岩藻黄素标准品配制成溶液, 在350~900 nm波长进行全波长扫描, 确定岩藻黄素最大吸收峰在448 nm处。在岩藻黄素吸收波长448 nm下, 测定粗提液的吸光度值, 再按如下公式计算岩藻黄素的提取率[19]:
岩藻黄素提取率(mg/g)=
式中, A448:岩藻黄素在448 nm处的吸光值;
实验数据为3个平行实验样品的平均值, 分别运用SPSS13.0和Excel 2007进行数据处理(方差分析, one-way ANOVA)和作图。采用Design-Expert 8.0.6软件对Box-Benhnken中心组合实验设计的数据进行回归分析。
2 结果与分析 2.1 提取溶剂的筛选岩藻黄素是一种亲脂性的化合物, 其极性由其特殊的化学结构所决定, 属于中等偏上, 根据相似相溶的原理, 易溶于极性较大的有机溶剂。本研究选用6种不同极性的有机溶剂进行实验, 结果如图 1所示, 甲醇作为提取溶剂时, 岩藻黄素的提取率达到1.22 mg/g, 远高于相同条件下其他溶剂的提取率, 丙酮次之, 提取率为0.97mg/g, 极性较低的正己烷的提取率最低。因此选用甲醇作为最佳提取溶剂。
 |
| 图 1 不同提取溶剂对鼠尾藻岩藻黄素提取率的影响 Fig. 1 Effect of different solvent on the extraction yield of fucoxanthin |
实验结果如图 2所示, 随着甲醇浓度的升高, 岩藻黄素的提取率逐渐升高, 当甲醇浓度为90%时, 提取率达到最大值, 为1.23 mg/g, 甲醇浓度为100%时, 岩藻黄素提取率略有降低, 为1.21 mg/g。综上所述, 90%的甲醇浓度为最佳提取浓度。
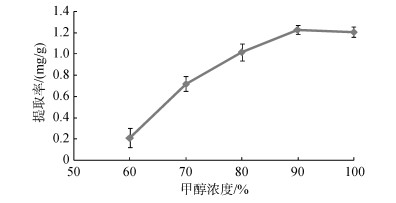 |
| 图 2 甲醇浓度对鼠尾藻岩藻黄素提取率的影响 Fig. 2 Effect of methanol concentration on the extraction yield of fucoxanthin |
实验结果如图 3所示, 随着提取溶剂比例的增加, 岩藻黄素提取率呈现先上升, 后趋于平稳的趋势。当料液比为1︰30时, 提取率达到最高, 为1.31mg/g。而当料液比为1︰40和1︰50时, 提取率不再升高, 可能是由于色素在细胞膜内外的浓度差已趋于平衡, 溶剂的增加无法进一步提高岩藻黄素的提取率。考虑到节约溶剂成本, 选择1︰30的作为最佳料液比。
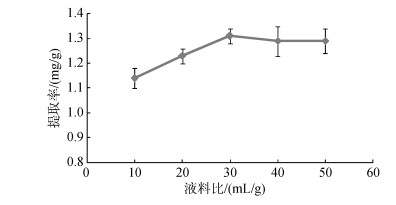 |
| 图 3 料液比对鼠尾藻岩藻黄素提取率的影响 Fig. 3 Effect of solid-liquid ratio on the extraction yield of fucoxanthin |
实验结果如图 4所示, 岩藻黄素的提取率随温度的增加而增加。60℃时, 提取率达到1.35 mg/g。由于甲醇的沸点为64.7℃, 当提取温度过高时, 溶剂易挥发, 不利于提取的顺利进行, 且高温会导致岩藻黄素的分子结构被破坏, 使其生物活性功能丧失[19], 因此选定60℃作为最佳提取温度。
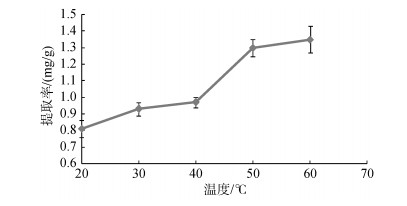 |
| 图 4 提取温度对鼠尾藻岩藻黄素提取率的影响 Fig. 4 Effect of extraction temperature on the extraction yield of fucoxanthin |
实验结果如图 5所示, 随着岩藻黄素提取时间的延长, 岩藻黄素的提取率先升高后降低。当提取时间为3 h时, 提取率最高, 达到1.32 mg/g; 提取时间为4 h时, 提取率降低。有文献报道氧气会明显地促进水体系中岩藻黄素的降解[20], 随着浸提液中岩藻黄素与空气中的氧接触时间的延长, 岩藻黄素可能部分发生降解, 导致提取时间为4 h时提取率下降。因此选择最佳提取时间为3 h。
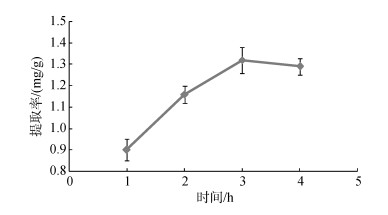 |
| 图 5 提取时间对鼠尾藻岩藻黄素提取率的影响 Fig. 5 Effect of extraction time on the extraction yield of fucoxanthin |
响应面的设计方案及实验结果如表 2所示。
| 实验 | A温度/℃ | B料液比 | C时间/h | 提取率/(mg/g) |
| 1 | 40 | 40 | 3.0 | 1.010 |
| 2 | 40 | 30 | 2.0 | 0.956 |
| 3 | 50 | 40 | 4.0 | 1.225 |
| 4 | 40 | 30 | 4.0 | 1.009 |
| 5 | 50 | 30 | 3.0 | 1.312 |
| 6 | 50 | 30 | 3.0 | 1.303 |
| 7 | 60 | 20 | 3.0 | 1.259 |
| 8 | 50 | 40 | 2.0 | 1.111 |
| 9 | 50 | 20 | 4.0 | 1.125 |
| 10 | 50 | 30 | 3.0 | 1.293 |
| 11 | 40 | 20 | 3.0 | 0.998 |
| 12 | 60 | 40 | 3.0 | 1.326 |
| 13 | 50 | 20 | 2.0 | 1.048 |
| 14 | 50 | 30 | 3.0 | 1.284 |
| 15 | 60 | 30 | 2.0 | 1.267 |
| 16 | 50 | 30 | 3.0 | 1.294 |
| 17 | 60 | 30 | 4.0 | 1.343 |
| 方差来源 | 平方和 | 自由度 | 均方 | F值 | P值 | 显著性 |
| 模型 | 0.30 | 9 | 0.033 | 96.27 | < 0.0001 | ** |
| A | 0.19 | 1 | 0.19 | 545.49 | < 0.0001 | ** |
| B | 7.321×10–3 | 1 | 7.321×10–3 | 21.39 | 0.0024 | * |
| C | 0.013 | 1 | 0.013 | 37.41 | 0.0005 | * |
| AB | 7.563×10–4 | 1 | 7.563×10–4 | 2.21 | 0.1807 | |
| AC | 1.323×10–4 | 1 | 1.323×10–4 | 0.39 | 0.5539 | |
| BC | 3.422×10–4 | 1 | 3.422×10–4 | 1.00 | 0.3506 | |
| A2 | 0.018 | 1 | 0.018 | 53.97 | 0.0002 | * |
| B2 | 0.029 | 1 | 0.029 | 84.21 | < 0.0001 | ** |
| C2 | 0.032 | 1 | 0.032 | 93.62 | < 0.0001 | ** |
| 残差 | 2.395×10–3 | 7 | 3.422×10–4 | |||
| 失拟项 | 1.940×10–3 | 3 | 6.468×10–4 | 5.69 | 0.0632 | |
| 纯误差 | 4.548×10–4 | 4 | 1.137×10–4 | |||
| 总离差 | 0.30 | 16 | ||||
| 注: **差异极显著, P < 0.01; *差异显著, P < 0.05 | ||||||
运用Design Expert 8.0.6软件进行二次多元回归拟合分析, 除去不显著项AC、BC得到岩藻黄素甲醇提取模型的二次多项回归方程为:
由表 3可知, 模型的P < 0.0001, 表明模型高度显著, 回归模型方程的决定系数Radj2=0.9829, 失拟项不显著(P=0.0632 > 0.05), 这表明该模型方程与实验数据的拟合程度高, 实验组的误差小, 模型可用于甲醇提取鼠尾藻中岩藻黄素结果的分析和预测。从表 3还可以看出, 因素一次项(A、B、C)、二次项(A2、B2、C2)对结果影响显著(P < 0.05), 交互项(AB、AC、BC)对结果影响不显著(P > 0.05)。
2.6.2 响应曲面图分析回归方程中的交互项所作的响应面图, 如图 6所示。
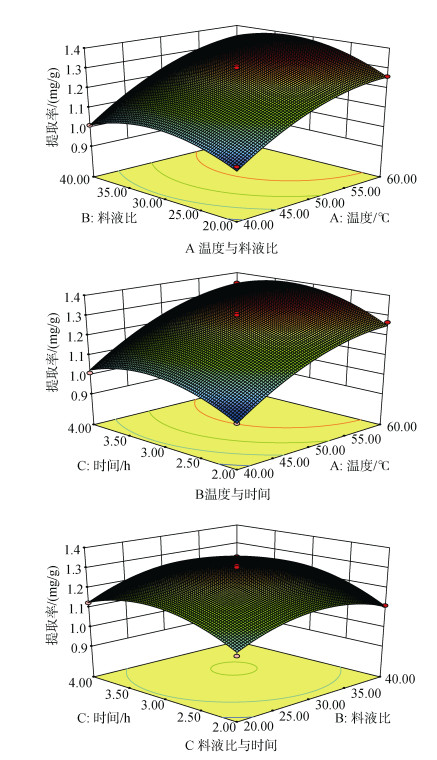 |
| 图 6 各因素及其交互作用对岩藻黄素提取影响的响应面图 Fig. 6 The response surface of different factors |
根据响应面实验设计原理及分析[21], 结合图 6及表 3结果, 温度、料液比和时间对岩藻黄素提取都有显著影响, 且在实验设置范围内影响的大小顺序为:温度 > 时间 > 料液比, 3个因素各水平之间交互作用不显著。
2.6.3 响应面法优化工艺条件验证依据甲醇提取鼠尾藻中岩藻黄素的响应面法实验结果及其回归方程模型, 求解得到在实验因素水平范围内的最优工艺条件为:温度60℃, 料液比32.81, 提取时间3.28 h, 此时的岩藻黄素提取率达到1.396 mg/g。为了便于操作, 将最优工艺确定为:温度60℃, 料液比1︰33, 提取时间3.25 h, 在此条件下开展三次验证实验, 测得岩藻黄素提取率为1.368 mg/g, 与理论预测值仅相差2.00%, 表明经响应面优化后的提取工艺条件准确可靠。
2.7 不同原料来源的岩藻黄素含量对比分析岩藻黄素是褐藻门的主要色素, 在金藻门金藻纲、硅藻纲中也有分布[22-23]。金藻纲和硅藻纲属海藻多为单细胞型海藻, 尤其是硅藻纲属海藻往往需要借助显微镜才可见。因此, 主要作为岩藻黄素提取原料的是褐藻门属海藻。而褐藻中产量比较大的海藻有海带、裙带菜、羊栖菜、马尾藻、鼠尾藻等。
刘梁等[16]利用有机溶剂法提取海带干粉中的岩藻黄素, 提取率为0.556 mg/g。闫相勇等[17]利用甲醇作为提取溶剂对干海带中的岩藻黄素进行提取, 提取率为0.375 mg/g。陈文佳[24]等采用酶法辅助提取海带干粉中的岩藻黄素, 提取率为1.007 mg/g。曲荣荣等[25]采用纳豆菌发酵法提取新鲜海带中的岩藻黄素, 提取率达到1.030 mg/g。尹尚军等[22]采用有机溶剂浸提冻干的羊栖菜中的岩藻黄素, 提取率为1.067 mg/g。苌钊等[18]运用超声波提取法对裙带菜中的岩藻黄素进行提取, 提取率为1.362 mg/g。在本实验研究中, 经过响应面法优化后, 鼠尾藻提取岩藻黄素的提取率达到1.368 mg/g, 高于刘梁等[16]、闫相勇等[17]、陈文佳[24]、曲荣荣等[25]报道的海带岩藻黄素提取率和尹尚军等[22]报道的羊栖菜岩藻黄素提取率, 与苌钊等[18]报道的裙带菜岩藻黄素的提取率接近, 这说明鼠尾藻是一种岩藻黄素含量较高的褐藻, 可以作为提取岩藻黄素的优良来源。
另外, 据报道, 鼠尾藻藻体内的岩藻黄素含量具有明显的季节变化, 冬春季节(12月-3月)含量较高, 而夏末(7月-11月)时的含量较低[26]。因而, 不同季节的鼠尾藻提取岩藻黄素时提取率可能会有波动, 本研究采用的鼠尾藻采集于2015年5月, 岩藻黄素含量和提取率可能并非最高水平。为了得到较高的岩藻黄素提取率, 应尽量采集冬春季节的藻体。
3 结论及进一步研究建议本研究以鼠尾藻为原料, 采用有机溶剂法对其中含有的特征性色素-岩藻黄素进行提取工艺研究。通过单因素和响应面实验, 优化得到鼠尾藻中岩藻黄素提取的最佳工艺参数为90%甲醇溶液, 料液比1︰33, 提取温度60℃, 提取时间3.25 h, 此时的岩藻黄素提取率达到1.368 mg/g。
经有机试剂提取得到的岩藻黄素粗提液中, 含有无机盐、脂肪、色素等杂质, 需进一步分离纯化。目前常用的纯化方法有硅胶柱层析法和制备相高效液相色谱法。硅胶柱层析是最为常用的纯化方法, 其操作简便, 分离效率高, 在岩藻黄素纯化中广泛应用, 缺点是耗时久, 纯化效果有限, 难以得到高纯度的岩藻黄素; 制备相高效液相色谱法由于分离效果佳, 速度快, 可直观的对岩藻黄素含量进行检测, 在实验室高纯度岩藻黄素的制备中应用广泛, 但是存在设备投资和维护费用高昂的问题, 不适合工业化生产。因此, 探索高效率、适宜工业化生产的岩藻黄素纯化方法是今后关注和研究的重点。
| [1] |
项斌, 高建荣. 天然色素[M]. 北京: 化学工业出版社, 2004: 105-172. Xiang Bin, Gao Jianrong. Natural Pigment[M]. Beijing: Chemical Industry Press, 2004: 105-172. |
| [2] |
李艳梅, 刘清华. 含岩藻黄素提取物的组合物[P]. 国际专利: WO2010081259, 2010-7-22. LI Yanmei, Liu Qinghua. Composition containing fuco xanthin extract[P]. International monopoly: WO2010081259, 2010-7-22 |
| [3] |
Ha A W, Na S J, Kim W K. Antioxidant effects of fucoxanthin rich powder in rats fed with high fat diet[J]. Nutrition Research and Practice, 2013, 7(6): 475-480. DOI:10.4162/nrp.2013.7.6.475 |
| [4] |
Kim K N, Heo S J, Yoon W J, et al. Fucoxanthin inhibits the inflammatory response by suppressing the activation of NF-κB and MAPKs in lipopolysaccharide-in duced RAW 264.7 macrophages[J]. European Journal of Pharmacology, 2010, 649(1-3): 369-375. DOI:10.1016/j.ejphar.2010.09.032 |
| [5] |
Peng Juan, Yuan JianPing, Wu ChouFei, et al. Fuco xanthin, a marine carotenoid present in brown seaweeds and diatoms: metabolism and bioactivities relevant to human health[J]. Marine Drugs, 2011, 9(10): 1806-1828. DOI:10.3390/md9101806 |
| [6] |
Abidov M, Ramazanov Z, Seifulla R, et al. The effects of Xanthigen™ in the weight management of obese premenopausal women with non-alcoholic fatty liver disease and normal liver fat[J]. Diabetes, Obesity and Metabolism, 2010, 12(1): 72-81. DOI:10.1111/dom.2010.12.issue-1 |
| [7] |
Maeda H, Hosokawa M, Sashima T, et al. Anti-obesity and anti-diabetic effects of fucoxanthin on diet-induced obesity conditions in a murine model[J]. Molecular Medicine Reports, 2009, 2(6): 897-902. |
| [8] |
Park H, Lee M, Park Y, et al. Beneficial effects of Undaria pinnatifida ethanol extract on diet-induced- insulin resistance in C57BL/6J mice[J]. Food and Chemical Toxicology, 2011, 49(4): 727-733. DOI:10.1016/j.fct.2010.11.032 |
| [9] |
Ishikawa C, Tafuku S, Kadekaru T, et al. Antiadult T- cell leukemia effects of brown algae fucoxanthin and its deacetylated product, fucoxanthinol[J]. International Journal of Cancer, 2008, 123(11): 2702-2712. DOI:10.1002/ijc.v123:11 |
| [10] |
Moreau D, Tomasoni C, Jacquot C, et al. Cultivated microalgae and the carotenoid fucoxanthin from Odontella aurita as potent anti-proliferative agents in bronchopulmonary and epithelial cell lines[J]. Environmental Toxicology and Pharmacology, 2006, 22(1): 97-103. DOI:10.1016/j.etap.2006.01.004 |
| [11] |
Yang Jinhyun, Graf Louis, Cho Chunghyun, et al. Complete plastid genome of an ecologically important brown alga Sargassum thunbergii (Fucales, Phaeophyceae)[J]. Marine Genomics, 2016, 28: 17-20. DOI:10.1016/j.margen.2016.03.003 |
| [12] |
Wang Renjun, Xiao Hui, Wang You, et al. Effects of three macroalgae, Ulva linza (Chlorophyta), Corallina pilulifera (Rhodophyta) and Sargassum thunbergii (Phaeophyta) on the growth of the red tide microalga Prorocentrum donghaiense under laboratory conditions[J]. Journal of Sea Research, 2007, 58: 189-197. DOI:10.1016/j.seares.2007.03.002 |
| [13] |
Liu Fuli, Sun Xiutao, Wang Wenjun, et al. Development of a female-specific RAPD marker for Sargassum thunbergii gender identification using bulked segregant analysis[J]. Aquatic Botany, 2012, 102: 79-81. DOI:10.1016/j.aquabot.2012.05.001 |
| [14] |
何平, 许伟定, 王丽梅. 鼠尾藻研究现状及发展趋势[J]. 上海海洋大学学报, 2011, 20(3): 363-367. He Ping, Xu Weiding, Wang Limei. Research status and development trend of Sargassum thunbergii[J]. Journal of Shanghai Ocean University, 2011, 20(3): 363-367. |
| [15] |
严小军, 范晓, 娄清香, 等. 海藻中类胡萝卜素的提取及含量测定[J]. 海洋科学集刊, 2001(43): 108-114. Yan Xiaojun, Fan Xiao, Lou Qingxiang, et al. Isolation and quantification of carotenoids from marine algae[J]. Studia Marina Sinica, 2001(43): 108-114. |
| [16] |
刘梁, 勾明玥, 张春枝, 等. 海带岩藻黄素提取工艺的优化[J]. 大连工业大学学报, 2010, 29(6): 406-408. Liu Liang, Gou Mingyue, Zhang Chunzhi, et al. Optimization on extraction of fucoxanthin from Laminaria japonica[J]. Journal of Dalian Polytechnic University, 2010, 29(6): 406-408. |
| [17] |
闫相勇, 刘翼翔, 吴永沛, 等. 海带岩藻黄素的提取及纯化工艺研究[J]. 中国食品学报, 2014, 14(3): 115-121. Yan Xiangyong, Liu Yixiang, Wu Yongpei, et al. Optimizing the Processes of Extracting and Purifying Fucoxanthin from Laminaria Japonica[J]. Journal of Chinese Institute of Food Science and Technology, 2014, 14(3): 115-121. |
| [18] |
苌钊, 徐小琴, 李强, 等. 超声提取裙带菜中岩藻黄素的工艺研究[J]. 药物评价研究, 2013, 36(4): 285-288. Chang Zhao, Xu Xiaoqin, Li Qiang, et al. Optimization of ultrasonic enhanced extraction of fucoxanthin from Undaria pinnatifida[J]. Drug Evaluation Research, 2013, 36(4): 285-288. |
| [19] |
惠伯棣. 类胡萝卜素化学及生物化学[M]. 北京: 中国轻工业出版社, 2005: 90-94. Hui Bodi. Carotenoid chemistry and biochemistry[M]. Beijing: China Light Industry Press, 2005: 90-94. |
| [20] |
陈晓利, 汪曙晖, 朱俊向, 等. 岩藻黄素在水、油模型体系中稳定性的研究[J]. 食品工业科技, 2016, 37(14): 298-302, 307. Chen Xiaoli, Wang Shuhui, Zhu Junxiang, et al. Study on stability of fucoxanthin in oil and aqueous model system[J]. Science and Technology of Food Industry, 2016, 37(14): 298-302, 307. |
| [21] |
乐龙, 覃艳, 王志祥. 响应曲面法优化超声提取辣椒中辣椒红色素的工艺研究[J]. 中国药科大学学报, 2011, 42(6): 573-577. Le Long, Tan Yan, Wang Zhixiang. Optimization of ultrasound-assisted extraction capsicum red pigment from Capsicum frutescens L. via response surface methodology[J]. Journal of China Pharmaceutical University, 2011, 42(6): 573-577. DOI:10.11665/j.issn.1000-5048.20110618 |
| [22] |
尹尚军, 徐涛, 刘丽平, 等. 羊栖菜岩藻黄质的提取工艺研究[J]. 食品工业科技, 2011, 32(4): 272-275. Yin Shangjun, Xu Tao, Liu Liping, et al. Study on extracting process of fucoxanthin from Sargassum fusiforme[J]. Science and Technology of Food Industry, 2011, 32(4): 272-275. |
| [23] |
臧正蓉, 解修俊, 赵佩佩, 等. 温度和光照对三角褐指藻的生长及岩藻黄素含量的影响[J]. 海洋科学, 2015, 39(7): 1-6. Zang Zhengrong, Xie Xiujun, Zhao Peipei, et al. Effect of different temperatures and light conditions on the growth and fucoxanthin content of Phaeodactylum tricornutum[J]. Marine Sciences, 2015, 39(7): 1-6. DOI:10.11759/hykx20140403002 |
| [24] |
陈文佳. 海带中岩藻黄素提取工艺优化及性质研究[D]. 济南: 山东轻工业学院, 2012: 23-37. Chen Wenjia. Optimization of extraction technology and properties of fucoxanthin from kelp[D]. Jinan: Shandong Polytechnic University, 2012: 23-37. http://cdmd.cnki.com.cn/Article/CDMD-10431-1012459821.htm |
| [25] |
曲荣荣, 张春枝. 发酵条件对海带中岩藻黄素提取率的影响[J]. 大连工业大学学报, 2012, 1(31): 12-14. Qu Rongrong, Zhang Chunzhi. Effect of fermentation conditions on fucoxanthin extraction rate from Laminaria japonica[J]. Journal of Dalian Polytechnic University, 2012, 1(31): 12-14. |
| [26] |
姜宏波, 田相利, 董双林, 等. 鼠尾藻生长、藻体成分及其生境的初步研究[J]. 海洋湖沼通报, 2009(2): 59-66. Jiang Hongbo, Tian Xiangli, Dong Shuanglin, et al. The preliminary study on growth, chemical constituent and habitat of Sargassum thunbergii[J]. Transactions of Oceanology and Limnology, 2009(2): 59-66. |
 2018, Vol. 42
2018, Vol. 42


