文章信息
- 余露军, 李建军, 魏远征, 蔡磊, 苗宗余, 黄韧. 2018.
- YU Lu-jun, LI Jian-jun, WEI Yuan-zheng, CAI Lei, MIAO Zong-yu, HUANG Ren. 2018.
- GFP标记的迟缓爱德华菌感染诸氏鲻虾虎鱼后组织分布研究
- Infection kinetics of GFP-Labeled Edwardsiella tarda in Mugilogobius chulae
- 海洋科学, 42(6): 57-62
- Marine Sciences, 42(6): 57-62.
- http://dx.doi.org/10.11759/hykx20180315001
-
文章历史
- 收稿日期:2018-03-15
- 修回日期:2018-04-10
迟缓爱德华菌(Edwarsiella tarda)是水产养殖中重要的病原菌之一, 在世界范围内广泛分布, 能感染多种海、淡水鱼类, 给养殖业造成严重危害[1]。同时, 迟缓爱德华菌具有广泛宿主范围, 可以感染包括人类在内的多种高等动物, 是一种人兽共患病病原[2-3]。迟缓爱德华菌属于条件致病菌, 其致病作用受多种因子协调作用[3-5], 且其胞内寄生的特点使其可逃避宿主免疫防御屏障, 为该病的治疗带来了困难, 因此其致病机理一直受到广泛关注。
诸氏鲻虾虎鱼(Mugilogobius chulae)属于鲈形目(Perciformes)、虾虎鱼亚目(Gobioidei)、虾虎鱼科(Gobiidae)、鲻虾虎鱼属(Mugilogobius), 为暖水性小型海洋鱼类, 具有胚胎及早期仔鱼透明、体形小、繁殖量大等特点, 作为一种潜在的海洋模式鱼类, 具有良好的应用前景。迟缓爱德华菌是诸氏鲻虾虎鱼养殖过程中最为严重的病原之一, 可引起诸氏鲻虾虎鱼全身充血、肝脏部位溃烂穿孔等症状, 造成大量死亡。本研究通过浸泡、腹腔注射、肌肉注射3种不同方式进行感染试验, 探讨不同途径下迟缓爱德华菌感染诸氏鲻虾虎鱼的组织动态分布, 为迟缓爱德华菌入侵机制和诸氏鲻虾虎鱼感染模型研究提供基础数据。
1 材料与方法 1.1 实验鱼实验鱼为本实验室培育的诸氏鲻虾虎鱼封闭群, 体长2.5~3.0 cm, 养殖水温26℃, 海水盐度15‰, 每天早晚各投喂卤虫(Artemia)1次, 每天更换1/3体积的养殖水。
1.2 EtMc1512-GFP构建迟缓爱德华菌为本实验室从诸氏鲻虾虎鱼分离的菌株EtMc1512。PMDpp-EGFP质粒由中国水产科学研究院珠江水产研究所李凯彬研究员赠送, 通过电转化法将质粒转入菌株EtMc1512[6], 荧光显微镜下筛选阳性克隆。
1.3 EtMc1512-GFP质粒稳定性检测将EtMc1512-GFP接种于脑心浸液(BHI)液体培养基(含氨苄青霉素50 μg/mL), 30℃、150 r/min振荡培养24 h, 再将菌液按1︰1000(体积比)接种于不含氨苄青霉素的BHI液体培养基, 每24 h转接1次, 转接的同时将菌液按一定比例稀释后涂布于含氨苄青霉素的BHI平板, 30℃培养48 h, 荧光显微镜下观察菌落并计数。质粒稳定性=绿色荧光菌落数/总菌落数×100%。
1.4 EtMc1512-GFP毒力检测EtMc1512菌株接种于BHI液体培养基, EtMc1512- GFP菌株接种于BHI液体培养基(含50 μg/mL氨苄青霉素), 在30℃、150 r/min条件下振荡培养24 h, 无菌生理盐水洗涤后重悬, 采用麦氏比浊法稀释到1.5×105、3×104、6×103、1.2×103、2.4×102 CFU/mL 5个浓度梯度, 腹腔注射诸氏鲻虾虎鱼, 每尾注射0.02 mL, 对照组注射生理盐水, 每个浓度组注射10尾。试验期间不投喂, 连续观察10 d, 统计各浓度组死亡数, spss17.0计算LD50。参照江云等[7]的方法对迟缓爱德华菌6个毒力基因(citC、mukF、esrB、katB、fimA、gadB)进行检测。
1.5 不同感染方式下迟缓爱德华菌在诸氏鲻虾虎鱼组织内的分布 1.5.1 浸泡感染在水温28℃、盐度15条件下, 用EtMc1512-GFP(终浓度1.0×107 CFU/mL)浸泡感染诸氏鲻虾虎鱼(共30尾), 浸泡1 h后洁净水冲洗3次, 转入洁净水中养殖。根据预实验结果, 24h后各组织菌量均已下降至最小值, 故浸泡感染后分别于0、2、4、6、8、12、24 h取实验鱼血液、鳃、肝脏、肠道、肌肉。血液从心脏部位采血, 鳃经无菌生理盐水冲洗3次除杂菌, 肝脏和肠道分别取全部肝脏和全肠, 肌肉取自背部两侧肌肉。每个时间点随机取3尾实验鱼的组织样品混合、称质量, 按每0.01g添加100 μL无菌生理盐水匀浆, 梯度稀释后涂布于BHI平板(含50 μg/mL氨苄青霉素), 每个样品设3个平行。28℃恒温培养36 h后, 在荧光显微镜下观察计数绿色菌落数量。采用SPSS17.0进行方差分析(ANOVA), P < 0.05表示差异显著, 试验结果以平均值±标准差表示。
1.5.2 腹腔注射和肌肉注射感染新鲜培养的EtMc1512-GFP用生理盐水稀释至2.1×103 CFU/mL, 分别腹腔注射和背部肌肉注射感染诸氏鲻虾虎鱼(0.02 mL/尾, 各30尾), 感染后置于28℃、盐度15的洁净水中养殖。根据预实验结果, 分别于感染后6、12、24、48、72、96 h取实验鱼血液、鳃、肝脏、肠、肌肉。取样、细菌培养、菌落观察计数以及数据分析方法同浸泡感染。
2 结果 2.1 EtMc1512-GFP菌株观察通过电转化法将GFP质粒转入EtMc1512菌株, 成功构建EtMc1512-GFP菌株, 在荧光显微镜下其单菌落和菌体呈较强的绿色荧光(图 1)。
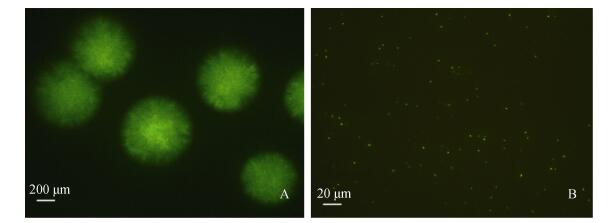 |
| 图 1 荧光显微镜下EtMc1512-GFP细菌形态观察 Fig. 1 Morphology of EtMc1512-GFP with fluorescent microscope A. EtMc1512-GFP菌落形态(40×); B. EtMc1512-GFP细菌形态(400×) A. Colonial morphology of EtMc1512-GFP(40×); B. Mycelial mophology of EtMc1512-GFP(400×) |
EtMc1512-GFP菌株在BHI液体培养基中传代培养, 至第16代GFP质粒稳定性仍为100%, 到第20代GFP质粒稳定性降为82%(表 1)。
| 传代数 | 稳定性/% |
| 1 | 100 |
| 2 | 100 |
| 3 | 100 |
| 4 | 100 |
| 5 | 100 |
| 6 | 100 |
| 7 | 100 |
| 8 | 100 |
| 9 | 100 |
| 10 | 100 |
| 11 | 100 |
| 12 | 100 |
| 13 | 100 |
| 14 | 100 |
| 15 | 100 |
| 16 | 100 |
| 17 | 94 |
| 18 | 90 |
| 19 | 84 |
| 20 | 82 |
腹腔注射感染条件下, EtMc1512-GFP菌株对诸氏鲻虾虎鱼的半数致死量LD50为21 CFU/尾, EtMc1512野生株对诸氏鲻虾虎鱼的半数致死量LD50为19 CFU/尾, 两者毒力无明显差别; 毒力基因检测结果显示, EtMc1512-GFP菌株和EtMc1512野生株6个毒力基因检测结果均为阳性(表 2)。
| 菌株 | 半致死浓度/ (CFU/尾) | 毒力基因 | |||||
| citC | mukF | esrB | katB | fimA | gadB | ||
| EtMc1512 | 1.9×101 | + | + | + | + | + | + |
| EtMc1512-GFP | 2.1×101 | + | + | + | + | + | + |
诸氏鲻虾虎鱼浸泡感染EtMc1512-GFP后不同组织细菌计数结果见图 2, 各组织菌量随时间表现为先升后降的趋势。肠道最高菌量出现在第6小时(2.51×106CFU/g), 鳃组织最高菌量出现在第4小时(4.19×104CFU/g), 血液最高菌量出现在第12小时(1.65×104CFU/g), 肝和肌肉菌量极低, 肠道菌量显著高于其他组织(P < 0.05)。不同组织最高菌量排序为:肠道 > 鳃 > 血液 > 肝 > 肌肉。
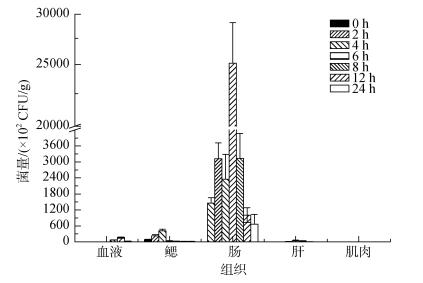 |
| 图 2 浸泡感染后不同时间诸氏鲻虾虎鱼各组织中的EtMc1512-GFP菌量 Fig. 2 The number of EtMc1512-GFP in M. chulae tissue samples after immersion challenge |
诸氏鲻虾虎鱼腹腔注射感染EtMc1512-GFP 72 h后, 鱼体腹部可见明显红肿症状, 严重者肝脏部位溃烂穿孔。不同组织细菌计数结果见图 3, 各组织最高菌量均出现在第96小时, 不同组织最高菌量排序为:血液(4.65×106CFU/g) > 肝(4.55×106CFU/g) > 肌肉(3.44×106CFU/g) > 肠道(1.70×106CFU/g) > 鳃(0.66× 106CFU/g)。腹腔注射感染后血液和肝最先检出目标细菌(12 h), 其次为鳃(48 h), 最后为肠道和肌肉(72 h), 血液菌量远高于同时间点其他组织菌量(P < 0.05)。
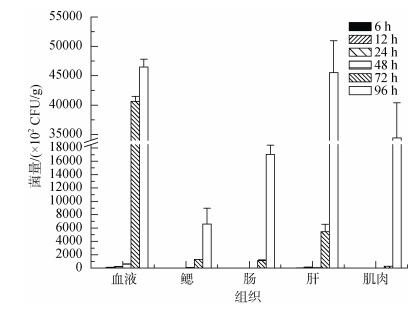 |
| 图 3 腹腔注射感染后不同时间诸氏鲻虾虎鱼各组织中的EtMc1512-GFP菌量 Fig. 3 The number of EtMc1512-GFP in M. chulae tissue samples after intraperitoneal challenge |
诸氏鲻虾虎鱼肌肉注射感染EtMc1512-GFP 72 h后, 鱼体注射部位可见红肿溃烂症状。不同组织细菌计数结果见图 4, 最高菌量为72 h的血液(2.93×104 CFU/g), 其次为72 h的鳃(0.5×104CFU/g)、48 h的肌肉(2.1× 103 CFU/g)、72 h的肝(1.1×103 CFU/g), 肠道未检出目标细菌。不同组织最高菌量排序为:血液 > 鳃 > 肌肉 > 肝 > 肠道, 各组织检出目标细菌的时间顺序为:肌肉(48 h) > 血液=鳃=肝(72 h)。
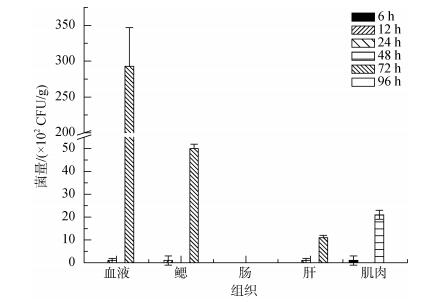 |
| 图 4 肌肉注射感染后不同时间诸氏鲻虾虎鱼各组织中的EtMc1512-GFP菌量 Fig. 4 The number of EtMc1512-GFP in M. chulae tissue samples after intramuscular challenge |
GFP荧光标记技术是研究病原入侵途径的理想方法, 与传统微生物分离[8]、同位素标记[9]、扫描电镜[10]及荧光定量PCR[11]等方法相比, 该方法能有效排除其他细菌和死亡细菌的干扰, 只需简单的技术操作即可直观观察和辨别细菌在宿主体内的感染和转移过程。近年, 已有较多鱼类病原成功应用该方法开展相关研究[12-13]。本研究GFP荧光标记的迟缓爱德华菌荧光信号强, 且具有氨苄青霉素抗性, 通过简单的培养操作即可监测病原在诸氏鲻虾虎鱼体内各组织的分布, 进一步证明利用荧光标记的病原菌是研究其感染动力学行之有效的方法。值得注意的是, GFP荧光标记的菌株质粒稳定性是其应用的重要基础。Wang等[14]荧光标记的迟缓爱德华菌SM菌株(pFPV25.1质粒)传代7次质粒稳定性为100%, 而杜以帅等[15]构建的杀鲑气单胞菌绿色荧光蛋白C4菌株(pGFPuv质粒)传代至第7代质粒稳定性开始下降(95%), 李静等[16]构建的嗜水气单胞菌绿色荧光蛋白AhJ-1强毒株(pWSK129质粒)传代至第10代质粒稳定性急剧下降, 弱毒株Ah4332株传代至70代质粒依然稳定, 表明菌种或菌株、质粒、转化方式均可能对质粒稳定性产生影响。本研究通过电转化构建的EtMc1512-GFP菌株, 连续传代至16代质粒稳定性仍可达100%, 且其毒性与野生株基本保持一致, 能很好地应用于急、慢性感染动力学研究。
鱼类的鳃和皮肤直接接触水环境, 易受到病原的侵袭, 大量研究证实鱼类鳃和受损伤的皮肤是细菌入侵的主要部位[17-18]。Rekecki等[19]研究表明, 在浸泡感染条件下鳗弧菌首先在欧洲鲈鱼肠道中黏附, 透射电镜显示肠道为主要感染部位; Otoole等[20]利用鳗弧菌浸泡感染斑马鱼, 发现肠道和体表是其主要感染部位; Ling等[21]、Farto等[22]研究结果也显示, 鳃、体表皮肤和肠道是病原菌感染鱼类的主要部位。而在本实验中, 迟缓爱德华菌浸泡感染诸氏鲻虾虎鱼后, 肠道菌量显著高于鳃组织菌量(100倍)。与淡水鱼类相比, 诸氏鲻虾虎鱼肠道含菌量较高, 这可能与海水鱼需要“饮水”来维持渗透压平衡[23], 从而经口吞入大量水环境中的细菌有关。本研究结果表明, 经口感染是迟缓爱德华菌入侵诸氏鲻虾虎鱼的重要途径, 诸氏鲻虾虎鱼肠道可作为迟缓爱德华菌浸泡感染模型重要评价部位。在诸氏鲻虾虎鱼养殖过程中, 水环境中的病原菌经口感染风险较高, 需要严格加以控制。
在感染模型研究中, 注射部位、注射剂量都是决定宿主细菌感染的重要因素[24], 因此病原与宿主间的相互作用机制、宿主适应性免疫反应等研究常采用肌肉和腹腔注射感染方式。在本试验中, 肌肉注射和腹腔注射感染后血液中的含菌量较高, 与鳟鱼腹腔注射感染布鲁氏耶尔森氏菌YRNC10-gfp结果一致[25];且感染后可引起诸氏鲻虾虎鱼全身红肿、出血症状, 与迟缓爱德华菌出血性败血症特征相符[26]。诸氏鲻虾虎鱼腹腔注射感染后, 肝脏和血液最先检出病原, 且菌量最高, 表明肝脏是诸氏鲻虾虎鱼腹腔感染模型重要评价部位, 而血液可能是迟缓爱德华菌在诸氏鲻虾虎鱼体内传播的重要媒介。
| [1] |
Park S B, Aoki T, Jung T S, et al. Pathogenesis of and strategies for preventing Edwardsiella tarda infection in fish[J]. Veterinary Research, 2012, 43(1): 67. DOI:10.1186/1297-9716-43-67 |
| [2] |
Xie H X, Lu J, Zhou Y, et al. Identification and functional characterization of the novel Edwardsiella tarda effector EseJ[J]. Infection and Immunity, 2015, 83(4): 1650-1660. DOI:10.1128/IAI.02566-14 |
| [3] |
Gao D, Li Y, Xu Z, et al. The role of regulator Eha in Edwardsiella tarda pathogenesis and virulence gene transcription[J]. Microbial Pathogenesis, 2016, 95: 216-223. DOI:10.1016/j.micpath.2016.03.010 |
| [4] |
Xu T, Zhang X. Edwardsiella tarda: an intriguing problem in aquaculture[J]. Aquaculture, 2014, 431: 129-135. DOI:10.1016/j.aquaculture.2013.12.001 |
| [5] |
Castro N, Osorio C R, Bujan N, et al. Insights into the virulence-related genes of Edwardsiella tarda isolated from turbot in Europe: genetic homogeneity and evidence for vibrioferrin production[J]. Journal of Fish Diseases, 2016, 39(5): 565-576. DOI:10.1111/jfd.12389 |
| [6] |
李宁求, 余露军, 付小哲, 等. 鳗源迟缓爱德华氏菌菌蜕的构建及制备条件优化[J]. 水产学报, 2012, 36(11): 1754-1762. Li Ningqiu, Yu Lujun, Fu Xiaozhe, et al. Construction of Edwardsiella tarda ghosts from eel and their optimization of preparation conditions[J]. Journal of Fisheries of China, 2012, 36(11): 1754-1762. |
| [7] |
江云, 李寿崧, 王寿昆, 等. 致病性迟钝爱德华氏菌毒力基因的PCR检测[J]. 中国食品学报, 2008, 4: 123-129. Jiang Yun, Li Shousong, Wang Shoukun, et al. Detection of the virulence genes of pathogenic Edwardsiella tarda by PCR assay[J]. Journal of Chinese Institute of Food Science and Technology, 2008, 4: 123-129. |
| [8] |
Amaro C, Biosca E G, Fouz B, et al. Evidence that water transmits Vibrio vulnificus biotype 2 infections to eels[J]. Applied and Environmental Microbiology, 1995, 61(3): 1133-1137. |
| [9] |
Svendsen Y S, Dalmo R A, Bogwald J, et al. Tissue localization of Aeromonas salmonicida in Atlantic salmon, Salmosalar L., following experimental challenge[J]. Journal of Fish Diseases, 1999, 22(2): 125-131. DOI:10.1046/j.1365-2761.1999.00153.x |
| [10] |
苏友禄, 冯娟, 郭志勋, 等. 美人鱼发光杆菌杀鱼亚种感染卵形鲳鲹的病理学观察[J]. 海洋科学, 2012, 36(2): 75-81. Su Youlu, Feng Juan, Guo Zhixun, et al. Histopathological analysis of golden pompano Trachinotus ovatus infected with Photobacterium damselae subsp. Piscicida[J]. Marine Sciences, 2012, 36(2): 75-81. |
| [11] |
闫云锋, 苏友禄, 郭志勋, 等. 鱼类神经坏死病毒对军曹鱼仔鱼的致病性[J]. 海洋科学, 2010, 34(4): 6-10. Yan Yunfeng, Su Youlu, Guo Zhixun, et al. The research on pathogenicity of fish nervous necrosis virus to Rachycentron canadum juvenile[J]. Marine Sciences, 2010, 34(4): 6-10. |
| [12] |
Liu Y J, Lu C P. Role of Ichthyophthirius multifiliis in the Infection of Aeromonas hydrophila[J]. Journal of Veterinary Medicine Series B-infectious Diseases and Veterinary Public Health, 2004, 51(5): 222-224. DOI:10.1111/jvb.2004.51.issue-5 |
| [13] |
Harmache A, Leberre M, Droineau S, et al. Bioluminescence imaging of live infected salmonids reveals that the fin bases are the major portal of entry for Novirhabdo virus[J]. Journal of Virology, 2006, 80(7): 3655-3659. DOI:10.1128/JVI.80.7.3655-3659.2006 |
| [14] |
Wang X P, Yan M C, Hu W L, et al. Visualization of Sparus macrocephalus infection by GFP-labeled Edwardsiella tardal[J]. Israeli Journal of Aquaculture- Bamidgeh, 2012, 64(7): 1-7. |
| [15] |
杜以帅, 张丽娜, 马晓娜, 等. 绿色荧光蛋白标记杀鲑气单胞菌的构建及其初步应用[J]. 海洋科学, 2016, 40(12): 30-35. Du Yishuai, Zhang Lina, Ma Xiaona, et al. Construction and application of green fluorescent protein for Aeromonas salmonicida strain[J]. Marine Sciences, 2016, 40(12): 30-35. DOI:10.11759/hykx20161206 |
| [16] |
李静, 张晓露, 刘永杰, 等. 绿色荧光蛋白基因标记嗜水气单胞菌的研究[J]. 畜牧与兽医, 2009, 41(3): 1-4. Li Jing, Zhang Xiaolu, Liu Yongjie, et al. Genetically marking of Aeromonas hydrophila strains with green fluorescent proteingene[J]. Animal Husbandry & Veterinary Medicin, 2009, 41(3): 1-4. |
| [17] |
Chu Weihua, Lu Chengping. In vivo fish models for visualizing Aeromonas hydrophila invasion pathway using GFP as a biomarker[J]. Aquaculture, 2008, 277: 152-155. DOI:10.1016/j.aquaculture.2008.03.009 |
| [18] |
陆春云, 谢骏, 习丙文, 等. 嗜水气单胞菌在浸泡感染团头鲂的组织动态分布[J]. 中国水产科学, 2015, 22(5): 1068-1074. Lu Chunyun, Xie Jun, Xi Bingwen, et al. Infection kinetics of Aeromonas hydrophila in the blunt-snout bream, Megalobrama amblycephala[J]. Journal of Fishery Sciences of China, 2015, 22(5): 1068-1074. |
| [19] |
Rekecki A, Gunasekara R, Dierckens K, et al. Bacterial host interaction of GFP-labelled Vibrio anguillarum HI-610 with gnotobiotic sea bass, Dicentrarchus labrax (L.), larvae[J]. Journal of Fish Diseases, 2012, 35(4): 265-273. DOI:10.1111/jfd.2012.35.issue-4 |
| [20] |
Otoole R, Von Hofsten J, Rosqvist R, et al. Visualisation of zebrafish infection by GFP-labelled Vibrio anguillarum[J]. Microbial Pathogenesis, 2004, 37(1): 41-46. DOI:10.1016/j.micpath.2004.03.001 |
| [21] |
Ling S H, Wang X H, Lim T M, et al. Green fluorescent protein-tagged Edwardsiella tarda reveals portal of entry in fish[J]. Fems Microbiology Letters, 2001, 194(2): 239-243. DOI:10.1111/fml.2001.194.issue-2 |
| [22] |
Farto R, Milton D L, Bermudez M B, et al. Colonization of turbot tissues by virulent and avirulent Aeromonas salmonicida subsp. salmonicida strains during infection[J]. Diseases of Aquatic Organisms, 2011, 95(2): 167-173. DOI:10.3354/dao02342 |
| [23] |
Guo Z, Gao N, Wu Y, et al. The simultaneous uptake of dietary and waterborne Cd in gastrointestinal tracts of marine yellowstripe goby Mugilogobius chulae[J]. Environmental Pollution, 2017, 223: 31-41. |
| [24] |
Li Y, Hu B. Establishment of multi-site infection model in zebrafish Larvae for studying Staphylococcus aureus infectious disease[J]. Journal of Genetics and Genomics, 2012, 39(9): 521-534. DOI:10.1016/j.jgg.2012.07.006 |
| [25] |
Welch T J, Wiens G D. Construction of a virulent, green fluorescent protein-tagged Yersinia ruckeri and detection in trout tissues after intraperitoneal and immersion challenge[J]. Diseases of Aquatic Organisms, 2005, 67(3): 267-272. |
| [26] |
Rao P S, Lim T M, Leung K Y, et al. Functional genomics approach to the identification of virulence genes involved in Edwardsiella tarda pathogenesis[J]. Infection and Immunity, 2003, 71(3): 1343-1351. DOI:10.1128/IAI.71.3.1343-1351.2003 |
 2018, Vol. 42
2018, Vol. 42


