文章信息
- 蔡学花, 顾文辉, 李元翔, 王广策. 2018.
- CAI Xue-hua, GU Wen-hui, LI Yuan-xiang, WANG Guang-ce. 2018.
- 基于蛋白组学分析杜氏盐藻对不同浓度CO2的响应
- The physiological and metabolic response of Dunaliella salina to different concentrations of CO2 based on proteomics
- 海洋科学, 42(9): 98-106
- Marine Sciences, 42(9): 98-106.
- http://dx.doi.org/10.11759/hykx20180327001
-
文章历史
- 收稿日期:2018-03-27
- 修回日期:2018-05-22
2. 青岛国家海洋实验室 海洋生物与技术功能实验室, 山东 青岛 266237;
3. 中国科学院大学, 北京 100049;
4. 中国科学院 海洋大科学研究中心, 山东 青岛 266071
2. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
3. College of Earth Sciences, University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
近年来, 大气中CO2浓度持续增加, 海水溶解大量的CO2使海水pH下降, 导致海洋酸化[1]。微藻是海洋中主要的初级生产力, 可以通过光合作用固定海水中的CO2, Dunaliella salina, Chlorella vulgaris和Galdieria partita等很多种属可耐受极高浓度的CO2(1%~5%以上)[2-3]。一些微藻, 如杜氏盐藻, 在生长阶段可积累油脂和类胡萝卜素等高附加值的产物, CO2作为光合作用的底物, 可影响这些产物的积累。
CO2浓度变化可引起细胞形态和生化组成的显著改变, 在高浓度压力下, 细胞通过调整光合器官结构和功能以提高光合效率[3-5]。不同藻类对高浓度CO2的耐受存在特异性, 有研究显示, 杜氏盐藻可耐受5%高浓度的CO2[6]。杜氏盐藻属于绿藻门、绿藻纲、团藻目、杜氏藻科、杜氏藻属, 细胞壁不完整, 细胞膜外只有一层薄而有弹性的糖蛋白和神经氨基酸外层, 可在较广范围的盐度生存、繁殖, 其主要渗透调节物是甘油[7]。高盐、强光、营养盐缺乏等条件, 可诱导杜氏盐藻大量积累β-胡萝卜素[8]。
盐藻对无机碳的固定首先通过细胞内主动转移无机碳的CO2浓缩的机制(CO2 concentrating mechanism, CCM)。该过程中的关键酶为碳酸酐酶(carbonic anhydrase, CA), CA参与催化HCO3–与CO2在细胞内外的相互转化, 以调控胞内的碳浓度。CO2浓度、温度和营养元素等环境因子对CCM具有调控作用[9-10]。
杜氏盐藻利用不同浓度CO2的研究已有报道[11-13], 但在蛋白组学水平上的整体研究仍有待补充。本研究以不同浓度的CO2为处理条件, 并利用GMS 150型高精度气体混合仪对浓度进行精确调控, 测定了杜氏盐藻细胞密度、碳酸酐酶活性等参数, 结合蛋白组学分析方法, 比较分析了不同处理条件下细胞内主要代谢路径中蛋白表达的差异, 以期深入认识杜氏盐藻对不同浓度CO2的响应机制。
1 材料与方法 1.1 实验藻种杜氏盐藻(Dunaliella salina)为本实验室保藏藻种, 采于天津长芦汉沽盐场。
1.2 培养条件培养基为Pick改良配方[14-16], 不加NaHCO3, 调节pH为7.4, 120℃, 20 min灭菌。光源为荧光灯, 光照强度为正常培养强度, 约6000 lx, 光暗周期为14 h/10 h, 温度为25℃。
利用GMS 150气体混合仪(Photon Systems Instruments, 捷克), 以内径6 cm、容积1 L的玻璃管作为小型气升式光反应器, 连续通气培养。通气条件分为4组: 99.97%N2 + 0.03%CO2, 99.7%N2 + 0.3% CO2, 97%N2 + 3%CO2, 91%N2 + 9%CO2。每组设3个平行。
1.3 生理指标的测定及质谱分析 1.3.1 细胞密度的测定充分摇匀取藻样, 以0.5%的甲醛固定藻细胞, 用血球计数板进行显微细胞计数。
1.3.2 碳酸酐酶活性的测定碳酸酐酶活性的测定参照Wilbur-Anderson量电法[17, 18]并做适当调整。
胞外碳酸酐酶活性测定:取各处理组一定体积藻液, 以2000 r/min、4℃条件离心5 min。去上清, 收集藻细胞。用4℃预冷的巴比妥钠缓冲液重悬藻细胞, 再次离心, 去上清, 然后用5 mL巴比妥钠缓冲液重悬, 得到细胞样品。将反应体系置于冰浴中, 控制温度约为4℃, 向样品中迅速加入3 mL 0℃的饱和CO2蒸馏水, 用pH计(Sartorius PB-10, 美国)测定pH值, 记录pH值从8.0降至7.0的时间。
总碳酸酐酶活性测定:测定破碎的藻细胞样品。使用超声细胞粉碎机(JY92-ⅠⅠ DN, 新芝生物, 宁波)进行破碎, 超声工作条件:功率200 W, 每次作用时间8 s, 间隔时间10 s, 共作用80 s。
1.3.3 甘油含量的测定用甘油含量测试试剂盒(南京建成, 南京), 按照说明书测定甘油含量, 每个样品做3次重复。
1.3.4 色素含量的测定色素提取液为甲醇︰丙酮(v︰v)=1︰1, 加入适量提取液, 置于冰上充分提取色素至镜检藻体沉淀为白色。使用0.45 μm滤膜过滤, 将滤液保存于–20℃。
用高效液相色谱仪(Shimazu LC-16, 日本)测定色素的含量, 测定条件参照THAYER[19]和XIE等[20]的方法。
1.3.5 叶绿素荧光活性的测定用叶绿素荧光测定仪(Walz, 德国)测定, 测定前将微藻样品暗适应5 min。在荧光仪上直接读出叶绿素荧光参数Fv/Fm(有效光能转换效率)、Y(Ⅱ)(最大光能转换效率)。
1.3.6 总可溶性蛋白提取及质谱分析(1) 蛋白提取
总可溶性蛋白的提取参照Wang等[21, 22]的方法并加以调整, 所得蛋白沉淀用内含125 mmol/L碳酸氢铵的8 mol/L尿素, 在室温下充分溶解。以10 000 r/min, 4℃离心10 min, 去未溶解的沉淀。
(2) 蛋白质定量、酶切和质谱检测分析
用二喹啉甲酸(bicinchoninic acid, BCA)蛋白浓度测定试剂盒(Cat#PC0020, Solarbio)进行蛋白定量, 以8 mol/L尿素稀释, 终浓度定量至约为1 mg/mL。37℃下用10 mmol/L的二硫苏糖醇还原蛋白样品1 h。随后在黑暗条件下, 向样品中加入50 mmol/L的碘乙酰胺, 充分烷基化30 min。加入碳酸氢铵, 将8 mol/L蛋白稀释到2 mol/L, 进行酶切。测序级胰蛋白酶(Promega, 美国)先于30℃水浴中处理5 min活化, 随后按胰酶︰蛋白=1︰30 (w/w)加入蛋白样品中, 于37℃水浴进行酶切。12 h后, 加入甲酸至终浓度为1%, 使胰酶失活。酶切后的样品在12000 r/min、4℃离心15 min, 上清按每管70 μL分装, 存储于–80℃, 以备LC-MS/MS检测使用。
质谱分析方法参照GU[23]和赵佩佩等[24]。质谱校正后(maxis plus QTOF, Bruker, 德国), 将酶切过的样品加入高效液相色谱系统(Agilent 1260 HPLC system, Agilent Advance BIO, 美国)。多肽洗脱中流动相A (0.1%甲酸超纯水)和B (0.1%甲酸乙腈), 参照Blonder等[25]的方法。
利用O-TOF Contron (版本4.1, Bruker, 德国)获取质谱分析后的原始数据, 通过Spectrum Mill MS Proteomics Workbench软件(版本A.03.03, Agilent, 美国)处理MS-MS图谱与搜索蛋白数据库, 并进行蛋白的定量计算。以归一化方法计算各蛋白的相对表达量, 并用软件SPSS 19.0进行统计学的显著性分析, P < 0.05为显著性差异。
1.3.7 pH测定通气24 h后, 用PB-10型pH计测定培养基的pH。
2 结果 2.1 不同CO2浓度组的细胞密度、碳酸酐酶活性和甘油含量变化不同CO2浓度下细胞密度变化曲线如图 1所示。初始细胞密度约为20×104个/mL, 培养5 d后, 3%浓度组盐藻细胞最高, 为79×104个/mL, 其次为0.3%和9%浓度组分别为67.2×104个/mL和46.1×104个/mL, 两组间差异显著(P < 0.05)。CO2浓度最低的0.03%组细胞密度增长最少, 仅达到22.45×104个/mL。表明在0.03%~3%浓度范围内, 随CO2浓度的升高, 杜氏盐藻细胞生长加快, 较高浓度的CO2可为细胞的生命活动提供充分碳源, 而过高浓度的CO2(9%)促进生长的作用减缓。
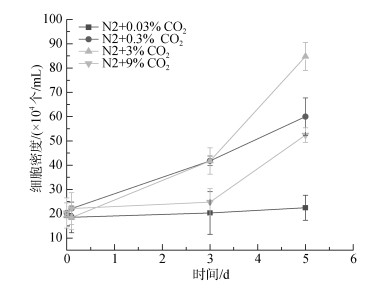 |
| 图 1 不同CO2浓度下盐藻细胞密度变化 Fig. 1 Cell density of D. salina under different CO2 concentrations |
甘油总含量如图 2所示。培养5 d后, 各组甘油含量均上升。在0.03%~9%CO2浓度范围内, 0.03%浓度组甘油含量最低, 由初始0.200 mmol/L± 0.005 mmol/L增长至0.439 mmol/L ± 0.068 mmol/L, 提高约2倍, 而其他高浓度组可提高约5~8倍, 且高浓度组间无显著差异。表明与近似空气中体积的CO2浓度(0.03%)相比, 提高CO2浓度可促进杜氏盐藻的甘油合成。
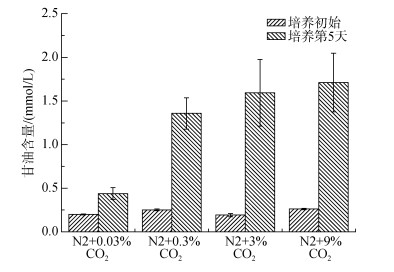 |
| 图 2 初始与第5天不同CO2浓度下甘油总含量 Fig. 2 Glycerol concentration of D. salina under different CO2 concentrations in initial phase and at day 5 |
碳酸酐酶含量如图 3所示。胞外碳酸酐酶活性在各处理组的含量有随着CO2浓度升高而下降的趋势, 0.03%浓度组最高为0.0130 U/104Cell ± 0.0017 U/104Cell, 9%浓度组最低为2.4018E-4 ± 3.6088E-4 U/104Cell。而3%浓度组分别与0.3%、9%浓度组无显著性差异。总碳酸酐酶活性为胞内及胞外酶的加和, 胞内及总碳酸酐酶含量在0.03%浓度下最高, 各浓度处理间无显著性差异(P > 0.05)。因此在0.03%~9%浓度范围内, CO2浓度对胞内碳酸酐酶活性的作用无显著性差异(P > 0.05)。
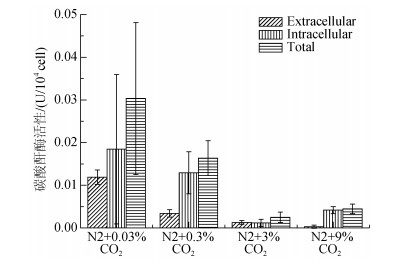 |
| 图 3 第5天不同CO2浓度下碳酸酐酶活性 Fig. 3 Carbonic anhydrase activity of D. salina under different CO2 concentrations at day 5 |
由图 4a可以看出, 培养5天后, 3%浓度组的β-胡萝卜素含量下降约50%, 其他几组无显著差异; 第5天对于不同处理组, 0.03%与3%, 9%浓度组有显著差异, 含量约是该两组的3倍, 即0.03%浓度组与3%和9%两个高浓度组相比, 低的CO2浓度下, β-胡萝卜素含量高, 利于其积累。
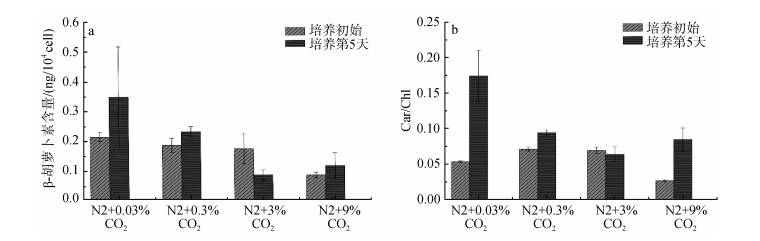 |
| 图 4 第0天与第5天不同CO2浓度下β-胡萝卜素含量与类胡萝卜素/叶绿素比值 Fig. 4 β-Carotene concentration and Carotene/chlorophyll of D. salina under different CO2 concentrations in initial phase and day 5 |
对于类胡萝卜素与叶绿素的比值Car/Chl, 在培养阶段0.3%和9%浓度组显著上升。第5天, 0.03%与其他处理组有显著差异, 约为其他各组的2倍, 低CO2浓度下捕光色素中类胡萝卜素比值较高。
2.3 PSⅡ荧光活性的变化光系统Ⅱ(PSⅡ)有效光化学效率Fv/Fm、最大光能转化效率Y(Ⅱ)如图 5所示。在0.03%~3%浓度范围内, 各处理组差异显著, 且呈上升趋势(P < 0.05)。在3%CO2浓度下, Fv/Fm、Y(Ⅱ)最高, 而在9%CO2浓度下两种参数值降低。
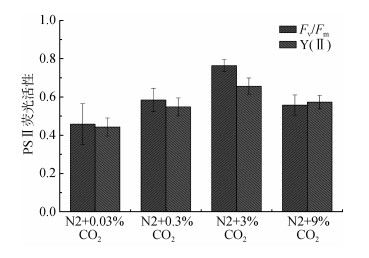 |
| 图 5 第5天不同处理组PSⅡ荧光参数变化 Fig. 5 Photosynthetic activity of PSⅡ under different CO2 concentrations at day 5 |
利用LC-MS/MS分析鉴定出15分以上的阳性蛋白有264个, 并用UniProt (http://www.uniprot.org/)网站搜索蛋白功能, 分成几个大类(图 6)。从图 6可以看出, 约21%的差异表达蛋白为推测蛋白(hypothetical proteins), 在数据库中没有找到注释。其他蛋白被注释为碳代谢、转录与翻译相关、光合作用与色素合成、氨基酸代谢、蛋白质代谢、抗氧化酶、脂质代谢、信号转导与产能代谢酶等蛋白。以归一法方法计算蛋白的相对表达量, 并用软件SPSS 19.0进行显著性分析。
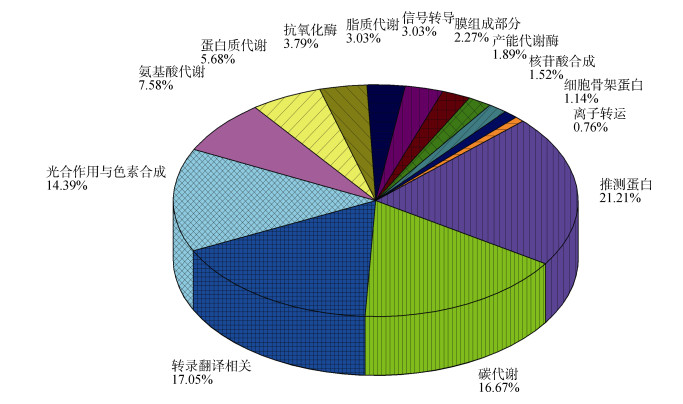 |
| 图 6 差异表达蛋白的功能分类 Fig. 6 Functional categories of differentially expressed proteins |
碳代谢相关蛋白, 如糖酵解途径中的葡萄糖-6-磷酸异构酶, 甘油醛-3磷酸脱氢酶(除3%浓度)以及催化葡萄糖-1-磷酸转化为葡萄糖-6-磷酸的以进入糖酵解途径的葡萄糖磷酸变位酶, 在0.03%~3%CO2浓度范围内随浓度升高而下降, 而CO2浓度9%时则有上升趋势。0.03%浓度组中的苹果酸脱氢酶(假定)与磷酸戊糖支路的核酮糖磷酸-3-差向异构酶表达量均高于其他浓度处理(图 7a)。此外, 卡尔文循环中的关键酶Rubisco酶大亚基rbcL、景天庚酮糖二磷酸酶(0.3%与3%浓度下无显著差异)的表达也有相近的趋势, 磷酸核酮糖激酶前体在0.03%与0.3%浓度下的表达量显著高于3%与9%浓度(图 7b)。
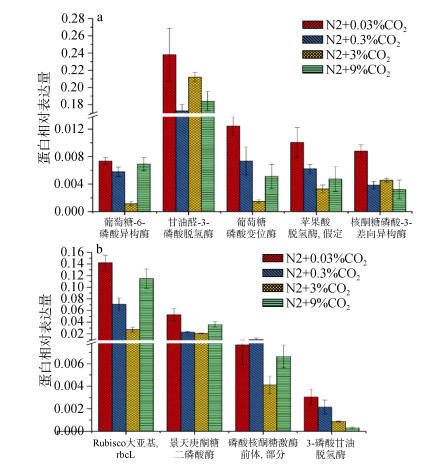 |
| 图 7 碳代谢过程相关蛋白的相对丰度 Fig. 7 The relative abundance of carbon metabolism-related proteins |
此外, 只在低碳浓度下(CO2浓度0.03%和3%)检测到的碳代谢相关蛋白有:低碳诱导蛋白LciD和碳酸酐酶。糖酵解途径中的关键酶磷酸果糖激酶则只在0.03%浓度下检测到。
2.4.2 光合作用相关蛋白光合过程相关蛋白相对丰度如图 8所示, 在0.03%~3%浓度范围内, 与光合作用相关的蛋白相对表达量有上调趋势, 如ATP合酶的CF1α亚基、CF2β亚基, 细胞色素f和b6(cyt b6在0.03%和3%无显著差异), PSⅡ的CP47和CP43反应中心蛋白(CP43在0.3%和3%无显著差异)、PSI亚基Ⅶ。在9%高CO2浓度下以上蛋白有些表达量略有上升或未检测到, 这些数据与PSⅡ荧光参数变化趋势相符合。
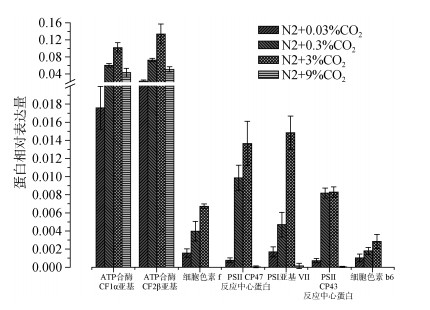 |
| 图 8 光合过程相关蛋白的相对丰度 Fig. 8 The relative abundance of photosynthesis-related proteins |
此外, 热激蛋白70B、假定蛋白(蛋白二硫键氧还酶活性)表现在0.03%~3%浓度时下降, 9%浓度时上升的趋势(图 9)。在该范围内, 热激蛋白90、热激蛋白70a、超氧化物歧化酶、30S核糖体蛋白S3(叶绿体)也有在低浓度(0.03%~0.3%浓度或0.03%~3%)时表达下调, 9%高浓度时表达上调的趋势。
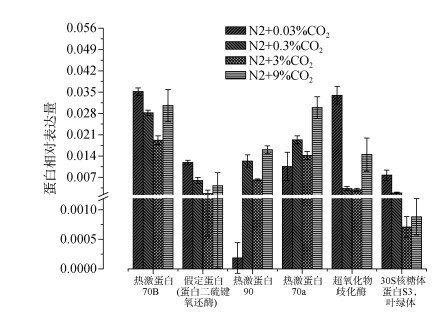 |
| 图 9 蛋白质代谢、抗氧化物及转录翻译等相关蛋白相对丰度 Fig. 9 The relative abundance of protein metabolism, antioxidant, transcription, and translation related proteins |
第1天不同处理组培养基pH如图 10所示, 随着气体中CO2浓度的升高, 培养基中pH降低, 9%高浓度下可使培养基pH < 5.0, 而藻细胞的存在使pH下降趋势减小。9%高浓度下培养基极低的pH可能通过影响CCM途径的CA酶等的活性对微藻的生长有一定的影响。
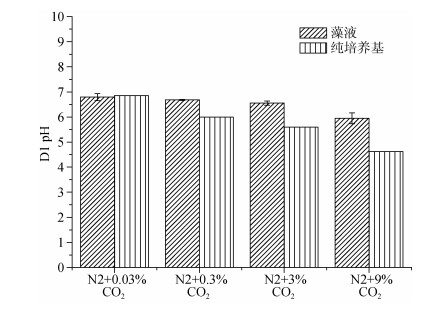 |
| 图 10 第1天不同CO2浓度下培养基pH Fig. 10 pH of medium under different CO2 concentrations at day 1 |
本研究结果表明, 本实验藻株杜氏盐藻的生长最适CO2浓度是3%。在一定范围内, 随着CO2浓度的升高, 杜氏盐藻的生理及光合活性提高, 过高浓度CO2则对细胞的生长有抑制作用。
胞外碳酸酐酶活性随着CO2浓度升高而下降, 0.03%浓度组的活性最高, 胞内碳酸酐酶活性不受CO2浓度的影响。蛋白质组学分析显示, 低CO2诱导蛋白LciD和碳酸酐酶的表达只在低碳浓度0.03%和3%下才能检测到。在高浓度CO2(1%~5%)下培养时, 培养液中的CO2能够满足细胞生长和光合作用的需要, 胞外碳酸酐酶的活性受到抑制[26]。CCM机制的形成需要低CO2浓度, 而高CO2浓度则会抑制微藻的CCM和碳酸酐酶的合成[27-28]。随着环境中CO2浓度的升高, 胞外碳酸酐酶活性呈下降趋势, 高CO2降低CCM途径中CA酶对无机碳的亲和力, 抑制了CCM的表达, 增加了供给1, 5-二磷酸核酮糖蛋白(RuBP)的CO2扩散通量[29-32], 细胞可利用的碳源增加, 细胞生长加快, 甘油等代谢产物的含量也随之上升。
0.03%的低CO2浓度利于β-胡萝卜素的积累, 同时类胡萝卜素占比升高。而杨晓玲等[33]通过向培养基中添加碳酸氢钠以提供CO2, 发现随着碳源浓度的升高, β-胡萝卜素积累有加速的趋势。二者产生差异的原因可能在于碳源提供方式与浓度的不同。
3%浓度下β-胡萝卜素含量最低, 而PSⅡ的光合活性参数Fv/Fm、Y(Ⅱ)最高, 且在0.03%~3%下呈上升趋势, 9%下叶绿素荧光参数降低, 与光合作用相关的蛋白如ATP合酶的CF1α亚基、CF2β亚基, 细胞色素b6f, PSⅡ的CP47和CP43反应中心蛋白以及PSI亚基Ⅶ相对表达量变化趋势相一致。有研究表明, CO2的加富可明显提高可变荧光, 使Fv/Fo(PSⅡ的潜在活性)和Fv/Fm的比值增大, 提高叶绿体内光能转化成化学能的速度和效率[34]。表明杜氏盐藻调节光合作用以响应CO2浓度变化可能是通过调节捕光色素的合成与比例, 在适应浓度下, 相关蛋白表达上调, 光合作用增强, 为细胞生长提供充足的能量, 以适应环境变化。
3.2 杜氏盐藻对CO2浓度的碳代谢响应蛋白质组分析结果显示, 在0.03%~3%CO2浓度范围内, 随着浓度升高, 杜氏盐藻胞内的糖酵解途径中某些酶表达下调。在0.03%浓度下, 三羧酸循环和磷酸戊糖支路的酶表达量最高。而卡尔文循环中的关键酶Rubisco酶的大亚基、景天庚酮糖二磷酸酶也有与之相近的趋势。可能是在低CO2浓度下, 细胞可利用的碳源减少, 为维持正常的生命活动, 细胞上调相关碳代谢路径上的酶表达量, 提高酶与底物的结合效率。有研究表明, 鱼腥藻在低浓度或高浓度CO2下Rubisco酶活性无明显差异, 但低CO2下细胞固碳能力高, 低CO2下细胞中积累无机碳的浓度超过介质中的无机碳度, 使Rubisco羧化酶能更有效的发挥作用[12]。
3.3 过高浓度CO2对杜氏盐藻的胁迫作用高浓度CO2可对杜氏盐藻胞内多种代谢途径产生影响。有研究表明, 高CO2条件下, 盐藻细胞内脂肪酸合成产生变化, 脂肪酸的去饱和被抑制, 在10% CO2浓度下, 饱和脂肪酸含量上升[35]。在环境中CO2体积分数大于5%时, 大部分微藻的生长将受到抑制, 影响固碳效率[36]。本研究结果显示, 过高浓度的CO2对杜氏盐藻细胞的生长并无明显的促进作用, 且可能对细胞产生胁迫, 抑制生长。
胞外碳酸酐酶可催化CO2转化为不易渗透通过质膜的HCO3–, 由此控制胞内pH的降低, 而随着CO2浓度增加, 溶解态CO2向细胞内扩散的速率增加, 并水解形成HCO3–和H+, 可使细胞质pH下降, 对微藻吸收和利用CO2产生阻碍[37]。通气过程中, 过高浓度的CO2抑制了碳酸酐酶活性, 使较多CO2进入胞内, 产生酸化[6]如图 11所示。细胞内环境中的pH大幅降低, 作用于细胞的生理活性与蛋白合成路径, 可对细胞产生氧化损害。根据蛋白质组分析结果, 高浓度CO2下热激蛋白、超氧化物歧化酶和蛋白二硫键氧还酶等表达上调, 说明过高浓度CO2可能对细胞引起氧化胁迫。因此过高浓度CO2下, 细胞内环境中的pH大幅降低, 同时对细胞产生氧化损害, 细胞上调抗氧化物的表达以应对氧化胁迫。
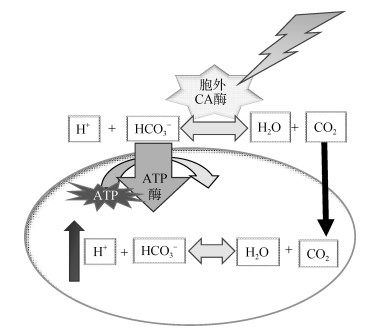 |
| 图 11 高浓度CO2对微藻细胞的影响 Fig. 11 The effect of high concentration of CO2 on microalgae cells |
| [1] |
Doney S C, Fabry V J, Feely R A, et al. Ocean acidification:the other CO2 problem[J]. Annual Review of Marine Science, 2009, 1(1): 169. |
| [2] |
Kodama M. A new species of highly CO2-tolerant fast-growing marine microalga suitable for high-density culture[J]. Journal of Marine Biotechnology, 1993, 1: 21-25. |
| [3] |
Sergeenko T V, Muradyan E A, Pronina N A, et al. The effect of extremely high CO2 concentration on the growth and biochemical composition of microalgae[J]. Russian Journal of Plant Physiology, 2000, 47(5): 632-638. |
| [4] |
Seckbach J, Gross H, Nathan M B. Growth and photosynthesis of Cyanidium caldarium cultured under pure CO2[J]. Israel J Bot, 1971, 20(2): 84-90. |
| [5] |
Mouradian E, Klyachko-Gurvich G, Pronina N. Lipid metabolism of Spirulina platensis under CO2-stress[J]. Advances in Plant Lipid Research, 1998, 511-513. |
| [6] |
孟范平, 谢爽, 于腾, 等. 耐酸性和耐高浓度CO2的海洋微藻筛选[J]. 化工进展, 2009, 2009(S1): 310-317. Meng Fanping, Xie Shuang, Yu Teng, et al. Screening acid and high concentration of CO2 resistant microalgae[J]. Chemical Industry and Engineering Progress, 2009, 2009(S1): 310-317. |
| [7] |
Lamers P P, Ccv D L, Kaasenbrood P S, et al. Carotenoid and fatty acid metabolism in light-stressed Dunaliella salina[J]. Biotechnology & Bioengineering, 2010, 106(4): 638-648. |
| [8] |
Craigie J, Mclachlan J. Glycerol as a photosynthetic product in Dunaliella tertiolecta Butcher[J]. Canadian journal of Botany, 1964, 42(6): 777-778. DOI:10.1139/b64-068 |
| [9] |
夏建荣, 高坤山. 绿藻CO2浓缩机制的研究进展[J]. 应用生态学报, 2002, 13(11): 1507-1510. Xia Jianrong, Gao Kunshan. Advances in research on CO2 concentrating mechanism of green algae[J]. Ying Yong Sheng Tai Xue Bao, 2002, 13(11): 1507-1510. DOI:10.3321/j.issn:1001-9332.2002.11.036 |
| [10] |
Miller A G, Espie G S, Canvin D T. Physiological aspects of CO2 and HCO3− transport by cyanobacteria:a r[J]. Revue Canadienne De Botanique, 1990, 68(6): 1291-1302. |
| [11] |
Badger M R, Kaplan A, Berry J A. Internal inorganic carbon pool of Chlamydomonas reinhardtii. evidence for a carbon dioxide-concentrating mechanism[J]. Plant Physiology, 1980, 66(3): 407. DOI:10.1104/pp.66.3.407 |
| [12] |
Kaplan A, Badger M R, Berry J A. Photosynthesis and the intracellular inorganic carbon pool in the bluegreen alga Anabaena variabilis:response to external CO2 concentration[J]. Planta, 1980, 149(3): 219-226. |
| [13] |
Atun G, Hazneda R O, Lu H N. Adaptation of Photosynthetic CO2 and HCO3− Accumulation by the Cyanobacterium Synechococcus PCC6301 to Growth at Different Inorganic Carbon Concentrations[J]. Australian Journal of Plant Physiology, 1987, 14(2): 189-201. |
| [14] |
Pick U, Karnil, Avron M. Determination of Ion Content and Ion Fluxes in the Halotolerant Alga Dunaliella salina[J]. Plant Physiology, 1986, 81(1): 92-96. DOI:10.1104/pp.81.1.92 |
| [15] |
程建峰, 胡芬红, 沈允钢. NaHSO3对盐生杜氏藻生长和光合色素含量的影响[J]. 热带海洋学报, 2010, 29(3): 65-70. Cheng Jianfeng, Hu Fenhong, Shen Yungang. Effects of NaHSO3 on the growth and contents of photosynthetic pigments in Dunaliella salina[J]. Journal of Tropical Oceanography, 2010, 29(3): 65-70. DOI:10.3969/j.issn.1009-5470.2010.03.010 |
| [16] |
周丽花, 施翔, 程建峰. 七种常用培养基对盐藻生长和色素含量的影响[J]. 水产科学, 2015, 34(12): 750-756. Zhou Lihua, Shi Xiang, Cheng Jianfeng. Effects of seven common culture media on growth and pigment contents in green alga Dunaliella salina[J]. Fisheries Science, 2015, 34(12): 750-756. |
| [17] |
王铭, 桑敏, 李爱芬, 等. 不同理化因子对雨生红球藻CG-11碳酸酐酶活性的影响[J]. 植物生理学报, 2010, 46(7): 701-706. Wang Ming, Sang Min, Li Aifen, et al. Effects of physical and chemical factors on carbonate dehydratase activity of Haematococcus pluvialis CG-11[J]. Plant Physiology Communications, 2010, 46(7): 701-706. |
| [18] |
Wilbur K M, Anderson N G. Electrometric and colorimetric determination of carbonic anhydrase[J]. Anatomical Record, 1948, 101(4): 147-154. |
| [19] |
Thayer S S, Bjrkman O. Leaf Xanthophyll content and composition in sun and shade determined by HPLC[J]. Photosynthesis Research, 1990, 23(3): 331-343. DOI:10.1007/BF00034864 |
| [20] |
Xie X, Huang A, Gu W, et al. Photorespiration participates in the assimilation of acetate in Chlorella sorokiniana under high light[J]. New Phytologist, 2016, 209(3): 987-998. DOI:10.1111/nph.2016.209.issue-3 |
| [21] |
Wang S B, Hu Q, Sommerfeld M, et al. An optimized protocol for isolation of soluble proteins from microalgae for two-dimensional gel electrophoresis analysis[J]. Journal of Applied Phycology, 2003, 15(6): 485-496. |
| [22] |
刘彩霞, 顾文辉, 黄爱优, 等. 兼养小球藻在不同浓度Fe3+培养下的蛋白质组学研究[J]. 海洋科学, 2017, 41(3): 1-7. Liu Caixia, Gu Wenhui, Huang Aiyou, et al. Proteomic analysis of mixotrophic cultivation of Chlorella vulgaris exposed to different iron concentrations[J]. Marine sciences, 2017, 41(3): 1-7. |
| [23] |
Gu W, Li H, Zhao P, et al. Quantitative proteomic analysis of thylakoid from two microalgae (Haematococcus pluvialis and Dunaliella salina) reveals two different high light-responsive strategies[J]. Scientific Reports, 2014, 4(4): 6661. |
| [24] |
赵佩佩, 顾文辉, 伍松翠, 等.氮限制有利于三角褐指藻脂质积累[J].科学通报, 2015, 23):2196-2208. Zhao Peipei, Gu Wenhui, Wu Songcui, et al. Changes in central carbon metabolism of Phaeodactylum tricornutum are beneficial for lipid accumulation under nitrogen starvation conditions[J]. 2015, (23): 2196-2208. http://www.cnki.com.cn/Article/CJFDTotal-KXTB201523006.htm |
| [25] |
Blonder J, Chan K C, Issaq H J, et al. Identification of membrane proteins from mammalian cell/tissue using methanol-facilitated solubilization and tryptic digestion coupled with 2D-LC-MS/MS[J]. Nature Protocols, 2006, 1(6): 2784-2790. |
| [26] |
Xia J R, Kun-Shan G A. Impacts of elevated CO2 concentration on biochemical composition, carbonic anhydrase, and nitrate reductase activity of freshwater green algae[J]. Journal of Integrative Plant Biology, 2005, 47(6): 668-675. |
| [27] |
Berry J, Boynton J, Kaplan A, et al. Growth and photosynthesis of Chlamydomonas reinhardtii as a function of CO2 concentration[M]. 1976.
|
| [28] |
Raven J. Physiology of inorganic carbon acquisition and implications for resource use efficiency by marine phytoplankton:Relation to increased carbon dioxide and temperature[J]. Plant Cell & Environment, 1991, 14(8): 779-794. |
| [29] |
Giordano M, Beardall J, Raven J A. CO2 concentrating mechanisms in algae:mechanisms, environmental modulation, and evolution[J]. Annual Review of Plant Biology, 2005, 56(1): 99-131. DOI:10.1146/annurev.arplant.56.032604.144052 |
| [30] |
Raven J A. Inorganic carbon acquisition by eukaryotic algae:four current questions[J]. Photosynthesis Research, 2010, 106(1-2): 123-134. DOI:10.1007/s11120-010-9563-7 |
| [31] |
Raven J A. Praeger Review: Effects on marine algae of changed seawater chemistry with increasing atmospheric CO2[C]//Biology and Environment: Proceedings of the Royal Irish Academy. Royal Irish Academy, 2011: 1-17.
|
| [32] |
Wu Y, Gao K, Riebesell U. CO2-induced seawater acidification affects physiological performance of the marine diatom Phaeodactylum tricornutum[J]. Biogeosciences Discussions, 2010, 7(9): 2915-2923. DOI:10.5194/bg-7-2915-2010 |
| [33] |
杨晓玲, 郭金耀. CO2对盐藻生长及物质积累的影响[J]. 江苏农业科学, 2012, 40(5): 211-212. Yang Xiaoling, Guo Jinyao. Effects of CO2 on growth and substance accumulation of Dunaliella salina[J]. Jiangsu Agricultural Sciences, 2012, 40(5): 211-212. DOI:10.3969/j.issn.1002-1302.2012.05.082 |
| [34] |
李春雷.海洋微藻对CO2加富响应的实验生态学研究[D].青岛: 中国海洋大学, 2009. Li Chunlei. The Experimental Ecology Studies on Responses of Marine Microalgae to the CO2 Enrichment[D]. Ocean University of China, 2009. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1503760 |
| [35] |
Muradyan E A, Klyachko-Gurvich G L, Tsoglin L N, et al. Changes in Lipid Metabolism during Adaptation of the Dunaliella salina Photosynthetic Apparatus to High CO2 Concentration[J]. Russian Journal of Plant Physiology, 2004, 51(1): 53-62. |
| [36] |
Becker E W. Microalgae, Biotechnology and Microbiology, Quarterly Review of Biology[M]. Cambridge: Cambridge University Press, 1995.
|
| [37] |
Cheng L H, Chen H L, Zhang L, et al. Study on medium composition of microalgae optimization for CO2 removal from air by a membrane-photobioreactor[R]. Sae Technical Paper, 2004.
|
 2018, Vol. 42
2018, Vol. 42


