文章信息
- 李洪辰, 张沛东, 李文涛, 杨晓龙, 胡成业, 李常军. 2019.
- LI Hong-chen, ZHANG Pei-dong, LI Wen-tao, YANG Xiao-long, HU Cheng-ye, LI Chang-jun. 2019.
- 黄海镆铘岛海域海草床数量分布及其生态特征
- Quantitative distribution and ecological characteristics of seagrass beds in the coastal area of Moye Island, Yellow Sea
- 海洋科学, 43(4): 46-51
- Marine Sciences, 43(4): 46-51.
- http://dx.doi.org/10.11759/hykx20180803001
-
文章历史
- 收稿日期:2018-08-03
- 修回日期:2018-09-27
海草是地球上唯一一类可完全生活在海水中的被子植物, 构筑的海草床是滨海三大典型生态系统之一, 也是最有效的碳捕获和碳封存系统之一, 具有极其重要的生态功能[1-5]。海草床属于脆弱生态系统, 受自然环境变迁和人类活动影响, 全球1/3以上的海草床已完全退化, 消失速度超过7%/年, 是热带森林的2~15倍[6]。Short等[7]统计发现, 全球范围内15种海草受到消失威胁, 22种海草的资源量处于衰退状态。中国海草床也已严重衰退, 如青岛、威海和烟台近岸海域超过80%的海草床已完全退化, 消失速率远大于1879~2006年全球海草床的总消失率(29%)[8]。然而中国对近海海草床的分布及其生境状况的认识还严重不足, 制约了海草床生态系统保护与修复工作的快速发展。
镆铘岛(36°54′N, 122°31′E)位于山东省荣成市东南端, 四面环海, 东临黑泥湾, 西靠石岛湾, 潮间带及近岸浅海底质主要为泥沙质和砾石, 滩涂分布有较多海参池[9]。2016年5月, 通过海草碎屑的现场观测和渔民走访, 初步确定本海域存在面积较大的海草床。为进一步查明此区域海草的种类和分布面积, 于2016年8月对镆铘岛海域的海草种类、分布面积、生物学特征及海域水文条件等开展现场调查, 以期为中国海草床生态系统的高效保护与科学管理提供数据基础。
1 调查内容与方法 1.1 海草种类和分布面积的现场调查2016年8月, 根据海草的生长特性, 结合镆铘岛海域的环境特征(包括海底地形、水文状况、陆源污染排放程度等), 布设调查断面对可能存在海草床的近海海域进行分段调查。共设置57个调查断面, 每个断面间隔30 m, 调查总面积24.10 km2, 包括镆铘岛近岸6 m以浅海域(图 1)。为尽可能准确识别海草分布状况, 在大潮低潮段, 由潜水员携带水下摄像机进行潜水拍摄调查。采用GPS定位记录海草床边界拐点(边界以海草覆盖度 > 5%为划分标准)、上下限及海草分布中心的经纬度坐标, 并在记录本上描绘海草分布与近岸标志性建筑的位置示意图。对拍摄录像以及定点坐标进行判读分析, 记录海草种类及估算海草的分布面积。
 |
| 图 1 镆铘岛海草床调查区域示意图 Fig. 1 Map of investigation area of seagrass beds in Moye Island |
在调查发现的海草床随机设置3~5个采样位点, 采用25 cm×25 cm的样方框取样, 每个站位采集3个平行样方。将样方框内所有海草的叶片和根状茎全部置于样品袋, 低温保存带回实验室, 分析样方的海草种类, 测定海草的形态学特征, 计算植株密度和生物量。
1.3 海草床关键环境因子调查在各采样点, 使用YSI 650(美国YSI公司)监测调查海域的水温、盐度、pH值和溶解氧含量, 运用SM-5A测深仪(美国Speedteach公司)测量水深, SD20透明度仪(北京普力特仪器有限公司)测量透明度; 采集沉积物样品, 带回实验室采用筛析法测定粒度。
1.4 数据分析运用ArcGIs10.2进行海草分布状况的绘图和海草分布面积的估算。运用SPSS17.0对海草形态学指标和关键环境因子进行统计学分析。
2 调查结果 2.1 海草种类及其分布面积通过植株形态学观察和组织切片法, 对调查区域的海草进行种类鉴定。结果表明镆铘岛海域共分布有2种海草, 隶属于1科2属, 包括鳗草科(Zosteraceae)、鳗草属(Zostera)的鳗草(Zostera marina)(图 2)及鳗草科、虾形草属(Phyllospadix)的红纤维虾形草(Phyllospadix iwatensis)(图 3)。
 |
| 图 2 鳗草形态学特征及其叶片组织切片 Fig. 2 Morphological characters of Z. marina and its transection of leaf |
 |
| 图 3 红纤维虾形草形态学特征及其叶片组织切片 Fig. 3 Morphological characters of P. iwatensis and its transection of leaf |
海草床总分布面积约为272.84 ha, 如图 4所示。其中鳗草的分布面积约为177.23 ha, 占总面积的65%, 主要分布在镆铘岛沿岸的海参养殖池中, 最大分布面积约为84.81 ha, 位于镆铘岛宜和海洋牧场的海参养殖池。红纤维虾形草的分布面积约为95.61 ha, 占总面积的35%, 主要分布在沿岸的礁石上, 集中于东沙尖、羊石和西南部附近海域, 呈明显的带状分布。其中东尖沙附近海域分布面积最大, 约为68.58 ha, 沿岸延伸4.2 km, 条带宽度80 m~200 m。羊石附近海域分布面积约为13.29 ha, 与西南部分布面积相近。镆铘岛西北部湾内主要是筏架养殖区域, 未发现海草分布。
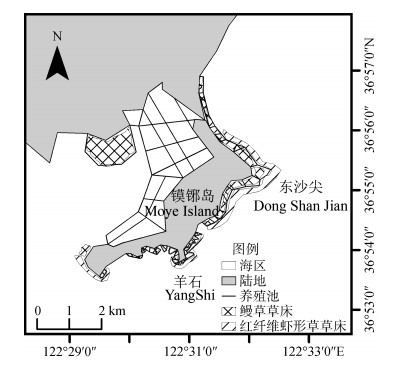 |
| 图 4 镆铘岛附近海域海草床的分布图 Fig. 4 The distribution of seagrass beds in sea areas of Moye Island |
鳗草的平均植株密度为(364.0±14.2)株/m2, 生物量为(528.7±20.5) g DW/m2。形态学特征如表 1所示, 其中株高为(86.8±5.8) cm, 单株叶片数达到(5.3± 0.2)片/株, 最大根长为(6.5±0.6)cm。
| 形态学指标 | 最小值 | 最大值 | 平均值 | 标准误 |
| 叶片数(片/株) | 4.0 | 6.0 | 5.3 | 0.2 |
| 侧枝数(株/株) | 0.0 | 2.0 | 0.8 | 0.2 |
| 节间数(个/株) | 3.0 | 9.0 | 4.3 | 0.4 |
| 株高(cm) | 47.6 | 115.2 | 86.8 | 5.8 |
| 叶鞘长(cm) | 8.0 | 20.1 | 15.5 | 0.8 |
| 叶鞘宽(cm) | 0.7 | 1.1 | 0.8 | 0.03 |
| 最大叶宽(cm) | 0.60 | 0.92 | 0.75 | 0.02 |
| 节间长(cm) | 1.09 | 2.38 | 1.63 | 0.10 |
| 节间直径(cm) | 0.37 | 0.54 | 0.45 | 0.02 |
| 最大根长(cm) | 3.0 | 14.0 | 6.5 | 0.6 |
红纤维虾形草的平均植株密度为(3 087.0± 35.4)株/m2, 生物量为(2 320.0±26.6) g DW/m2。红纤维虾形草主要生长在岩礁上, 末端膨大的根部和密生根毛结构增加了其与岩礁底质的接触面积, 增强了固着能力, 并通过发达根毛的辅助作用, 适应坚硬岩礁底质和海流冲击。调查结果表明, 红纤维虾形草叶片线形, 下部全缘, 上部边缘具连续的鳍刺状齿, 叶端钝, 植株基部常有红棕色毛状纤维包围, 根茎粗短。其形态学特征如表 2所示, 其中株高(112.8±3.8)cm, 单株叶片数(3.1±0.1)片/株, 节间直径(0.39±0.01) cm, 根长(1.62±0.11)cm。
| 形态学指标 | 最小值 | 最大值 | 平均值 | 标准误 |
| 叶片数(片/株) | 2.0 | 4.0 | 3.1 | 0.1 |
| 株高(cm) | 85.6 | 138.5 | 112.8 | 3.8 |
| 叶鞘长(cm) | 14.7 | 22.9 | 19.5 | 0.6 |
| 叶鞘宽(cm) | 0.21 | 0.36 | 0.27 | 0.01 |
| 最大叶宽(cm) | 0.19 | 0.26 | 0.23 | 0.01 |
| 节间直径(cm) | 0.30 | 0.48 | 0.39 | 0.01 |
| 根长(cm) | 0.67 | 2.15 | 1.62 | 0.11 |
| 根直径(cm) | 0.06 | 0.13 | 0.09 | 0.00 |
镆铘岛海草床关键环境因子如表 3所示。其中水深为(1.80±0.04)m, 盐度为31.45±0.01, 溶解氧含量较高, 达到(10.4±0.1)mg/L, pH值较高, 为8.8±0.1, 平均底质粒径为(4.6±0.1)mm。
| 环境因子 | 最小值 | 最大值 | 平均值 | 标准误 |
| 水深(m) | 1.65 | 1.92 | 1.80 | 0.04 |
| 透明度(m) | 0.30 | 0.43 | 0.37 | 0.02 |
| 水温(℃) | 21.8 | 24.9 | 23.0 | 0.6 |
| 盐度 | 31.43 | 31.47 | 31.45 | 0.01 |
| 溶解氧含量(mg/L) | 10.1 | 10.8 | 10.4 | 0.1 |
| pH值 | 8.6 | 9.0 | 8.8 | 0.1 |
| 底质粒径(mm) | 4.4 | 4.8 | 4.6 | 0.1 |
现场考察发现, 镆铘岛周边村庄保留着200多户海草房, 大多是用虾行草的干叶苫成房顶; 渔民反映, 近20年来, 镆铘岛海域的海草床退化严重, 目前已很难看到海草脱落叶片的大量上岸。本次调查发现, 镆铘岛海草床总分布面积已不足300 ha, 占分布面积65%的鳗草绝大多数分布于沿岸的海参养殖池, 浅海中仅零星发现极小斑块分布; 红纤维虾形草的分布面积不足100 ha, 根据沿岸村庄海草房的数量, 可以初步估计90%以上的红纤维虾形草已完全退化。因此, 亟待开展镆铘岛海草床的修复和保护计划, 以防止海草床生态系统的继续退化并促进它们的恢复, 从而对解除近岸海域生态压力和恢复受损生境产生明显生态作用。
3.2 镆铘岛海草的生物学特征与环境特征本次调查显示, 镆铘岛海区鳗草的平均植株密度为364株/m2, 低于同一季节荣成天鹅湖鳗草的植株密度(416株/m2), 这可能是因为镆铘岛的鳗草分布于近岸的海参池塘, 其适生生境劣于浅海海域, 形态学指标和生物量与天鹅湖海域的鳗草相近[10]。红纤维虾形草仅分布于东亚和北美沿岸海域, 附着生长于岩石或礁石之上, 具有发达的根系, 通常分布水深较窄, 因此大多呈现带状分布[11]。本次调查发现, 镆铘岛红纤维虾形草分布水深仅为(1.6~1.9)m, 带状分布明显, 平均植株密度则达到3 087株/m2, 对环境改善作用明显, 水体平均溶解氧含量达到10.4 mg/L。红纤维虾形草附着于岩石上, 其有性繁殖的苗种补充率很低, 无性克隆生长速度慢, 而且植株移植受水流影响成功率极低[12-13]。因此早在2011年, 红纤维虾形草既被列为极易危种[7], 对其退化生境修复技术的研发仍需大力开展。
3.3 海草床生境的主要威胁调查发现, 镆铘岛海域的海草床生境面临严重威胁, 主要来源于不断增加的人类活动。一方面, 镆铘岛紧邻石岛港, 是中国北方最大的渔港, 大量渔业船舶的频繁进出渔港, 能够对海草叶片造成严重的机械损伤, 这可能是造成该海域鳗草主要分布于沿岸海参养殖池的主要原因; 另一方面, 近年来镆铘岛沿海的海带筏式养殖面积急剧扩大, 不仅与海草争夺生长所需的营养盐, 还造成海草床所处海域的水体交换减弱, 水体浊度增加, 从而削弱海草生存最重要的光照条件, 对海草床的自我维持也造成严重威胁。如1997年1月到4月的暴风雨致使美国加利福尼亚半岛附近的两个泻湖的水体悬浮物浓度增加了6倍, 超过3周光照接近于零, 致使鳗草组织糖类含量下降了约85%, 大量植株死亡[14], 这可能是导致筏架养殖区的镆铘岛西北部湾内并未发现海草分布的主要原因。
3.4 保护建议针对镆铘岛海草床所受威胁的类型和强度, 建议对镆铘岛海区进行科学的功能区划, 以实现有效保护和科学管理。根据镆铘岛海域地形及养殖活动的分布情况, 可将该区域划分为3个主要功能区(图 5):池塘养殖区、核心保护区和渔业捕捞区。
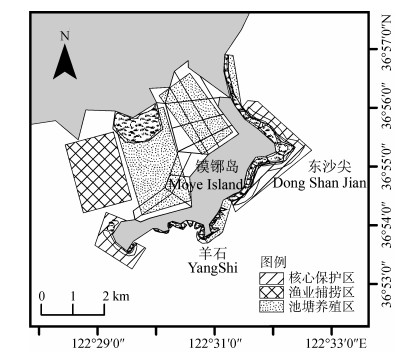 |
| 图 5 镆铘岛海域功能区分布图 Fig. 5 The distribution map of functional areas in the Moye Island sea areas |
(1) 池塘养殖区, 总面积771.45 ha, 主要分布在镆铘岛沿岸及湾内。该区域分布大面积的养殖池塘, 池塘内大多有鳗草分布, 池塘内水动力作用较弱, 营养丰富, 特别是鳗草碎屑可以作为水产养殖动物的食物来源。此外, 池塘养殖区距离岸边较近, 便于管理和水产动物的收获。
(2) 核心保护区, 总面积246.04 ha, 是海草床密集区, 特别是位于池塘养殖区外围的红纤维虾形草分布区以及位于镆铘岛西端的鳗草自然分布区。该区域海草成片分布, 但由于毗邻航道或者养殖池塘, 受人为活动干扰严重, 保护不当会造成海草床衰退, 因此该区域应严格限制养殖活动、渔业捕捞以及开挖航道等人类活动。
(3) 渔业捕捞区, 面积281.52 ha, 分布在镆铘岛外湾入口处。该区域靠近港口, 受陆源径流影响, 是典型的咸淡水混合区, 营养盐含量丰富, 初级生产力高, 渔业资源多样性高, 且水深较深, 适合渔船捕捞活动。
此外, 应加强该区域生态系统的修复与保护, 生态环境的改善是海草床退化生境恢复的第一步, 也是最关键的一环[15]。在此基础上, 开展海草床适宜生境的分析, 并应用目前成熟的种子保护袋播种法[16-17]和枚订植株移植法[18]等方法进行海草床的修复和重建。
综上, 作者对黄海镆铘岛海域的海草床进行了调查, 初步摸清了镆铘岛海域海草的种类、分布面积、生物量以及生境特征。同时发现该海域海草床正面临着严重威胁。结合实际调查资料, 初步分析了海草床退化的原因, 并提出了相应的建议和对策, 可为下一步海草床资源保护和近海生态环境修复提供参考。
| [1] |
Costanza R, d'Arge R, Groot R, et al. The value of the world's ecosystem services and natural capital[J]. Nature, 1997, 387: 253-260. DOI:10.1038/387253a0 |
| [2] |
Bos A R, Bouma T J, de Kort G L J, et al. Ecosystem engineering by annual intertidal seagrass beds:Sediment accretion and modification[J]. Estuarine, Coastal and Shelf Science, 2007, 74: 344-348. DOI:10.1016/j.ecss.2007.04.006 |
| [3] |
Lamb J B, van de Water J A J M, Bourne D G, et al. Seagrass ecosystems reduce exposure to bacterial pathogens of humans, fishes, and invertebrates[J]. Science, 2017, 355: 731-733. DOI:10.1126/science.aal1956 |
| [4] |
Duarte C M, Middelburg J J, Caraco N. Major role of marine vegetation on the oceanic carbon cycle[J]. Biogeosciences, 2005, 2: 1-8. |
| [5] |
Fourqurean J W, Duarte C M, Kennedy H, et al. Seagrass ecosystems as a globally significant carbon stock[J]. Nature Geoscience, 2012, 5: 505-509. DOI:10.1038/ngeo1477 |
| [6] |
Waycott M, Duarte C M, Carruthers T J B, et al. Accelerating loss of seagrasses across the globe threatens coastal ecosystems[J]. Proceedings of the National Academy of Sciences of the USA (PNAS), 2009, 106: 12377-12381. DOI:10.1073/pnas.0905620106 |
| [7] |
Short F T, Polidoro B, Livingstone S R, et al. Extinction risk assessment of the world's seagrass species[J]. Biological Conservation, 2011, 144(7): 1961-1971. DOI:10.1016/j.biocon.2011.04.010 |
| [8] |
郑凤英, 邱广龙, 范航清, 等. 中国海草的多样性, 分布及保护[J]. 生物多样性, 2013, 21(5): 517-526. Zheng Fengying, Qiu Guanglong, Fan Hangqing, et al. Diversity, distribution and conservation of Chinese seagrass species[J]. Biodiversity Science, 2013, 21(5): 517-526. |
| [9] |
黄慧, 李新正, 王洪法, 等. 山东半岛镆铘岛潮间带大型底栖动物群落特征[J]. 海洋科学, 2012, 36(11): 90-97. Huang Hui, Li Xinzheng, Wang Hongfa, et al. Characteristics of macrobenthos community from the intertidal zones of Moye Island, Shandong Peninsula[J]. Marine Sciences, 2012, 36(11): 90-97. |
| [10] |
Zhang P D, Liu Y S, Guo D, et al. Seasonal variation in growth, morphology, and reproduction of eelgrass Zostera marina on the eastern coast of the Shandong Peninsula, China[J]. Journal of Coastal Research, 2016, 32(2): 315-322. |
| [11] |
Larkum A W D. Seagrasses: Biology, Ecology and Conservation[M]. Germany Berlin: Springer Netherlands, 2007: 1-23.
|
| [12] |
Holbrook S J, Reed D C, Bull J S. Survival experiments with outplanted seedlings of surfgrass (Phyllospadix torreyi) to enhance establishment on artificial structures[J]. ICES Journal of Marine Science, 2002, 59: S350-S355. DOI:10.1006/jmsc.2002.1224 |
| [13] |
Bull J S, Reed D C, Holbrook S J. An experimental evaluation of different methods of restoring Phyllospadix torreyi (surfgrass)[J]. Restoration Ecology, 2004, 12(1): 70-79. DOI:10.1111/j.1061-2971.2004.00258.x |
| [14] |
Cabello-Pasini A, Lara-Turrent C, Zimmerman R C. Effect of storms on photosynthesis, carbohydrate content and survival of eelgrass populations from a coastal lagoon and the adjacent open ocean[J]. Aquatic Botany, 2002, 74(2): 149-164. DOI:10.1016/S0304-3770(02)00076-1 |
| [15] |
Tanner J E. Restoration of the seagrass Amphibolis antarctica-temporal variability and long-term success[J]. Estuaries and Coasts, 2014, 38(2): 668-678. |
| [16] |
Zhang P D, Fang C, Liu J, et al. An effective seed protection method for planting Zostera marina (eelgrass) seeds:implications for their large-scale restoration[J]. Marine Pollution Bulletin, 2015, 95(1): 89-99. DOI:10.1016/j.marpolbul.2015.04.036 |
| [17] |
Zhao J S, Liu Y S, Zhang P D, et al. Assessment of the establishment success of eelgrass Zostera marina (Alismatales:Zosteraceae) from seeds in a cost-effective seed protection method:implications for large-scale restoration[J]. Botanica Marina, 2016, 59(4): 259-266. |
| [18] |
刘燕山, 郭栋, 张沛东, 等. 北方澙湖大叶藻植株枚订移植法的效果评估与适宜性分析[J]. 植物生态学报, 2015, 39(2): 176-183. Liu Yanshan, Guo Dong, Zhang Peidong, et al. Assessing establishment success and suitability analysis of Zostera marina transplants using staple method in northern lagoons[J]. Chinese Journal of Plant Ecology, 2015, 39(2): 176-183. |
 2019, Vol. 43
2019, Vol. 43


