文章信息
- 潘家琳, 袁琳, 袁晓, 薄顺奇, 赵志远, 朱晓泾, 陈雅慧, 李阳, 张晋磊. 2019.
- PAN Jia-lin, YUAN Lin, YUAN Xiao, Bo Shun-qi, ZHAO Zhi-yuan, ZHU Xiao-jing, CHEN Ya-hui, LI Yang, ZHANG Jin-lei. 2019.
- 海岸圈围对雁鸭类种群及生境的影响研究——以长江口横沙东滩为例
- Effects of coastal reclamation on the population and habitat of Anatidae birds: A case study of East Hengsha Shoal, Shanghai
- 海洋科学, 43(5): 45-56
- Marine Sciences, 43(5): 45-56.
- http://dx.doi.org/10.11759/hykx20190219002
-
文章历史
- 收稿日期:2019-02-19
- 修回日期:2019-04-23
2. 上海市野生动物植物保护管理站, 上海 200033
2. Shanghai wildlife and plant protection administration station, Shanghai 200233, China
滨海湿地是位于海洋与陆地之间的生态过渡带[1], 作为海岸带的关键组成部分和世界上生产力最高的生态系统之一, 其在提供生物栖息地、保护生物多样性、净化环境、维持区域生态平衡等方面发挥着不可替代的作用[2-4]。长江口滨海湿地处于“东亚-澳大利亚”鸟类迁徙路线上, 因其良好的栖息环境, 每年的迁徙越冬季节都吸引了大量雁鸭类在此越冬[5], 是国际性迁徙候鸟重要的栖息地与觅食地[6]。迁徙越冬期雁鸭类主要以植物性食物为主[7], 例如水草、水生植物的根茎和盐生植物的种子[8-9]。它们不仅是长江口湿地环境质量变化的指标物种, 也是湿地保护工作中的主要内容, 具有十分重要的保护价值[10]。
近年来, 随着经济社会的发展, 城市化进程的加快, 为了减缓城市用地矛盾, 我国沿海开展了大规模、高强度的海岸圈围工程[11-12]。海岸圈围工程对于区域的发展有着极其重要的作用, 但同时也对生态环境造成了一定的影响, 它改变了湿地生态系统的自然演变规律, 引起湿地生态系统服务功能下降、生物多样性降低等一系列问题[13-14]。2003年起, 位于长江口的横沙东滩开始实施大规模的海岸圈围促淤工程[12]。随着工程的推进, 形成了自然潮滩(未实施圈围)、促淤区(正在实施吹填促淤)和成陆区(已完成圈围)三种生境类型。圈围过程中, 湿地的水文过程、动力地貌及自然属性发生快速变化[15-16], 湿地植物群落结构与生境也随之发生改变, 进而影响了雁鸭类种群特征, 对水鸟及其栖息地保护带来了巨大的挑战。然而, 对于滨海湿地圈围促淤后, 水鸟栖息地变化以及水鸟种群的响应, 目前尚缺乏深入研究[17]。
已有的研究表明, 某一物种的分布(或存在)与栖息地的某些特征之间具有可预测的关联性[18]。因此摸清横沙东滩滨海湿地圈围后, 湿地生境演替趋势、雁鸭类种群变化以及生境变化与水鸟群落变化之间的关系, 对于滨海湿地水鸟栖息地保护和湿地资源可持续利用等工作都具有重要意义。
本文通过对横沙东滩圈围促淤过程中形成的三种不同生境类型(自然潮滩、促淤区和成陆区)的生境因子与雁鸭类数量的时空变化特征进行分析, 探讨了生境因子与雁鸭类种群的相关关系, 从而揭示海岸圈围对雁鸭类种群及生境的影响, 并提出水鸟栖息地保护建议与对策, 以期为滨海湿地资源保护和可持续利用提供科学依据与支撑。
1 方法 1.1 研究区域横沙岛(31°17′N~31°23′N, 121°47′E~121°53′E)位于长江口的最东端, 西邻长兴岛, 北邻崇明岛(图 1)。地势低平, 地面高程约为2.87 m(吴淞零点), 总面积约为49.26 km2。横沙岛属于典型的北温带海洋性气候, 年均气温约15.4℃, 年降水量约1140 mm。横沙东滩位于横沙岛东侧, 实施圈围前湿地类型主要为近海与海岸湿地, 因受海岸圈围工程建设影响以及长江径流和东海潮流影响, 湿地类型、结构、空间分布发生着剧烈变化, 是目前长江口受人类活动和自然影响较为严重的湿地区域[19]。
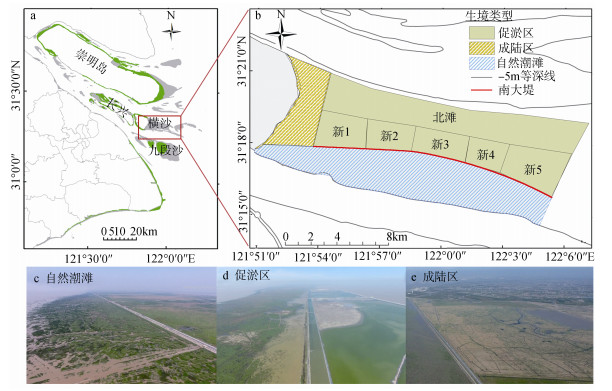 |
| 图 1 横沙东滩地理位置(a)、生境类型划分(b)和不同生境无人机航拍(c~e) Fig. 1 (a) Location of the East Hengsha Shoal (b) habitat types, and (c~e) aerial photography of the different habitats |
本文选取横沙东滩的自然潮滩、促淤区和成陆区这三种生境为主要研究区, 其中:
(1) 自然潮滩位于新建南大堤南侧, 该区域受不规则半日潮影响, 地物覆盖主要以浅海水域、光滩和盐沼植被为主(图 1c)。本研究中, 以–5 m等深线划定自然潮滩向海边界, 确定其研究范围。
(2) 促淤区位于促淤过程中新建的南大堤北侧, 包括北滩和南滩两部分(图 1d)。其中南滩被新建堤坝划分为“新1~新5”5个区域, 于2011—2015年间实施了吹填[12], 至2017年工程结束, 地物覆盖以植被、光滩、浅水面为主, 但不同区域因其吹填时间不同, 植被覆盖状况也有所差异。北滩吹填工程滞后于南滩, 主要为大面积静水水域。
(3) 成陆区位于横沙东滩西侧, 于2010年完成圈围工程[12], 内部区域已完全不受潮汐动力的影响, 形成了植被带、池塘和无植被裸地相间分布的生境类型(图 1e)。
1.2 研究方法 1.2.1 雁鸭类调查及数据分析本文分别在2013、2015、2016和2017年的水鸟越冬期, 即每年的10月至翌年4月, 每月开展1次调查(每年7次)。为保证调查的同步性, 每次调查均在当月中旬完成。共设置3条样线, 已覆盖自然潮滩、促淤区和成陆区的所有水鸟聚集点。自然潮滩两条样线分别长18.8 km和18.1 km, 与促淤区重合, 成陆区样线长为9.2 km。调查过程中, 以20~60倍单筒望远镜进行观测, 小群水鸟采用直接计数法, 大群水鸟采用集团计数法[20-21]。2013—2017年, 在横沙东滩共观测到雁鸭类19种, 分别为小天鹅(Cygnus columbianus)、豆雁(Anser fabails)、白额雁(Anser albifrons)、灰雁(Anser anser)、花脸鸭(Anas formosa)、翘鼻麻鸭(Tadorna tadorna)、鸳鸯(Aix galericulata)、赤膀鸭(Anas strepera)、罗纹鸭(Anas falcata)、赤颈鸭(Anas penelope)、绿头鸭(Anas platyrhynchos)、斑嘴鸭(Anas poecilorhyncha)、琵嘴鸭(Anas clypeata)、针尾鸭(Anas acuta)、白眉鸭(Anas querquedula)、绿翅鸭(Anas crecca)、红头潜鸭(Aythya ferina)、凤头潜鸭(Aythya fuligula)和白秋沙鸭(Mergus albellus)等。为了更加准确分析雁鸭类种群与生境因子的相关性, 本文选取数量占绝对优势的12种雁鸭类进行分析, 它们是以植物性食物, 如水生藻类(穗状狐尾藻)和水生植物的根、茎、叶和种子(海三棱藨草)为主的赤膀鸭、罗纹鸭、赤颈鸭、绿头鸭、斑嘴鸭、针尾鸭、白眉鸭、绿翅鸭和红头潜鸭以及杂食性(水生植物根、茎、叶等植物性食物和鱼虾贝壳等动物性食物)的翘鼻麻鸭、琵嘴鸭和凤头潜鸭[7]。按照自然潮滩、促淤区(新1~新5和北滩)和成陆区的区域划分(图 1c~e), 分别统计各区域雁鸭类水鸟数量。
1.2.2 遥感影像处理与分析 1.2.2.1 遥感解译本研究选用2013、2015、2016和2017年, 共4个时相的Landsat-8 TM多光谱卫星遥感影像(分辨率30 m), 分析横沙东滩湿地生境的时空动态。在野外实地调查和历史数据资料的基础上, 分别建立了水域(无沉水植物分布的纯水域)、光滩、海三棱藨草(Scirpus mariqueter)/藨草(Scirpus triqueter)群系、芦苇(Phragmites australis)群系、林地群系、互花米草(Spartina alterniflora)群系、水烛(Typha angustifolia)群系和沉水植物群系这8类训练样区, 执行监督分类, 得到2013、2015、2016和2017年横沙东滩不同地物类型的分布信息。并通过野外实地验证, 对遥感解译结果进行人工校验。基于ArcGIS平台, 定量分析横沙东滩湿地生境时空分布变化特征。
1.2.2.2 植被归一化指数提取利用ENVI 5.1分别提取这4年遥感影像的近红外波段与红波段反射率信息, 通过公式(1)进行计算得到横沙东滩各年的植被归一化指数(NDVI)空间分布情况, 以表征研究区植被的盖度。具体公式如下:
| $ \frac{{{\rm{NIR}} - R}}{{{\rm{NIR}} + R}} = \frac{{{\rm{NIR}} + R + 2R}}{{{\rm{NIR}} + R}} = 1 - \frac{{2R}}{{{\rm{NIR}} - R}} $ | (1) |
不同数值的NDVI代表不同的植被覆盖信息[22]:
1. NDVI < 0, 表示地面覆盖为水域, 无植被覆盖;
2. NDVI=0, 表示地面覆盖为光滩, 无植被覆盖;
3. NDVI > 0, 表示地面有植被覆盖, 数值越大植被盖度越大;
在地理信息平台ArcGIS 10.3中, 进行空间叠置分析, 获得2013、2015、2016和2017年植被归一化指数(NDVI)的空间分布情况。
1.2.2.3 生境因子计算在遥感影像信息提取的基础上, 利用ArcGIS 10.3进行拓扑构面, 计算各年份不同生境类型中不同地物类型面积和NDVI指数在植被覆盖区域的均值, 从而得到横沙东滩湿地生境因子(挺水植被面积、沉水植物面积、海三棱藨草/藨草面积、水域面积、NDVI指数)的时空变化, 并进一步计算如下生境因子指数:
1.挺水植物所占面积比例(%):该区域挺水植物(芦苇、水烛、林地、海三棱藨草/藨草、互花米草)面积占该区域总面积的比例值。
2.沉水植物所占面积比例(%):该区域沉水植物面积占该区域总面积的比例值。
3.海三棱藨草/藨草所占面积比例(%):该区域海三棱藨草/藨草群系面积占该区域总面积的比例值。
4.水域所占面积比例(%):无植被生长的水域面积占该区域总面积的比例值。
1.2.3 围垦对雁鸭类种群和生境的影响分析利用Pearson二元相关性分析方法, 统计分析生境因子指数与雁鸭类数量的相关性。在此基础上, 剔除相关性不显著的生境因子, 利用Origin 2017进行拟合回归分析(Fitting Regression Analysis), 得到不同生境类型中关键生境因子与雁鸭类数量之间的关系曲线。最后利用“空间代替时间”的方法, 探讨海岸围垦不同阶段(前, 中, 后), 滨海湿地生境因子变化对雁鸭类产生的影响。
2 结果与分析 2.1 圈围后横沙东滩雁鸭类数量的时空变化在自然潮滩生境中, 4年共观测到雁鸭类4 967只, 是水鸟数量最少的生境类型。从2013年到2017年, 自然潮滩区域雁鸭类数量总体呈现先增加后减少的趋势, 其中2015年数量最多(3 700只), 2013年数量最少(42只)(图 2)。
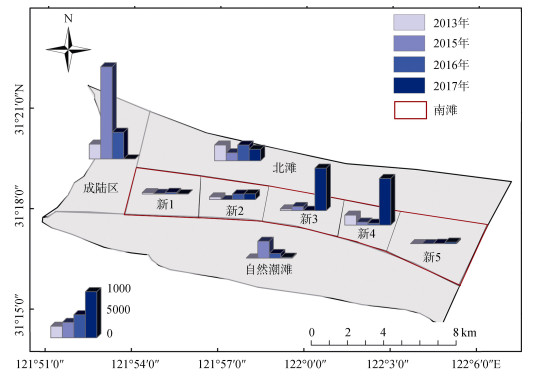 |
| 图 2 横沙东滩2013、2015、2016、2017年雁鸭类数量空间分布情况 Fig. 2 Spatial distribution of Anatidae populations in the East Hengsha Shoal in 2013, 2015, 2016, and 2017 |
圈围实施过程中的促淤区共观测到雁鸭类32 334只, 在三种生境中水鸟数量最多(约为自然潮滩数量的6倍)。从2013年到2017年, 促淤区雁鸭类数量变化趋势与自然潮滩相反, 呈现先减少后增加的趋势(图 2), 其中2015年水鸟数量最少(1 757只), 至2017年水鸟数量上升至23 678只(约为2015年的13.5倍)。2017年, 雁鸭类主要集中分布在新3和新4区中, 为植被带、水域和光滩相间分布的生境。在促淤区已形成植被、水域、光滩等多种生境的南滩区域中(4年共28 516只), 雁鸭类数量整体上多余北滩(生境仅为水面, 4年共11 174只)。
已完成圈围的成陆区共观测到雁鸭类29 301只。从2013年到2017年, 雁鸭类数量变化趋势与自然潮滩相同, 也为先增加后减少的变化趋势(图 2)。在2015年出现数量最大值(20 167只), 随后因人为利用、种林等影响, 水鸟数量显著下降, 至2017年, 仅观测到雁鸭类25只。
总体而言, 圈围初期雁鸭类多集中于相对稳定的成陆区和自然潮滩。随着海岸圈围促淤工程的不断推进, 大量雁鸭类从成陆区和自然潮滩转移至促淤区。
2.2 圈围后横沙东滩生境因子的时空变化自然潮滩主要包括光滩、水域和挺水植物这3种地物类型(图 3a)。随着围垦的推进, 2013—2015年间, 自然潮滩盐沼植被明显恢复, 面积从1.34 km2 (2013)增加至4.77 km2(2015), 主要为海三棱藨草/藨草群系, 并且在近岸高程较高处还出现了芦苇群落。随后, 在河口水动力和河势变化影响下, 湿地植被面积有所下降(图 3a), 至2017年减少为2.87 km2, 但仍比围垦初期有了明显增加。挺水植物面积及所占比例也随之发生波动变化。同时, 随着湿地植物的生长, NDVI指数逐年增加(图 3b)。
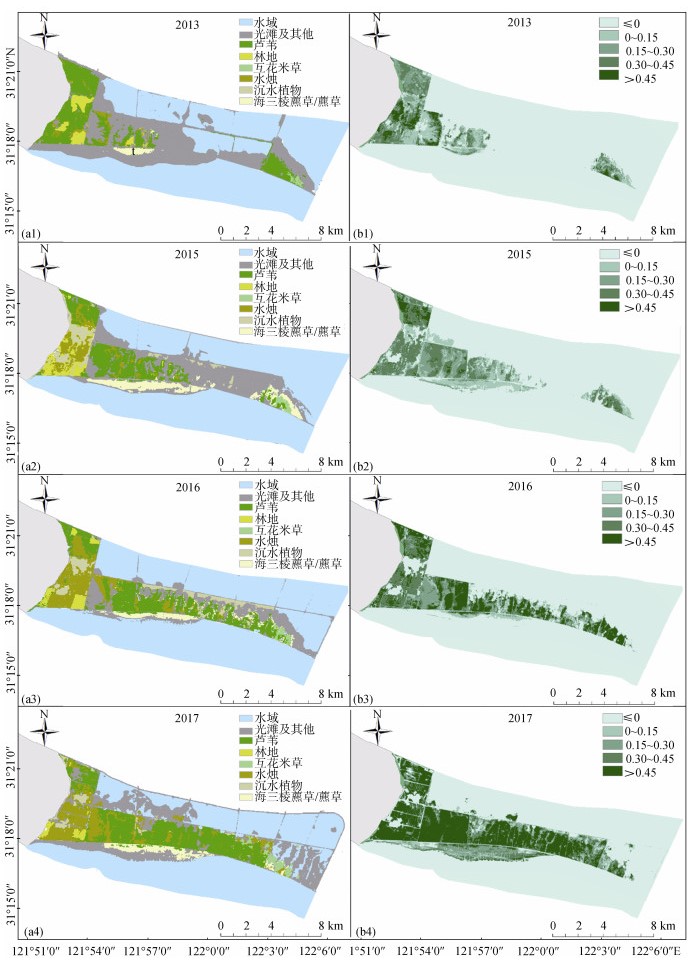 |
| 图 3 横沙东滩2013、2015、2016和2017年遥感解译(a1~a4)及NDVI指数(b1~b4)空间分布情况 Fig. 3 (a1~a4) Remote sensing interpretation results, and (b1~b4) NDVI spatial distribution of the East Hengsha Shoal |
促淤区是一种介于自然潮滩与成陆区的过渡生境类型, 虽然不再受潮汐影响, 但在促淤过程中, 仍然存在水沙交换过程, 伴随着泥沙吹填上滩, 促淤区内部高程不断抬高, 逐渐形成了由挺水植物(芦苇、水烛)、沉水植物(穗状狐尾藻Myriophyllum spicatum)、水域和光滩等地物类型组成的复合生境(图 3a)。并且随着促淤工程的推进, 大面积新生湿地逐渐形成, 湿地植物快速发育, 挺水植物面积、所占面积比例和NDVI指数均逐年上升, 其中挺水植物面积和所占面积比例在2017年(30.15 km2, 33.52%)是2013年(9.39 km2, 10.17%)的3.3倍, NDVI指数在2017年(0.32)为2013(0.01)的32倍。芦苇群系是促淤区中最主要的植物群落(图 3a, 3b), 占促淤区挺水植物总面积的64.03%(2017年)。此外, 在促淤区部分浅水区域, 沉水植物也快速发育, 其面积和所占面积比例在2016年达到最大值(3.97 km2, 4.30%), 主要分布于南大堤南面的浅水水域中; 随着高程的进一步抬高及挺水植物芦苇、水烛的扩散, 沉水植物面积有所下降(2017年仅0.61 km2)(图 3a)。伴随着湿地植物的扩张, 促淤区水域面积和所占面积比例呈现逐年下降趋势。
成陆区圈围工程已完工, 不再受潮水影响, 主要受人类开发和利用的影响, 因此内部生境相对复杂, 主要包括挺水植物(水烛和芦苇)、人工林地、沉水植物等地物类型(图 3a)。其中挺水植物是成陆区最主要的地物类型, 其所占面积比例维持在70%~85%之间。但因成陆区内部水体逐渐淡化的影响, 挺水植物群落从原有的芦苇群系逐渐转变为水烛群系。沉水植物面积和所占面积比例在2015年达到最大值(4.03 km2; 23.19%), 随后逐渐下降, 这主要是因为道路施工等人类活动导致的水域丧失而引起的。伴随着成陆区内人工种植柽柳, 林地面积在2015年达到最大值(4.03 km2), 随后因淡水植物的大面积扩散而略有降低。NDVI指数在2013—2015年间变化不明显(图 3b), 至2017年显著增加(约为前三年的1.35倍)。由于成陆区围垦时间最长, 所有水域中都有高盖度的沉水植物。
2.3 雁鸭类数量与生境因子相关关系生境因子指数与雁鸭类数量显著性分析与拟合结果表明:在未进行圈围的自然潮滩中, 挺水植物所占面积比例、水体所占面积比例和NDVI指数与雁鸭类种群数量之间均未发现相关关系(图 4a, 表 1), 但与海三棱藨草/藨草所占面积比例成显著正相关关系(P < 0.05, 表 1), 说明海三棱藨草/藨草面积是影响自然潮滩雁鸭类种群数量的主要因素, 且两者呈现线性增长关系(R2=0.90, P=0.049)(图 5a)。
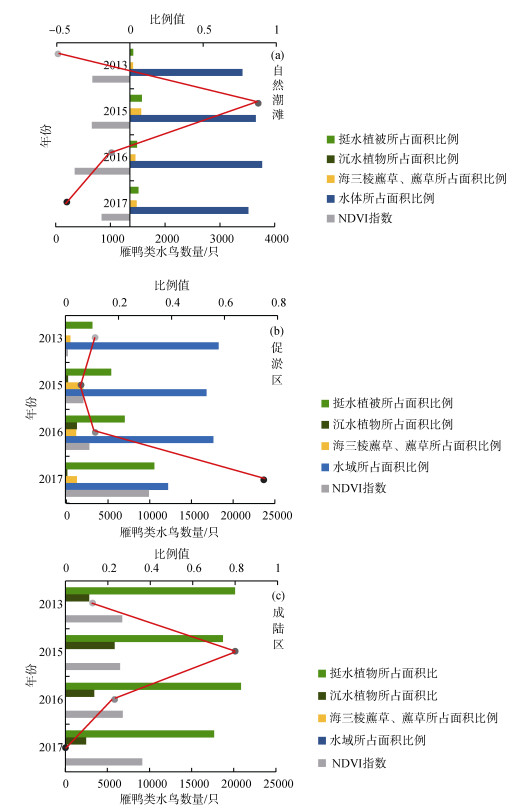 |
| 图 4 自然潮滩(a)、促淤区(b)和成陆区(c)生境因子与雁鸭类数量年际上变化趋势直观比较图 Fig. 4 (a) Comparison of annual variation trends of habitat factors in natural tidal flat, (b) deposit-promoting region, and (c) land- forming region with the number of Anatidae |
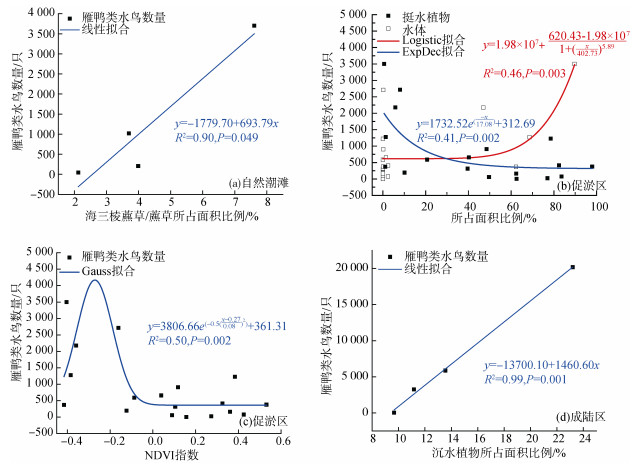 |
| 图 5 横沙东滩自然潮滩(a)、促淤区(b, c)和成陆区(d)关键生境因子与雁鸭类数量拟合曲线 Fig. 5 (a) Key habitat factors in the natural tidal flat, (b, c) deposit-promoting region, and (d) land-forming region, fitted with the number of Anatidae in East Hengsha Shoal |
| 生境类型 | 挺水植被所占 面积比例(%) |
沉水植物所占 面积比例(%) |
水体所占 面积比例(%) |
NDVI指数 | 海三棱藨草/藨草所占 面积比例(%) |
|
| 自然潮滩 | F | 0.832 | - | 0.509 | –0.139 | 0.950* |
| p | 0.168 | - | 0.491 | 0.861 | 0.050 | |
| 促淤区 | F | –0.508* | 0.016 | 0.569* | –0.544* | –0.094 |
| P | 0.026 | 0.949 | 0.011 | 0.016 | 0.702 | |
| 成陆区 | F | –0.032 | 0.999** | - | –0.632 | - |
| P | 0.968 | 0.001 | - | 0.368 | - | |
| 注: *表示变量之间的相关性P < 0.05, 为显著相关关系; **表示变量之间的相关性P < 0.01, 为极显著相关关系。 |
||||||
在促淤区, 水域面积、挺水植物面积和植物覆盖度为影响促淤区雁鸭类种群的主要因素(图 4b, 表 1), 其中挺水植物所占面积比例和NDVI指数均与雁鸭类种群数量呈显著负相关关系(P < 0.05, 表 1), 而水体所占面积比例则与雁鸭类种群数量呈极显著正相关关系(P < 0.01, 表 1)。挺水植物所占面积比例与雁鸭类种群数量符合ExpDec函数(R2=0.41, P=0.002)关系(图 5b); 水体所占面积比例与雁鸭类种群数量符合Logistic函数(R2=0.46, P=0.003)关系(图 5b); NDVI指数与雁鸭类种群数量符合Gauss函数(R2= 0.50, P=0.002)关系(图 5c), 当植被归一化指数值为–0.24时, 雁鸭类种群数量将会达到峰值, 此时生境为大面积的水域与光滩(图 5c)。可见, 在促淤区内, 雁鸭类喜好有充足水面且植被覆盖不高的生境类型。
在已完成圈围的成陆区, 仅沉水植物所占面积比例与雁鸭类种群数量存在极显著正相关关系(P < 0.01, 表 1), 表明沉水植被面积是影响成陆区雁鸭类种群的主要因素, 且二者呈线性增长关系(R2=0.99, P=0.001)(图 5d)。
3 讨论 3.1 海岸圈围对越冬水鸟生境的影响海岸圈围工程快速改变了滨海湿地的空间格局及湿地类型[16, 23]。从本研究结果可以看出, 海岸圈围对自然潮滩生境格局的时空影响呈现动态变化趋势。围垦工程的实施会在初期促进河口高浊度泥沙在新建大堤外侧快速淤积, 从而促进自然潮滩的快速发育。随着潮滩的发育, 在近岸处高程、水动力等条件适宜的区域, 先锋盐沼植物海三棱藨草/藨草开始定居并逐步扩散, 同时又会进一步促进泥沙在高潮滩的淤积[24]。随着潮滩环境的改变, 植被组成逐步变化, 在自然潮滩沿高程梯度呈现“浅海水域-光滩-海三棱藨草/藨草群落-芦苇群落”的空间分布格局。但随后, 由于河口河势和水动力变化的影响, 近岸泥沙淤积发生变化[25-26], 进而湿地植被面积会发生动态变化, 并非持续增长。
与此同时, 海岸圈围过程中的吹填、促淤等工程手段使得促淤区局部高程快速抬升, 伴随着生境的变化。促淤区内部生境逐步由大面积水域向水域、光滩、植被等多样生境组成的复合生境转变, 形成了一种介于滨海湿地与陆地之间的过渡类型, 但同时也是不稳定的快速变化类型[27]。本研究中, 海岸圈围工程促使横沙东滩形成了大面积的新生湿地, 湿地植被面积不断增加, 但地物类型和植物种类都在发生快速的时空变化。例如, 已有湿地植被分布的区域, 很有可能因为一次吹填活动而被全部掩埋成为光滩; 在吹填过程中形成了新的适宜生境后, 又会很快发育出新的湿地植物。此外, 促淤区湿地植物变化也较为明显, 起初植被群落以芦苇、海三棱藨草和互花米草为主, 具有显著的耐盐特征; 后期由于受潮水影响减弱, 水体和土壤中的盐度均有所下降, 淡水植物(芦苇和水烛)的比重明显增加。
已完成圈围促淤的成陆区, 已不再与河口有直接的水沙盐交换过程, 相对稳定, 生境变化主要受人类活动的影响。大量研究表明, 在人类圈围活动的干扰下, 沿海滩涂湿地生态系统植物群落的变化是从适宜潮滩生长的沼生、盐生植被向陆生、淡水植被群落转变[28-30]。本研究中, 成陆区内部生境在雨水及其他淡水来源的作用下, 表现为底质逐渐脱盐[31]、水位相对稳定、水体盐度逐渐淡化的特点, 因而盐沼植物逐渐被淡水植物水烛和芦苇所替代; 同时由于水位稳定、水体淡化, 成陆区的水域形成了高盖度的沉水植物分布区。
总体而言, 海岸圈围实施后, 若不实施高强度人类开发利用, 在自然演替过程中, 圈围工程促进了大面积新生湿地、湿地植被及多样生境的形成, 为雁鸭类提供了多样的栖息环境和丰富的食物来源, 同时也为其它水鸟、底栖生物、鱼类提供了丰富、多样的生境, 发挥着重要的生态服务功能。
3.2 海岸圈围对雁鸭类种群的影响水鸟对食物和生境具有很强的专一性, 不同生境类型会有不同的水鸟群落[32], 影响水鸟种群的生境因子往往存在着明显的区域差异[33-35]。本研究也发现, 自然潮滩、促淤区和成陆区三种不同生境中影响雁鸭类数量的主要因素各不相同, 这可能与鸟类的行为密切关系。雁鸭类为游禽, 主要以水草、水生植物的根茎和盐生植物的种子为食[7-9]。因此, 自然潮滩主要是它的取食地; 促淤区在起始阶段主要为水域, 此时主要是雁鸭类的游憩区, 随后逐渐形成水域、光滩和植被多种生境后, 成为它们的取食和游憩区; 成陆区若能保留水域、沉水植物和低盖度的挺水植物, 则仍可能成为雁鸭类的取食地和休憩区, 否则将不再适宜雁鸭类的栖息。
食物是影响水鸟分布的重要因子[36]。长江口的海三棱藨草和藨草是雁鸭类的重要食物来源之一[37]。本研究中, 自然潮滩的雁鸭类数量随海三棱藨草/藨草面积的增加而线性增加。此外, 有研究发现雁鸭类数量与沉水植物的丰富度呈显著正相关[38]。本研究中也有类似的结果, 成陆区雁鸭类多集中于有沉水植物分布的水域, 且水鸟数量随着沉水植物所占面积比例(< 25%范围内)的增大加线性上升。海岸圈围实施后, 在自然的演替过程中, 圈围工程促进了自然潮滩海三棱藨草/藨草群落和促淤区及成陆区沉水植物的发育, 这些均为雁鸭类提供了丰富的食物来源。
此外有研究表明, 水生植被结构也是影响水鸟分布的重要因素[39-40]。雁鸭类倾向于选择在水面面积大和植被稀疏的生境栖息和觅食[36, 41-42]。挺水植物高而密集的生境类型会对水鸟的觅食产生不利的影响[43-45]。除了麻鸭等少数雁鸭类, 更多的种群喜好无植被或者是植被矮而稀疏的生境类型[46-48]。本研究也有类似的结果, 促淤区雁鸭类数量随挺水植物所占面积比例的增加急剧下降, 并且与NDVI指数(表征植物覆盖度)[22]为负相关关系。海岸圈围后, 促进了挺水植物(芦苇、水烛)的生长繁殖, 在一定程度上能为雁鸭类提供隐蔽场所, 但植被盖度过高的挺水植物则不利于雁鸭类的取食及游憩。
水面面积对水鸟尤其是游禽具有很大的影响[49]。雁鸭类多数分布在远离人类活动的水面上, 倾向于浅滩生境和开阔水面生境[50-52]; 并且水面面积大的水塘由于较大的容纳量、缓冲人为干扰等原因, 相对小面积的水面能够吸引更多种类和密度的游禽[49]。本研究结果也表明, 促淤区雁鸭类数量会随水域面积的增加呈现快速上升的趋势。对于偏好在水域活动的雁鸭类而言, 水面面积越大, 生境可利用性也就越大。
可以看出, 雁鸭类喜欢选择水面宽阔、有沉水植物和海三棱藨草等食物来源、挺水植物稀疏的生境栖息。由于促淤区往往能提供这类生境, 因此横沙东滩实施海岸圈围后, 雁鸭类种群逐渐从成陆区及自然滩涂转移至促淤区。一旦促淤区吹填工程完成, 逐渐成为成陆区后, 雁鸭类种群可能会随着湿地生态系统的演替发生进一步变化, 需要开展进一步的深入研究。综上所述, 若不实施高强度人类开发和利用, 海岸圈围后, 通过改造水鸟生境[53], 为雁鸭类提供食物、游憩环境、隐蔽场所等, 可以为雁鸭类提供停歇、休憩和越冬生境。
3.3 海岸圈围后水鸟栖息地保护管理建议本研究结果表明圈围后形成的新生湿地为鸟类提供了重要的栖息地。即使滨海湿地圈围成陆, 若在圈围区保留部分水面、促进沉水植物的发育、维持适宜的挺水植物密度等, 同样也能为雁鸭类提供适宜栖息地。根据本研究的结果, 对海岸圈围后水鸟栖息地保护和管理提出以下建议:
(1) 在圈围区尽可能保留部分区域作为沼泽湿地, 并根据水鸟对生境的具体需求, 结合吹填、促淤等过程, 营造水鸟的适宜生境。
(2) 在迁徙越冬期, 圈围区内应该保留大面积水域, 并为沉水植物的生长与繁殖提供适宜环境, 为雁鸭类的觅食与游憩提供适宜条件。
(3) 对于高密度的挺水植物区, 可利用物理刈割等手段控制挺水植物面积及盖度, 将其维持在适宜的状况, 来满足水鸟的休憩、觅食需求。
(4) 加强对自然和圈围栖息地水文、地貌、植物、动物等多要素的综合监测, 防止水鸟栖息地的减少与丧失。
(5) 进一步开展海岸圈围对其他种类水鸟种群的影响, 形成综合的水鸟栖息地修复及管理对策。
致谢: 本文研究得到上海市野生动物植物保护管理站的大力支持与协助, 特此感谢!
| [1] |
Tong C, Wang W Q, Huang J F, et al. Invasive alien plants increase CH4 emissions from a subtropical tidal estuarine wetland[J]. Biogeochemistry (Dordrecht), 2012, 111(1-3): 677-693. DOI:10.1007/s10533-012-9712-5 |
| [2] |
Mitsch W J. Wetland creation, restoration, and conservation:A wetland invitational at the Olentangy River Wetland Research Park[J]. Ecological Engineering, 2005, 24(4): 243-251. DOI:10.1016/j.ecoleng.2005.02.006 |
| [3] |
Barbier E B, Koch E W, Silliman B R, et al. Coastal ecosystem-based management with nonlinear ecological functions and values[J]. Science, 2008, 319(5861): 321-323. DOI:10.1126/science.1150349 |
| [4] |
Temmerman S, Meire P, Bouma T J, et al. Ecosystem-based coastal defence in the face of global change[J]. Nature, 2013, 504(7478): 79-83. DOI:10.1038/nature12859 |
| [5] |
Ge Z, Wang T, Zhou X, et al. Seasonal change and habitat selection of shorebird community at the South Yangtze River Mouth and North Hangzhou Bay, China[J]. Acta Ecologica Sinica, 2006, 26(1): 40-47. DOI:10.1016/S1872-2032(06)60004-8 |
| [6] |
Wang T H, Qian G Z. Shorebirds in the Yangtze River Estuary and Hangzhou Bay[M]. Shanghai: East China Normal University Press, 1988: 16-19.
|
| [7] |
赵正阶. 中国鸟类志(上卷:非雀形目)[M]. 长春: 吉林科学技术出版社, 2001: 175-208. Zhao Zhengjie. A Handbook of the Birds of China (Volume I:Non-passerines)[M]. Changchun: Science and Technique Press of Jilin province, 2001: 175-208. |
| [8] |
Buckton S. Threatened Birds of the World. BIRDLIFE INTERNATIONAL (2000). Barcelona and Cambridge, UK:Lynx Edicions and BirdLife International. 852 pages, 70[J]. Bird Conservation International, 2001, 11(1): 71-75. |
| [9] |
杨预展.长江中下流域草食性雁食性及肠道微生物研究[D].合肥: 中国科学技术大学, 2016. Yang Yuzhan. Diet analysis and gut microbiota of herbivorous Anatidae in the Middle and Lower Yangtze River Floodplain[D]. Hefei: University of Science and Technology of China, 2016. |
| [10] |
李丁男.中国受胁雁鸭类的地理分布及保护状况研究[D].北京: 北京林业大学, 2014. Li Dingnan. Geographical distribution and protection status of threatened species of Anatidae in China[D]. Beijing: Beijing Forestry University, 2014. |
| [11] |
Li Jiufa, Dai Zhijun, Ying Ming, et al. Analysis on the development and evolution of tidal flats and reclamation of land resource along shore of Shanghai city[J]. Journal of Natural Resources, 2007, 22(3): 361-371. |
| [12] |
Ji Lan, Tang chen, Zhang Jianfeng, et al. Application of Yangtze estuary dredged material to East Hengsha Shoal reclamation projects[J]. Port & Waterway Engineering, 2011(07): 163-167. |
| [13] |
谢文霞, 李晓燕, 于蓉蓉, 等. 胶州湾湿地的退化影响因素与生态修复建议[J]. 海洋科学, 2012, 36(10): 99-106. Xie Wenxia, Li Xiaoyan, Yu Rongrong, et al. Degradation factors and ideas on ecological restoration of the Jiaozhou Bay wetland[J]. Marine Sciences, 2012, 36(10): 99-106. |
| [14] |
Lu Yongjun, Hou Qingzhi, Lu Yan, et al. Advances in development and management of estuarine and coastal mudflats[J]. Hydro-Science and Engineering, 2011(4): 1-12. |
| [15] |
Chen Haiying, Sun Peng, Lou Fei, et al. Regulation utilization and prospect of East Hengsha Shoal in the Yangtze Estuary[J]. Port & Waterway Engineering, 2017(11): 152-155, 160. |
| [16] |
梁文, 胡自宁, 黎广钊, 等. 50年来北海市滨海湿地景观格局变化及其驱动机制[J]. 海洋科学, 2016, 40(2): 84-93. Liang Wen, Hu Zining, Li Guangzhao, et al. Change and driving mechanism of landscape patterns in the coastal wetland of Beihai city in the last 50 years[J]. Marine Sciences, 2016, 40(2): 84-93. |
| [17] |
Xu Caiyao, Pu Lijie, Zhu Ming. Effect of reclamation activity on coastal ecological environment:progress and perspectives[J]. Acta Ecologica Sinica, 2018, 38(3): 1148-1162. |
| [18] |
M Rejmánek, J Jeník. Niche, habitat, and related ecological concepts[J]. Acta Biotheoretica, 1975, 24(3-4): 100-107. DOI:10.1007/BF01556997 |
| [19] |
Tian Bo, Zhou Yunxuan, Yuan Lin, et al. Investigation and analysis on the biodiversity and ecological environment in the East Hengsha Shoal of the Yangtze Estuary[J]. Journal of East China Normal University (Natural Science), 2013, 2013(4): 120-127. |
| [20] |
Sutherland W J, Newton I, Green R. Bird ecology and conservation:a handbook of techniques[M]. New York: Oxford University Press, 2004.
|
| [21] |
Zhou Wenhui, Zhu Jinghai, Liu Hexin, et al. Overview of wetland bird survey methods[J]. Chinese Joural of Wildlife, 2018, 39(3): 588-593. |
| [22] |
Defries R S, Townshend J R G. NDVI-derived land cover classifications at a global scale[J]. International Journal of Remote Sensing, 1994, 15(17): 3567-3586. DOI:10.1080/01431169408954345 |
| [23] |
Shen Jiahong, Hu Renyong, Li Minghong, et al. Influence of reclamation on plant diversity of beach wetlands in Hangzhou Bay and Yueqing Bay in East China[J]. Journal of Zhejiang University (Science Edition), 2006, 33(3): 324. |
| [24] |
Oorschot M V, Kleinhans M, Geerling G, et al. Distinct patterns of interaction between vegetation and morphodynamics[J]. Earth Surface Processes and Landforms, 2016, 41(6): 791-808. DOI:10.1002/esp.3864 |
| [25] |
叶翔, 王爱军, 马牧, 等. 高强度人类活动对泉州湾滨海湿地环境的影响及其对策[J]. 海洋科学, 2016, 40(1): 94-100. Ye Xiang, Wang Aijun, Ma Mu, et al. Effects of high-intensity human activities on the environment variations of coastal wetland in the Quanzhou Bay, China[J]. Marine Sciences, 2016, 40(1): 94-100. |
| [26] |
Guo Chaoshuo, Zhu Jianrong. Impact of Qingcaosha reservoir project on the bed erosion and deposition nearby the water area[J]. Journal of Marine Sciences, 2015, 33(3): 34-41. |
| [27] |
Li Jialin, Yang Xiaoping, Tongyiqin. Progress on environmental effects of tidal flat reclamation[J]. Progress in Geography, 2007(2): 43-51. |
| [28] |
Castellanos E M, Heredia C, Figueroa M E, et al. Tiller dynamics of Spartina maritima in successional and non-successional mediterranean salt marsh[J]. Plant Ecology, 1998, 137: 213-225. DOI:10.1023/A:1009732231830 |
| [29] |
Yang Tonghui, Zhang Jiahong, Zhang Lingju, et al. Study on the diversity of plant communities at the front line of south beach of Hangzhou Bay[J]. Jour of Fujian Forestry Science and Technology, 2007, 34(3): 170-172. |
| [30] |
Gong Huizheng, Li Shengfeng. Study on plant community succession and diversity gradients in Jiangsu tidal flat reclamation area[J]. Ecological Science, 2015(6): 16-21. |
| [31] |
陈琤, 刘玉虹, 陆滢, 等. 防潮堤坝对山东昌邑滨海湿地植物及土壤性质的影响分析[J]. 海洋科学, 2017, 41(5): 50-58. Chen Cheng, Liu Yuhong, Lu Ying, et al. Effects of tide dyke on plants and soil properties of coastal wetlands in Changyi, Shandong[J]. Marine Sciences, 2017, 41(5): 50-58. |
| [32] |
Kantrud H A, Stewart R E. Use of natural basin wetlands by breeding waterfowl in North Dakota[J]. Journal of Wildlife Management, 1977, 41(2): 243. DOI:10.2307/3800601 |
| [33] |
Isola C R, Colwell M A, Safran O W T J. Interspecific differences in habitat use of shorebirds and waterfowl foraging in managed wetlands of California's San Joaquin Valley[J]. Waterbird:The International Journal of Waterbird Biology, 2000, 23(2): 196-203. |
| [34] |
Smith L M, Haukos D A, Prather R M. Avian response to vegetative pattern in playa wetlands during winter[J]. Wildlife Society Bulletin, 2011, 32(2): 474-480. |
| [35] |
Faragó, Sándor, Hangya K. Effects of water level on waterbird abundance and diversity along the middle section of the Danube River[J]. Hydrobiologia, 2012, 697(1): 15-21. DOI:10.1007/s10750-012-1166-1 |
| [36] |
Erwin R M. Feeding habitats of nesting wading birds:spatial use and social influences[J]. Auk, 1983, 100(4): 960-970. |
| [37] |
Yu Kuai. The Anatidae and Scirpus mariqueter in Eastern Chongming Shoal[J]. China Nature, 1994(3): 7-8. |
| [38] |
Wicker A M, Endres K M. Relationship between waterfowl and American coot abundance with submersed macrophytic vegetation in Currituck Sound, North Carolina[J]. Estuaries, 1995, 18(2): 428-431. DOI:10.2307/1352325 |
| [39] |
Murkin H R, Murkin E J, Ball J P. Avian habitat selection and prairie wetland dynamics:a 10-year experiment[J]. Ecological Applications, 1997, 7(4): 1144-1159. DOI:10.1890/1051-0761(1997)007[1144:AHSAPW]2.0.CO;2 |
| [40] |
Elphick C S, Oring L W. Conservation implications of flooding rice fields on winter waterbird communities[J]. Agriculture Ecosystems & Environment, 2003, 94(1): 17-29. |
| [41] |
Davis C A, Smith L M. Ecology and management of migrant shorebirds in the Playa Lakes Region of Texas[J]. Wildlife Monographs, 1998, 105(140): 3-45. |
| [42] |
Niu Junying, Heng Nannan, Zhang Bin, et al. Waterbird habitat-selection during winter and spring in reclaimed coastal wetlands in Nanhui Dongtan, Shanghai[J], 2011, 32(6): 624-630.
|
| [43] |
Fujioka M, Armacost J W, Yoshida H, et al. Value of fallow farmlands as summer habitats for waterbirds in a Japanese rural area[J]. Ecological Research, 2010, 16(3): 555-567. |
| [44] |
Bancroft G T, Gawlik D E and Rutchey K. Distribution of wading birds relative to vegetation and water depths in the Northern Everglades of Florida, USA[J]. WATERBIRDS, 2002, Vol.25: 265-277.
|
| [45] |
White C L, Main M B. Waterbird use of created wetlands in golf-course landscapes[J]. Wildlife Society Bulletin, 2011, 33(2): 411-421. |
| [46] |
Maeda T. Patterns of bird abundance and habitat use in rice fields of the Kanto Plain, central Japan[J]. Ecological Research, 2001, Vol.16(3): 569-585. DOI:10.1046/j.1440-1703.2001.00418.x |
| [47] |
Darnell T M. Avian Use of Natural and Created Salt Marsh in Texas, USA[J]. Waterbirds the International Journal of Waterbird Biology, 2004, 27(3): 355-361. |
| [48] |
J.A. Sánchez-Zapata, J.D. Anadón, Carrete M, et al. Breeding waterbirds in relation to artificial pond attributes: implications for the design of irrigation facilities[J]. Biodiversity and Conservation, 2005, 14(7): 1627-1639.
|
| [49] |
Hua Ning, Ma Zhijun, Ma Qiang, et al. Waterbird use of aquacultural ponds in winter at Chongming Dongtan[J]. 2009, (12): 6342-6350.
|
| [50] |
Mckinstry M C, Caffrey P, Anderson S H. The importance of beaver to wetland habitats and waterfowl in wyoming[J]. Jawra Journal of the American Water Resources Association, 2010, 37(6): 1571-1577. |
| [51] |
Tang Jian, Lu Changhu, Yuan, Anquan. The species composition, abundance and distribution in habitat of Geese and Ducks in the Eastern Hongzehu wetland natural reserve[J]. 2007, 42(1): 94-101.
|
| [52] |
Pei Enle, Yuan Xiao, Tang Chendong, et al. Community structure and dynamic distribution pattern of waterbird in Shanghai[J]. Chinese Journal of Ecology, 2012, 31(10): 2599-2605. |
| [53] |
张晓龙, 李培英, 刘月良, 等. 黄河三角洲湿地研究进展[J]. 海洋科学, 2007, 31(7): 81-85. Zhang Xiaolong, Li Peiying, Liu Yueliang, et al. Study on the wetland of the Yellow River Delta:a review[J]. Marine Sciences, 2007, 31(7): 81-85. DOI:10.3969/j.issn.1000-3096.2007.07.016 |
 2019, Vol. 43
2019, Vol. 43


