文章信息
- 李毅, 周大颜, 陈晓磁, 许莉莉, 曹亮. 2020.
- LI Yi, ZHOU Da-yan, CHEN Xiao-ci, XU Li-li, CAO Liang. 2020.
- 模拟夏季温排水温升对福宁湾常见海洋生物的热耐受性研究
- Thermal tolerance of common marine organisms in Funing Bay by simulation of temperature increase in summer from thermal drainage
- 海洋科学, 44(12): 61-68
- Marine Sciences, 44(12): 61-68.
- http://dx.doi.org/10.11759/hykx20200304003
-
文章历史
- 收稿日期:2020-03-04
- 修回日期:2020-04-10
2. 华能霞浦核电有限公司 宁德 351000;
3. 海洋国家实验室海洋生态与环境科学功能实验室, 青岛 266071;
4. 广西水产引育种中心, 南宁 530031
2. Huaneng Xiapu nuclear power development Co. Ltd., Ningde 351000, China;
3. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China;
4. Aquatic Species Introduction and Breeding Center of Guangxi, Nanning 530031, China
由于几乎不污染环境, 产生的固体废物相对较少, 而且比其他化石燃料效率高, 核电被认为是一种稳定的清洁高效能源, 如今全球超过16%的电力由核电提供。近年来, 我国核电呈现快速发展的态势。截至2018年4月, 我国内地已运营核电机组38台, 在建核电机组18台, 在建规模居世界首位。核电在我国优化能源结构、保障能源安全、促进减排和应对气候变化等方面发挥了积极作用。但是核电发展仍面临着一些问题, 其中核电厂运行过程中向周边海域排放大量的温排水, 伴随而来的热污染问题日益严峻, 已成为近年来我国海洋生态环境领域普遍关注的热点问题之一[1]。
温排水将大量余热释放到海洋中, 能使排水口水域的水温升高大约8~12℃, 带来了明显的环境热污染[2], 对受纳水域的水文条件、海水水质、生态环境、生物群落组成与结构等方面造成严重影响。例如美国比斯坎湾的一座核电站, 运行高峰时其排放的温排水使附近水域水温增加了8℃, 导致了排放口周围1.5 km2海域内生物消失[3]。巴西伊尔哈格兰德湾核电站长期排放的温排水改变了临近水域底栖生物群落组成, 降低了其丰富度, 从而影响了鱼类的群落结构及空间分布[4]。Bozorgchenania等(2018)[5]也发现了类似的现象, Neka发电厂热排放造成伊朗里海南岸大型底栖动物密度增加, 但多样性相对降低。温排水造成了印度印诺尔港邻近海域浮游植物和浮游动物的种群密度分别减少了64%和93%, 间接导致了鱼类补充幼体的减少, 对当地渔业造成了不利影响[6]。蒋朝鹏等[7]分析了秦山核电海域温排水对鱼类分布的影响, 发现温排水导致邻近海域鱼类群落、种类和数量分布等发生变化, 改变了这一水域的渔场属性。温排水对临近水域生态系统的影响程度与当地生物群落的结构组成以及是否有温度敏感物种密切相关, 因此, 需要对不同生物的热耐受性进行研究。
福建霞浦核电厂址位于福建省宁德市霞浦县东冲半岛东北部的长表岛海域, 地处福宁湾和高罗澳之间。厂址海域夏季表层平均水温达28.6℃, 由近岸至外海逐渐升高的趋势。厂址规划建设6台核电机组, 包括4台百万千瓦级核电机组和2台60万千瓦级(或百万千瓦级)快中子反应堆机组。6台机组运行时, 夏季排水量443 m3/s, 温升8.0℃。根据三维水动力数值模拟的综合分析结果, 霞浦核电厂6台机组运行时, 夏季温排水1.0℃温升最大包络面积7 926.5 hm2, 2.0℃温升最大包络面积360.4 hm2, 3.0℃温升最大包络面积26.4 hm2, 4.0℃温升最大包络面积3.7 hm2(图 1)。
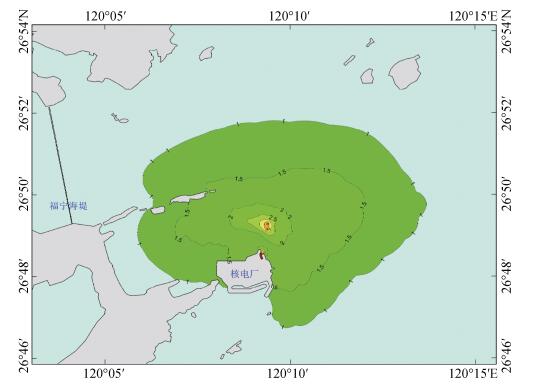 |
| 图 1 霞浦核电厂温排水夏季最大温升包络影响范围 Fig. 1 Influence range of the maximum rise of thermal-drainage temperature envelope from Xiapu nuclear power plant in summer |
福宁湾隶属闽东渔场, 为亚热带海域, 是大黄鱼(Larimichthys crocea)、黑鲷(Sparus macrocephalus)等许多经济渔业生物重要的产卵、育幼、索饵和越冬场所。优越的生态环境和丰富的饵料生物繁衍了大量的经济鱼类、虾类、蟹类等海洋生物, 是我国南方海域渔业资源丰富、生产力水平较高的重要渔场之一。根据2019年夏季的渔业资源调查, 核电厂址海域的主要渔业生物有棘头梅童鱼(Collichthys lucidus)、龙头鱼(Harpodon neherus)、口虾蛄(Oratosquilla oratoria)、孔虾虎鱼(Trypauchen vagina)、矛尾虾虎鱼(Chaeturichthys stigmatias)、三疣梭子蟹(Portunus trituberculatus)、短吻红舌鳎(Cynoglossus joyneri)、黑鲷、大黄鱼等。
由于夏季自然水温较高, 若再排放大量的温排水, 可能会对某些敏感物种造成严重的不利影响。基于地域性(常年生活于核电站周边水域)、可获性(可获得足够的活体材料进行试验)和可比性(相同生活阶段的个体), 本研究选取该海域常见的四种重要经济动物(大黄鱼、黑鲷、口虾蛄和三疣梭子蟹)为研究对象, 模拟夏季温排水温升研究这四种生物热耐受性指标的变化特征, 评估试验中这四种海洋生物对温度升高的敏感程度, 评估水温升高对海洋生物的热暴露风险。以期为核电厂温排水的排放控制方案优化及其环境影响评估提供基础数据和科学依据。
1 材料与方法 1.1 试验材料试验所用1龄内大黄鱼和黑鲷幼鱼购自福建省三沙湾网箱养殖场, 口虾蛄和三疣梭子蟹幼体为三沙湾海域捕获的野生个体。试验前将试验生物在驯化水槽中(30℃)暂养10天后, 选取大小相相近、体质健康的个体进行试验。试验生物的规格见表 1。
| 物种 | 全长或头胸甲长/mm | 体重/g |
| 大黄鱼L. crocea | *121.3±4.8 | 22.7±3.9 |
| 黑鲷S. macrocephalus | *133.1±6.3 | 38.6±8.4 |
| 口虾蛄O. oratoria | #29.6±4.2 | 19.4±5.6 |
| 三疣梭子蟹P. trituberculatus | #12.9±4.2 | 4.8±2.0 |
| 注: “*”为全长, “#”为头胸甲长。 | ||
试验容器为容积150 L的聚乙烯塑料水槽, 试验用海水为经过滤后的福宁湾自然海水。海水水质参数pH 8.1±0.1;盐度30.7±0.8 ppt; 溶解氧7.1±0.4 mg/L。
试验水体的温度由钛加热棒(德国Armaturenbau)和精密温控仪(韩国A-MI 211H)控制并使用精密水银温度计进行校正。加热棒的功率范围为100~2 000 W, 温控仪的温控范围0~90℃, 感温灵敏度0.1℃。根据试验水体的体积和温升速率选取不同功率的加热棒, 以保持升温速率一致。试验过程中保持充气, 使水槽中的水温分布均匀。
1.2.2 动态试验由于温排水持续大量的排入受纳水域, 与排水口的距离不同以及不同的水层均有不同的温升速率, 动态温升试验模拟持续排放温排水导致的各种速率的水温升高。本试验设置了7个处理组, 每个处理组设3个平行, 温升速率分别为0.1, 0.5, 1.0, 2.0, 4.0, 8.0, 12.0℃/h, 以不同功率的加热棒控制升温的速率。每种试验生物取10尾(个)放入试验水槽中, 适应10分钟后开始以设定速率加热。在此期间密切观察试验生物的反应, 当出现异常行为(如跳跃、冲撞、侧游、身体翻转等)时记录为该物种的临界热最大值(Critical thermal maximum, CTM)。
1.2.3 静态试验静态试验研究在24 h的暴露时间内受试生物死亡率达到50%时的温度值, 即24 h高起始致死温度(24 h UILT50)。本试验设置11个水温梯度组, 分别为对照组30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃、38℃、39℃、40℃组。每个温度组设3个平行组。每种试验生物取10尾(个)放入各试验水槽中, 试验时间为24 h, 试验过程中各温度处理组保持水温恒定。静态试验以受试生物的死亡作为试验的端点, 以呼吸停止(鱼类)、对外界物理刺激无反应(虾蟹类)等行为定义为生物个体死亡。试验过程中及时取出死亡个体并记录, 以直线内插法或SPSS统计分析法分别求得各受试生物24小时高起始致死温度(24 h Upper Incipient Lethal Temperature, 24 h UILT50)。
1.3 数据分析四种受试生物在各处理水平中的CTM与24 h UILT50值均表示为平均值±标准差(mean±SD), 所有统计分析均在IBM SPSS Statistics 20.0上进行。采用one- way ANOVA检验和多重比较(Tukey HSD test)对动态试验中同一物种在不同温升速率下的CTM值以及静态实验中各物种的24 h UILT50值进行差异显著性检验和分析, 统计学显著性差异水平设置为P < 0.05。
2 结果 2.1 动态试验:不同温升速率对试验生物临界热最大值的影响当高温升速率组(8.0℃/h和12.0℃/h)水温升到33℃左右时, 口虾蛄率先出现了临界反应, 表现为快速游动, 侧游等; 水温升高到34~35℃之间时, 大黄鱼和黑鲷相继出现了激烈的临界反应, 表现有快速游动, 跳跃, 冲撞等行为; 三疣梭子蟹对高温的忍耐力较强, 水温升到39℃左右时才出现临界反应。
四种试验生物的临界热最大值均随温升速率的升高呈先增加而后降低的趋势(表 2)。口虾蛄、大黄鱼、黑鲷和三疣梭子蟹的CTM最大值分别为34.8℃、35.5℃、36.7℃和40.4℃, 除口虾蛄的CTM最大值出现在1.0℃/h温升速率处理组外, 其他三种受试生物的CTM最大值均出现在2.0℃/h温升速率处理组, 并且均显著高于慢温升速率组(0.1℃/h和0.5℃/h)和快温升速率组(8.0℃/h和12.0℃/h, P < 0.05; 表 2)。动态试验结果表明:这四种受试生物的热耐受能力为三疣梭子蟹 > 黑鲷 > 大黄鱼> 口虾蛄。
| 温升速率(℃/h) | 临界热最大值(CTM, ℃) | |||
| 大黄鱼 | 黑鲷 | 口虾蛄 | 三疣梭子蟹 | |
| 0.1 | 34.1±0.1a | 34.5±0.9a | 33.3±0.3ab | 38.9±0.4a |
| 0.5 | 34.8±0.1ab | 35.2±0.5ab | 33.5±0.3ab | 39.1±0.6a |
| 1.0 | 35.0±0.2ab | 35.9±0.4abc | 34.8±0.8c | 39.5±0.3ab |
| 2.0 | 35.5±0.2b | 36.7±0.3c | 34.5±0.4bc | 40.4±0.5b |
| 4.0 | 34.8±0.6ab | 35.9±0.2bc | 34.0±0.5abc | 39.8±0.3ab |
| 8.0 | 34.2±0.7a | 35.2±0.4ab | 33.2±0.3a | 38.9±0.3a |
| 12.0 | 34.3±0.3a | 34.9±0.5ab | 33.1±0.4a | 38.8±0.4a |
| 注: Tukey HSD检验, 数值上标不同字母表示各温升速率处理组之间的差异显著, P < 0.05 | ||||
在24小时静态试验中, 大黄鱼、黑鲷和口虾蛄在水温≤33.0℃的四个处理组中均无个体死亡, 而在水温≥38.0℃的三个处理组中的死亡率均达到了100%;与动态试验类似, 三疣梭子蟹表现出极强的热耐受能力, 在水温≤35.0℃的六个处理组中均无个体死亡, 即使在最高水温处理组(40.0℃)中仍有个体存活。
在夏季自然水温为30.0℃时, 口虾蛄、大黄鱼、黑鲷和三疣梭子蟹四种受试生物的24 h UILT50分别为35.6℃、35.8℃、36.3℃和38.2℃(表 3)。四种受试生物中, 三疣梭子蟹在静态热试验中表现的热耐受能力最强, 其24 h UILT50比背景温度高了8.2℃。其他三种受试生物的的静态热耐受能力较为接近, 均在35~36℃之间, 亦均高出背景温度超过5℃。与动态试验结果一致:这四种受试生物的静态热耐受能力依次为三疣梭子蟹 > 黑鲷 > 大黄鱼> 口虾蛄。
| 物种 | 暴露时间/h | 回归方程 | 高起始致死温度/℃ |
| 大黄鱼 | 24 | Y=0.14X–4.3, R2=0.83 | 35.8 |
| 黑鲷 | 24 | Y=0.13X–4.0, R2=0.81 | 36.3 |
| 口虾蛄 | 24 | Y=0.14X–4.4, R2=0.90 | 35.6 |
| 三疣梭子蟹 | 24 | Y=0.07X–2.1, R2=0.63 | 38.2 |
按照设计, 霞浦核电厂夏季排水量443 m3/s, 温升8.0℃。利用刘永叶等(2016)[8]中的公式: TC=Tmax– ΔT1+ΔT和试验结果中的UILT50值, 推算出厂址海域排放口控制的最高排放温度限值在夏季为40℃。其中Tmax取四种受试生物的最低24 h UILT50值, ΔT为核电厂的设计取排水温升8.0℃, ΔT1为温排水混合区边缘的温升限值39.6℃。
3 讨论滨海电厂温排水携带大量热量排入海中引起局部水域的热污染, 造成电厂附近水温在一定范围内海水温度升高, 进而造成海水多种理化性质的变化, 包括溶解氧下降、pH值增大、水色变浊、透明度降低、氨氮含量增高、水质矿化度增高等。对水生生物的各种生命过程产生不利影响[9-10]。水温是影响水生生物生长、发育和繁殖的最关键因子之一, 对于外温动物, 环境温度对其生化和生理活动有深远的影响, 直接关系着水生生物数量的变动[1]。针对全球气温不断升高的趋势以及近岸局部海域的热污染, 研究人员开展了大量水生生物的温度适应能力、耐热性及高温对其健康影响的研究工作[1, 11-17]。
海洋生物可以适应自然环境中的温度升高[16], 但根据谢尔福德耐受性定律[18], 生物对温度的适应性存在一定的限度, 在适温范围内, 生物的生长发育速度随温度的升高而加快。而超出这个范围其生长和生存就会受到影响。例如普通鱼类的适温范围一般是12~30℃, 当升温至37℃及以上时大多数鱼类会失去平衡乃至死亡[19]。因此, 确定海洋生物对温度的耐受水平对于评估气候变化及其他热污染对海洋生物死亡率的影响程度及物种的丰度和分布至关重要。
3.1 生物热耐受性的研究方法通过将生物暴露于高温下直至其表现出热应激反应或死亡症状来确定生物的耐热性是热生物学领域的常见做法。海洋生物的热耐受性通常通过两种不同的试验方法来量化。一种是“静态法”, 将生物暴露于一系列设定的温度处理组中, 期间保持水温恒定, 通过试验获得在一定时期内50%的生物个体不能存活的温度, 即起始致死温度; 而另一种方法为“动态法”中, 试验过程中通过一定的温升速率使水温逐渐升高直至生物达到临界点(如失去平衡等)。在动态方法中, 临界热最大值(CTM)被量化为生物个体达到这个临界点时的平均温度[1]。由于“动态法”客观考虑温升速率随时间、温排水流量及其输运扩散的动态变化, 更接近野外实际情况, 而且能够快速获得数据, “动态法”得到了更广泛的应用[1]。然而使用“动态法”确定生物的耐热水平存在的一个问题是温升速率的影响, 过慢或过快的升温均可能高估或低估生物的耐热性[1, 11, 18-20]。而“静态法”的优点是操作简单。评价结果直观, 但也存在不足之处, 如试验时间较长、没有充分考虑水温的动态变化等[1, 20]。因此, 在生物的热耐受评估中将两种方法结合应用能更准确地反映受试生物的热忍耐能力。
在相同的水温条件下, 由“动态法”鱼类(许氏平鲉Sebastes schlegeli、大泷六线鱼Hexagrammos otakii、矛尾鰕虎鱼Chaeturichthys stigmatias和褐菖鲉Sebastiscus marmoratus)的热耐受指标(CTM)均高于通过“静态法”得到的指标(UILT50)[1]。类似的, 张梅英等(1999)[21]发现在梭鱼(Liza haematocheila)幼鱼暴露在25~34℃的三种水温条件下, 通过“动态法”取得的耐热性指标比通过“静态法”得到的指标高4℃左右。本研究并没有得到一致的结果, 三疣梭子蟹的CTM高于UILT50, 大黄鱼和口虾蛄的CTM均低于UILT50, 而黑鲷在温升速率2.0℃/h时的CTM与UILT50值较为接近。这说明生物的热耐受性受很多因素的影响, 其中物种间的差异性是其中一个重要方面。
3.2 生物热耐受性的影响因素海洋生物的热耐受性是由于环境变化引起的自然选择, 由其遗传特性和地理分布等因素决定, 具有很大的种间差异[13]。本研究的两种鱼类中黑鲷的耐热能力强于大黄鱼, 它们的CTM最大值分别为36.7℃和35.5℃。同样是这两种鱼类, 陈全震等[22]发现在夏季自然起始水温为28.5℃时, 黑鲷和大黄鱼的临界热最大值分别为36.8℃和35.0℃, 这与本研究这两种鱼类的热耐受结果较为相近。在夏季石岛湾水域起始水温为26℃时, 许氏平鲉、大泷六线鱼、褐菖鲉和矛尾虾虎鱼的CTM最大值分别为33.8℃、32.4℃、32.9℃和38.1℃[1]。而与本试验起始水温接近, 夏季黄矛海水域起始水温30.8℃时, 褐篮子鱼(Siganus fuscescens)、褐菖鲉(Sebasticus marmoratus)和褐石斑鱼(Epinephelus brunneus)的CTM最大值分别为38.1℃、38.6℃和38.1℃, 这几种鱼类的热耐受能力均强于本研究的大黄鱼和黑鲷[12]。本研究中的两种甲壳类生物对高温的耐受能力有较大差别, 三疣梭子蟹表现出极强的耐高温能力, 其CTM最大值高达40.4℃; 而口虾蛄对高温较为敏感, 其CTM最大值为34.8℃, 甚至低于本研究中的两种鱼类, 这可能与其长期穴居于低温环境的生活习性有关[1]。
温升速率不仅影响受试生物适应环境的时间, 还会影响它们暴露于致命温度的持续时间。本研究中, 四种受试生物的CTM值均随温升速率的升高呈先上升后降低趋势。低于1℃/h的温升速率组(0.1℃/h和0.5℃/h)和高于4℃/h的温升速率组(8℃/h和12℃/h)受试生物均展现出较低的耐热性, 而1℃/h和2℃/h温升速率处理组中生物的耐热性较高。不同的海洋生物对温升速率的响应存在明显的种间差异。例如, 在温升速率为1℃/h时, 汉氏棘胎鳚的临界热值最高, 高于快速升温组(60℃/h)和缓慢升温组(1℃/48h~1℃/12h)[23]。同在29℃水温条件下, 温升速率对两种甲壳类(叶状泥蟹和古巴石蟹)临界热最大值的影响也不相同, 前者随温升速率的增加而升高, 而后者随升温速率的增加先升高而后降低[24]。鱼类和甲壳类均为变温动物, 它们的体温与周围水体时刻处在动态平衡中。它们在进化过程中形成了一系列适应不同环境温度的生理生态学机制, 演化出一系列抵消或缓冲温度波动的适应调节机制[25-26]。然而由于夏季基础水温本已较高, 特别是极端高温天气叠加温排水造成的增温会超出某些海洋生物的温度适应极限, 可能会造成热敏感物种的死亡。
在影响水生动物热耐受性的诸多生物、物理和化学因素中, 驯化温度被认为是另一个非常关键的因素。通常情况下, 生物的热耐受能力会随着驯化温度的升高而升高[1, 27]。例如, 在秋季自然水温14℃时以1℃/d的温升速率对大黄鱼进行驯化, 测得其UILT50为28℃, 而在夏季自然水温29℃时以相同的试验参数测得的UILT50升高为34℃[28]。在驯化温度14℃、19℃、24℃和29℃时尖头鱥(Rhynchocypris oxycephalus)的CTM分别为32.3℃、33.2℃、33.4℃和35.7℃[29]。同样, 南、北方花鲈(Lateolabrax maculatus)幼鱼群体的CTM与驯化温度呈明显的正相关关系, 但是在相同的驯化温度下, 南、北方花鲈幼鱼的CTM并无显著差异[30]。这些较大的种间差异表明, 每种物种对热环境的适应因物种而异。生物的耐热驯化是一种对环境温度变化的补偿性、可逆性的改变, 这种热适应会伴随着代谢功能和能量需求的改变, 表现为生物的各种生理活动增强, 相应的也增强了对高温的抵抗能力[31-32]。
4 结论本研究发现三疣梭子蟹对温排水热胁迫的适应性高于口虾蛄、黑鲷和大黄鱼。鱼类等游泳动物具有相对较强的逃避能力, 温度升高时能够退往深水区以躲避温排水的不利影响, 而甲壳类和底栖动物迁移能力较弱, 更易受温排水的高温影响。数值模拟结果表明霞浦核电厂夏季温排水4.0℃温升最大包络面积3.73 hm2, 对生物群落的影响范围及程度相对较小。建议对温排水影响较大的特定海域进行长期跟踪观测, 查明该区域的生物群落组成和对高温敏感的物种, 监控和调整夏季核电厂排水的最高排放温度, 根据现场水温和水动力条件(潮汐、波浪、潮流等)及时调整温排水的排放流速, 以降低夏季温排水对水生生物的不利影响。
| [1] |
窦硕增, 南鸥, 曹亮, 等. 石岛湾四种常见鱼类的热耐受性比较研究[J]. 海洋科学, 2017, 41(9): 56-64. Dou Shuozeng, Nan Ou, Cao Liang, et al. A comparative study of the thermal tolerance of four common fish species in Shidao Bay, the Yellow Sea[J]. Marine Sciences, 2017, 41(9): 56-64. |
| [2] |
Bamber R N. The influence of rising background temperature on the effects of marine thermal effluents[J]. Journal of Thermal Biology, 1995, 20(1-2): 105-110. DOI:10.1016/0306-4565(94)00038-K |
| [3] |
兰志刚, 李新仲, 肖钢, 等. 海上浮式核电站温排水对海洋生态环境的影响[J]. 海洋科学, 2016, 40(6): 84-88. Lan Zhigang, Li Xinzhong, Xiao Gang, et al. Potential impacts of thermal discharge on marine environment from offshore floating nuclear power plant[J]. Marine Sciences, 2016, 40(6): 84-88. |
| [4] |
Teixeira T P, Neves L M, Araújo F G. Effects of a nuclear power plant thermal discharge on habitat complexity and fish community structure in Ilha Grande Bay, Brazil[J]. Marine Environmental Research, 2009, 68: 188-195. DOI:10.1016/j.marenvres.2009.06.004 |
| [5] |
Bozorgchenania A, Seyfabadia J, Shokri M R. Effects of thermal discharge from Neka power plant (southern Caspian Sea) on macrobenthic diversity and abundance[J]. Journal of Thermal Biology, 2018, 75: 13-30. DOI:10.1016/j.jtherbio.2018.05.002 |
| [6] |
Jebakumar J P P, Nandhagopal G, Babu B R., et al. Impact of coastal power plant cooling system on planktonic diversity of a polluted creek system[J]. Marine Pollution Bulletin, 2018, 133: 378-391. DOI:10.1016/j.marpolbul.2018.05.053 |
| [7] |
蒋朝鹏, 徐兆礼, 陈佳杰, 等. 秦山核电温排水对鱼类分布的影响[J]. 中国水产科学, 2016, 23(2): 478-488. Jiang Chaopeng, Xu Zhaoli, Chen Jiajie, et al. Effects of the thermal discharge from Qinshan Nuclear Plant on the distribution pattern of fish[J]. Journal of Fishery Sciences of China, 2016, 23(2): 478-488. |
| [8] |
刘永叶, 陈鲁, 乔亚华, 等. 典型北方滨海核电厂温排水混合区边缘温升限值研究[J]. 环境工程, 2016, 11: 60-63. Liu Yongye, Chen Lu, Qiao Yahua, et al. Study on temperature rise limits on the edge of the mixing zone of thermal discharge from a typical coastal npp in northern China[J]. Environmental Engineering, 2016, 11: 60-63. DOI:10.12030/j.cjee.20160110 |
| [9] |
徐镜波. 电厂热排水对水体溶解氧的影响[J]. 重庆环境科学, 1990, 12(6): 24-28. Xu Jingbo. Effects of thermal discharge from power plant to dissolved oxygen in body of water[J]. Chongqing Environmental Science, 1990, 12(6): 24-28. |
| [10] |
孙艳涛, 王惠民, 吴修锋. 温排水对水体生态环境影响的分析及处理[J]. 水资源保护, 2008, 24(2): 70-72. Sun Yantao, Wang Huimin, Wu Xiufeng. Impacts of thermal discharge on aquatic ecological environment and the countermeasures[J]. Water Resources Protection, 2008, 24(2): 70-72. DOI:10.3969/j.issn.1004-6933.2008.02.018 |
| [11] |
Beitinger T L, Bennett W A, McCauley R W. Temperature tolerances of north American freshwater fishes exposed to dynamic changes in temperature[J]. Environmental Biology of Fishes, 2000, 58(3): 237-275. DOI:10.1023/A:1007676325825 |
| [12] |
崔雯婷, 宋骏杰, 田洪林, 等. 黄茅海五种常见海洋生物的热耐受性[J]. 水产学报, 2018, 42(4): 522-533. Cui Wenting, Song Junjie, Tian Honglin, et al. The thermal tolerance of five common marine species in Huangmao Sea, the South China Sea[J]. Journal of Fisheries of China, 2018, 42(4): 522-533. |
| [13] |
任中华, 宋骏杰, 刘永叶, 等. 辽东湾4种海洋生物的热耐受性研究[J]. 渔业科学进展, 2018, 39(3): 1-10. Ren Zhonghua, Song Junjie, Liu Yongye, et al. An experimental study on the thermal tolerance of four marine species in Liaodong Bay[J]. Progress in Fishery Sciences, 2018, 39(3): 1-10. |
| [14] |
田洪林, 曹亮, 刘金虎, 等. 驯化水温及温升速率对三门湾三种虾蟹类热耐受性的影响[J]. 海洋科学, 2018, 42(4): 43-52. Tian Honglin, Cao Liang, Liu Jinhu, et al. Impact of the acclimation temperature and warming rate on three common crustaceans in Sanmen Bay, the East China Sea[J]. Marine Sciences, 2018, 42(4): 43-52. |
| [15] |
Portner H O, Peck L, Somero G. Thermal limits and adaptation in marine Antarctic ectotherms:an integrative view[J]. Philosophical Transactions:Biological Sciences, 2007, 362: 2233-2258. DOI:10.1098/rstb.2006.1947 |
| [16] |
Ospina F, Mora C. Effect of body size on reef fish tolerance to extreme low and high temperatures[J]. Environmental Biology of Fishes, 2004, 70: 339-343. DOI:10.1023/B:EBFI.0000035429.39129.34 |
| [17] |
龙华. 温度对鱼类生存的影响[J]. 中山大学学报(自然科学版), 2005, S1: 254-257. Long Hua. The effect of temperature on fish survival[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2005, S1: 254-257. |
| [18] |
Shelford V E. Animal Communities in Temperate America: as Illustrated in the Chicago Region: a Study in Animal Ecology[M]. University of Chicago Press, 1913.
|
| [19] |
Lutterschmidt W I, Hutchison V H. The critical thermal maximum:data to support the onset of spasms as the definitive end point[J]. Canadian Journal of Zoology, 1997, 75: 1553-1560. DOI:10.1139/z97-782 |
| [20] |
Mora C, Ospína A. Tolerance to high temperatures and potential impact of sea warming on reef fishes of Gorgona Island (tropical eastern Pacific)[J]. Marine Biology, 2001, 139(4): 765-769. DOI:10.1007/s002270100626 |
| [21] |
张梅英, 侯文礼, 汝少国. 梭鱼幼鱼热耐受温度的研究[J]. 生态学杂志, 1999, 18(2): 60-62. Zhang Meiying, Hou Wenli, Ru Shaoguo. Study on the temperature of thermal tolerance of the mullet larva (Liza haematocheila)[J]. Chinese Journal of Ecology, 1999, 18(2): 60-62. |
| [22] |
陈全震, 曾江宁, 高爱根, 等. 鱼类热忍耐温度研究进展[J]. 水产学报, 2004, 28(5): 562-567. Chen Quanzhen, Zeng Jiangning, Gao Aigen, et al. Advances in study of temperature of thermal tolerance of fishes[J]. Journal of Fisheries of China, 2004, 28(5): 562-567. |
| [23] |
Mora C, Maya M F. Effect of the rate of temperature increase of the dynamic method on the heat tolerance of fishes[J]. Journal of Thermal Biology, 2006, 31(4): 337-341. DOI:10.1016/j.jtherbio.2006.01.005 |
| [24] |
Vinagre C, Leal I, Mendonça V. Effect of warming rate on the critical thermal maxima of crabs, shrimp and fish[J]. Journal of Thermal Biology, 2015, 47: 19-25. |
| [25] |
Seebacher F, Brand M D, Else P L, et al. Plasticity of oxidative metabolism in variable climates:molecular mechanisms[J]. Physiological Biochemistry and Zoology, 2010, 83(5): 721-732. |
| [26] |
闫玉莲, 谢小军. 鱼类适应环境温度的代谢补偿及其线粒体水平的调节机制[J]. 水生生物学报, 2012, 36(3): 532-540. Yan Yulian, Xie Xiaojun. Metabolic compensation based on regulating mechanism in mitochondrial of fish in response to environmental temperature[J]. Acta Hydrobiologica Sinica, 2012, 36(3): 532-540. |
| [27] |
Beitinger T L, Bennett W A. Quantification of the role of acclimation temperature in temperature tolerance of fishes[J]. Environmental Biology of Fishes, 2000, 58: 277-288. |
| [28] |
曾江宁.滨海电厂温排水对亚热带海域生态影响的研究[D].杭州: 浙江大学, 2008. Zeng Jiangning. Ecological effect by thermal discharged water from subtropical coastal power plants[D]. Hangzhou: Zhejiang University, 2008. |
| [29] |
俞丹, 沈中源, 张智, 等. 温度驯化对尖头鳉热耐受特征的影响[J]. 水生生物学报, 2017, 41(3): 538-542. Yu Dan, Shen Zhongyuan, Zhang Zhi, et al. Effect of temperature acclimation on the thermal tolerance of Rhynchocypris oxycephalus[J]. Acta Hydrobiologica Sinica, 2017, 41(3): 538-542. |
| [30] |
胡彦波, 李昀, 温海深, 等. 不同群体花鲈幼鱼温度耐受特征的初步研究[J]. 中国海洋大学学报, 2019, 49: 1-7. Hu Yanbo, Li Yun, Wen Haishen, et al. Characterization of thermal tolerance of juvenile Lateolabrax maculatus from different communities[J]. Periodical of Ocean University of China, 2019, 49: 1-7. |
| [31] |
Magozzi S, Calosi P. Integrating metabolic performance, thermal tolerance, and plasticity enables for more accurate predictions on species vulnerability to acute and chronic effects of global warming[J]. Global Change Biology, 2015, 21: 181-194. |
| [32] |
Zerebecki R A, Sorte C J B. Temperature tolerance and stress proteins as mechanisms of invasive species success[J]. PloS One, 2011, 6: e14806. |
 2020, Vol. 44
2020, Vol. 44


