文章信息
- 田传远, 夏珮伦, 张嘉荣, 于瑞海, 郑小东, 顾忠旗, 黄继. 2020.
- TIAN Chuan-yuan, XIA Pei-lun, ZHANG Jia-rong, YU Rui-hai, ZHENG Xiao-dong, GU Zhong-qi, HUANG Ji. 2020.
- 疣荔枝螺(Thais clavigera Kuster)人工繁育技术研究
- Study on artificial breeding technique of Thais clavigera Kuster
- 海洋科学, 44(6): 122-130
- Marine Sciences, 44(6): 122-130.
- http://dx.doi.org/10.11759/hykx20200225002
-
文章历史
- 收稿日期:2020-02-25
- 修回日期:2020-03-14
2. 嵊泗县海洋科技研究所, 浙江 舟山 202450
2. Zhejiang Shengsi Institute of Marine Science and Technology, Zhoushan 202450, China
中国是世界水产养殖第一大国, 如今我国水产养殖量占世界水产养殖总量的80%, 其中海水养殖量约占我国水产养殖总量的四成, 而贝类养殖在海水养殖中占比最高。近年来, 由于人们消费水平的提高, 水产品的需求量也随之上升, 许多野捕贝类的产量已经无法满足人们的需求。因此开展养殖新品种人工繁育技术研究显得尤为重要。中国也在这方面取得了不菲的成就, 先后成功突破了大竹蛏[1](Solen grandis)、管角螺(Hemifusus tuba)[2]等重要经济贝类的人工繁育技术。
疣荔枝螺(Thais clavigera Kuster)隶属腹足纲(Gastropoda)、新腹足目(Neogastropoda)、骨螺科(Muricidae), 为我国习见种, 中国沿海均有分布, 黄海、渤海数量较多。该种贝类生长速度快; 肉略显辣味, 俗称“辣螺”。因其肉有“辣味”和特殊的口感, 加之营养丰富, 广受人们的喜爱。随着人们对疣荔枝螺消费量的增加, 采捕强度连年增强, 致使疣荔枝螺资源量锐减, 目前已经难以满足市场的巨大需求, 价格也随之飞涨。价格的攀升更刺激人们加大了捕捞强度, 使得疣荔枝螺资源呈现枯竭态势。针对疣荔枝螺资源与市场需求间的矛盾, 为补充疣荔枝螺的苗种资源, 有必要开展疣荔枝螺规模化人工繁育和增养殖技术研究。目前国内外对疣荔枝螺的研究内容主要集中在其生态习性[3-4]、营养药用价值[5-6]、性畸变[7-8]和染色体分析[9]等方面, 未见有关苗种繁育方面的报道。本实验主要开展了疣荔枝螺室内人工繁育方面的研究, 以期为疣荔枝螺资源修复及人工增养殖产业化提供理论及技术支持。
1 材料与方法 1.1 实验条件实验在青岛城阳区一处贝类育苗车间进行, 育苗池长宽高为2 m×6 m×1 m。单胞藻饵料品种包括纤细角毛藻(Chaetoceros gracilis)、湛江等鞭金藻(Isochrysis zhanjiangensis)、亚心形扁藻(Platymonas subcordiformis)、小球藻(Chlorella vulgaris)和光合细菌等, 单胞藻饵料在水泥池和白色塑料桶内培养; 代用饵料包括盐藻粉和螺旋藻粉。育苗用水经沉淀池沉淀24 h后, 再通过砂滤池过滤2次后使用。充气设施主要包括罗茨鼓风机、送风管、充气软管和气石; 在培育池内平均每2 m2布设一个气石。室内光照强度控制在1 000~1 500 lx, 培育用海水盐度为30~33, 水温为27~30 ℃, pH值为7.6~8.4。
1.2 亲螺来源与运输亲螺于2017年7月采自青岛和烟台海区, 共进亲螺20 kg; 其中, 10 kg亲螺用于摄食喜好选择实验, 另10 kg亲螺用于繁育实验。个体平均体重为10.1 g, 壳高38.28 mm, 壳宽21.33 mm。采用低温干运方法将亲螺运送到实验场地。
1.3 亲螺培育 1.3.1 亲螺蓄养亲螺经洗刷和消毒等处理后, 放入培育篮中, 在培育池中用砂滤海水进行蓄养。
培育篮为自制的镂空塑料篮, 形状为长方体, 长宽高为30 cm×20 cm×10 cm, 培育篮六面开有方形的小孔与外界相通, 小孔直径小于螺体壳宽。培育篮通过吊绳悬吊在浮漂下方; 为保障水体环境相对稳定, 通过调整浮漂吊绳的长度, 使培育篮悬挂于培育池的中间水层。
每篮放亲螺1~2 kg, 约100~200只/篮。
每天16: 00投喂鲜活的菲律宾蛤仔(Ruditapes philippinarum)和四角蛤蜊(Mactra veneriformis)等活体贝类。投喂前, 先检查残饵情况, 清除摄食后残留的贝壳及死亡的亲螺。
在亲螺蓄养期间, 培育池水深控制在80 cm左右。日换水量为池水的30%~40%, 每4 d换池一次。
1.3.2 亲螺摄食喜好选择实验在亲螺培育过程中, 开展亲螺对不同饵料种类的摄食喜好选择实验。
饵料种类选取市面上常见的菲律宾蛤仔、四角蛤蜊、缢蛏(Sinonovacula constricta)、中国蛤蜊(Mactra chinensis)、文蛤(Meretrix meretrix)、长牡蛎(Crassostrea gigas)和青蛤(Cyclina sinensis)等活体贝类。
实验亲螺共10 kg。以上述活体贝类为饵料, 采取混合投喂的方式, 每种饵料的投喂量皆为150 g, 每次实验的时间为24 h, 重复3次。
每次实验于亲螺连续摄食24 h后, 统计疣荔枝螺亲螺摄食情况。分别称量各种饵料投喂前的初始质量、剩余质量及死亡质量, 三者差值即为亲螺当次实验的摄食质量。其中, 剩余质量为剩余活体饵料的整体质量(包括贝壳质量和软体部质量), 摄食质量为被摄食个体的整体质量, 死亡质量为死亡个体的整体质量。
实验重复3次, 最后取3次的平均值进行统计分析。
1.4 亲螺产卵与孵化采集亲螺卵囊的附着基为培育篮和篮内放置的波纹板。在采集卵囊的过程中, 观察卵囊的颜色; 定期取样测量卵囊大小, 统计每个卵簇内卵囊的数量, 观察统计每个卵囊内受精卵数量。
将附着有卵囊的培育篮和波纹板, 用砂滤海水冲洗干净后, 移入孵化池中孵化。孵化期间, 保持孵化池水位在85~90 cm。每天换水1次, 换水量为水体的1/3。孵化用海水盐度为30~33, 水温为27~29℃。
1.5 幼虫培育与采苗待卵囊孵化出足够量的幼虫后, 将培育篮和波纹板转移到新的孵化池继续孵化。把孵化完毕的孵化池内的幼虫进行选优, 把选优收集的幼虫放到培育池开始幼虫培育。
幼虫培育密度控制在0.2~0.3个/mL。在培育期间, 每天换水2次, 每次换水1/3。
幼虫饵料种类为金藻、扁藻和光合细菌等生物饵料, 每天添加盐藻粉和螺旋藻粉等代用饵料; 采取混合投喂的方式培育。
每天7: 00、15: 00和23: 00各投喂一次, 根据残饵、水色及镜检幼虫肠胃内含物多少进行调整具体投喂量, 一般绝大多数的幼虫满胃即可。
每天用显微镜观察记录幼虫生长情况。
幼虫经过12 d左右的生长, 幼虫壳长平均约600 μm, 有3/4发育至三螺层幼虫初期, 此时幼虫面盘持续增大并拉长。17 d左右, 幼虫单个面盘长度超过体宽, 并且出现亲壁和上浮现象, 此时陆续开始投放附着基。并开展不同附着基附苗效果实验、不同饵料和光照对幼虫诱导附着变态作用的影响实验和不同饵料对幼虫变态的影响效果实验。
1.5.1 幼虫对附着基选择及采苗效果实验实验用附着基分为光板波纹板(指没有附着任何生物和饵料的波纹板)、附着底栖硅藻的波纹板、光片栉孔扇贝贝壳串(指贝壳未固着牡蛎苗)、固着有牡蛎苗的栉孔扇贝贝壳串和固着有牡蛎苗的虾夷扇贝贝壳串。以上各组实验的幼虫培育密度均为0.2个/mL。实验中, 观察幼虫附着及采苗效果。
1.5.2 不同饵料和光照对幼虫诱导附着作用实验容器为70 L的白色聚乙烯桶; 共分6个实验组, 每个实验组包含两个平行组。实验材料选用的是即将变态的后期面盘幼虫。在不同光照条件下和投喂不同饵料情况下, 观察比较72 h内幼虫的附着变态率。对于强光照实验组, 光照昼夜变动范围为0~10 000 lx, 水温平均为29.9℃; 在低光照实验组, 光照昼夜变化范围为0~100 lx, 水温平均为29.7℃。投喂的饵料分别为糠虾和牡蛎肉榨取汁以及螺旋藻, 榨取汁和螺旋藻用300目筛绢过滤后投喂, 投喂1 h后换水80%, 然后各组均投入相同密度的金藻。每天早上8: 00和下午16: 00各投喂一次。糠虾和牡蛎肉的榨取汁系把糠虾和牡蛎肉用搅拌机打碎后再经300目筛绢过滤后制成。
1.5.3 不同饵料对幼虫变态的影响效果实验材料选择即将附着变态的后期面盘幼虫, 壳高平均为650~700 μm。实验容器为70 L的聚乙烯白桶。幼虫密度平均为0.2个/mL。每种饵料设三个平行组, 共9桶。投喂的饵料分别为糠虾和牡蛎榨取汁以及鲍鱼微颗粒饲料, 榨取汁和鲍鱼微颗粒饲料用200目筛绢过滤后投喂, 投喂1 h后换水80%, 然后各组均投入相同密度的金藻。每天早上8: 00和下午16: 00各投喂一次。观察稚螺的变态率。
1.6 稚螺培育投放附着基5~7 d后, 水体中的浮游幼虫转为匍匐生活; 在波纹板和贝壳上可以看到黑色稚螺, 此时进入稚螺培育阶段。
稚螺培育前期, 在稚螺个体小于1 mm时, 每天换水2次, 每次换水1/2, 每隔3 d换池一次。稚螺采用盐藻粉、蛋黄、糠虾榨取汁和新鲜蛤蜊肉榨取汁等作为饵料, 进行混合投喂。盐藻粉和蛋黄使用200目筛绢过滤后投喂; 糠虾和新鲜蛤蜊肉的榨取汁系把糠虾和新鲜蛤蜊肉用搅拌机打碎后再经200目筛绢过滤后制成。
当稚螺生长达到1 mm时, 用软毛刷将其轻轻从附着基上刷下, 池壁上的稚螺用水冲下后在排水口外用80目筛网收集, 将其转移到鲍鱼培育网箱内培育。此时, 每天将稚螺连同网箱倒入新的培育池。饵料为蛋黄、糠虾和蛤蜊肉榨取汁。
2 结果与分析 2.1 亲螺摄食喜好研究亲螺对缢蛏、菲律宾蛤蜊、四角蛤蜊、中国蛤蜊、文蛤、长牡蛎和青蛤等贝类的喜好选择结果见表 1。
| 实验项目 | 初始质量/g | 剩余质量/g | 死亡质量/g | 摄食质量/g |
| 缢蛏Sinonovacula constricta | 150.0 | 21.2±7.6 | 0.0±0.0 | 128.8±7.6 |
| 菲律宾蛤仔Ruditapes philippinarum | 150.0 | 118.8±23.2 | 3.1±4.3 | 28.1±20.2 |
| 四角蛤蜊Mactra veneriformis | 150.0 | 21.2±6.7 | 0.0±0.0 | 128.8±6.7 |
| 文蛤Meretrix meretrix | 150.0 | 113.4±26.4 | 0.0±0.0 | 36.6±26.4 |
| 长牡蛎Crassostrea gigas | 150.0 | 136.8±18.7 | 0.0±0.0 | 13.2±18.7 |
| 中国蛤蜊Mactra chinensis | 150.0 | 20.5±12.4 | 0.0±0.0 | 129.5±12.4 |
| 青蛤Cyclina sinensis | 150.0 | 148.3±2.5 | 0.0±0.0 | 1.7±2.5 |
由表 1可以看出, 疣荔枝螺较为喜欢摄食缢蛏、四角蛤蜊和中国蛤蜊, 而对于菲律宾蛤仔、文蛤和长牡蛎摄食较少, 青蛤则极少摄食。
2.2 亲螺培育与产卵经观察, 水温在24℃及以上时, 疣荔枝螺开始大规模产卵。
在培育池内, 亲螺交配后, 雌螺在附着基上产出淡黄色瓶状卵囊, 多个卵囊聚成卵簇。卵囊长4~8 mm, 直径为0.5~1.5 mm。
产卵过程中每个卵簇所含卵囊数目不同, 一个卵簇所含卵囊数最少为72个, 最多为538个, 平均每个卵簇有250个卵囊。每个卵囊的平均重量约为9.7 mg。
不同长度卵囊的怀卵量差异较大(具体见表 2)。卵囊怀卵量总体趋势为:卵囊越长, 其怀卵量越大。每个卵囊所含受精卵数最少为133粒, 最多为401粒, 平均每个卵囊含有247粒受精卵, 每个亲螺平均每次产卵量为61 750粒。
| 卵囊长度/mm | 4.5±0.2 | 5.0±0.2 | 5.5±0.2 | 6.0±0.2 | 6.5±0.2 | 7.0±0.2 | 7.5±0.2 | 8.0±0.2 |
| 受精卵数量 | 133±20 | 166±30 | 197±21 | 231±22 | 270±31 | 305±29 | 366±34 | 401±29 |
卵囊从产出到孵化, 其颜色由淡黄色逐渐变为黑色。在27℃水温下, 卵囊经过13 d左右孵出面盘幼虫, 面盘幼虫在水中营浮游生活。至此, 进入幼虫培育阶段。
2.3 疣荔枝螺个体发育过程幼虫从卵囊出膜后, 营浮游生活; 此后, 主要经历初期面盘幼虫、中期面盘幼虫、后期面盘幼虫和变态幼虫这四个时期。见表 3。
| 发育阶段 | 出膜后时间 | 幼虫大小/μm | 主要形态特征 |
| 初期面盘幼虫 | 1 d | 300~330 | 1个螺层, 具有两个椭圆形面盘 |
| 中期面盘幼虫 | 3~5 d | 370~430 | 2个螺层, 面盘增大呈蝶形 |
| 后期面盘幼虫 | 8~15 d | 470~600 | 3个螺层, 面盘继续增大, 并且拉长, 依然呈蝶形, 面盘腹足皆可运动 |
| 变态幼虫 | 16~25 d | 800~1 000 | 开始沉底附着, 幼虫存在面盘且逐渐退化, 但只用腹足运动 |
| 稚螺 | 25 d+ | 1 000+ | 3螺层, 底栖生活, 吸附力强 |
由表 3可知, 浮游幼虫在水温27~28℃条件下, 浮游期为15~20 d, 变态期为10~15 d。附着后的疣荔枝螺稚螺有3个螺层, 刚完成变态稚螺的壳高约为1 000 μm。此时, 稚螺习性与成螺完全一致, 营底栖生活, 为肉食性螺类。
疣荔枝螺胚胎及幼虫和稚螺发育全过程见图 1。
 |
| 图 1 疣荔枝螺卵、胚胎和幼虫的形态 Fig. 1 The morphology of eggs, embryos and larvae of Thais clavigera Kuster 注: a.卵囊; b.受精卵; c.排出极体; d.胚盘形成; e. 2细胞期; f. 4细胞期; g. 8细胞期; h. 16细胞期; i. 32细胞期; j.多细胞期; k.囊胚期; l.原肠期; m~n.膜内担轮幼虫期; o~q.膜内面盘幼虫; r.孵出幼虫后的卵囊; s.前期面盘幼虫; t.后期面盘幼虫; u.后期面盘幼虫(变态期幼虫) v.稚螺 |
疣荔枝螺浮游时期幼虫壳长生长情况见图 2。从图 2可知, 幼虫在第1~5 d时生长缓慢; 但随后第6 d开始, 幼虫生长进入快速生长期, 并一直持续到第20 d。在整个幼虫浮游时期, 壳长平均每天生长16.35 μm, 其中在1螺层生长到2螺层期间壳长生长最慢, 平均每天生长6.67 μm; 2螺层后期生长速度最快, 平均每天生长33.67 μm。
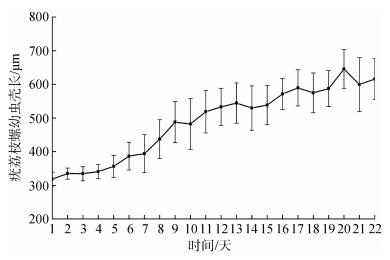 |
| 图 2 浮游期幼虫壳长生长(27~28℃) Fig. 2 Larval shell lengths over time during planktonic period (27~28℃) |
幼虫对附着基选择及采苗效果实验结果见表 4。
| 附苗器材 | 幼虫 数量/k |
采苗 数量/k |
平均采苗率/% |
| 光板波纹板 | 1 000 | 80 | 8 |
| 附着底栖硅藻波纹板 | 1 250 | 350 | 28 |
| 光片栉孔扇贝贝壳串 | 2 000 | 100 | 5 |
| 固着牡蛎苗的栉孔扇贝贝壳串 | 4 000 | 1 000 | 25 |
| 固着牡蛎苗的虾夷扇贝贝壳串 | 500 | 50 | 10 |
由表 4可以看出, 固着底栖硅藻的波纹板采苗率最高, 为28%;其次是固着有牡蛎苗的栉孔扇贝贝壳串, 为25%;光片栉孔扇贝贝壳串采苗效果最差。
2.6 不同饵料和光照对幼虫诱导附着作用不同饵料和光照对幼虫诱导附着作用实验结果见表 5。
| 条件 | 强光照条件附着率/% | 低光照条件附着率/% | |||||
| 时间 | 24 h | 48 h | 72 h | 24 h | 48 h | 72 h | |
| 糠虾肉 | 21.7 ± 6.2 | 36.7 ± 10.2 | 43.3 ± 8.5 | 0.0 ± 0.0 | 0.0 ± 0.0 | 6.6 ± 7.1 | |
| 牡蛎肉 | 10 ± 4.1 | 20 ± 7.1 | 28.3 ± 6.2 | 0.0 ± 0.0 | 0.0 ± 0.0 | 4.3 ± 0.9 | |
| 螺旋藻 | 1.7 ± 0.9 | 3.0 ± 1.4 | 5.0 ± 0.8 | 0.0 ± 0.0 | 0.0 ± 0.0 | 3.6 ± 0.9 | |
由表 5可见, 在强光照环境下, 同时间段幼虫的整体附着率好于低光照环境。在强光照和低光照环境下, 三种饵料对于幼虫诱导附着效果的顺序一致, 皆为糠虾榨取汁 > 牡蛎肉榨取汁 > 螺旋藻。各组幼虫存活率均大于95%。
由于螺旋藻对幼虫诱导附着变态的效果较差, 因此, 在后续的相关实验中, 不再使用螺旋藻, 而改用鲍鱼微颗粒饲料(30~40 μm球状颗粒饲料)。
2.7 不同饵料对幼虫变态率的影响效果在强光照条件下, 开展不同饵料对幼虫变态影响效果实验。结果见表 6。
| 饵料 | 糠虾榨取汁 | 牡蛎肉榨取汁 | 鲍鱼微颗粒饲料 |
| 变态率/% | 52.3 ± 8.8 | 31.3 ± 3.4 | 65.0 ± 4.1 |
由表 6可知, 实验选取的三种饵料对疣荔枝螺幼虫变态率作用从大到小的顺序依次为:鲍鱼微颗粒饲料、糠虾榨取汁和牡蛎肉榨取汁。
2.8 人工育苗情况2017年, 实验育苗水体为72 m3, 共孵化初期面盘幼虫2 470万只, 后期面盘幼虫988万只, 培育出壳高1 mm以上大小的稚螺约140万只。
3 讨论 3.1 疣荔枝螺繁殖力繁殖力是表示动物生殖机能的强弱和生育后代的能力, 亦称生殖力; 由一系列生理现象和许多性能指标构成, 其中排卵量是很重要的一个指标[10]。魏利平[11]{魏利平, 1999 #66;魏利平, 1999 #66}等报道脉红螺平均每个卵囊长度为18 mm, 其所含受精卵数量平均为1 149粒, 每个亲螺每次产卵量约为75.4万粒, 卵囊内所含受精卵数目与卵囊长度有很大差异。相比较而言, 疣荔枝螺个体比脉红螺小许多, 卵囊较小, 卵囊平均长度为5.95 mm, 每只亲螺每次怀卵量为6万余粒。由此推测, 亲螺卵囊长度和怀卵量与个体大小存在一定关系, 而且, 亲螺个体越大, 产出的卵囊越长, 怀卵量越高。
3.2 疣荔枝螺幼虫生长速度疣荔枝螺面盘幼虫刚从卵囊孵出后, 壳长为300 μm左右, 与已有报道的脉红螺(Rapana venosa)[12]和瘤荔枝螺(Thais bronni)[13]相似, 但是三者之间在变态幼虫壳长及刚完成变态的稚螺的壳长差异明显。疣荔枝螺幼虫变态时壳长最小, 约为600 μm; 瘤荔枝螺的较大, 约为900 μm; 脉红螺变态幼虫的壳长最大, 约为1 200 μm。这表明幼虫变态时的大小可能与成螺大小间具有一定的关系; 对于成螺较大的品种, 幼虫变态时壳长较大。但这种关系对方斑东风螺(Babylonia areolata)[14]来说则刚好相反, 即刚孵出幼虫的壳长及变态幼虫的壳长均大于脉红螺, 但方斑东风螺的成螺个体远小于脉红螺。关于幼虫变态时的大小与成螺大小间是否具有相关关系, 有待进一步研究。
疣荔枝螺浮游幼虫在27~29 ℃水温条件下, 壳长日生长约为16 μm, 约浮游生活20 d后开始附着变态, 比瘤荔枝螺和脉红螺都要快, 这可能与培育条件和种间差异存在一定关系。
从图 2看出, 20 d后幼虫壳长的测量结果变小; 其原因可能由于此时绝大部分较大个体幼虫已经附着到附着基上, 取样测量的样本主要为生长较慢个体所致。
3.3 疣荔枝螺变态期幼虫对附着基的选择性实验表明, 疣荔枝螺变态期幼虫对附着基的选择具有明显的倾向性; 附有底栖硅藻的波纹板和固着有牡蛎苗的栉孔扇贝壳上附着的幼虫数量明显多于其他附着基。刘晓赫等[15]在研究脉红螺室内人工育苗技术时, 同样发现附着底栖硅藻的波纹板采苗效果明显好于普通波纹板。这可能是由于附着基上的饵料对幼虫附着具有一定的诱导作用。
除了饵料因素以外, 附着基的材质和附着基形态结构对采苗效果可能也有一定的影响。陈坚等[16]在青蛤人工育苗附着基的选择中发现黄沙、海泥和水泥墙壁这三者中海泥更适合青蛤附着; 沈永龙等[17]在研究不同孵化方式、培育密度和附着基对瘤背石磺(Onchidium struma)人工繁育的影响时, 指出大孔径的海绵组的幼虫附着效果和存活率高于小孔径海绵组。
因此, 在疣荔枝螺苗种培育过程中, 选择合适的附着基是提高稚螺产量的重要措施。而且, 对于特定的附着基, 其上提前采集底栖硅藻或固着一定数量的牡蛎苗, 对于提高稚螺附着量以及满足变态稚螺的摄食具有重要意义。
3.4 光照环境及饵料种类对幼虫变态影响在水产动物育苗过程中, 光照条件[18-19]和饵料种类[20-21]是生产的重要管理环节。在本实验中, 相同饵料条件下, 强光照条件的幼虫附着率和变态率都明显高于低光照条件的情况; 相同光照条件下, 糠虾碎屑对幼虫附着变态效果较好。
本实验结果与方斑东风螺的类似研究结果相似, 如魏永杰等[22]发现在0~10 000 lx光照强度范围内, 方斑东风螺幼体摄食率随光照强度增强而升高。但本实验有关光照条件对幼虫变态影响的结果与有些贝类苗种繁育的研究结果存在一定差异, 如劳赞等[23]研究珠母贝人工繁育优化技术时指出, 强光不利于幼虫的变态和稚贝的存活; 严正凛[24]在研究光照强度对九孔鲍(Haliotis diversicolor)幼虫及幼鲍生长存活的影响时发现, 高温长光照下, 光照强度高时幼鲍存活率显著下降; 缪志前等[25]发现缢蛏稚贝生长过程中最适的光照强度为380±145 lx, 高于或低于此光照范围, 稚贝生长都会受到抑制。这些差异可能是由于种间差异造成的, 有待进一步研究。
在投喂不同饵料情况下, 疣荔枝螺幼虫变态率有明显的差异。与投喂糠虾和牡蛎肉相比, 投喂螺旋藻饵料时幼虫的变态率较低; 这可能是由于动物性蛋白在幼虫的变态生长过程中具有不可或缺的作用。脉红螺同样具有食性转换特征, 杨智鹏等[26]认为在变态期间适当的投喂一些动物性饵料可以帮助幼虫更好的变态。在饵料对稚螺变态作用实验中, 投喂鲍鱼微颗粒饲料时成螺率最高。可能由于该商品饲料中含有鱼粉和诱食剂成分, 且营养成分比单一饵料更加均衡。因此, 在疣荔枝螺苗种培育过程中, 可以采用混合投喂的方式, 丰富和强化幼虫的营养, 对提高幼虫变态率和稚螺成活率具有重要意义。
此外, 饵料蛋白质的结构、形态和物理特性等可能与肉食性螺类的消化率存在一定关系。柯才焕等[27]研究发现, 波部东风螺(Babylonia formosae habei)对于菲律宾蛤仔肉、罗非鱼肉、枪乌贼肉等5种饵料的蛋白消化率较高, 而对虾肉蛋白消化率低。在生产实践中发现, 疣荔枝螺对于动物性饵料的摄入具有较强的选择性, 其主要摄食种类为甲壳类和贝类; 其原因可能跟这些饵料对疣荔枝螺具有较好的诱食性有关。有关疣荔枝螺对甲壳类和贝类蛋白的消化率有待进一步研究。
4 结论本实验研究了室内条件下疣荔枝螺的人工繁育技术, 获得了疣荔枝螺繁殖生物学等方面研究结果, 探明了幼虫生长发育的规律, 开展了幼虫可口饵料的研究, 解决了稚螺食性转化的技术瓶颈, 筛选出稚螺的适口饵料。期望本研究结果为今后疣荔枝螺规模化繁育提供重要的理论和技术支持。
| [1] |
任福海. 大竹蛏人工繁育与中间育成技术[J]. 河北渔业, 2018(1): 41-42. Ren Fuhai. Artificial breeding and intermediate breeding technology of Solen grandis[J]. Hebei Fisheries, 2018(1): 41-42. DOI:10.3969/j.issn.1004-6755.2018.01.012 |
| [2] |
潘英, 王强哲, 庞有萍, 等. 管角螺全人工育苗试验[J]. 水产科技情报, 2007, 34(2): 84-85. Pan Ying, Wang Qiangzhe, Pang Youping, et al. Experiments on artificial seedling raising of Hemi fusus tuba[J]. Fishery Science and Technology Information, 2007, 34(2): 84-85. DOI:10.3969/j.issn.1001-1994.2007.02.008 |
| [3] |
樊甄姣, 吕振明, 吴常文, 等. 温度、盐度和pH值对疣荔枝螺耗氧率的影响[J]. 河北渔业, 2009(2): 5-6. Fan Zhenhuan, Lü Zhenming, Wu Changwen, et al. Effects of temperature, salinity and pH value on oxygen consumption rate of Thais clavigera Kuster[J]. Hebei Fisheries, 2009(2): 5-6. DOI:10.3969/j.issn.1004-6755.2009.02.002 |
| [4] |
Lau D C P, Leung K M Y. Feeding physiology of the carnivorous gastropod Thais clavigera Kuster:do they eat "soup"?[J]. Journal of Experimental Marine Biology & Ecology, 2004, 312(1): 43-66. |
| [5] |
朱爱意, 谢佳彦, 杨运琪, 等. 舟山东极岛潮间带两种荔枝螺的营养成分分析[J]. 海洋学研究, 2008, 26(1): 80-84. Zhu Aiyi, Xie Jiayan, Yang Yunqi, et al. Nutrient analysis of two Thais clavigera Kuster in the intertidal zone of the polar island of Dongji, Zhoushan[J]. Marine Research, 2008, 26(1): 80-84. DOI:10.3969/j.issn.1001-909X.2008.01.012 |
| [6] |
张芳, 杨善军, 王昭凯, 等. 海洋疣荔枝螺体外抗肿瘤活性[J]. 应用海洋学学报, 2017, 36(1): 103-110. Zhang Fang, Yang Shanjun, Wang Zhaokai, et al. Antitumor activity in vitro of marine wart Thais clavigera Kuster[J]. Journal of Applied Oceanology, 2017, 36(1): 103-110. DOI:10.3969/J.ISSN.2095-4972.2017.01.013 |
| [7] |
Shim W J, Kahng S H, Hong S H, et al. Imposex in the rock shell, Thais clavigera, as evidence of organotin contamination in the marine environment of Korea[J]. Marine Environmental Research, 49(5): 435-451. DOI:10.1016/S0141-1136(99)00084-7 |
| [8] |
Horiguchi T, Nishikawa T, Ohta Y, et al. Retinoid X receptor gene expression and protein content in tissues of the rock shell Thais clavigera[J]. Aquatic Toxicology, 84(3): 379-388. DOI:10.1016/j.aquatox.2007.06.019 |
| [9] |
管云雁, 韩雅莉. 两种荔枝螺染色体核型以及性畸变个体染色体研究[J]. 海洋环境科学, 2004, 23(3): 21-23. Guan Yunyan, Han Yali. Studies on the chromosome karyotypes of two Thais clavigera Kuster and individual chromosomes of sexual aberrations[J]. Marine Environmental Science, 2004, 23(3): 21-23. DOI:10.3969/j.issn.1007-6336.2004.03.006 |
| [10] |
普通动物学(第三版)[M].北京: 高等教育出版社, 1997: 663-664. General Zoology (Third Edition)[M]. Beijing: Higher Education Press, 1997: 663-664. |
| [11] |
魏利平, 王宝钢. 脉红螺繁殖生物学的研究[J]. 水产学报, 1999(2): 150-155. Wei Liping, Wang Baogang. Study on Reproductive Biology of Rapana venosa[J]. Journal of Fisheries of China, 1999(2): 150-155. |
| [12] |
杨大佐, 周一兵, 管兆成, 等. 脉红螺工厂化人工育苗试验[J]. 水产科学, 2007, 26(4): 237-239. Yang Dazuo, Zhou Yibing, Guan Zhaocheng, et al. Experiment on the factory artificial breeding of Rapana venosa[J]. Fisheries Science, 2007, 26(4): 237-239. DOI:10.3969/j.issn.1003-1111.2007.04.013 |
| [13] |
顾忠旗, 田传远, 倪梦麟, 等. 瘤荔枝螺人工繁育技术研究[J]. 科学养鱼, 2016(7): 8-10. Gu Zhongqi, Tian Chuanyuan, Ni Menglin, et al. Research on artificial breeding technology of Thais bronni[J]. Scientific Fish Farming, 2016(7): 8-10. |
| [14] |
黄瑞, 黄标武, 汤文杰, 等. 方斑东风螺早期发育阶段形态的观察[J]. 应用海洋学学报, 2010, 29(3): 380-388. Huang Rui, Huang Biaowu, Tang Wenjie, et al. Observation of morphology of the early development stages of Babylonia areolata[J]. Journal of Applied Oceanology, 2010, 29(3): 380-388. DOI:10.3969/J.ISSN.1000-8160.2010.03.012 |
| [15] |
刘晓赫, 于瑞海, 李琪, 等. 脉红螺(Rapana venosa (Valenciennes))室内人工育苗技术的研究[J]. 海洋湖沼通报, 2015(2): 68-74. Liu Xiaohe, Yu Ruihai, Li Qi, et al. Research on indoor artificial seedling technology of Rapana venosa (Valenciennes)[J]. Journal of Oceanology and Limnology, 2015(2): 68-74. |
| [16] |
陈坚, 杨星星, 柯爱英, 等. 青蛤人工育苗中附着基的选择[J]. 上海海洋大学学报, 2006, 15(1): 114-117. Chen Jian, Yang Xingxing, Ke Aiying, et al. Selection of attachment groups in artificial clam seedlings of Cyclina sinensis[J]. Journal of Shanghai Ocean University, 2006, 15(1): 114-117. DOI:10.3969/j.issn.1004-7271.2006.01.021 |
| [17] |
沈永龙, 黄金田, 戈贤平, 等. 不同孵化方式、培育密度和附着基对瘤背石磺人工繁育的影响[J]. 海洋科学, 2013, 37(3): 109-116. Shen Yonglong, Huang jintian, Ge Xianping, et al. Effects of different incubation methods, cultivation densities and attachment bases on the artificial breeding of Onchidium verruculatum[J]. Marine Sciences, 2013, 37(3): 109-116. |
| [18] |
Anderson N H. Depressant effect of moonlight on activity of aquatic insects[J]. Nature, 1966, 209(5020): 319-320. DOI:10.1038/209319a0 |
| [19] |
Villamizar N, Blancovives B, Migaud H, et al. Effects of light during early larval development of some aquacultured teleosts:A review[J]. Aquaculture, 2011, 315(1): 86-94. |
| [20] |
Alós J, Arlinghaus R, Palmer M, et al. The influence of type of natural bait on fish catches and hooking location in a mixed-species marine recreational fishery, with implications for management[J]. Fisheries Research, 2009, 97(3): 270-277. DOI:10.1016/j.fishres.2009.03.003 |
| [21] |
Arterburn J E, Berry C R. Effect of hook style, bait type, and river location on trotline catches of Flathead and Channel Catfish[J]. North American Journal of Fisheries Management, 2002, 22(2): 573-578. DOI:10.1577/1548-8675(2002)022<0573:EOHSBT>2.0.CO;2 |
| [22] |
魏永杰, 曾臻.光照条件对方斑东风螺幼体活力和摄食的影响[C].//中国动物学会、中国海洋湖沼学会贝类学分会第八次会员代表大会暨第十三次全国贝类学术讨论会论文摘要集.中国动物学会、中国海洋湖沼学会贝类学分会: 中国海洋湖沼学会, 2007: 36. Wei Yongjie, Zeng Zhen. Effects of light conditions on the viability and feeding of Babylonia areolata[C]. The eighth member congress of the Chinese Zoological Society, the Chinese Society of Marine Limnology and Shellfish Branch and the 13th National Symposium Abstract Paper Collection.Chinese Zoological Society, Chinese Marine Limnology Society Shellfish Branch: China Marine Limnology Society, 2007: 36. |
| [23] |
劳赞, 黄海立, 符韶, 等. 珠母贝人工繁育优化技术的研究[J]. 海洋科学, 2009, 33(10): 31-35. Lao Zan, Huang Haili, Fu Shao, et al. Research on optimization technology of artificial breeding of Pinctada martensi[J]. Marine Sciences, 2009, 33(10): 31-35. |
| [24] |
严正凛. 光照强度对九孔鲍幼虫及幼鲍生长存活的影响[J]. 水产学报, 2001, 25(4): 336-341. Yan Zhenglin. Effect of light intensity on the growth and survival of the Haliotis diversicolor[J]. Journal of Fisheries of China, 2001, 25(4): 336-341. |
| [25] |
缪志前, 刘知欢, 徐继林, 等. 光照强度对缢蛏稚贝生长的影响[J]. 宁波大学学报(理工版), 2016, 29(2): 1-5. Miao Zhiqian, Liu Zhihuan, Xu Jilin, et al. Effects of light intensity on the growth of juvenile Sinonovacula constricta[J]. Journal of Ningbo University (Science and Technology Edition), 2016, 29(2): 1-5. |
| [26] |
杨智鹏, 于红, 于瑞海, 等. 脉红螺附着变态与食性转换的研究[J]. 水产学报, 2016, 40(9): 1472-1478. Yang Zhipeng, Yu Hong, Yu Ruihai, et al. Study on attachment metamorphism and food change of Rapana venosa[J]. Journal of Fisheries, 2016, 40(9): 1472-1478. |
| [27] |
柯才焕, 符艳, 汤鸿, 等. 波部台湾东风螺对饵料的摄食和饵料蛋白质的消化率[J]. 海洋科学, 1997, 21(5): 5-7. Ke Caihuan, Fu Yan, Tang Hong, et al. Feed intake and digestibility of bait proteins by Babylonia formosae habei in Taiwan[J]. Marine Science, 1997, 21(5): 5-7. |
 2020, Vol. 44
2020, Vol. 44

