文章信息
- 胡艺豪, 姜明玉, 曹文瑞, 萨仁高娃, 于心科, 常凤鸣. 2022.
- HU Yi-hao, JIANG Ming-yu, CAO Wen-rui, SAREN Gao-wa, YU Xin-ke, CHANG Feng-ming. 2022.
- 海洋微生物Paenisporosarcina quisquiliarum对Fe的生物矿化过程
- Biomineralization of Fe by the marine microorganism Paenisporosarcina quisquiliarum
- 海洋科学, 46(1): 1-9
- Marine Sciences, 46(1): 1-9.
- http://dx.doi.org/10.11759/hykx20210126002
-
文章历史
- 收稿日期:2021-01-26
- 修回日期:2021-03-10
2. 中国科学院海洋大科学研究中心, 山东 青岛 266071;
3. 中国科学院大学, 北京 100049
2. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
大洋铁锰结核是一种以Fe、Mn为主要金属元素的固体矿产资源, 广泛地分布在现代洋底[1]。铁锰结核由核心和围绕它的壳层组成, 主要矿物是含铁的水羟锰矿和非晶态的水羟铁矿, 其余主要是碎屑矿物[2]。作为一种极具开发潜力的海底矿产资源[3], 了解铁锰结核的成矿机制十分重要, 当前的研究认为, 生物矿化作用在铁锰结核的形成过程中贡献巨大[4-5]。由生物介导形成矿物沉淀的过程被称为生物矿化, 大多数生物矿物是碳酸钙、硅酸盐、氧化铁或硫化物[6]。微生物是一种十分活跃的地质营力, 通过生物矿化作用形成了大量的固体矿物以及矿床等[7-8]。最近的研究表明微生物对环境中铁、锰的迁移及沉淀起着极大作用[9-11], 参与到了氧化和沉淀游离态的Fe2+和Mn2+成为Fe-Mn氧化物或氢氧化物的过程中[12-13]。然而对于具体的大洋铁锰结核的生物矿化过程研究还不全面, 尤其是其成矿机理方面的研究。因此研究大洋微生物对Fe的生物矿化作用过程, 对认识大洋铁锰结核的形成过程有着重要意义。
目前对Fe的生物矿化实验研究主要集中在氧化亚铁硫杆菌(A. ferrooxidans)[14-15]、铁还原菌(iron reducing bacteria)[16-17]和趋磁细菌(magnetotactic bacteria)[18], 其中氧化亚铁硫杆菌在酸性环境中氧化Fe2+, 铁还原菌需要厌氧环境才能还原Fe3+, 而趋磁细菌通过其特殊的细胞器--磁小体生成磁铁矿。但是在大范围的中性含氧的海洋环境中, 对海洋微生物的生物矿化实验研究较少, 无法准确地认识海洋微生物在常见海洋环境中对Fe的生物矿化作用。此外, Fe作为海洋浮游生物的必需营养元素, 对全球初级生产力及C、N等多种元素的地球化学循环有着重要影响[19]。同时海洋微生物对游离态Fe2+的氧化在Fe2+与Fe3+的迁移转化过程中有重要意义[20]。因此研究普遍存在的海洋细菌对Fe的生物矿化过程, 对理解海洋中Fe2+的行为及其相关的生物地球化学过程有重要价值。
本文选取芽孢八叠球菌(Paenisporosarcina quisquiliarum)作为实验菌株, 为避免细菌培养基中的各种离子和营养物质可能对Fe矿化过程产生的影响[21], 使用从液体培养基中分离的细胞悬浮液, 在人工海水环境中与Fe2+进行Fe的生物矿化实验, 以接近自然环境中的条件。芽孢八叠球菌是海洋中的普通菌, 分布广泛, 适应性强, 易于在实验室培养和实验, 反应现象也具有较好的普适性。通过实验室模拟实验, 对Fe的生物矿化过程进行研究, 进一步认识微生物在大洋铁锰结核形成过程中的作用。
1 材料与方法 1.1 实验材料实验中使用的芽孢八叠球菌(Paenisporosarcina quisquiliarum)由本实验室分离自冲绳海槽表层沉积物(表层4 cm, 水深1 193 m), 革兰氏阳性菌, 椭圆杆状, 大小约1.0~2.0 μm, 菌株16s RNA基因序列GenBank No.307800, 为此沉积物中的优势菌种。将冻存于−80 ℃冰箱中的菌种活化后接种到2216E液体培养基中培养富集(25 ℃、120 r/min、24 h)。2216E培养基组成为: 过滤后的天然海水中加入5 g/L蛋白胨, 1 g/L酵母提取物, pH调节至7.0。
由于溶液的pH值影响着Fe的溶解度、形态以及氧化还原电位[19], 为保持反应体系的pH值稳定, 实验选取不与Fe2+和其他阳离子络合的MOPS(3-吗啉丙磺酸)作为反应体系的缓冲液[22], 配方为: MOPS 0.5 mol/L, NaCl 0.6 mol/L, 配制完成后pH值调至6.5。经考察确定反应体系中的MOPS缓冲液浓度为30 mmol/L, 该浓度的MOPS缓冲液缓冲效果良好且对微生物活性无影响。反应使用的人工海水配方参考文献[23]。配制10 mmol/L的Fe2+标准溶液(FeCl2·4H2O, 麦克林公司, 纯度 > 99.95%), 配制时加入5%的抗坏血酸作为抗氧化剂。
1.2 实验方法实验设置有菌实验组、死菌对照组和无菌对照组同时进行。选取500 mL锥形瓶, 每瓶加入222 mL人工海水经高压蒸汽灭菌后备用。MOPS缓冲液和Fe2+标准溶液经过滤除菌后分别加入15 mL和30 mL至锥形瓶中。离心收集在2216E液体培养基中已培养好的芽孢八叠球菌(OD600= 0.8~1; 4 000 r/min离心10 min), 将收集的细菌用灭菌人工海水清洗3次后, 使用灭菌人工海水重悬为菌密度相同的6份菌液, 将其中3份菌液进行高压蒸汽灭菌。随后向锥形瓶中加入30 mL菌液, 设置为有菌实验组, 将加入死菌菌液的设为死菌对照组, 而只加入灭菌人工海水不含菌液的设置为空白对照组。分别抽取部分反应液通过分光光度计测定反应液中的菌密度。反应液中MOPS缓冲液浓度为30 mmol/L, Fe2+浓度为0.1 mmol/L。与微生物处理有关的实验操作均在无菌操作台中进行。
1.3 测试方法为了测定反应过程中Fe离子浓度的变化, 在不同反应时间间隔取样, 反应液经0.22 μm聚四氟乙烯滤膜过滤后, 采用磺基水杨酸(SSA)分光光度法测定反应液中Fe离子浓度。磺基水杨酸分光光度法能快速准确地同时测定反应液中Fe3+和总Fe的含量[24]。向待测溶液中加入10%磺基水杨酸, 在中性环境下磺基水杨酸能与Fe3+结合形成红色络合物, 再加入25%氨水后, 与Fe3+形成黄色络合物, 两者的最大吸光度波长分别为500 nm和425 nm, 且吸光度与Fe离子浓度符合朗伯-比尔定律。在测定之前, 配置浓度为1×10–8~2×10–5 g/g的FeCl3标准溶液, 绘制该方法的标准曲线。吸光度与实验过程中溶液的菌密度(OD600)均使用UV-5500PC型分光光度计测定。
利用透射电镜(transmission electron microscope, TEM, Hitachi公司, HT7700)观察反应过程中细菌形态和矿物颗粒形态的变化。抽取不同反应时间的反应液离心(4 000 r/min, 10 min), 用超纯水洗涤3次后, 将重悬的菌液滴在铜网上, 待干燥后进行TEM观察。细胞表面和矿物颗粒的元素组成采用扫描电镜(Scanning Electron Microscope, SEM, Hitachi公司, S-3400N)结合能量色散X射线光谱法(EDS)测定。将稀释后的细菌悬浊液滴在样品台的碳胶带上, 干燥并镀膜后进行SEM-EDS分析, 工作电压为20 kV。
2 结果与讨论 2.1 磺基水杨酸分光光度法标准曲线向一系列已知浓度FeCl3标准溶液中加入10%磺基水杨酸溶液显色后, 运用分光光度计测定FeCl3标准溶液在500 nm处的吸光度, 再加入25%氨水显色, 测定其在425 nm处的吸光度, 以试剂空白作为参比溶液, 绘制该方法的标准曲线(图 1)。结果表明, 其相关系数R2分别为0.997和0.999, P值均小于0.000 1, 线性相关性较好, 满足测试要求。
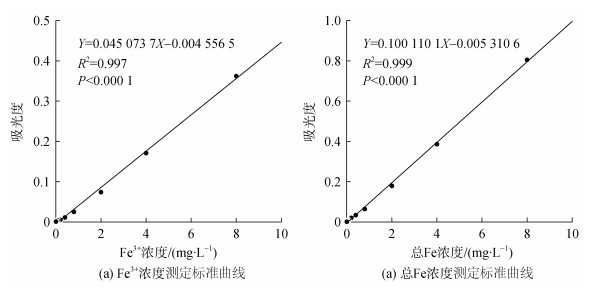 |
| 图 1 磺基水杨酸分光光度法标准曲线 Fig. 1 Standard curve of SSA spectrophotometry |
在芽孢八叠球菌与Fe生物矿化反应过程中, 采用磺基水杨酸分光光度法分别测定了有菌实验组、死菌对照组和无菌对照组的总Fe浓度、Fe2+浓度和Fe3+浓度的变化。图 2a-c分别显示了反应过程中, 总Fe浓度、Fe2+浓度和Fe3+浓度随时间的变化趋势。有菌实验组的总Fe浓度下降最快, 尤其是在前24 h, 反应72 h后, 体系中绝大多数Fe已反应完全。Fe2+浓度变化趋势与总Fe浓度变化趋势相似, 在前24 h浓度降低较快, 至72 h时反应体系中仅有极低浓度的Fe2+。同时, 体系中的Fe3+在反应开始约24 h后便全部沉淀。死菌对照组总Fe浓度在前12 h下降较快, 之后下降速率较为稳定, 反应96 h时, 体系中仍有浓度约为1 mg/L的Fe未反应。此外, Fe2+浓度变化趋势与总Fe浓度变化趋势相似, 在前12 h浓度下降较快, 96 h后反应体系中Fe2+浓度约为0.8 mg/L。死菌对照组中, Fe3+浓度变化与实验组相似, 在前24 h下降速率较快, 但其Fe3+浓度远高于有菌实验组, 随后下降速率明显降低, 72 h后稳定在0.35 mg/L左右。空白对照组中, 总Fe浓度缓慢降低, 反应96 h后总Fe浓度约为3 mg/L。空白对照组Fe2+浓度下降速率也较为稳定, 与总Fe浓度变化类似。而反应体系中的Fe3+浓度在0.4 mg/L左右浮动, 48 h后出现明显下降趋势。
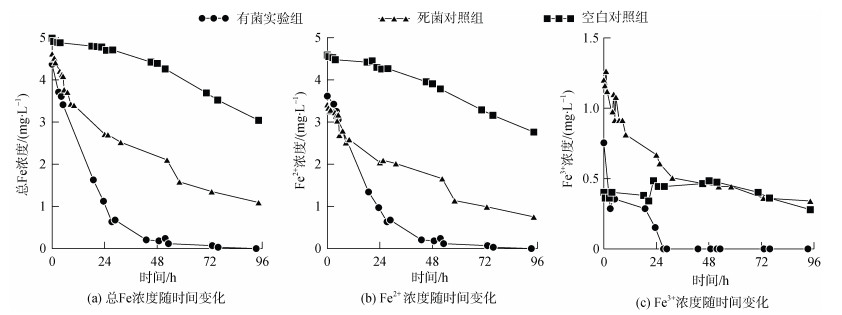 |
| 图 2 反应过程中总Fe浓度/Fe2+浓度/Fe3+浓度随时间变化图 Fig. 2 Time dependence of total Fe concentrations (a), Fe2+ concentrations (b), Fe3+ concentrations(c) |
通过分析反应过程中不同试验组的Fe浓度的变化, 显示出芽孢八叠球菌的生物矿化反应在前24 h最为迅速, 总Fe浓度、Fe2+浓度和Fe3+浓度均快速下降, 表明细菌的活动极大地促进了Fe2+氧化以及Fe3+沉淀。这可能与该菌的生物活性有关, 芽孢八叠球菌在5~24 h时处于对数生长期, 随后进入稳定期[25], 对数生长期的细菌量迅速增加, 细菌活性较强。此外, 与空白对照组相比较, 死菌对照组在前12 h反应速率较快, 推测可能是由于死菌的细胞物质为Fe成矿提供了的成核位点, 加速了Fe的吸附矿化。这一过程仅需要细菌贡献某些促进沉淀的活性位点, 而不要求细胞生命活动的作用。细菌细胞的胞外聚合物、细胞壁、外鞘以及其他有机物能够为环境中丰富的金属阳离子提供位点[26-27]。在这些位点上, Fe3+与带负电荷的聚合物结合, 或Fe2+与溶解的氧自发反应, 形成铁的氢氧化物沉淀[28-29]。反应24 h后, 死菌对照组中的反应速率下降, 其反应速率与空白对照组接近, 表明此后体系中的氧气对Fe氧化沉淀是导致Fe离子浓度下降的主要因素, 而在微生物作用下, 含有细菌的试验组会使得Fe离子浓度下降更快。
芽孢八叠球菌对Fe生物矿化反应过程包含了Fe3+沉淀与Fe2+氧化的过程, 其中Fe3+的沉淀过程以细菌提供丰富成矿位点等被动过程为主, 而Fe2+的氧化过程则代表了以细菌生命活动促进Fe2+氧化为主的主动过程, 包括细菌活动导致局部环境中pH值升高, 加速Fe2+氧化, 或者是产生某些特殊的Fe氧化酶等。为进一步分析生物矿化过程中, Fe3+沉淀和Fe2+氧化过程间的关系, 选取总Fe浓度、Fe2+浓度变化曲线进行分析。其中, 反应体系内总Fe浓度的降低体现了Fe3+的沉淀过程, Fe2+浓度的变化是Fe2+被氧化的结果, 而Fe3+浓度变化包含Fe3+沉淀与Fe2+氧化的共同作用。为分析反应过程中Fe3+沉淀和Fe2+氧化速率的变化, 使用多项式分别对总Fe浓度、Fe2+浓度-时间变化曲线进行拟合, 拟合的原则为: 在符合曲线变化趋势的前提下, 选取最小的多项式次数以防止发生过拟合。各曲线的拟合结果如表 1所示。将拟合的浓度-时间变化曲线对时间求一次导, 得到速率-时间变化函数, 为便于比较反应速率间的差异, 将导函数取相反数后绘制函数图像, 图 3反映了各反应体系中Fe3+沉淀和Fe2+氧化速率随时间的变化关系。我们发现有菌实验组Fe3+沉淀速率和Fe2+氧化速率最快, 且两者均随时间的增加而减慢。在前48 h, Fe3+沉淀速率一直高于Fe2+氧化速率, 导致在有菌实验组中Fe3+浓度在反应开始后迅速降低, 此时体系的反应速率由Fe2+氧化速率制约。48 h后, Fe3+沉淀速率和Fe2+氧化速率相等, 此时体系的反应速率限制于Fe3+沉淀速率。反应进行72 h后, Fe3+沉淀速率和Fe2+氧化速率约为0, 反应基本结束。这与图 2中显示的有菌实验组在前48 h快速反应, 72 h后反应基本结束的过程相一致。而死菌对照组中, Fe3+沉淀速率和Fe2+氧化速率的变化趋势在前24 h与有菌实验组类似, 随后变化趋势与空白对照组相似。同时, 不论是Fe3+沉淀速率, 还是Fe2+氧化速率都较有菌实验组有明显降低。这表明死亡细菌的细胞物质对Fe3+沉淀和Fe2+氧化都起到了明显的促进作用, 但由于这些细菌没有生物活性, 这种作用不仅强度不及有菌实验组, 而且仅能维持24 h左右。
| 组别 | 拟合结果 | 决定系数R2 |
| 有菌实验组总Fe浓度 | y = 0.034 4x4 – 0.484 5x3 + 2.449 3x2 – 5.353 2x + 4.396 1 | 0.998 |
| 有菌实验组Fe2+浓度 | y = 0.021 4x4 – 0.350 5x3 + 1.938 1x2 – 4.486 1x + 3.836 6 | 0.996 |
| 死菌对照组总Fe浓度 | y = –0.023 9x5 + 0.325 2x4 – 1.589 4x3 + 3.505x2 – 4.162 4x + 4.669 3 | 0.994 |
| 死菌对照组Fe2+浓度 | y = –0.018 7x5 + 0.255 7x4 – 1.236 3x3 + 2.629 4x2 – 2.980 6x + 3.458 3 | 0.981 |
| 空白对照组总Fe浓度 | y = 0.026 2x4 – 0.185 6x3 + 0.283 1x2–0.320 9x +4.940 5 | 0.999 |
| 空白对照组Fe2+浓度 | y = 0.013 3x4 – 0.079 8x3 + 0.045 9x2 – 0.214x + 4.554 7 | 0.997 |
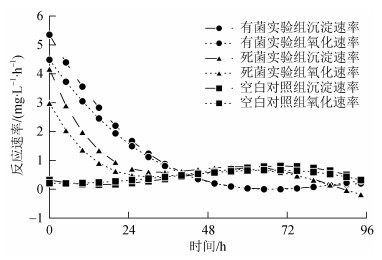 |
| 图 3 各组沉淀、反应速率随时间变化图 Fig. 3 Time dependence of reaction rate of each group |
芽孢八叠球菌与Fe进行生物矿化反应过程中, 细胞表面矿物形态的透射电镜图像如图 4所示。细菌大小约为1~2 μm, 呈杆状, 有鞭毛(图 4a)。对有菌实验组和死菌对照组进行间隔取样, 观察细菌表面矿物生成情况的变化。图 4a-e为有菌实验组分别反应0 h、5.5 h、9 h、27.5 h、73.5 h时的透射电镜图像。图 4f-g为死菌对照组在反应6.5 h和52.5 h时的生物矿物生成情况。图 4h为空白对照组反应52.5 h后的透射电镜图像。有菌实验组的透射电镜图片显示, 反应前后细菌形态没有明显的差异。随着反应时间的增长, 细菌表面有明显的矿物颗粒生成。反应5 h时, 生成的矿物颗粒较小, 且分布较为分散, 大部分颗粒大小在0.2 μm左右。此时细胞提供的成核位点大大地促进了Fe3+的沉淀, 这些较小的矿物颗粒首先在细菌细胞的两端发生沉淀, 这可能是由于细胞两端有着大量的官能团和聚集的蛋白质, 使得矿物沉淀优先发生在细胞的两端[30-31]。之后随着反应时间的增加, 矿物颗粒的大小进一步增大。反应进行至9 h时, 菌体表面的矿物颗粒明显增多, 同时大量的矿物颗粒聚集在一起生长在菌体的一端, 形成数微米的矿物颗粒。生物矿化反应进行至27.5 h时, 大部分菌体表面都有矿物颗粒分布, 代表着生物矿化作用的广泛发生, 但矿物颗粒大小较反应9 h时有所减小。而矿化反应开始73.5 h后, 菌体表面的矿物颗粒数量最少, 尺寸也较小, 约为0.2~0.3 μm。推测可能是由于生物活性降低导致矿化反应减缓, 同时前期生成的矿物逐渐从细菌表面脱落, 导致观察到的矿物颗粒较少。死菌对照组的透射电镜照片(图 4f-g)显示, 由于细菌细胞壁已被破坏, 死菌菌体边缘不清晰, 细胞形态大多不完整。菌体周围可见形状不规则的聚合物, 推测为菌体中的细胞物质。生物矿化反应开始6.5 h后, 死菌菌体表面的矿物颗粒极少。而反应52.5 h后, 菌体表面可见少量体积较大的矿物颗粒, 直径可达5 μm左右, 这些矿物在形态上与有菌实验组中的矿物颗粒有明显差异。与图 4b相比, 死菌对照组中的单个矿物较大且形成了直径数微米的矿物颗粒, 这与空白对照组(图 4h)反应52.5 h所形成沉淀物类似, 证明这是由于体系中氧气的存在而导致的Fe自发氧化沉淀。
 |
| 图 4 生物矿化过程中各组TEM照片 Fig. 4 TEM Photographs of each group |
图 5展示了芽孢八叠球菌在含0.1 mmol/L Fe2+的人工海水中矿化反应24 h后, 细菌菌体以及表面颗粒矿物形态的扫描电镜图片(SEM)和对应的能谱图片(EDS)。图中细菌密度较大, 这些杆状细菌直径约1 μm, 长度达数微米。此时细胞表面可以观察到尺寸不一的亮点, 这些亮点为导电程度更好的矿物颗粒。结合图 2和图 3中空白组中铁离子浓度的变化趋势, 显示矿化反应24 h时, Fe的自氧化沉淀极少, 因此这些矿物颗粒是生物矿化作用的产物。同时, 电镜照片中显示尺寸较大的矿物颗粒为大量较小颗粒聚集而成。对两标记处矿物颗粒进行了EDS分析, 结果显示, 主要的元素组成为C, O, P, S, K, Mg, Si, Al, Fe, 两处矿物颗粒的元素组成及相对含量大致相同。其中C, O, P, S, Si, K, Mg为微生物的基础元素或测试背景元素, Al来源于制样时使用的铝台, Fe则来源于生物矿化过程中Fe的富集作用。这表明芽孢八叠球菌菌体表面生成了含铁的矿物颗粒, 并推测其成分为Fe的氧化物或氢氧化物。
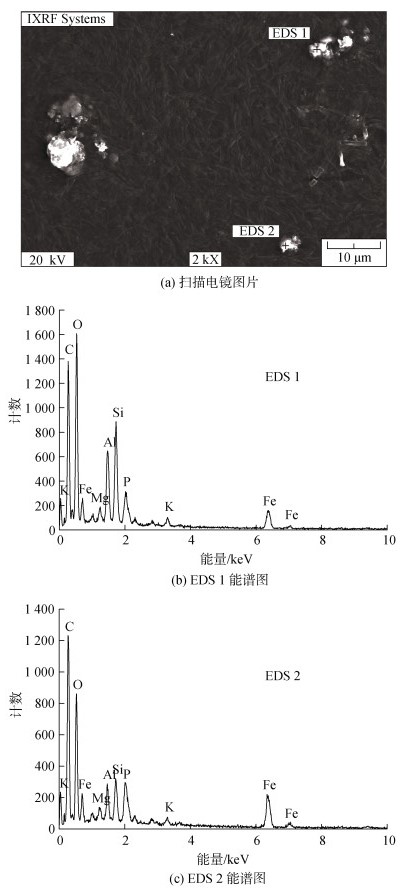 |
| 图 5 生物矿化反应24h时的SEM-EDS图 Fig. 5 SEM–EDS analysis after 24 hours' biomineralization |
在本研究中选取了芽孢八叠球菌(Paenisporosarcina quisquiliarum)这一海洋普通细菌, 通过开展实验室模拟实验, 研究了在中性有氧条件下, 海洋微生物对Fe的生物矿化的作用过程。芽孢八叠球菌对Fe的生物矿化作用应该与大多数的生物诱导矿化一样, 是一个主被动机制共同作用的过程[32]。虽然在整个体系中, 由于缓冲溶液的存在, pH值基本不变, 但是细菌的生命活动可以导致局部环境的pH值升高。其次, 细菌细胞表面存在着大量的带负电荷的结构, 如细胞壁、胞外聚合物、外鞘以及各种功能的蛋白质。这些结构对体系中的金属阳离子起到了很好的吸附作用, 使得细胞周围的Fe离子浓度上升。此外, 部分细菌可以通过酶的作用, 使得某些金属离子发生氧化或者还原, 而本实验中的芽孢八叠球菌是否也具有这样的能力有待进一步的研究。在细菌的作用下, 在细胞的周围形成了一个高pH值, 高Fe离子浓度的环境, 在氧气的参与下, 这种环境十分有利于Fe的氢氧化物沉淀的生成。同时, 细胞又提供了大量的结晶成核位点, 大量Fe的矿物在细胞表面生成。
该研究表明, 在中性有氧环境中, 微生物活动导致Fe的生物矿化是一个广泛发生的过程, 并观察了反应中Fe2+氧化速率与Fe3+沉淀速率的动态平衡过程, 为微生物在大洋铁锰结核形成过程中的作用提供了理论依据, 并进一步揭示了海洋微生物在大洋金属矿物形成过程中的意义。同时此研究对进一步研究海洋微生物矿化形成的生物矿物的特征和环境指示意义有促进作用, 有利于揭示大洋多金属结核生长的环境特征, 并期待在大洋资源勘探及利用方面发挥积极作用。
| [1] |
姜明玉, 胡艺豪, 于心科, 等. 大洋铁锰结核的微生物成矿过程及其研究进展[J]. 海洋科学, 2020, 44(7): 156-164. JIANG Mingyu, HU Yihao, YU Xinke, et al. Advances in research on biological mineralization process of marine ferromanganese nodules[J]. Marine Sciences, 2020, 44(7): 156-164. |
| [2] |
HEIN J R, MIZELL K, KOSCHINSKY A, et al. Deep-ocean mineral deposits as a source of critical metals for high- and green- technology applications: Comparison with land-based resources[J]. Ore Geology Reviews, 2013, 51: 1-14. DOI:10.1016/j.oregeorev.2012.12.001 |
| [3] |
徐兆凯. 东菲律宾海铁锰结壳(核)成因与古海洋环境响应[D]. 青岛: 中国科学院海洋研究所, 2007. XU Zhaokai. Origin and paleoceanographic environment response of ferromanganese crusts (nodules) in the East Philippine Sea[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2007. |
| [4] |
BURTON E D, HOCKMANN K, KARIMIAN N, et al. Antimony mobility in reducing environments: The effect of microbial iron(Ⅲ)-reduction and associated secondary mineralization[J]. Geochimica et Cosmochimica Acta, 2019, 245: 278-289. DOI:10.1016/j.gca.2018.11.005 |
| [5] |
JIANG X D, SUN X M, GUAN Y, et al. Biomineralisation of the ferromanganese crusts in the Western Pacific Ocean[J]. Journal of Asian Earth Sciences, 2017, 136: 58-67. DOI:10.1016/j.jseaes.2017.01.025 |
| [6] |
FRANKEL R B, BAZYLINSKI D A. Biologically induced mineralization by bacteria[J]. Reviews in mineralogy and geochemistry, 2003, 54(1): 95-114. DOI:10.2113/0540095 |
| [7] |
JIANG M Y, OHNUKI T, TANAKA K, et al. Post-adsorption process of Yb phosphate nano-particle formation by Saccharomyces cerevisiae[J]. Geochimica et Cosmochimica Acta, 2012, 93: 30-46. DOI:10.1016/j.gca.2012.06.016 |
| [8] |
JIANG M Y, OHNUKI T, UTSUNOMIYA S. Biomineralization of middle rare earth element Samarium in yeast and bacteria systems[J]. Geomicrobiology Journal, 2018, 35(5): 375-384. DOI:10.1080/01490451.2017.1377320 |
| [9] |
BLÖTHE M, WEGORZEWSKI A, MÜ LLER C, et al. Manganese-cycling microbial communities inside deep-sea manganese nodules[J]. Environmental science & technology, 2015, 49(13): 7692-7700. |
| [10] |
EHRLICH H L, NEWMAN D K, KAPPLER A. Ehrlich's Geomicrobiology[M]. Boca Raton, Florida, USA: CRC Presss/Taylor & Francis, 2015.
|
| [11] |
阎葆瑞, 张锡根. 微生物成矿学[M]. 北京: 科学出版社, 2000. YAN Baorui, ZHANG Xigen. Microbial metallogeny[M]. Beijing: Science Press, 2000. |
| [12] |
WANG X, MüLLER W E G. Marine biominerals: perspectives and challenges for polymetallic nodules and crusts[J]. Trends in Biotechnology, 2009, 27(6): 375-383. DOI:10.1016/j.tibtech.2009.03.004 |
| [13] |
WEBB S M, TEBO B M, BARGAR J R. Structural characterization of biogenic Mn oxides produced in seawater by the marine bacillus sp. strain SG-1[J]. American Mineralogist, 2005, 90(8/9): 1342-1357. |
| [14] |
SANTELLI C M, WELCH S A, WESTRICH H R, et al. The effect of Fe-oxidizing bacteria on Fe-silicate mineral dissolution[J]. Chemical Geology, 2001, 180(1/4): 99-115. |
| [15] |
GlEISNER M, HERBERT JR R B, KOCKUM P C F. Pyrite oxidation by Acidithiobacillus ferrooxidans at various concentrations of dissolved oxygen[J]. Chemical Geology, 2006, 225(1/2): 16-29. |
| [16] |
DONG Y, SANFORD R A, BOYANOV M I, et al. Controls on iron reduction and biomineralization over broad environmental conditions as suggested by the Firmicutes Orenia metallireducens Strain Z6[J]. Environmental science & Technology, 2020, 54(16): 10128-10140. |
| [17] |
ROH Y, GAO H, VALI H, et al. Metal reduction and iron biomineralization by a psychrotolerant Fe (Ⅲ)-reducing bacterium, Shewanella sp. strain PV-4[J]. Applied and Environmental Microbiology, 2006, 72(5): 3236-3244. DOI:10.1128/AEM.72.5.3236-3244.2006 |
| [18] |
KOMEILI A. Molecular mechanisms of compartmentalization and biomineralization in magnetotactic bacteria[J]. FEMS Microbiology Reviews, 2012, 36(1): 232-255. DOI:10.1111/j.1574-6976.2011.00315.x |
| [19] |
BOYD P W, LAW C S, WONG C S, et al. The decline an fate of an iron-induced subarctic phytoplankton bloom[J]. Nature, 2004, 428: 549-553. DOI:10.1038/nature02437 |
| [20] |
曲胜路, 杨茹君, 苏函, 等. 海洋中Fe(Ⅱ)的行为及微生物参与下的过程研究概述[J]. 海洋科学, 2017, 41(10): 139-148. QU Shenglu, YANG Rujun, SU Han, et al. A review of the behavior and microbial activity of Fe(Ⅱ) in seawater[J]. Marine Sciences, 2017, 41(10): 139-148. |
| [21] |
LARESE-CASANOVA P, HADERLEIN S B, KAPPLER A. Biomineralization of lepidocrocite and goethite by nitrate-reducing Fe(Ⅱ)-oxidizing bacteria: effect of pH, bicarbonate, phosphate, and humic acids[J]. Geochimica et Cosmochimica Acta, 2010, 74(13): 3721-3734. DOI:10.1016/j.gca.2010.03.037 |
| [22] |
YU Q, KANDEGEDARA A, XU Y, et al. Avoiding interferences from Good's buffers: a contiguous series of noncomplexing tertiary amine buffers covering the entire range of pH 3-11[J]. Analytical Biochemistry, 1997, 253(1): 50-56. DOI:10.1006/abio.1997.2349 |
| [23] |
KESTER D R, DUEDALL I W, CONNORS D N, et al. Preparation of artificial seawater[J]. Limnology and Oceanography, 1967, 12(1): 176-179. DOI:10.4319/lo.1967.12.1.0176 |
| [24] |
KARAMANEV D G, NIKOLOV L N, MAMATARKOVA V. Rapid simultaneous quantitative determination of ferric and ferrous ions in drainage waters and similar solutions[J]. Minerals Engineering, 2002, 15(5): 341-346. DOI:10.1016/S0892-6875(02)00026-2 |
| [25] |
吕靖. 海洋微生物与铁锰结核(壳)相互作用机制的初步研究[D]. 青岛: 中国科学院大学(中国科学院海洋研究所), 2019. LÜ Jing. Preliminary study on the mechanism of interaction between marine microorganisms and ferromanganese nodules(crusts)[D]. Qingdao: University of Chinese Academy of Sciences (Institute of Oceanology, Chinese Academy of Sciences), 2019. |
| [26] |
WRIGHT D T, OREN A. Nonphotosynthetic bacteria and the formation of carbonates and evaporites through time[J]. Geomicrobiology Journal, 2005, 22(1/2): 27-53. |
| [27] |
GONZáLEZ-MUÑOZ M T, DE LINARES C, MARTíNEZ-RUIZ F, et al. Ca-Mg kutnahorite and struvite production by Idiomarina strains at modern seawater salinities[J]. Chemosphere, 2008, 72(3): 465-472. DOI:10.1016/j.chemosphere.2008.02.010 |
| [28] |
KONHAUSER K O. Diversity of bacterial iron mineralization[J]. Earth-Science Reviews, 1998, 43(3/4): 91-121. |
| [29] |
CHÂTELLIER X, FORTIN D, WEST M M, et al. Effect of the presence of bacterial surfaces during the synthesis of Fe oxides by oxidation of ferrous ions[J]. European Journal of Mineralogy, 2001, 13(4): 705-714. DOI:10.1127/0935-1221/2001/0013-0705 |
| [30] |
MIOT J, BENZERARA K, MORIN G, et al. Iron biomineralization by anaerobic neutrophilic iron-oxidizing bacteria[J]. Geochimica et Cosmochimica Acta, 2009, 73(3): 696-711. |
| [31] |
GLASAUER S, LANGLEY S, BOYANOV M, et al. Mixed-valence cytoplasmic iron granules are linked to anaerobic respiration[J]. Applied and Environmental Microbiology, 2007, 73(3): 993-996. |
| [32] |
PEREZ-GONZALEZ T, JIMENEZ-LOPEZ C, NEAL A L, et al. Magnetite biomineralization induced by Shewanella oneidensis[J]. Geochimica et Cosmochimica Acta, 2010, 74(3): 967-979. |
 2022, Vol. 46
2022, Vol. 46


