文章信息
- 张阳, 金铭, 刘宏星, 郑赟, 詹宇, 李凌云, 程浩翔, 包永波, 彭志兰, 张晓林. 2023.
- ZHANG Yang, JIN Ming, LIU Hong-xing, ZHENG Yun, ZHAN Yu, LI Ling-yun, CHENG Hao-xiang, BAO Yong-bo, PENG Zhi-lan, ZHANG Xiao-lin. 2023.
- 泥蚶低氧胁迫后血细胞转录组及耐低氧相关基因的筛选与分析
- Blood cell transcriptome and screening, analysis of genes related to hypoxia tolerance of Tegillarca granosa
- 海洋科学, 47(1): 34-44
- Marine Sciences, 47(1): 34-44.
- http://dx.doi.org/10.11759/hykx20220708001
-
文章历史
- 收稿日期:2022-07-08
- 修回日期:2022-08-24
2. 浙江万里学院 生物与环境学院, 浙江 宁波 315100;
3. 浙江万里学院 宁海海洋种业研究院, 浙江 宁波 315600;
4. 浙江海洋大学 海洋科学与技术学院, 浙江 舟山 316022
2. College of Biological and Environmental Sciences, Zhejiang Wanli University, Ningbo 315000, China;
3. Ninghai Institute of Mariculture Breeding and Seed Industry, Zhejiang Wanli University, Ningbo 315600, China;
4. Marine Science and Technology College, Zhejiang Ocean University, Zhoushan 316022, China
溶解氧(DO)是养殖生态系统中一个重要的环境因子, 在有氧代谢过程中维持细胞内能量平衡, 影响水生动物的生长和生存[1-2]。DO≤2 mg/L通常被定义为低氧[3]。低氧影响水生动物的氧气运输、机体代谢、信号转导、细胞增殖与凋亡和血管形成等多种生理生化过程[4-5]。水生动物以不同的方式应对低氧压力; 一些鱼、虾和蟹物种主动避开低氧水域, 而有一些物种已经进化出适应低氧的能力[6-9]。低氧的生理调节是通过增加氧量、降低能量消耗和代谢水平来实现的[10-11]。
目前已有多种方法应用到了深入研究低氧胁迫与水产生物个体之间相互作用关系, Cheng等[12]通过生理生化指标检测显示鲍鱼(Haliotis diversicolor supertexta)暴露在3.08 mg/L及更低的环境DO, 扰乱了酸碱平衡, 影响了无氧代谢, 增加了葡萄糖和乳酸的产生, 并产生了酸中毒。聂鸿涛等[13]通过对菲律宾蛤仔低氧胁迫后LDH、SDH、AKP酶活研究, 发现这些抗氧化酶类在应对低氧胁迫过程中具有重要作用。Shang等[14]通过高通量测序分析, 初步阐明了红鳍东方鲀(Takifugu rubripes)对低氧胁迫的分子机制。在脊椎动物研究中发现在低氧胁迫过程中低氧诱导因子(Hypoxia-inducible factors-1α, HIF-1α)是一种常见的重要的转录调节因子, 在低氧条件下被激活, 并诱导包括VEGF在内的多种基因的表达[15], 王婷[16]在对无脊椎动物如太平洋牡蛎的研究中通过qPCR、酵母杂交、原核表达等方法也发现HIF-1是其低氧适应过程中的关键基因。张高伟[17]对魁蚶低氧胁迫转录组研究中发现HIF-1信号通路相关的3个基因—SbHIF-1α、SbHIF-1β和SBENO-1, 并且用qRT-PCR方法检测出了SbHIF-1α在魁蚶的鳃和血浆中的高表达。转录组测序作为高通量测序的一种, 具有检测覆盖范围广、准确性好等特点, 现已广泛应用到探究外界环境与个体之间关系的研究中。
泥蚶(Tegillarca granosa)是一种具有重要生态和经济价值的海洋双壳类动物, 广泛分布于亚洲沿海和河口地区[18]。泥蚶主要生活在潮间带泥滩, 周期性的遭受低氧胁迫[19]。根据已有的研究显示, 相比于贝类中的如丽文蛤(Meretrix cusoria)、花蛤(Ruditapes philippinarum)、毛蚶(Scapharca subcrenata)、魁蚶(Scapharca broughtonii)低氧216 h的存活率分别为35%、32%、45%、56%, 泥蚶(低氧216 h存活率93%)表现出较强的耐低氧特性[17, 19], 但目前对于泥蚶应对低氧胁迫所涉及的分子调控机理还未见报道。本研究基于Illumina HiSeqTM 2500高通量测序, 对泥蚶低氧胁迫不同时长后, 取其血淋巴提取RNA进行转录组测序, 通过基因富集分析及DEGs注释, 寻找与耐低氧相关的功能基因; 并采用实时荧光定量PCR技术检测低氧胁迫后DEGs的表达量, 以初探泥蚶耐受低氧的分子机理。
1 材料与方法 1.1 样本来源与低氧胁迫处理实验用泥蚶于2021年12月选自浙江宁波市宁海养殖塘, 挑选200粒, 外壳无损伤, 斧足伸缩灵敏, 活力良好, 体质量为16±4 g的泥蚶。置于40 cm×26 cm×25 cm的水族箱暂养3 d, 设实验组与对照组各3组平行, 实验组用氮气调整DO保持在0.5 mg/L, 每2 h测定调节1次溶氧浓度, 对照组常规充气, 养殖水盐度为22, 每日换水1次、投食1次小球藻(Chlorella vulgaris)。
在低氧胁迫6、24、72、120 h后, 分别从各实验组、对照组中各取9粒泥蚶的血样, 每3粒泥蚶血样混匀后进行离心取血细胞。立即存于液氮, 再于–80℃冰箱中保存, 用于后续总RNA的提取。
1.2 RNA提取及文库制备对样品总RNA的提取采用Trizol法(mirVana™ miRNA ISOlation Kit)。使用NanoDrop 2000分光光度计(Thermo Scientific, USA)评测RNA纯度和定量。使用Agilent 2100生物分析仪(Agilent Technologies, Santa Clara, CA, USA)对RNA完整性进行评估, 检测结果样品RIN > 8.0认定为合格, 大于9.0视为较好。然后根据制造商的说明使用TruSeq Stranded mRNA LT Sample Prep Kit(Illumina, San Diego, CA, USA)构建文库。
1.3 转录组测序与差异表达基因分析数据预处理及质量控制转录组测序由欧易生物技术有限公司(中国上海)进行, 在Illumina HiSeq X Ten平台上对文库进行测序, 并产生150 bp的双端reads。fastq格式的原始数据(raw reads)首先使用Trimomatic进行处理, 去除低质量的reads以获得有效数据。
1.4 差异表达基因(DEGs)的GO功能富集和KEGG通路富集分析使用HISAT2将有效数据映射到泥蚶基因组(ASM1337562)。使用Cufflinks计算每个基因的FPKM, 并通过HTSeq-count获得每个基因的读取计数。使用DESeq(2012) R程序包进行差异表达分析。以q值< 0.05、|log2FoldChange| > 1为差异表达阈值筛选出差异基因。以基于超几何分布算法的R程序包对显著差异基因集进行了GO富集分析和KEGG通路富集分析, 根据KEGG富集出的结果, 选出在72、120 h共同富集到的相同通路, 再在DEGs集中选择与这些通路有关的、差异倍数较大的基因进行qPCR实验及相关文献的调研研究; 又对经典的HIF-1通路进行研究, 并选取与通路相关的显著差异基因进行qPCR实验及相关文献的调研研究。
1.5 低氧适应相关基因筛选为预测实验组中与低氧适应相关的差异表达基因, 结合文献, 从72 h、120 h共同富集到的KEGG通路有关的基因中选取4~5个基因, 又从HIF-1通路中的显著差异基因集中选取2个显著差异基因。
1.6 qRT-PCR验证实验对1.5中筛选出的7个基因进行实验, 分别是JUN、DUSP10、CCKR、PTHR2、TRIM45、HIF-1α、EIF-4E, 内参为18S rDNA。使用Primer Premier5软件设计引物, 并由上海生工生物工程股份有限公司合成(见表 1), 进行qRT-PCR实验, 以验证本次转录组测序实验的准确性。
| 引物名称primer name | 引物序列sequence (5′-3′) |
| 18s-F | CTTTCAAATGTCTGCCCTATCAACT |
| 18s-R | TCCCGTATTGTTATTTTTCGTCACT |
| JUN-F | CACAACACCAACACCGAC |
| JUN-R | CATTATGAAGTTCCGCCA |
| HIF-1α-F | ATTCCAGCCCAGACCTT |
| HIF-1α-R | GGGAGCCAAATGAGTAAGA |
| DUSP10-F | CGCTTCTAATCCCCCTT |
| DUSP10-R | AACGCCGTGGTTCAAAG |
| CCKR-F | CGCTTCTAATCCCCCTT |
| CCKR-R | AACGCCGTGGTTCAAAG |
| TRIM45-F | CTGTGAACAATGTCAAAAGG |
| TRIM45-R | GGCATCTCCTATTTTCTGTA |
| EIF-4E-F | TGGTGGAAGGTGGTTGA |
| EIF-4E -R | CGTCTTGTCGTCTGGCA |
| PTHR2-F | CTTTGGGTCCCTGATGT |
| PTHR2-R | TTGGAGCACACATGACG |
通过对熔解曲线的分析确定为单一曲线扩增并采用2–ΔΔCt指标分析目的基因的表达情况。采用双样本双尾t检验, 以P < 0.05作为显著标准。
2 结果 2.1 转录组数据低氧处理泥蚶6、24、72、120 h后取样血细胞后测序共得到24组转录组数据, 原始数据过滤掉测序接头序列、未知碱基序列、低质量序列后得到168.89 G高质量测序数据clean reads, 各样本的有效数据量分布在6.71~7.37 G, Q30分布在94.24%~95.54 %, 平均GC含量为41.00%。
2.2 DEGs分析由图 1可以看出, 相比于对照组, 实验组6 h到120 h的4个时间点的DEGs数量呈增多的趋势, 从6 h的30个逐渐增加到120 h的245个。低氧胁迫后6 h→120 h的4个时间点没有共同持续响应的DEGs; 但24 h→120 h的3个时间点有4个共同持续响应的DEGs, 分别为PIM-3(丝氨酸/苏氨酸蛋白激酶)、HSP 70-B2、MR-1B (褪黑素受体1B)、未注释蛋白KP79; 从72 h→120 h的2个时间点共同持续响应的DEGs有33个; 到120 h才开始响应的DEGs有199个。
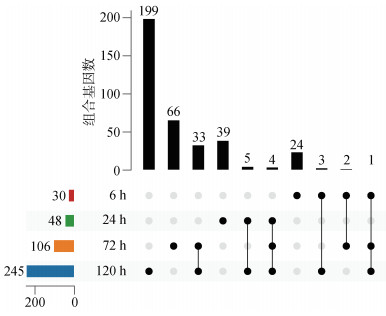 |
| 图 1 泥蚶血细胞低氧处理6、24、72、120 h后实验组与对照组间DEGs的upset图 Fig. 1 UpSet diagram of DEGs in blood cells of T. granosa in the experimental group subjected to hypoxic conditions and control group at 6, 24, 72, and 120 h 注: 左下侧横线柱状图表示每个集合包含元素的数目, 中间表示组合方式, 上面的柱状图表示每种组合方式含有的元素个数; 组合基因数: 该组合下的基因数, 条形图越高代表该集合包含的基因数量越多 |
低氧胁迫不同时间点的实验组、对照组间DEGs的GO富集分析结果取P-value的Top30进行分析(筛选3种分类中对应差异基因数目大于3的GO条目, 按照每个条目对应的−lg(P-value)由大到小排序的各10条), 重点分析富集出的生物学功能(biological process)条目(level-1)。
低氧处理6 h、24 h未能富集出biological process条目, 且其他类别的条目较少, 这可能提示胁迫至24 h还未能对泥蚶形成足够强的刺激, 从72 h才开始富集出biological process条目, 故本节重点阐述72 h与120 h的GO富集结果。
低氧处理72 h后实验组和对照组的DEGs经过GO功能富集分析存在8个生物学过程条目, 10个细胞组分条目, 4个分子功能条目(图 2a), 其中, 生物学过程的显著条目(P < 0.05)是RNA聚合酶II负调控转录、血管生成、G蛋白偶联受体信号通路; 细胞组分的显著条目是细胞骨架、胞外区; 分子功能的显著条目是DNA结合转录因子活性_RNA聚合酶II特异性、RNA聚合酶II近端启动子序列特异性DNA结合。
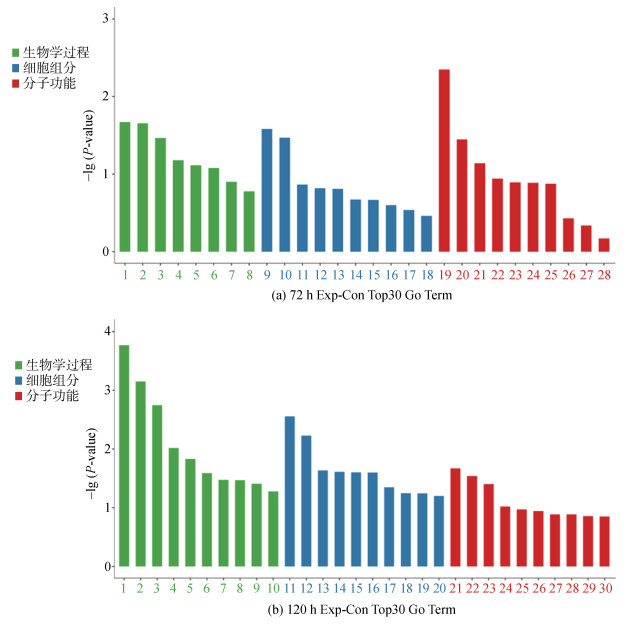 |
| 图 2 实验组与对照组泥蚶血细胞低氧处理72 h和120 h后DEGs的GO富集分析图 Fig. 2 GO enrichment analysis of DEGs in blood cells of T. granosa in the experimental group subjected to hypoxic conditions and control group at 72 and 120 h 注: 柱状图代表富集的GO level3条目; 高度表示为以10为底的P-value对数的负数, 高度越高表示该条目相对越显著。图 2a中生物学过程条目从左到右依次的中文释义: 1. RNA聚合酶II负调控转录; 2. 血管生成、3. G蛋白偶联受体信号通路; 4. RNA聚合酶II调控转录; 5. 凋亡进程; 6. 细胞黏附; 7. 先天免疫反应; 8. RNA聚合酶II正调控转录。细胞组分条目从左到右依次的中文释义: 9. 细胞骨架; 10. 胞外区; 11. 核质; 12. 膜; 13. 顶端质膜; 14. 质膜; 15. 神经元投射; 16. 细胞内面上细胞器; 17. 内质网; 18. 胞外外泌体。分子功能条目从左到右依次的中文释义: 19. DNA结合转录因子活性_RNA聚合酶II特异性; 20. RNA聚合酶II近端启动子序列特异性DNA结合; 21. 碳水化合物结合; 22. 蛋白质异源二聚化活动; 23. DNA结合转录因子活性; 24. G蛋白偶联受体活性; 25. GTP酶活性; 26. DNA结合; 27. 蛋白质同源二聚化活动; 28. 金属离子结合。图 2b中的生物学过程条目从左到右依次的中文释义: 1. JUN激酶活性的负调控; 2. 蛋白质水解的负调控; 3. 免疫系统进程; 4. 小GTP酶介导的信号转导; 5. 多细胞生物体的发育; 6. 细胞迁移的正调控; 7. 细胞分化; 8. 凋亡进程; 9. 细胞黏附; 10. 肌动蛋白细胞骨架组织。细胞组分条目从左到右依次的中文释义: 11. 嗜苯胺蓝的颗粒内腔; 12. 细胞核; 13. 胞外外泌体; 14. 线粒体内膜; 15. 包含胶原的细胞外基质; 16. 内质网; 17. 质膜; 18. 微管细胞骨架; 19. 染色体; 20. 细胞突起。分子功能条目从左到右依次的中文释义: 21. 胞外基质结构成分; 22. 血红素结合; 23. 蛋白酶结合; 24. 氧化还原酶活性; 25. DNA结合转录因子活性_RNA聚合酶II特异性; 26. GTP结合; 27. RNA聚合酶II调控区序列特异性DNA结合; 28. 蛋白质同源二聚化活动; 29. DNA结合; 30. 蛋白质异源二聚化活动 |
低氧处理120 h后实验组和对照组的DEGs经过GO功能富集分析存在10个生物学功能条目, 10个细胞组分条目, 10个分子功能条目(图 2b), 其中, 生物学过程的显著条目(P < 0.05)是JUN激酶活性的负调控、蛋白质水解的负调控、免疫系统进程、小GTP酶介导的信号转导、多细胞生物体的发育、细胞迁移的正调控、细胞分化、凋亡进程、细胞黏附; 细胞组分的显著条目是嗜苯胺蓝的颗粒内腔、细胞核、胞外外泌体、线粒体内膜、包含胶原的细胞外基质、内质网、质膜; 分子功能的显著条目是胞外基质结构成分、血红素结合、蛋白酶结合。
2.4 DEGs的KEGG富集分析对4个不同时间点的DEGs进行KEGG的Top15分析(标准: 筛选对应差异基因数目大于3的Pathway条目, 按照每个条目对应的–lg(P-value)由大到小排序), 结果显示, 低氧胁迫处理6、24 h后的DEGs没有富集出KEGG富集通路, 从72 h才开始出现富集, 这一点与GO富集体现的结果相印证。
低氧处理72 h后的实验组与对照组间筛选出11条富集通路(图 3a), 其中的显著条目(P < 0.05)是流体剪切应力和动脉粥样硬化、紧密连接、胰腺分泌、丝裂原活化蛋白激酶(MAPK)信号通路、雌激素信号通路、钙信号通路。
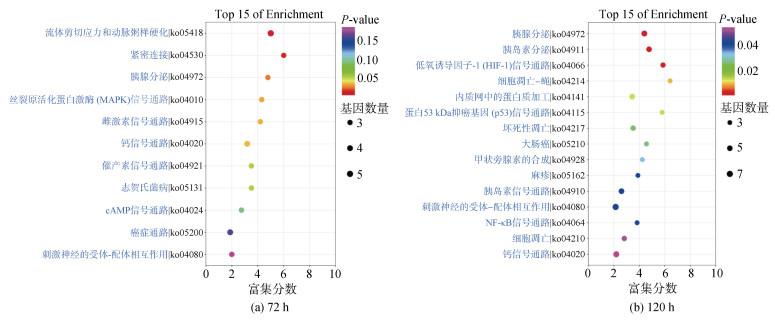 |
| 图 3 实验组与对照组泥蚶血细胞低氧处理72 h和120 h后DEGs的KEGG通路富集分析 Fig. 3 KEGG pathway enrichment analysis of DEGs in blood cells of T. granosa in the experimental group subjected to hypoxic conditions and control group at 72 h and 120 h 注: 图中横轴表示的富集分数越高, 富集效果越好; 气泡越大的条目包含的差异蛋白编码基因数目越多, 气泡颜色由紫→蓝→绿→红变化(代表P-value由高变化到低), 富集P-value越小, 表示显著程度越大; ko0XXXX为富集到该KEGG通路的ID号 |
低氧处理120 h后的实验组与对照组间筛选出15条富集通路(图 3b), 其中的显著条目(P < 0.05)是胰腺分泌、胰岛素分泌、低氧诱导因子–1(HIF-1)信号通路、细胞凋亡-蝇、内质网中的蛋白质加工、蛋白53 kDa抑癌基因(p53)信号通路、坏死性凋亡、大肠癌、甲状旁腺素的合成、麻疹、胰岛素信号通路、刺激神经的受体-配体相互作用、NF-κB信号通路。
2.5 qRT-PCR验证挑选的7个差异显著基因中上调基因是JUN、DUSP10、EIF-4E、CCKR、HIF-1α、TRIM45, 下调基因是PTHR2。使用荧光定量PCR相对定量法检测胁迫组与对照组基因的表达情况, 如图 4所示。低氧胁迫泥蚶血细胞72 h、120 h后, 筛选的7个基因的表达趋势(即上调和下调的趋势)与RNA-seq分析结果总体一致, 证实了转录组分析结果的可靠性。对于基因的表达差异倍数, 从图中也体现出, 随着胁迫时间的增长, 基因的表达差异倍数也呈现升高的趋势, 即基因上调或下调得更多。
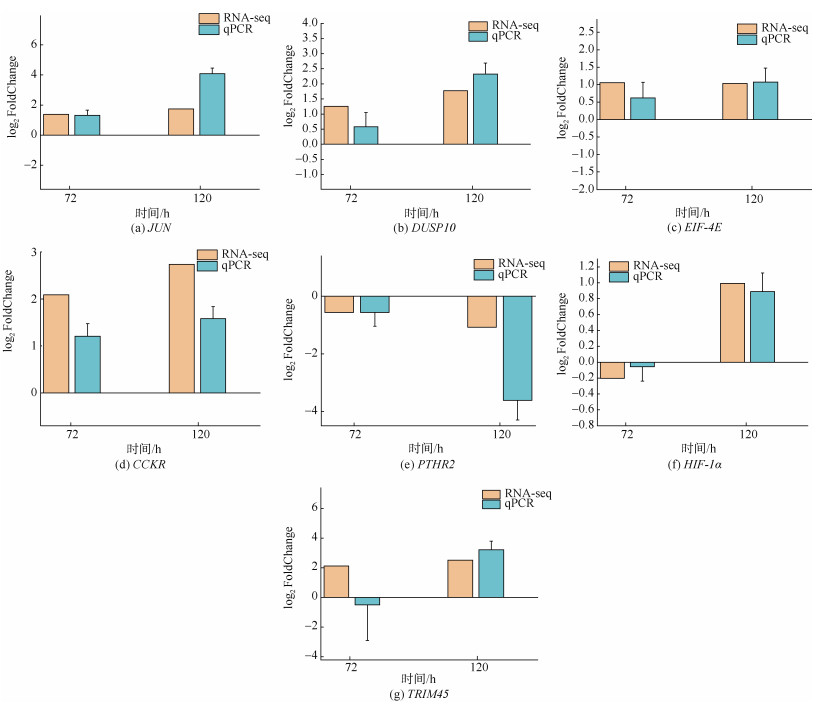 |
| 图 4 qPCR验证72 h、120 h的7个DEGs表达结果比较分析 Fig. 4 Comparison and analysis of seven DEGs expressed in the experimental and control groups measured using qPCR 注: 条形图高度表示该基因qPCR实验体现的实验组与对照组表达差异倍数的以2为底的对数, 正数表示上调, 负数表示下调。各基因详细释义: JUN——JUN样蛋白转录因子; DUSP10——双特异性蛋白磷酸酶10; EIF-4E——真核生物翻译起始因子4E; CCKR——胆囊收缩素受体; PTHR2——甲状旁腺激素受体2; HIF-1α——低氧诱导因子1-α; TRIM45——三基序蛋白45 |
在地球的生态环境中, 低氧环境是一种常见的生态环境, 生物进化到如今, 已有不少生物现是长期生活在低氧环境中, 但不同生物进化出耐低氧的机制不尽相同, 常见机制有如腺苷A1受体、ATP敏感钾通道、NF-κB、VEGF、EPO、HIF、NOS、NMDA受体、MnSOD、TNF、糖原、乳酸等[20]。HIF-1α作为常见的动物体应对低氧反应的转录因子, 低氧条件下表达量会明显升高, 能够激活多个相关基因和通路, 但本研究发现HIF-1α响应时间较晚且差异倍数不高, 这可能与不同物种的特性有关[21]。
3.1 24 h至120 h持续响应的基因分析本研究进行了4个时间点DEGs的upset图分析, 胁迫6 h→120 h的4个时间点没有出现相同DEGs持续响应, 但胁迫24 h→120 h的3个时间点出现4个相同持续响应的基因, 它们分别是MR-1B(褪黑素受体1B型)、HSP70、PIM-3(丝氨酸/苏氨酸蛋白激酶3)、未命名蛋白KP79。
对于MR-1B, 3个时间点的胁迫组都有显著的响应, 提示在低氧耐受过程中, 泥蚶的褪黑素分泌会增加, 有研究显示, 褪黑素可以减轻低氧对于人心肌细胞的损伤[22], 其机制可能与抑制RIPK3/CaMK Ⅱ信号通路有关, 钙信号参与调节这个过程。对于HSP70, 有研究报道, 在低氧胁迫下, 大鼠海马神经细胞的HSP70表达上调[23], 另外对于心肌细胞的低氧胁迫研究中, 也发现HSP70表达上调, 在低氧应激损伤时, 一些早应答基因如HSP70、c-fos、s-jun会激活[24], 这可能抑制某些凋亡相关基因如p53的激活, 从而抑制凋亡的过程[25]; 其也可以通过上调Bcl-2和下调Bax来抑制凋亡进程[26]。有研究显示, PIM-3上调与细胞凋亡的抑制有明显的相关[27], 也有研究表明, 低氧胁迫人脑组织和心肌细胞, 作为PIM家族中的PIM-3会有显著性的响应[28], PIM激酶可以通过协同或者调控Bcl-2的抗凋亡蛋白的功能, 来抑制细胞凋亡的线粒体通路[29-30]。对于未命名蛋白KP79, 由于未有已知蛋白与其同源, 没有这个蛋白的注释, 故对其知之甚少, 但该蛋白从胁迫24 h开始, 之后3个时间点内均持续响应, 提示该蛋白在泥蚶应对低氧胁迫中可能也发挥了重要作用, 有待深入研究。
3.2 GO与KEGG富集结果分析GO和KEGG富集结果均显示, 当胁迫到72 h后, 泥蚶才应答出明显的生物学过程及通路, 72 h和120 h的通路分析共同富集到胰腺分泌和钙信号通路结果; 120 h的富集结果中, GO和KEGG富集结果均反映细胞凋亡进程的出现, 成为胁迫至该时间点泥蚶体内发生的一个重要的生物学过程。
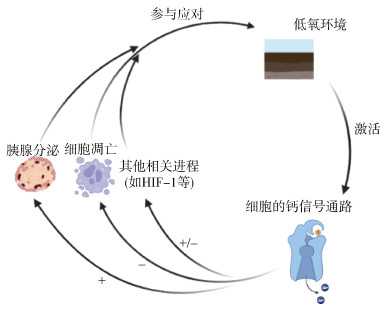
本研究结果显示胰腺分泌在泥蚶耐低氧过程中是一项重要的生物学过程, 但在魁蚶低氧胁迫的转录组研究中未能显著富集出这个生物学过程[17], 其能分泌胰岛素, 胰腺分泌过程可能与加强糖类的吸收及代谢有关[31], 本研究结果显示胰岛素信号通路是显著响应的, 文献报道胰岛素的分泌通路在低氧条件下, 可以通过抑制细胞凋亡的方式来缓解低氧的应激反应[32]; 泥蚶胰腺也可能会释放一些其他的激素来尽可能保护细胞免受低氧损伤, 如CCK等[33-35]。钙信号通路介导调控多种生物学过程(图 5), 包括凋亡过程、MAPK通路、胰腺分泌等, 这些生物学过程在本研究结果中也均显著富集到, 与魁蚶、人光感受器细胞对低氧胁迫研究结果相似[17, 36]。凋亡过程是一个普遍的低氧响应过程, 在魁蚶、中华绒螯蟹、人视网膜色素上皮细胞、人光感受器细胞的低氧胁迫转录组研究中均显示凋亡进程是一个重要进程[17, 36-38], 不同的是相对于很多其他物种的低氧响应凋亡过程, 泥蚶出现凋亡响应的时间点较晚, 这提示在低氧耐受过程中泥蚶有较强的抗凋亡能力; 有研究发现凋亡通路与HIF-1通路的响应密切联系, 本研究结果显示凋亡通路与HIF-1通路是同时开始响应的, 与文献相印证[39-40]。
本研究挑选的qRT-PCR验证的7个基因, 分别为HIF-1α、JUN蛋白、DUSP10 (双特异性蛋白磷酸酶10)、CCKR(胆囊收缩素受体)、TRIM(三基序蛋白)、EIF-4E(翻译起始因子4E)、PTHR(甲状旁腺激素受体), 均在泥蚶耐低氧过程中发挥了一定作用, qPCR验证这些基因在72 h和120 h表达趋势总体与转录组测序结果一致, 并且随着胁迫时间增加, 这些基因呈现上调/下调的更多的趋势。
其中, HIF-1α是HIF-1信号通路的关键基因, 调控代谢通路中的下游通路, 且与钙信号通路密切相关, 廖晓敏[42]曾对低氧状态下的乳腺癌细胞加入钙通道阻滞剂检测HIF-1α的表达变化, 结果发现, 相对于未加阻滞剂组, HIF-1α的转录水平和蛋白水平均显著降低, 推测可能是由于细胞内钙信号变化引起ROS产生减少而导致HIF-1α表达下降。JUN蛋白也与钙离子信号通路有关[43]; 可能与HSP70蛋白间具有协同或调控作用, 低氧胁迫下也可能具有一定的神经保护作用[44-45]。对于DUSP, 其在低氧状态下可通过负调控ERK MAPK来保护HIF-1因子的过表达[46]。对于CCKR, 其与CCK结合, 是胰腺分泌过程中的一种调控基因[41]。本研究结果显示, 有2个CCKR基因经过低氧胁迫后相比对照组有显著响应, 提示泥蚶在低氧胁迫后胆囊收缩素分泌增加; 文献研究显示, 胆囊收缩素对于低氧处理的神经细胞具有保护作用, 这个作用可被CCKR拮抗剂阻断, 这也提示在低氧状态下, 生物体对于细胞的保护机理是由CCKR介导产生的[33]。对于TRIM, 研究显示其在调节细胞增殖、分化、发育、细胞凋亡过程发挥了显著的作用, TRIM 45蛋白也可与HSP蛋白作用[47], 低氧状态下会协同保护细胞应激低氧损伤[48]。对于EIF-4E, 有研究显示, 肝细胞在低氧条件下孵育增加翻译起始因子EIF-4E与其抑制调节因子4E-BP1的结合, EIF-4E会上调, 低氧刺激4E-BP1去磷酸化, 诱导其与EIF-4E作用[49]。对于PTHR, 本研究表明PTHR在低氧胁迫过程中会下调, 提示甲状旁腺激素分泌会减少, 文献报道研究新生儿低氧病症也发现低氧会造成PTH显著下降, 推测这与血钙吸收有关[50]; 在无脊椎动物中, 泥蚶是比较特别的具有红血的动物, 而且本研究分析的通路富集结果显示钙信号通路是显著通路, 所以实验下一步检测低氧状态下血液中血钙浓度有利于进一步揭示泥蚶耐低氧机理。
4 结论本研究基于Illumina Hiseq TM 2500测序平台, 采用RNA-Seq技术探究了泥蚶在低氧持续胁迫下的适应和调节的过程。GO及KEGG富集分析富集出了多个条目, 结果显示低氧胁迫下的泥蚶血细胞中胰腺分泌、细胞凋亡、钙信号通路显著响应。我们推测胰腺分泌信号通路、细胞凋亡、钙信号通路在泥蚶耐受低氧过程起到了重要作用, 与这些通路相关的JUN、PIM-3、TRIM45、MR-1B、CCKR可能是在泥蚶应对低氧胁迫过程中起到关键作用的基因。实验结果表明泥蚶对低氧胁迫适应是一个涉及多通路多基因的复杂过程。本研究结果可为贝类低氧适应驯化及遗传育种研究提供科学依据参考。
| [1] |
SOMERO G N, BEERS J M, CHAN F, et al. What changes in the carbonate system, oxygen, and temperature portend for the Northeastern Pacific Ocean: A physiological perspective[J]. Bioscience, 2016, 66(1): 14-26. DOI:10.1093/biosci/biv162 |
| [2] |
GORR T A, WICHMANN D, HU J, et al. Hypoxia tole rance in animals: Biology and application[J]. Physiological and Biochemical Zoology, 2010, 83(5): 733-752. DOI:10.1086/648581 |
| [3] |
LI Q, SUN S, ZHANG F, et al. Effects of hypoxia on survival, behavior, metabolism and cellular damage of Manila clam (Ruditapes philippinarum)[J]. PLoS ONE, 2019, 14(4): e0215158. DOI:10.1371/journal.pone.0215158 |
| [4] |
LI T D, BROUWER M. Hypoxia-inducible factor, gsHIF, of the grass shrimp Palaemonetes pugio: Molecular characterization and response to hypoxia[J]. Comparative Biochemisty and Physiology, Part B, 2007, 147(1): 11-19. |
| [5] |
TZANEVA V, VADEBONCOEUR C, TING J, et al. Effects of hypoxia-induced gill remodelling on the innervation and distribution of ionocytes in the gill of goldfish, Carassius auratus[J]. Journal of Comparative Neurology, 2014, 522(1): 118-130. DOI:10.1002/cne.23392 |
| [6] |
GREENWAY S C, STOREY K B. Effects of seasonal change and prolonged anoxia on metabolic enzymes of Littorina littorea[J]. Canadian Journal of Zoology-Revue Canadienne De Zoologie, 2001, 79(5): 907-915. DOI:10.1139/z01-056 |
| [7] |
WANNAMAKER C M, RICE J A. Effects of hypoxia on movements and behavior of selected estuarine organisms from the southeastern United States[J]. Journal of Experimental Marine Biology and Ecology, 2000, 249(2): 145-163. DOI:10.1016/S0022-0981(00)00160-X |
| [8] |
XIAO W H. The hypoxia signaling pathway and hypoxic adaptation in fishes[J]. Science China Life Sciences, 2015, 58(2): 148-155. DOI:10.1007/s11427-015-4801-z |
| [9] |
徐贺, 陈秀梅, 王桂芹, 等. 低氧胁迫在水产养殖中的研究进展[J]. 饲料工业, 2016, 37(2): 33-37. XU He, CHEN Xiumei, WANG Guiqin, et al. Research progress of hypoxia on aquaculture[J]. Feed Industry, 2016, 37(2): 33-37. DOI:10.13302/j.cnki.fi.2016.02.007 |
| [10] |
KAWABE S, YOKOYAMA Y. Role of hypoxia-inducible factor alpha in response to hypoxia and heat shock in the Pacific oyster Crassostrea gigas[J]. Marine Biotechnology, 2012, 14(1): 106-119. DOI:10.1007/s10126-011-9394-3 |
| [11] |
NILSSON G E, RENSHAW G M C. Hypoxic survival strategies in two fishes: extreme anoxia tolerance in the North European crucian carp and natural hypoxic preconditioning in a coral-reef shark[J]. Journal of Experimental Biology, 2004, 207(18): 3131-3139. DOI:10.1242/jeb.00979 |
| [12] |
CHENG W, LIU C H, CHENG S Y, et al. Effect of dissolved oxygen on the acid-base balance and ion concentration of Taiwan abalone Haliotis diversicolor supertexta[J]. Aquaculture, 2004, 231(1/4): 573-86. |
| [13] |
聂鸿涛, 卢长炜, 柴成林, 等. 低氧胁迫对菲律宾蛤仔抗氧化酶的影响[J]. 海洋科学, 2017, 41(11): 32-37. NIE Hongtao, LU Changwei, CHAI Chenglin, et al. Effects of hypoxic stress on antioxidant enzymes of chlamydia philippinalis[J]. Marine Sciences, 2017, 41(11): 32-37. |
| [14] |
SHANG F, BAO M, LIU F, et al. Transcriptome profiling of tiger pufferfish (Takifugu rubripes) gills in response to acute hypoxia[J]. Aquaculture, 2022, 557: 738324. DOI:10.1016/j.aquaculture.2022.738324 |
| [15] |
KURIHARA T, WESTENSKOW P D, FRIEDLANDER M. Hypoxia-inducible factor (HIF)/vascular endothelial growth factor (VEGF) signaling in the retina[J]. Advances in Experimental Medicine & Biology, 2014, 801: 275-281. |
| [16] |
王婷. 长牡蛎低氧信号通路分子作用机制研究[D]. 青岛: 中国科学院大学(中国科学院海洋研究所), 2017. WANG Ting. Molecular mechanism of hypoxia signaling pathway in Crassostrea gigas[D]. Qingdao: University of Chinese Academy of Sciences (Institute of Oceanology, CAS), 2017. |
| [17] |
张高伟. 低氧胁迫对魁蚶机体的影响及分子响应初探[D]. 上海: 上海海洋大学, 2019. ZHANG Gaowei. Effects of hypoxia stress on body and molecular response of Granosa granosa[D]. Shanghai: Shanghai Ocean University, 2019. |
| [18] |
BAO Y B, WANG J J, LI C H, et al. A preliminary study on the antibacterial mechanism of Tegillarca granosa hemoglobin by derived peptides and peroxidase activity[J]. Fish & Shellfish Immunology, 2016, 51: 9-16. |
| [19] |
ZHAN Y, ZHA S J, PENG Z L, et al. Hypoxia-mediated immunotoxicity in the blood clam Tegillarca granosa[J]. Marine Environmental Research, 2022, 177: 105632. DOI:10.1016/j.marenvres.2022.105632 |
| [20] |
SHARP F R, RAN R, LU A, et al. Hypoxic preconditioning protects against ischemic brain injury[J]. NeuroRx, 2004, 1(1): 26-35. DOI:10.1602/neurorx.1.1.26 |
| [21] |
GENG X, FENG J B, LIU S K, et al. Transcriptional regulation of hypoxia inducible factors alpha (HIF-alpha) and their inhibiting factor (FIH-1) of channel catfish (Ictalurus punctatus) under hypoxia[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 2014, 169: 38-50. |
| [22] |
杨吉平, 费琳, 钟钰西, 等. 褪黑素对H9c2心肌细胞缺氧/复氧损伤的保护作用及其机制[J]. 山西医科大学学报, 2020, 51(8): 761-765. YANG Jiping, FEI Lin, ZHONG Yuxi, et al. Protective effect of melatonin on hypoxia/reoxygenation injury of H9c2 cardiomyocytes and its mechanism[J]. Journal of Shanxi Medical University, 2020, 51(8): 761-765. DOI:10.13753/j.issn.1007-6611.2020.08.005 |
| [23] |
匡培根. 在缺氧条件下培养的海马神经元形态结构及热休克蛋白(HSP)70表达变化及丹参的影响[J]. 脑与神经疾病杂志, 1997, 5(1): 1-4. KUANG Peigen. Morphological structure and expression changes of heat shock protein (HSP)70 in hippocampal neurons cultured under hypoxia and effects of Salvia miltiorrhiza[J]. Journal of Brain and Neurological Diseases, 1997, 5(1): 1-4. |
| [24] |
PLUMIER J, ROBERTSON H A, CURRIE W R. Differential accumulation of mRNA for immediate early genes and heat shock genes in heart after ischaemic injury[J]. Journal of Molecular & Cellular Cardiology, 1996, 28(6): 1251. |
| [25] |
李洪, 刘桥义. 热休克蛋白70表达与心肌细胞缺氧性凋亡的关系[J]. 中华麻醉学杂志, 2000, 20(3): 185-186. LI Hong, LIU Qiaoyi. Relationship between heat shock protein 70 expression and hypoxic apoptosis of cardiomyocytes[J]. Chinese Journal of Anesthesiology, 2000, 20(3): 185-186. |
| [26] |
赵倩, 曹静, 李明霞. 热休克蛋白70调控Bcl-2/Bax对缺氧性肺高压新生大鼠肺血管内皮细胞凋亡及肺动脉压力的作用[J]. 新疆医科大学学报, 2021, 44(9): 981-988. ZHAO Qian, CAO Jing, LI Mingxia. Effects of heat shock protein 70 on apoptosis of pulmonary vascular endothelial cells and pulmonary artery pressure in neonates with hypoxic pulmonary hypertension[J]. Journal of Xinjiang Medical University, 2021, 44(9): 981-988. |
| [27] |
LU A, TANG Y, RAN R, et al. Genomics of the periinfarction cortex after focal cerebral ischemia[J]. Journal of Cerebral Blood Flow and Metabolism: Official Jour nal of the International Society of Cerebral Blood Flow and Metabolism, 2003, 23(7): 786. DOI:10.1097/01.WCB.0000062340.80057.06 |
| [28] |
SPECTOR D L, GOLDMAN R D, LEINWAND L A. Culture and biochemical analysis of cells[M]. New York: Cold Spring Harbor Laboratory Press, 1998.
|
| [29] |
LILLY M, SANDHOLM J, COOPER J J, et al. The PIM-1 serine kinase prolongs survival and inhibits apoptosis-related mitochondrial dysfunction in part through a bcl-2-dependent pathway[J]. Oncogene, 1999, 18(27): 4022-4031. |
| [30] |
刘丹, 何明, 易波, 等. Pim-3对抗心肌细胞缺氧/复氧损伤的研究[J]. 中国药理学通报, 2009, 25(3): 321-325. LIU Dan, HE Ming, YI Bo, et al. Effects of pim-3 on hypoxia/reoxygenation injury of cardiomyocytes[J]. Chinese Pharmacological Bulletin, 2009, 25(3): 321-325. |
| [31] |
王单松, 靳大勇. 重症急性胰腺炎糖代谢异常的调控[J]. 中国实用外科杂志, 2006, 26(5): 333-334. WANG Shansong, JIN Dayong. Management of glycometabolism dysfunction resulted from severe acute pancreatitis[J]. Chinese Journal of Practical Surgery, 2006, 26(5): 333-334. |
| [32] |
粱敏, BENSON R, HULLEY P. 胰岛素抑制缺氧诱导的人成纤维细胞凋亡[C]//广东省口腔医学会第三次会员代表大会暨第十次学术会议论文集. 广州, 2011: 32-33. LIANG Min, BENSON R, HULLEY P. Insulin inhibits hypoxia-induced apoptosis of human fibroblasts[C]// Proceedings of the 3rd Member Congress and 10th Academic Conference of Guangdong Stomatological Association, Guangzhou, 2011: 32-33. |
| [33] |
梁卫兰, 熊晖, 母得志, 等. 八肽胆囊收缩素对神经细胞缺氧的作用[J]. 中华围产医学杂志, 2000, 3(2): 120-122. LIANG Weilan, XIONG Hui, MU Dezhi, et al. Effect of cholecystokinin octapeptide on hypoxia of nerve cells[J]. Chinese Journal of Perinatal Medicine, 2000, 3(2): 120-122. |
| [34] |
徐晓晴, 邱帅, 陈喜娟, 等. 胆囊收缩素对小肠Ⅰ细胞及胰腺细胞和小鼠胰腺消化酶储备的影响[J]. 天津医科大学学报, 2022, 28(2): 156-159. XU Xiaoqing, QIU Shuai, CHEN Xijuan, et al. Effects of cholecystokinin on intestinal I cells, pancreatic cells and digestive enzyme reserve in mouse pancreas[J]. Journal of Tianjin Medical University, 2022, 28(2): 156-159. |
| [35] |
李秋菊, 王丰. 胆囊收缩素及其受体的研究进展[J]. 重庆医学, 2021, 50(20): 3571-3575. LI Qiuju, WANG Feng. Research progress of cholecystokinin and its receptor[J]. Chongqing Medicine, 2021, 50(20): 3571-3575. |
| [36] |
杨琪翔, 史平玲, 卢聪, 等. 光感受器661细胞系早期低氧损伤转录组测序的生物信息学分析[J]. 中华眼底病杂志, 2021, 37(3): 214-223. YANG Qixiang, SHI Pingling, LU Cong, et al. Bioinformatics analysis of early hypoxic damage transcriptomic sequencing in photoreceptor 661 cell line[J]. Chinese Journal of Ocular Fundus Diseases, 2021, 37(3): 214-223. |
| [37] |
候利波, 陆银月, 任秋霖, 等. 低氧胁迫下中华绒螯蟹血淋巴细胞的转录组学[J]. 水产学报, 2020, 1-16. HOU Libo, LU Yinyue, REN Qiulin, et al. Transcriptomics of blood lymphocytes of Chinese mitten crab (Eriocheir sinensis) under hypoxia stress[J]. Journal of Fisheries of China, 2020, 1-16. |
| [38] |
卢聪, 史平玲, 杨琪翔, 等. 低氧诱导视网膜色素上皮细胞损伤的生物学机制转录组测序分析[J]. 中华实验眼科杂志, 2021, 39(6): 505-514. LU Cong, SHI Pingling, YANG Qixiang, et al. Transcriptomic sequencing analysis of the biological mechanism of hypoxia-induced retinal pigment epithelial cell injury[J]. Chinese Journal of Experimental Ophthalmology, 2021, 39(6): 505-514. |
| [39] |
ZHANG J J, XU J, DONG Y H, et al. Downregulation of HIF-1α inhibits the proliferation, migration and invasion of gastric cancer by inhibiting PI3K/AKT pathway and VEGF expression[J]. Bioscience Reports, 2018, 38(6): BSR20180741. |
| [40] |
顾霞, 赵敏, 王平义, 等. 低氧诱导因子1α与低氧相关疾病信号通路的关系[J]. 中国组织工程研究, 2021, 25(8): 1284-1289. GU Xia, ZHAO Min, WANG Pingyi, et al. The relationship between hypoxia inducer 1α and hypoxia related disease signaling pathway[J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1284-1289. |
| [41] |
KANEHISA M, ARAKI M, GOTO S, et al. KEGG for linking genomes to life and the environment[J]. Nucleic Acids Research, 2008, 36(Database issue): D480-D484. |
| [42] |
廖晓敏. HIF-1α与钙信号在低氧下对乳腺癌细胞侵袭转移作用的探讨[D]. 重庆: 重庆医科大学, 2009. LIAO Xiaomin. Effect of HIF-1α and calcium signaling on invasion and metastasis of breast cancer cells under hypoxia[D]. Chongqing: Chongqing Medical University, 2009. |
| [43] |
SALNIKOW K, KLUZ T, COSTA M, et al. The regulation of hypoxic genes by calcium involves c-Jun/AP-1, which cooperates with hypoxia-inducible factor 1 in response to hypoxia[J]. Molecular & Cellular Biology, 2002, 22(6): 1734-1741. |
| [44] |
何悦, 董兆君, 蔡颖, 等. 持续低氧对海马神经元凋亡及蛋白表达影响[J]. 中国公共卫生, 2010, 26(11): 1397-1398. HE Yue, DONG Zhaojun, CAI Ying, et al. Effects of continuous hypoxia on hippocampal neuronal apoptosis and protein expression[J]. Chinese Journal of Public Health, 2010, 26(11): 1397-1398. |
| [45] |
NESS J M, HARVEY C R, WASHINGTON J D, et al. Differential activation of c-fos and caspase-3 in hippocampal neuron subpopulations following neonatal hypoxia-ischemia[J]. Journal of Neuroscience Research, 2008, 86(5): 1115-1124. |
| [46] |
LIU C J, SHI Y Q, DU Y L, et al. Dual-specificity phosphatase DUSP1 protects overactivation of hypoxia-inducible factor 1 through inactivating ERK MAPK[J]. Experimental Cell Research, 2005, 309(2): 410-418. |
| [47] |
CAO C M, ZHANG Y, WEISLEDER N, et al. MG53 constitutes a primary determinant of cardiac ischemic preconditioning[J]. Circulation, 2010, 121(23): 2565-2574. |
| [48] |
刘洋, 陈东, 侯翠柳, 等. 泛素E3连接酶TRIM10在心肌细胞缺氧/复氧损伤的作用及机制[J]. 心肺血管病杂志, 2019, 38(5): 566-572. LIU Yang, CHEN Dong, HOU Cuiliu, et al. Role and mechanism of ubiquitin E3 ligase TRIM10 in hypoxia/reoxygenation injury of cardiomyocytes[J]. Journal of Cardiovascular and Pulmonary, 2019, 38(5): 566-572. |
| [49] |
TINTON S A, BUC-CALDERON P M. Hypoxia increases the association of 4E-binding protein 1 with the initiation factor 4E in isolated rat hepatocytes[J]. FEBS Letters, 1999, 446: 55-59. |
| [50] |
丘惠娴, 刘红, 丘小丽, 等. 新生儿缺氧缺血性脑病血浆内皮素、甲状旁腺素和血钙的变化及临床意义[J]. 医学理论与实践, 2004, 17(5): 503-504. QIU Huixian, LIU Hong, QIU Xiaoli, et al. Changes of plasma endothelin, parathyroid hormone and serum calcium in neonates with hypoxic-ischemic encephalopathy[J]. The Journal of Medical Theory & Practice, 2004, 17(5): 503-504. |
 2023, Vol. 47
2023, Vol. 47