文章信息
- 詹皓禹, 宋敏杰, 王云峰, 颜天. 2023.
- ZHAN Hao-yu, SONG Min-jie, WANG Yun-feng, YAN Tian. 2023.
- 海州湾赤潮高发区浮游细菌与赤潮及环境因子的关系
- Relationship between bacterioplankton and the red tide and environmental factors in frequent harmful algal bloom areas in Haizhou Bay
- 海洋科学, 47(3): 32-40
- Marine Sciences, 47(3): 32-40.
- http://dx.doi.org/10.11759/hykx20220510001
-
文章历史
- 收稿日期:2022-05-10
- 修回日期:2022-06-10
2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
赤潮是我国近海最突出的生态灾害之一[1]。近年来, 我国近海海域赤潮发生的频率及规模增加, 危害程度加大。赤潮能够通过产生毒素、造成物理损伤、改变水体理化特征等多种机制, 对海洋生态系统以及人类健康等造成危害[2]。赤潮也能引起浮游细菌群落结构的变动[3-4]。浮游植物能够产生多种有机物质, 不同的细菌对营养物质的偏好不同, 因此赤潮期间浮游细菌优势类群会发生变化[5]。细菌也能调节浮游植物的生长, 它们不仅能够为浮游植物提供营养盐, 还能裂解藻细胞, 在赤潮消亡中发挥作用[6]。藻菌关系密切、相互作用复杂, 探究赤潮期间细菌群落的变动, 对于进一步了解赤潮与细菌的关系, 阐明赤潮的发展规律具有重要意义。
海州湾是南黄海赤潮高发区之一, 赤潮原因种包括赤潮异弯藻(Heterosigma akashiwo)、短角弯角藻(Eucampia zoodiacu)、多纹膝沟藻(Gonyaulax polygramma)、海链藻(Thalassiosira sp.)、强壮前沟藻(Amphidinium carterae)、夜光藻(Noctiluca scintillans)和中肋骨条藻(Skeletonema costatum)等[7]。2018年, 该海域还出现了罕见的赤潮、绿潮和金潮共发的现象[8]。富营养化是该海域赤潮高发的重要原因, 人类活动显著影响了海州湾近岸海域的富营养化状况[9]。海州湾分布着条斑紫菜及贝类养殖区, 养殖生物生长、排泄、死亡等生命活动产生的生物碎屑都会使水体中的营养物质增加, 高浓度有机污染物容易在水域积累。2015年以来, 海州湾的紫菜养殖规模迅速扩大, 紫菜腐烂和施肥使海水中无机氮浓度急剧升高[10]。除了频繁出现的有毒有害赤潮, 浮游细菌也是影响该海域水产养殖安全以及人类健康的重要因素。弧菌(Vibrio)是水产养殖中最常见的病原菌, 其引起的贝、虾大规模死亡事件多有报道[11-12]。然而, 目前对于海州湾的水质以及赤潮生物已经有了不少调查, 但对于该海域细菌群落结构及动态变化的资料还比较缺乏, 对于海水中致病菌的报道也比较少。
2020年至2021年, 本研究在海州湾赤潮高发区展开了多次航次调查。2020年11月12日例行调查期间, 在海州湾南部近岸海域观察到小规模赤潮。本文分析了该次赤潮期间环境因子的分布状况, 并分析了赤潮原因种的情况、弧菌数量以及浮游细菌群落结构, 初步探究了浮游细菌群落与赤潮及环境因子之间的关系。
1 材料与方法 1.1 采样站位与时间2020年11月12日, 于海州湾进行了航次调查, 共设置8个站位, 采样站位如图 1所示。A1、A2站位位于紫菜及贝类养殖区附近, C1、C2站位位于贝类养殖区附近。调查过程中, 仅观察到A1、A2站位表层水色明显变化, 表层叶绿素a质量浓度均超过10 μg/L, 两站位发生了赤潮。
 |
| 图 1 海州湾采样站位分布图 Fig. 1 Sampling stations in Haizhou Bay |
各站位水温、盐度及叶绿素a参数通过CTD剖面仪(Maestro3, 加拿大RBR)现场获取。营养盐浓度由全自动营养盐分析仪(QuAAtro, 德国SEAL)测定, 测定的营养盐包括硝酸盐(NO3–-N, μmol/L)、亚硝酸盐(NO2–-N, μmol/L)、铵盐(NH4+-N, μmol/L)、溶解态有机氮(DON, μmol/L)、磷酸盐(PO43–-P, μmol/L)、溶解态有机磷(DOP, μmol/L)、硅酸盐(SiO32–-Si, μmol/L)。各站位表层营养盐样品采集按照《海洋监测规范》[13]相关技术规程进行。
1.3 浮游植物样品采集与鉴定各站位表层浮游植物采样及分析方法根据《海洋赤潮监测技术规程》[14]进行。使用光学显微镜观察各站位浮游植物样品, 并进行计数。
1.4 弧菌样品采集及培养量取各站位表层海水250 mL, 用200 μm筛绢除去大型浮游生物后, 将过滤所得海水收集在采样瓶中, 常温运回实验室后, 用0.22 μm的聚碳酸酯膜过滤, 将100 mL、50 mL、10 mL海水分别过滤至3张滤膜上。将3张滤膜有菌的一面朝上, 贴在制备好的硫代硫酸盐-柠檬酸盐-胆盐-蔗糖琼脂培养基(Thiosulfate Citrate Bile Salts Sucrose Agar, TCBS)平板上, 将平板放入培养箱中, 37℃培养24 h后, 挑取菌落数目合适、便于计数的平板进行计数, 获得样品中弧菌的菌落数(colony forming units, CFU), 菌落数除以对应的过滤体积计算出各站位海水样品中弧菌的密度。
1.5 16S rRNA高通量测序16S rRNA高通量测序基于Illumina Novaseq平台进行, 测序区域为V3和V4区, 所用引物为338F (5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGA CTACHVGGGTWTCTAAT-3′), 测序及数据前处理由北京百迈客生物科技有限公司完成。在97%的相似度水平上, 对获得的有效序列进行OTU划分, 以Silva为参考数据库使用朴素贝叶斯分类器进行分类学注释, 以获取各站位细菌群落组成信息。
1.6 数据处理与分析使用IBM SPSS Statistics 28对浮游细菌优势目与环境因子进行斯皮尔曼(Spearman)相关性分析。使用香农指数来分析浮游细菌的多样性, 香农指数(H)的计算方法为:
其中, S为OTUs的总数, pi为第i个OTU占OTU总数的比例。
2 结果 2.1 赤潮发生情况及赤潮优势种鉴定调查当日, 调查海域叶绿素a浓度自西向东不断降低(图 2)。离岸较近的A1、A2站位发生赤潮, 两站位表层叶绿素a浓度均超过14 μg/L。A1、A2站位的赤潮优势种为三叶原甲藻(Prorocentrum triestinum) [15]、赤潮异弯藻(Heterosigma akashiwo) [16]和塔胞藻(Pyramimonas sp.) [17](表 1)。
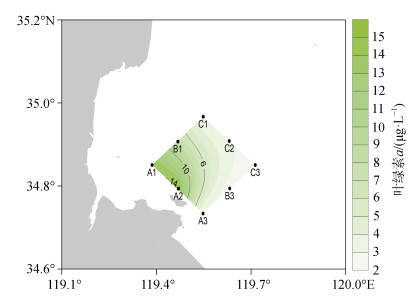 |
| 图 2 2020年11月12日海州湾表层海水叶绿素a(μg/L)分布情况 Fig. 2 Distribution of chlorophyll a (μg/L) in the surface water of Haizhou Bay on November 12, 2020 |
| A1 | A2 | |
| 三叶原甲藻 | 9.20×104 | 3.60×105 |
| 赤潮异弯藻 | 3.76×105 | 1.24×105 |
| 塔胞藻 | 1.22×105 | 2.14×105 |
16S rRNA高通量测序共得到626 366条有效序列, 共获得1 009个OTUs, 香农指数在6.37~7.98(图 3)。发生赤潮的A1、A2站位香农多样性指数略低于其他非赤潮发生站位, 位于贝类养殖区的C2站位香农指数最高。
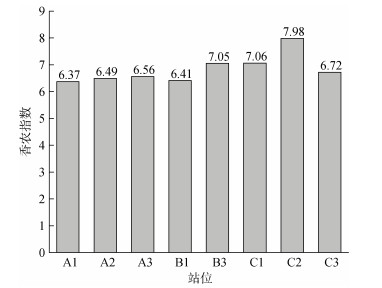 |
| 图 3 海州湾各站位表层海水浮游细菌香农指数 Fig. 3 Shannon index of bacterioplankton collected from the surface water at different stations in Haizhou Bay |
对测序得到的特征序列进行分类学注释, 共得到29个门, 61个纲, 158个目, 282个科, 524个属及577个种, 各站位浮游细菌样品分析结果如表 2所示。从物种种类数看, 发生赤潮的A1、A2站位物种数量略低于其他非赤潮发生站位, 贝类养殖区的C1、C2站位物种数较多。
| 站位 | 门 | 纲 | 目 | 科 | 属 | 种 |
| A1 | 18 | 31 | 93 | 163 | 272 | 288 |
| A2 | 16 | 31 | 91 | 162 | 270 | 290 |
| A3 | 20 | 36 | 103 | 183 | 290 | 305 |
| B1 | 21 | 35 | 103 | 183 | 309 | 338 |
| B3 | 23 | 38 | 109 | 199 | 353 | 382 |
| C1 | 21 | 36 | 106 | 198 | 348 | 383 |
| C2 | 25 | 51 | 132 | 225 | 373 | 400 |
| C3 | 22 | 35 | 106 | 191 | 325 | 346 |
所调查海域表层海水中, 浮游细菌相对丰度前十的细菌门类包括变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、蓝细菌门(Cyanobacteria)、SAR406类群、疣微菌门(Verrucomicrobia)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、Patescibacteria, 其中, 变形菌门在各个站位均为最优菌门(图 4a)。C2站位的变形菌门相对丰度最低, 但疣微菌门、酸杆菌门的相对丰度有所增加。A1、A2站位的蓝细菌门相对丰度较其他站位低, 厚壁菌门在B3站位有明显优势。
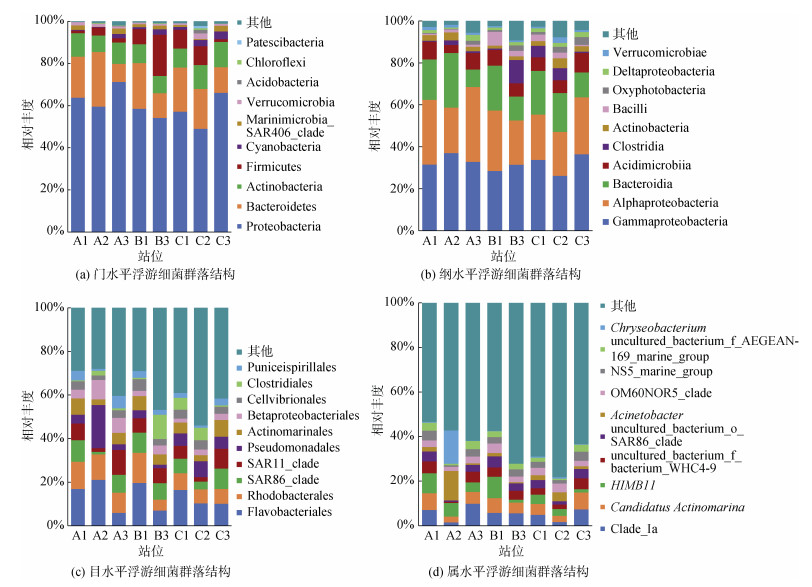 |
| 图 4 2020年11月12日海州湾表层海水浮游细菌群落结构 Fig. 4 Bacterial community structure in the surface water of Haizhou Bay on November 12, 2020 |
纲水平上, 相对丰度较高的是γ-变形菌纲(Gammaproteobacteria)、α-变形菌纲(Alphaproteobacteria)、拟杆菌纲(Bacteroidia)、酸微菌纲(Acidimicrobiia)、梭菌纲(Clostridia)、放线菌纲(Actinobacteria)、芽孢杆菌纲(Bacilli)、产氧光细菌纲(Oxyphotobacteria)、δ-变形菌纲(Deltaproteobacteria)。A1、A2站产氧光细菌的相对丰度明显低于其他站位, B3、C1、C2站位的梭菌纲相对丰度较高(图 4b)。
目水平上(图 4c), A2站位的假单胞菌目(Pseudomonadales)的相对丰度明显高于其他站位, 为19.8%, 而该站位的SAR11、SAR86类群的相对丰度则较低。属水平上(图 4d), A2站位的优势属为不动杆菌属(Acinetobacter)和金黄杆菌属(Chryseobacterium), 相对丰度分别为13.3%、15.0%。
2.3 弧菌平板计数结果各站位弧菌平板计数结果显示(图 5), 所调查海域表层海水的弧菌密度变化范围为500~6 100 CFU/L, 位于贝类养殖区的C2站位弧菌密度较高, 达到6 100 CFU/L。由于A1、A3站位样品损失, 未能对A1、A3站位的弧菌进行计数。
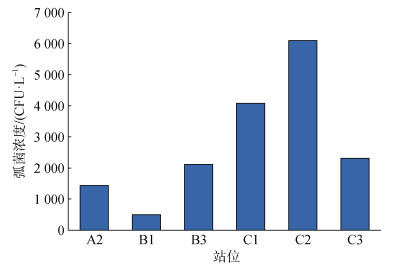 |
| 图 5 2020年11月12日海州湾表层海水中的弧菌密度 Fig. 5 Vibrio density in the surface water of Haizhou Bay on November 12, 2020 |
航次调查所获得的环境因子数据如表 3所示。调查当日, 各站位的表层水温变化范围为15.7~17.7℃, 平均水温16.8℃, 盐度变化范围为26.9~29.5, 平均盐度28.6, 调查海域东南侧的温度、盐度较高。
| 站位 | A1 | A2 | A3 | B1 | B3 | C1 | C2 | C3 |
| 温度/(℃) | 15.7 | 15.9 | 16.8 | 16.6 | 17.6 | 16.8 | 17.1 | 17.7 |
| 盐度 | 26.94 | 27.19 | 29.55 | 28.77 | 29.44 | 28.76 | 28.89 | 29.43 |
| 叶绿素a/(µg/L) | 14.0 | 14.6 | 2.4 | 7.5 | 2.5 | 2.8 | 3.3 | 2.3 |
| 硝酸盐/(µmol/L) | 12.04 | 8.89 | 15.66 | 13.48 | 13.14 | 12.33 | 13.66 | 11.62 |
| 亚硝酸盐/(µmol/L) | 1.40 | 0.79 | 1.88 | 1.38 | 1.33 | 1.15 | 1.34 | 1.22 |
| 铵盐/(µmol/L) | 0.81 | 0.58 | 0.75 | 0.66 | 0.69 | 1.31 | 1.34 | 0.56 |
| DON/(µmol/L) | 11.81 | 6.74 | 44.63 | 43.38 | 39.14 | 17.37 | 35.54 | 26.88 |
| 磷酸盐/(µmol/L) | 0.21 | 0.15 | 0.43 | 0.22 | 0.28 | 0.25 | 0.23 | 0.27 |
| DOP/(µmol/L) | 0.27 | 0.20 | 0.17 | 0.24 | 0.19 | 0.19 | 0.21 | 0.18 |
| 硅酸盐/(µmol/L) | 10.44 | 10.78 | 13.53 | 12.82 | 10.72 | 8.46 | 10.04 | 9.64 |
溶解态有机氮(DON)是调查海域氮元素的主要形态, 浓度变化范围为6.74~44.63 μmol/L。各站位的溶解态无机氮(DIN)以硝酸盐为主, 浓度变化范围为8.89~15.66 μmol/L, 除A2站位外, 其余站位硝酸盐浓度均超过10 μmol/L。亚硝酸盐浓度与铵盐浓度相近, 其浓度变化范围分别为0.79~1.88 μmol/L, 0.56~ 1.34 μmol/L。发生赤潮的A2站位各形态氮的浓度都很低。南侧站位的硝酸盐、亚硝酸盐浓度较高, 北侧站位铵盐的浓度较高。
所调查海域的磷酸盐、溶解态有机磷(DOP)浓度相近, 其浓度变化范围分别为0.15~0.43 μmol/L, 0.17~0.27 μmol/L, A2站位的磷酸盐浓度最低。南侧站位的磷酸盐浓度较高, 而西北侧站位的DOP浓度较高。硅酸盐浓度变化范围为8.46~13.53 μmol/L, 湾口附近的东北侧站位硅酸盐浓度较低。
2.5 表层海水中优势浮游细菌与环境因子相关性分析Spearman相关性分析显示(表 4), 黄杆菌目与叶绿素a显著正相关, 与盐度以及磷酸盐浓度显著负相关。浮游植物生物量的增加可能有利于黄杆菌目的繁殖。
| 黄杆菌目 | 红杆菌目 | SAR86_clade | SAR11_clade | 假单胞菌目 | |
| 温度 | –0.667 | –0.857** | –0.071 | 0.190 | –0.143 |
| 叶绿素a | 0.881** | 0.595 | –0.262 | –0.667 | 0.452 |
| 盐度 | –0.881** | –0.571 | 0.024 | 0.524 | –0.571 |
| 磷酸盐 | –0.952** | –0.595 | 0.143 | 0.643 | –0.619 |
| 铵盐 | –0.143 | –0.190 | –0.214 | –0.190 | 0.095 |
| 亚硝酸盐 | –0.357 | 0.286 | 0.571 | 0.619 | –0.619 |
| 硝酸盐 | –0.524 | –0.143 | –0.024 | 0.238 | –0.476 |
| 硅酸盐 | 0.000 | 0.452 | 0.024 | 0.190 | –0.452 |
| DOP | 0.690 | 0.452 | 0.119 | –0.429 | 0.167 |
| DON | –0.619 | –0.143 | 0.190 | 0.476 | –0.714* |
| *表示在0.05级别相关性显著, **表示在0.01级别相关性显著 | |||||
海州湾此次赤潮主要由三叶原甲藻、赤潮异弯藻和塔胞藻引起, 是海州湾海域目前记录到的发生时间较晚的赤潮。发生赤潮的站位表层海水平均温度为15.8℃, 平均盐度27, 无机氮浓度低, 可能是赤潮藻类生长繁殖的消耗所致。发生赤潮的A1、A2站位位于紫菜及贝类混合养殖区, 出海调查时观察到这两站位的紫菜幼苗生长状态不佳。11月紫菜处在幼苗阶段, 对硝酸盐的吸收转化能力弱, 可能使赤潮藻类有充足的营养物质来进行增殖。
三叶原甲藻、塔胞藻很少作为赤潮优势种被报道。全球有害藻华事件数据库(Harmful Algae Event Database, HAEDAT)的记录显示, 三叶原甲藻曾在美国、墨西哥、南非、希腊、德国、日本、韩国等国家引发过赤潮。在我国, 三叶原甲藻曾在东海引发过赤潮, 其暴发时间常集中在5月份, 暴发时水温多在18℃以上, 盐度高于27[18-19]。朱旭宇等[20]对连云港近岸海域浮游植物的调查显示, 三叶原甲藻是秋季海州湾近岸海域的优势种, 但该海域还未有过三叶原甲藻赤潮暴发的记录。三叶原甲藻不会产生对鱼类有害的毒素, 但是其消退过程会消耗水体中的氧气。2015年, 南非发生的大面积三叶原甲藻赤潮期间, 水体中溶解氧浓度降至0.06 mL/L, 导致了岩龙虾(Jasus lalandii)在内的大量海洋生物缺氧死亡[21]。塔胞藻在海州湾非条斑紫菜养殖海区具有优势[22], 而此次塔胞藻暴发出现在紫菜养殖区。条斑紫菜养殖对塔胞藻生长的影响还需要一步探究。
赤潮异弯藻在我国渤海、黄海、东海均有分布。2004—2017年, 海州湾区域发生过3次由赤潮异弯藻引发的赤潮, 发生时间集中在5—6月[8, 23], 而此次赤潮出现在11月份。赤潮异弯藻在15~30℃温度范围内能够生长, 对盐度具有广泛适应性[24]。2008年5月, 海州湾东、西连岛附近发生赤潮异弯藻赤潮时, 水温为18~19℃, 盐度由30下降到28[25]。本次调查中, 发生赤潮的站位盐度较其他站位低, 盐度与赤潮异弯藻分布有一定的联系。
这次赤潮对所调查海域的浮游细菌群落造成了影响。发生赤潮的站位浮游细菌多样性略低于其他站位, 浮游细菌物种数相对减少, 优势细菌也与其他站位明显不同。红杆菌目、黄杆菌目在赤潮发生站位的相对丰度较高, 这两类细菌能够对环境变化做出迅速的反应[26], 在硅藻、甲藻及球形棕囊藻赤潮环境中也具有优势地位[27-29]。此次调查中, 红杆菌目下的HIMB11细菌具有优势。HIMB11细菌属于玫瑰杆菌类群, 玫瑰杆菌在藻华期间, 尤其是那些产生DMSP的藻华期间丰度往往较高[30-31]。HIMB11细菌有多种能量代谢途径, 不仅可以使用DMSP和CO进行代谢, 还能利用光能维持生长[32]。此次赤潮优势藻种的代谢产物可能有利于HIMB11细菌的迅速生长。黄杆菌目与叶绿素a呈正相关关系, 这可能与黄杆菌目的溶藻作用有关[33]。
发生赤潮的A1、A2站位浮游细菌群落结构也存在差异, A1站位SAR11类群、SAR86类群的相对丰度高于A1, 而A2站位假单胞菌目具有明显优势。在赤潮的发展过程中, 浮游细菌群落也在发生动态变化[34], A1与A2之间的差异性可能反映了这两站位处于不同的赤潮发展阶段。研究表明, 在东海原甲藻赤潮中期, 红杆菌科、SAR11及SAR86类群对细菌群落贡献较大[35], A1可能处于赤潮发展中期。假单胞菌目中的多种细菌都具有溶藻作用[36], 大量假单胞菌目细菌的出现说明A2站位的赤潮可能在经历消退的过程, 在黄海中部一次红色中缢虫赤潮消退过程中也有假单胞菌目相对丰度增加的现象[37]。值得注意的是, 在本次赤潮中假单胞菌目呈现出优势, 而在北部湾球形棕囊藻赤潮中期, 则是假交替单胞菌占据优势[34]。不同的赤潮原因种产生不同形式的有机质, 可能支持不同细菌的生长, 从而使菌落结构的变化呈现出不同的特点。假单胞菌目与此次赤潮原因种之间的关系还需进一步研究。
除了赤潮, 贝类养殖活动也是影响调查海域浮游细菌群落的因素。位于贝类吊养区的C2站位, 浮游细菌多样性高, 物种数量多, 养殖区丰富的有机质有利于细菌的生长繁殖。贝类养殖区的弧菌密度高于发生赤潮的站位, 相较于赤潮生物产生的有机质, 弧菌可能更偏好于养殖区的营养条件。
4 结论1) 2020年11月, 海州湾赤潮的优势种为三叶原甲藻、赤潮异弯藻及塔胞藻。
2) 发生赤潮站位的浮游细菌多样性略低于其他非赤潮发生站位, 其优势细菌与非赤潮站位有明显不同, 以假单胞菌目、红杆菌目、黄杆菌目为主。
3) 黄杆菌目与叶绿素a显著正相关, 表明其与赤潮发生有一定的关系。
| [1] |
于仁成, 吕颂辉, 齐雨藻, 等. 中国近海有害藻华研究现状与展望[J]. 海洋与湖沼, 2020, 51(4): 768-788. YU Rencheng, LÜ Songhui, QI Yuzao, et al. Progress and perspectives of harmful algal bloom studies in China[J]. Oceanologia et Limnologia Sinica, 2020, 51(4): 768-788. |
| [2] |
LANDSBERG J H. The effects of harmful algal blooms on aquatic organisms[J]. Reviews in Fisheries Science, 2002, 10(2): 113-390. DOI:10.1080/20026491051695 |
| [3] |
常虹, 王博, 姚蜜蜜, 等. 深圳大鹏湾海域锥状斯氏藻赤潮期间细菌群落结构变化研究[J]. 现代生物医学进展, 2014, 14(10): 1801-1807. CHANG Hong, WANG Bo, YAO Mimi, et al. Structural dynamic of bacterial community associated with a Scrippsiella Trochoidea bloom in Dapeng Bay of Shenzhen[J]. Progress in Modern Biomedicine, 2014, 14(10): 1801-1807. DOI:10.13241/j.cnki.pmb.2014.10.001 |
| [4] |
ZHOU J, LAO Y M, SONG J T, et al. Temporal heterogeneity of microbial communities and metabolic activities during a natural algal bloom[J]. Water Research, 2020, 183: 116020. DOI:10.1016/j.watres.2020.116020 |
| [5] |
BUCHAN A, LECLEIR G R, GULVIK C A, et al. Master recyclers: features and functions of bacteria associated with phytoplankton blooms[J]. Nature Reviews Microbiology, 2014, 12: 686-698. DOI:10.1038/nrmicro3326 |
| [6] |
郑天凌, 苏建强. 海洋微生物在赤潮生消过程中的作用[J]. 水生生物学报, 2003, 27(3): 291-295. ZHENG Tianling, SU Jianqiang. The role of marine microorganisms in the occurrence and declination of red-tide[J]. Acta Hydrobiologica Sinica, 2003, 27(3): 291-295. DOI:10.3321/j.issn:1000-3207.2003.03.015 |
| [7] |
高清清, 曹兵, 杨波, 等. 江苏海域赤潮分布特征研究[J]. 海洋通报, 2017, 36(2): 217-229. GAO Qingqing, CAO Bing, YANG Bo, et al. Characteristics of the red tide in the sea area of Jiangsu[J]. Marine Science Bulletin, 2017, 36(2): 217-229. |
| [8] |
孔凡洲, 姜鹏, 魏传杰, 等. 2017年春、夏季黄海35°N共发的绿潮、金潮和赤潮[J]. 海洋与湖沼, 2018, 49(5): 1021-1030. KONG Fanzhou, JIANG Peng, WEI Chuanjie, et al. Co-occurrence of green tide, golden tide and red tides along the 35°N transect in the Yellow Sea during spring and summer in 2017[J]. Oceanologia et Limnologia Sinica, 2018, 49(5): 1021-1030. |
| [9] |
王以斌, 刘军, 邵帅, 等. 连云港近岸海域2011-2016年环境变化研究[J]. 中国环境科学, 2019, 39(8): 3430-3440. WANG Yibin, LIU Jun, SHAO Shuai, et al. 2011-2016 marine environment temporal variations research in the Lianyungang coastal area[J]. China Environmental Science, 2019, 39(8): 3430-3440. DOI:10.3969/j.issn.1000-6923.2019.08.037 |
| [10] |
王娟, 曹雷. 紫菜养殖对海州湾水质影响分析[J]. 环境科技, 2020, 33(5): 54-58, 64. WANG Juan, CAO Lei. Effect of laver culture on water quality in Haizhou Bay[J]. Environmental Science and Technology, 2020, 33(5): 54-58, 64. DOI:10.19824/j.cnki.cn32-1786/x.2020.0076 |
| [11] |
张颖雪, 苏洁, 樊景凤, 等. 海水养殖贝类弧菌病流行暴发及其环境影响因素研究进展[J]. 海洋环境科学, 2020, 39(3): 480-487. ZHANG Yingxue, SU Jie, FAN Jingfeng, et al. Outbreaks of Vibriosis in mariculture shellfish and its research progress[J]. Marine Environmental Science, 2020, 39(3): 480-487. DOI:10.13634/j.cnki.mes.2020.03.024 |
| [12] |
MARTIN G, RUBIN N, SWANSON E. Vibrio parahaemolyticus and V. harveyi cause detachment of the epithelium from the midgut trunk of the penaeid shrimp Sicyonia ingentis[J]. Diseases of Aquatic Organisms, 2004, 60(1): 21-29. |
| [13] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 海洋监测规范GB17378-2007[S]. 北京: 中国标准出版社, 2008. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. The specification for marine monitoring GB 17378-2007[S]. Beijing: Standards Press of China, 2008. |
| [14] |
国家海洋局. 海洋赤潮监测技术规程HYT 069-2005[S]. 北京: 中国标准出版社, 2005. State Oceanic Administration. Technical specification for red tide monitoring HYT 069-2005[S]. Beijing: Standards Press of China, 2005. |
| [15] |
王红霞, 陆斗定, 何飘霞, 等. 东海三叶原甲藻(Prorocentrum triestinum)的形态特征及其ITS序列分析[J]. 海洋学报, 2012, 34(4): 155-162. WANG Hongxia, LU Douding, HE Piaoxia, et al. Morphological characteristic and ITS sequence analysis of Prorocentrum triestinum isolated from the East China Sea[J]. Acta Oceanologica Sinica, 2012, 34(4): 155-162. |
| [16] |
郭玉洁. 大连湾赤潮生物——赤潮异弯藻[J]. 海洋与湖沼, 1994, 25(2): 212-215. GUO Yujie. Studies on Heterosigma akashiwo (hada) hada in the Dalian Bight, Liaoning, China[J]. Oceanologia et Limnologia Sinica, 1994, 25(2): 212-215. |
| [17] |
MCFADDEN G I, HILL D, WETHERBEE R. A study of the genus Pyramimonas (Prasinophyceae) from southeastern Australia[J]. Nordic Journal of Botany, 2010, 6(2): 209-234. |
| [18] |
李扬, 吕颂辉, 江天久, 等. 南麂列岛海域原甲藻种群动态及其环境影响因子分析[J]. 水生生物学报, 2009, 33(2): 236-245. LI Yang, LÜ Songhui, JIANG Tianjiu, et al. Dynamics of Prorocentrum population and its relation with environmental factors in Nanji Islands sea area[J]. Acta Hydrobiologica Sinica, 2009, 33(2): 236-245. |
| [19] |
李道季, 曹勇, 张经. 长江口尖叶原甲藻赤潮消亡期叶绿素连续观测[J]. 中国环境科学, 2002, 22(5): 400-403. LI Daoji, CAO Yong, ZHANG Jing. Continuous observation of chlorophyll in Prorocentrum triestinum of the Changjiang (Yangtze River) Estuary in the red tide dying time[J]. China Environmental Science, 2002, 22(5): 400-403. DOI:10.3321/j.issn:1000-6923.2002.05.005 |
| [20] |
朱旭宇, 许海华, 许娴, 等. 连云港邻近海域网采浮游植物分布特征及其影响因素[J]. 应用海洋学学报, 2017, 36(3): 385-394. ZHU Xuyu, XU Haihua, XU Xian, et al. Community composition of net-collected phytoplankton and its relation to environmental factors near Lianyungang sea area[J]. Journal of Applied Oceanography, 2017, 36(3): 385-394. DOI:10.3969/J.ISSN.2095-4972.2017.03.012 |
| [21] |
NDHLOVU A, DHAR N, GARG N, et al. A red tide forming dinoflagellate Prorocentrum triestinum: identification, phylogeny and impacts on St Helena Bay, South Africa[J]. Phycologia, 2019, 56: 649-665. |
| [22] |
王洪斌, 李信书, 宋秀梅, 等. 海州湾条斑紫菜养殖对浮游藻类群落结构及遗传多样性的影响[J]. 海洋科学, 2014, 38(12): 103-109. WANG Hongbin, LI Xinshu, SONG Xiumei, et al. Effect of Porphyra yezoensis farming on the structure and genetic diversity of phytoplankton community in Haizhou Bay[J]. Marine Sciences, 2014, 38(12): 103-109. |
| [23] |
矫新明, 徐虹, 花卫华, 等. 海州湾海域的赤潮生物[J]. 水产养殖, 2010, 31(5): 25-29. JIAO Xinming, XU Hong, HUA Weihua, et al. The red tide organisms in Haizhou Bay[J]. Journal of Aquaculture, 2010, 31(5): 25-29. DOI:10.3969/j.issn.1004-2091.2010.05.007 |
| [24] |
颜天, 周名江, 钱培元. 赤潮异弯藻Heterosigma akashiwo的生长特性[J]. 海洋与湖沼, 2002, 33(2): 209-214. YAN Tian, ZHOU Mingjiang, QIAN Peiyuan. Growth of fish-killing red tide species Raphidophyte Heterosigma akashiwo[J]. Oceanologia et Limnologia Sinica, 2002, 33(2): 209-214. DOI:10.3321/j.issn:0029-814X.2002.02.014 |
| [25] |
杨志远, 徐虹. 海州湾海域一次赤潮异弯藻赤潮与环境因子的关系[J]. 水产养殖, 2012, 33(4): 17-19. YANG Zhiyuan, XU Hong. A bloom of Heterosigma akashiwo and its correlation with environmental factors[J]. Journal of Aquaculture, 2012, 33(4): 17-19. DOI:10.3969/j.isssn.1004-2091.2012.04.005 |
| [26] |
BRINKHOFF T, GIEBEL H, SIMON M. Diversity, ecology, and genomics of the Roseobacter clade: a short overview[J]. Archives of Microbiology, 2008, 189(6): 531-539. DOI:10.1007/s00203-008-0353-y |
| [27] |
PINHASSI J, SALA M, HAVSKUM H, et al. Changes in bacterioplankton composition under different phytoplankton regimens[J]. Applied Environmental Microbiology, 2004, 70(11): 6753-6766. DOI:10.1128/AEM.70.11.6753-6766.2004 |
| [28] |
BERND W, FRANZISKA W, JACQUELINE H, et al. The green impact: bacterioplankton response toward a phytoplankton spring bloom in the southern North Sea assessed by comparative metagenomic and meta transcriptomic approaches[J]. Frontiers in Microbiology, 2015, 6: 805. |
| [29] |
PINHASSI J, SIMÓ R, GONZÁLEZ J, et al. Dimethyl sulfoniopropionate turnover is linked to the composition and dynamics of the bacterioplankton assemblage during a microcosm phytoplankton bloom[J]. Applied Environmental Microbiology, 2005, 71(12): 7650-7660. DOI:10.1128/AEM.71.12.7650-7660.2005 |
| [30] |
GONZÁLEZ J M, SIMÓ R, MASSANA R, et al. Bacterial community structure associated with a dimethylsulfoniopropionate-producing North Atlantic algal bloom[J]. Applied Environmental Microbiology, 2000, 66(10): 4237-4246. DOI:10.1128/AEM.66.10.4237-4246.2000 |
| [31] |
YEO S K, HUGGETT M J, EILER A, et al. Coastal bacterioplankton community dynamics in response to a natural disturbance[J]. PLoS One, 2013, 8: e56207. DOI:10.1371/journal.pone.0056207 |
| [32] |
DURHAM B P, GROTE J, WHITTAKER K A, et al. Draft genome sequence of marine alphaproteobacterial strain HIMB11, the first cultivated representative of a unique lineage within the Roseobacter clade possessing an unusually small genome[J]. Standards in Genomic Sciences, 2014, 9: 632-645. DOI:10.4056/sigs.4998989 |
| [33] |
MAYALI X, AZAM F. Algicidal bacteria in the sea and their impact on algal blooms[J]. Journal of Eukaryotic Microbiology, 2004, 51(2): 139-144. DOI:10.1111/j.1550-7408.2004.tb00538.x |
| [34] |
LI N, ZHAO H X, JIANG G L X, et al. Phylogenetic responses of marine free-living bacterial community to Phaeocystis globosa bloom in Beibu Gulf, China[J]. Frontiers in Microbiology, 2020, 11: 1624. DOI:10.3389/fmicb.2020.01624 |
| [35] |
LI D X, ZHANG H, CHEN X H, et al. Metaproteomics reveals major microbial players and their metabolic activities during the blooming period of a marine dinoflagellate Prorocentrum donghaiense[J]. Environmental Microbiology, 2018, 20(2): 632-644. DOI:10.1111/1462-2920.13986 |
| [36] |
COYNE K J, WANG Y F, JOHNSON G. Algicidal bacteria: a review of current knowledge and applications to control harmful algal blooms[J]. Frontiers in Microbiology, 2022, 13: 871177. DOI:10.3389/fmicb.2022.871177 |
| [37] |
MIN L, TIAN X, SUN J, et al. Bacterial community structures associated with a natural spring phytoplankton bloom in the Yellow Sea, China[J]. Deep-Sea Research Part Ⅱ, 2013, 97: 85-92. DOI:10.1016/j.dsr2.2013.05.016 |
 2023, Vol. 47
2023, Vol. 47


