中国海洋湖沼学会主办。
文章信息
- 黄春秀, 董焕嫦, 吴海燕, 谭志军, 李扬. 2017.
- HUANG Chun-Xiu, DONG Huan-Chang, WU Hai-Yan, TAN Zhi-Jun, LI Yang. 2017.
- 福氏拟菱形藻(Pseudo-nitzschia fukuyoi)——中国产毒拟菱形藻的新记录
- PSEUDO-NITZSCHIA FUKUYOI-A NEW RECORD OF TOXIC PSEUDO-NITZSCHIA TAXA FROM CHINA
- 海洋与湖沼, 48(5): 1014-1021
- Oceanologia et Limnologia Sinica, 48(5): 1014-1021.
- http://dx.doi.org/10.11693/hyhz20170200032
-
文章历史
- 收稿日期:2017-02-18
- 收修改稿日期:2017-06-01
2. 华南师范大学生命科学学院 广东省水产健康安全养殖重点实验室 广州 510631;
3. 中国水产科学研究院黄海水产研究所 农业部水产品质量安全检测与评价重点实验室 青岛 266071
2. Guangdong Provincial key Laboratory of Healthy and Safe Aquaculture, College of Life Science, South China Normal University, Guangzhou 510631, China;
3. Key Laboratory of Testing and Evaluation for Aquatic Product Safety and Quality, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China
拟菱形藻(Pseudo-nitzschia Peragallo)广泛分布于全球近岸水域, 是记忆缺失性贝毒(amnesic shellfish poisoning, ASP)——多莫酸(domoic acid, DA)的重要生物来源(Lelong et al, 2012; Trainer et al, 2012)。自1987年引发首次ASP中毒事件之后(Bates et al, 1989), 拟菱形藻和DA备受关注。DA能够沿着食物链在各级海洋生物体内累积, 并最终危害鸟类、海狮、鲸鱼、人类等高等动物(Lelong et al, 2012; Trainer et al, 2012)。截至目前, 全球已记录了49种拟菱形藻, 其中有26种能够产生DA(Teng et al, 2016; Li et al, 2017; Moestrup et al, 2017)。
以往研究发现拟菱形藻在我国沿海广泛分布(吕颂辉等, 1992; 钱宏林等, 2000; 陈菊芳等, 2002; 李扬等, 2010; Lü et al, 2012), 并常常在春季和夏季达到较高细胞丰度, 甚至引发藻华(陈菊芳等, 2005; Lü et al, 2012)。另外, 全球已报道的能够产生DA的26个拟菱形藻物种之中(Teng et al, 2016; Li et al, 2017; Moestrup et al, 2017), 有16种在我国沿海有分布(李扬等, 2010; Lü et al, 2012; 徐国双等, 2015; Li et al, 2017)。我国学者曾对中国海域多个拟菱形藻物种, 如尖刺拟菱形藻(P. pungens)(Li et al, 2005)、尖细拟菱形藻(P. cuspidata)和多纹拟菱形藻(P. multistriata)(邢小丽等, 2007)、银河拟菱形藻(P. galaxiae)和微孔拟菱形藻(P. micropora)(徐国双等, 2015)、并基拟菱形藻(P. decipiens)(黄春秀等, 2017)等开展产毒能力研究, 均未检测到DA。但是, Li等(2017)在广东沿海分离鉴定了一个新种:伪装拟菱形藻(P. simulans), 并在其培养株系中检测到DA, 单细胞产毒水平是1.05—1.54×10-3pg, 这是关于我国产毒拟菱形藻的唯一报道。但这并不意味着我国海域中产毒拟菱形藻物种多样性低, 因为近年在我国沿海多个区域的海产品中均检出DA, 如大连、湛江、北海和舟山海域(宋琍琍等, 2008; 吉薇等, 2011; 王恒, 2011), 这表明中国海域DA分布广泛, 且作为海域DA重要产生者——可产毒的拟菱形藻在我国近海分布也可能较为广泛, 物种多样性也较高。但目前相关认识还非常少, 因此本文基于建立的单克隆培养株系, 对中国沿海拟菱形藻开展了种源信息和产毒特征的分析, 增加对我国海域拟菱形藻属物种多样性和产毒能力的认识。
1 材料和方法 1.1 单克隆藻株的建立本实验室于2016年8月在广东大亚湾海域, 利用浮游植物网(孔径10μm)进行水平拖网, 并尽快带回实验室。利用毛细管复洗法在倒置显微镜(Mshot MI-12, 广州明美科技有限公司, 中国)下分离目标藻细胞, 经过多次水洗和转移, 以确保目标藻的纯化。最后转移至预先滴有L1培养基的48孔细胞培养板中(Guillard et al, 1993; Lundholm et al, 2006), 放置在光照强度约50—80μmol photons/(m2·s)、光周期12h﹕12h、温度20±2℃的条件下培养。待其存活并繁殖达到约100个藻细胞之后, 转移到盛有L1培养基的100mL锥形瓶中培养, 以MC(Marine collection)序列进行编号。
1.2 卤虫和轮虫的培养及诱导将市场中购买的卤虫(Artemia salina)卵置于浓度200mg/L的福尔马林溶液中浸泡30min消毒, 再用灭菌人工海水冲洗至无气味, 投入经过灭菌处理的L1培养基中, 培养温度等条件与拟菱形藻培养条件一样。约10d后, 将10—20个成体的卤虫用毛细管复洗法转移到盛有L1培养基(已加入约100个藻细胞)的锥形瓶中。同样, 将市场上购买回来的褶皱臂尾轮虫(Brachionus plicatilis)活体, 用毛细管复洗法分离10—20个转移到培养基中。然后放置在光照强度约50—80μmol photons/(m2·s)、光周期12h﹕12h、温度20±2℃的条件下培养。
1.3 形态学观察光学显微镜(light microscopy, LM)观察:取处于对数生长期的藻液0.1mL, 滴在载玻片上, 盖上玻片后, 利用正置光学显微镜(Olympus BX53, 日本)进行微分干涉(differential interference contrast, DIC)的观察, 并使用Olympus DP27数码相机拍照, 在Olympus CellSens软件上获取图像信息。主要观察群体特征、细胞色素体形态等。
透射电子显微镜(transmission electron microscopy, TEM)观察:取对数生长期的藻液2mL, 加入等量浓硫酸(>95%)以去除有机质, 然后用蒸馏水多次水洗至中性(徐国双等, 2015)。用微量进样器吸取5—10μL酸化后的水样, 滴加在喷镀碳膜的铜网(100目)上, 自然晾干后, 即可在透射电镜(日立JEM-1010, 日本)下观察和拍照。主要观察壳面超微结构, 如点条纹、肋突、孔纹等。
1.4 分子系统学分析离心法收集处于对数生长期的藻细胞, 进行总DNA的提取(Lundholm et al, 2002)。利用引物ITS1和ITS4进行核糖体转录间隔区(ITS)的扩增和测序(Lim et al, 2013)。PCR产物送至上海立菲生物科技有限公司进行纯化和测序。从NCBI下载拟菱形藻种类的ITS nrDNA序列, 使用BioEdit软件进行序列的比对和矩阵(Lim et al, 2013)。基于MrModeltest 2.3软件的计算, 选择最适模型和参数为GTR+I+G, 用MrBayes 3.2软件(Ronquist et al, 2012)构建贝叶斯推理树(Bayesian inference, BI), 用RAxML-HPC2软件(Miller et al, 2010)构建最大似然树(maximum likelihood, ML)。以奇异棍形藻(Bacillaria paxillifer)、新月细柱藻(Cylindrotheca closterium)和船斑菱形藻(Nitzschia navis-varingica)为群外对照(Teng et al, 2014)。
1.5 ITS2二级结构的预测及CBCs分析从GenBank下载福氏拟菱形藻的ITS nrDNA序列, 参考序列标注, 将其ITS2片段截下。使用Mfold软件(Percopo et al, 2016)在线预测其ITS2的二级结构, 所得二级结构含4个环和一个拟菱形藻属环。以福氏拟菱形藻的二级结构为同源模板, 使用ITS2 Database软件(Percopo et al, 2016)在线预测本文的5个福氏拟菱形藻单克隆株系, 与其亲缘关系最接近的伪柔弱拟菱形藻(P. pseudodelicatissima)和尖细拟菱形藻的RNA二级结构。最后使用VARNA软件(Lim et al, 2013)观察并下载二级结构。同时使用4SALE v.1.7软件(Lim et al, 2013)中自带的补偿碱基变化(compensatory base changes, CBCs)功能观察CBC差异, 分析生殖隔离情况。
1.6 LC-MS/MS法检测藻毒素取处于生长稳定期中后期的藻液300—600mL, 藻细胞浓度约5×105cell/mL, 经0.2μm醋酸纤维滤膜过滤, 压力不高于0.5Pa, 收集藻细胞立刻置于-20℃冰箱中保存; 另外取5mL混匀的藻细胞加2mL鲁格试剂于-4℃保存, 用于单细胞产毒量的计算。将已收集的藻细胞加4mL甲醇水(甲醇﹕水=1﹕1) 充分混匀, 用超声波细胞粉碎机冰浴破碎5min, 经0.22μm滤膜过滤, 滤液于-20℃下保存备用。本实验样品皆寄往中国水产科学研究院黄海水产研究所上机检测。
采用Prominence UFLC超快速液相色谱(Shimadzu公司)和5500 QTRAP四极杆-线性离子阱复合质谱检测系统(SCIEX公司)对预处理的样品进行DA检测, 参见Wu等(2014)方法进行分析。DA标准品购自德国Sigma公司。
2 结果 2.1 形态学描述福氏拟菱形藻(Pseudo-nitzschia fukuyoi Lim, Teng, Leaw & Lim)(图 1a—g)细胞具有两个黄褐色的色素体, 对称分布在横轴两侧, 可形成链状群体, 细胞间重叠部为壳面全长的1/4—1/5(图 1a, b)。细胞壳面呈线形至披针形(图 1a, b), 壳面两端相似, 呈箭头状(图 1c, d), 环面观时两壳端形状稍微呈S型(图 1b)。壳面长49—55μm, 宽2.1—2.5μm。管壳缝强烈偏心, 具有中央较大船骨点(图 1e)。壳套高1—2个孔纹, 中部高2个孔纹(图 1e), 接近两端高1个孔纹(图 1d)。肋突分布在壳缘, 排列不规则(图 1e), 密度为16—21个/10μm。点条纹由一排孔纹组成(图 1e, f), 密度为34—39条/10μm。孔纹形状为圆形或方形, 孔纹内部的筛板膜分成1—5个分区, 以2—3个分区为主, 每个分区为不规则的六边形, 可见少部分分区在孔纹中央(图 1f), 孔纹密度为4—6个/1μm。可观察到三条环带, 壳环带宽2个孔纹, 高3—4个孔纹, 点条纹密度44—46个/10μm(图 1h), 孔纹内部有裂缝, 分成不规则的六边形, 接近两端出现壳环带高2个孔纹(图 1g); 第二条环带点条纹由一排孔纹组成(图 1g), 孔纹内部都是由六边形的筛孔构成(图 1g)。第三条环带只有一排纵向排列的孔纹。
 |
| 图 1 福氏拟菱形藻的显微照片 Fig. 1 Microscope images of Pseudo-nitzschia fukuyoi 注: a—b.光学显微镜图, 示2个细胞的链状群体; c—h.透射电子显微镜图; c.壳面外形, d.壳端, e.壳面中部放大, f.壳面局部放大; g—h.环带; a—b图中标尺为20μm, c图中标尺为5μm, d图中标尺为1μm, e和g—h图中标尺为0.5μm, f图中标尺为0.2μm; VC代表壳环带, Ⅱ代表第二条环带, Ⅲ代表第三条环带。 |
本种营海水浮游生活, 此前有产生DA的报道, 单细胞产毒量为3.85—4.54pg(Dao et al, 2015), 本文亦检测到DA的存在, 单细胞产毒水平为0.02—0.23pg。本种采自广东大亚湾(8月), 也曾报道被发现于马来西亚和越南(Lim et al, 2013; Dao et al, 2015; Teng et al, 2016)。
2.2 基于ITS序列分析的分子系统学分析对ITS1-5.8S-ITS2序列的972个碱基进行了比对分析, 建立的最大似然树和贝叶斯推理树具有相同的结构, 合并形成图 2。MC3284、MC3286、MC3303和MC3323的基因完全相同, 与MC3344有1个碱基的差异。前4个株系与马来西亚株系PnKk36、Pnmi158的基因完全相同, 与马来西亚株系PnTb25、PnTb39有1个碱基差异, 但是与马来西亚株系PnLk02遗传差异较大, 有6个碱基差异。由于越南株系Pn5、Pn6的ITS序列尚未上传到NCBI, 因此暂未作比对。本文建立的5个株系与已报道的5株马来西亚福氏拟菱形藻聚在同一个分支上, 且具有较高的置信值(BPP=1, ML=99), 这表明分子分类的结果也支持形态鉴定的结论。
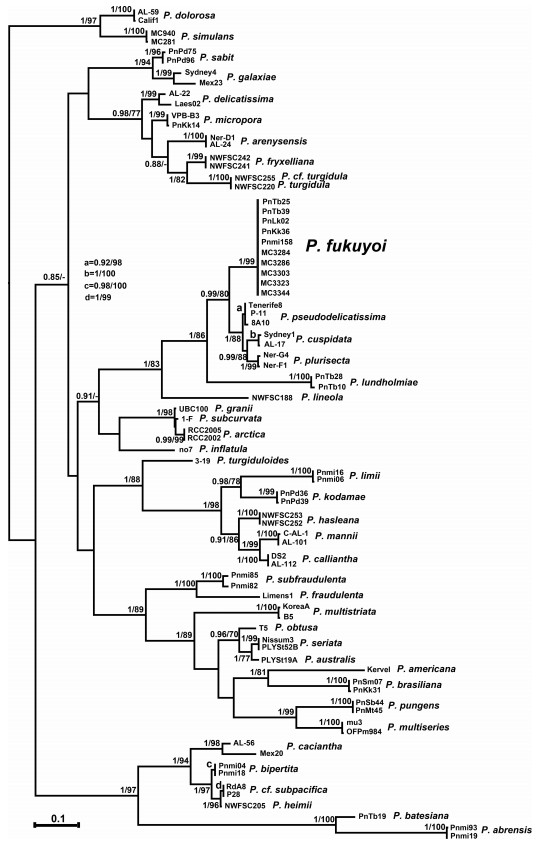 |
| 图 2 基于核糖体转录间隔区ITS1-5.8S-ITS2的最大似然树 Fig. 2 Maximum likelihood tree inferred from ITS1-5.8S-ITS2 rDNA 注:分支节点处分别显示贝叶斯推理树和最大似然树的置信值比。 |
福氏拟菱形藻的ITS2二级结构模型具有四个单环和一个拟环IIa(图 3), 与已报道的福氏拟菱形藻的ITS2二级结构基本一致(Lim et al, 2013)。福氏拟菱形藻ITS2-RNA的标志性区间位于helix Ⅲ和helix Ⅳ, 33-bp信号区域: 5'-CCATTTGGCAAGCCTGGATGGT TTCTAAGTCTA-3'。本文4个福氏拟菱形藻株系(MC3284、MC3286、MC3303、MC3323) 与之前报道的马来西亚株系PnKk36、Pnmi158具有完全一致的ITS2二级结构, 与MC3344和马来西亚株系PnTb25、PnLk02只有1个单核苷酸多态性(single nucleotide polymorphism, SNP)的差异, 没有CBC和hemi-CBC(HCBC)的差异, 这表明ITS2二级结构的结论亦支持形态学与分子分类的鉴定结果。将本文的福氏拟菱形藻与系统发育树上亲缘关系最近的伪柔弱拟菱形藻(8A10, P-11) 和尖细拟菱形藻(AL-17, Sydney1) 相比较, 发现与前者有1个CBC和4个SNPs的差异, 与后者有1个CBC, 1个HCBC和6个SNPs的差异。
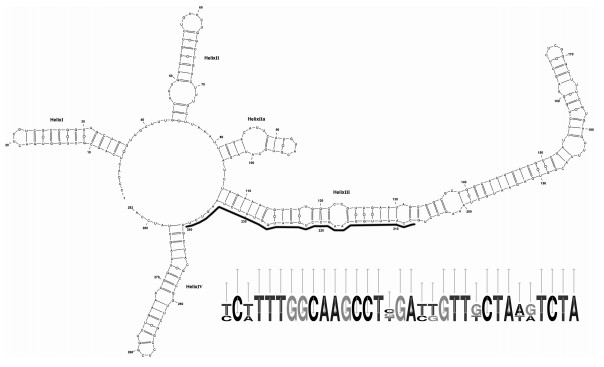 |
| 图 3 福氏拟菱形藻ITS2二级结构图 Fig. 3 The secondary structure of ITS2-RNA in Pseudo-nitzschia fukuyoi strain MC3286 注:右下角的碱基(二级结构图中黑线标出部分)是福氏拟菱形藻与其亲缘关系最为接近的两个物种(伪柔弱拟菱形藻和尖细拟菱形藻)特异性标记区段中碱基的合并, 突出三者在该区段的碱基差异情况。 |
以DA标准品浓度(μg/mL)为横坐标, 峰面积为纵坐标, 建立LC-MS/MS检测DA的标准曲线, DA浓度为50—500μg/L时, 其峰面积与质量浓度有良好的线性关系(R2=0.99934), 回归方程为y=164.64875x-3947.22457。本方法的检测下限为50ng/mL。DA的出峰保留时间为0.77min。对常规培养和浮游动物诱导的福氏拟菱形藻进行LC-MS/MS检测, 结果在预定的保留时间内都出现样品峰, 检出量见表 1。这也是我国报道的能够产生DA的第二个拟菱形藻物种。
| 株系 | 浮游动物种类 | 培养时间(d) | 检出 (μg/L) |
单细胞DA量 (pg) |
| MC3284 | / | 8 | 1394.893 | 8.2×10-2 |
| MC3286 | / | 8 | 1007.996 | 2×10-2 |
| MC3303 | / | 8 | 3389.651 | 0.10 |
| MC3323 | / | 8 | 8758.2 | 0.23 |
| MC3344 | / | 8 | 2050.911 | 5.4×10-2 |
| MC3323 | 卤虫 | 7 | 39552.27 | 1.63 |
| MC3323 | 褶皱臂尾轮虫 | 7 | 21490.386 | 1.08 |
| MC3344 | 卤虫 | 7 | 4147.779 | 0.29 |
| MC3344 | 褶皱臂尾轮虫 | 7 | 7072.378 | 1.54 |
另外, 本文对2株福氏拟菱形藻(MC3323, MC3344) 进行了浮游动物混培诱导实验。结果显示(表 1): MC3323株系在卤虫的诱导下, DA水平增加了7倍, 在褶皱臂尾轮虫诱导后增加了4.7倍; 而株系MC3344在卤虫的作用下产DA量只增加了5.4倍, 但是在褶皱臂尾轮虫的诱导下增加量高达28.5倍。因此, 卤虫和褶皱臂尾轮虫都能提高福氏拟菱形藻的DA产毒水平。
3 讨论 3.1 福氏拟菱形藻与相似种的比较研究福氏拟菱形藻的形态特征是壳面呈线形至披针形, 具有中央船骨点, 点条纹由单排孔纹组成, 属于伪柔弱拟菱形藻复合群(P. pseudodelicatissima complex)(Lim et al, 2013)。在最初的研究中, 对于伪柔弱拟菱形藻的认知较为笼统, 将所有点条纹由单排孔纹组成的物种都归为伪柔弱拟菱形藻。但是随着研究的深入, 发现该种形态多样, 产毒特征也不稳定, 或许存在(拟)隐形种。Lundholm等(2003)对点条纹由单排孔纹组成的拟菱形藻进行了二次研究, 提出了伪柔弱拟菱形藻复合群的概念, 认为伪柔弱拟菱形藻复合群物种的主要形态特征有: (1) 壳面呈线形或披针形; (2) 点条纹由单排孔纹组成; (3) 具有中央较大船骨点; (4) 具有相似的壳套和壳环带结构(Lundholm et al, 2003; 李扬等, 2010)。然而该复合群物种间的形态学差异需要在电子显微镜下才能区分出来, 关键区别特征是孔纹内部的小孔数量和排列方式(Lundholm et al, 2003; Lim et al, 2013; Teng et al, 2016)。截止目前, 伪柔弱拟菱形藻复合群中的物种已经丰富到23个种(Li et al, 2017)。
本研究的福氏拟菱形藻(2.1—2.5μm; 16—21μm; 34—39μm)在宽度、肋突和点条纹上与以往报道的越南株系(1.53—2.28μm; 16—21μm; 33—37μm)更为接近(Dao et al, 2015), 而在孔纹密度(4—6个)和壳环带上的点条纹密度(44—46μm)则与已报道的马来西亚株系(4—7个; 39—47μm)更为接近(Lim et al, 2013)。无论是在形态学还是遗传学上, 福氏拟菱形藻的最相似种类都是尖细拟菱形藻和伪柔弱拟菱形藻(Lim et al, 2013)。但是本文福氏拟菱形藻的宽度(2.1—2.5μm)明显高于尖细拟菱形藻(1.4—2.0μm)和伪柔弱拟菱形藻(0.9—1.6μm), 而在肋突密度、点条纹密度和环带上的点条纹密度上, 本实验株系(16—21μm; 34—39μm; 44—46μm)明显低于尖细拟菱形藻(19—25μm; 35—44μm; 47—53μm)和伪柔弱拟菱形藻(20—25μm; 36—43μm; 48—55μm)(Lundholm et al, 2003)。三者最明显的区别在于, 孔纹内的筛板膜分区有所差异, 前者孔纹被硅质桥分成1—5部分, 以2—3个分区为主, 而且出现部分分区位于孔纹中央, 而后两者孔纹内部主要分成2部分, 为上下不规则的2部分(Lundholm et al, 2003; Lim et al, 2013)。总之, 拟菱形藻属不同物种之间的形态学差异非常细微, 以超微形态学特征对其进行鉴定仍存在着不少困难, 所以本文结合形态学与分子系统学对福氏拟菱形藻进行了物种识别。
3.2 拟菱形藻属DA产毒特征分析福氏拟菱形藻首次报道于马来西亚(Lim et al, 2013), 当时作为拟菱形藻属的新物种进行报道, 并未对其产毒特征进行检测。之后报道于越南海域, 并检测到高浓度DA, 产毒量为3.85—4.54pg/cell(Dao et al, 2015)。本文从大亚湾水域分离并建立了5个福氏拟菱形藻培养株系, 利用LC-MS/MS技术对其产毒特征进行检测, 均能检测到DA, 单细胞产毒量为0.02—0.23pg, 低于越南株系的产毒水平。以往研究也已证实, 拟菱形藻产毒是一个比较复杂的情况, 不同海域同种拟菱形藻产DA特征也存在差异, 如采自新西兰一些水域的尖刺拟菱形藻可产DA(徐国双等, 2015), 而采自中国沿海的尖刺拟菱形藻却没有检测到DA(Li et al, 2005)。同样, 采自马来西亚一些水域的柯氏拟菱形藻(P. kodamae)可产生DA, 但采自东马来西亚一些海域的柯氏拟菱形藻却没有检测到DA(Teng et al, 2016)。这表明拟菱形藻是否产毒不是一个稳定特征。而且有研究认为, 产毒拟菱形藻的生理特征与生长的环境因子如生长周期、硅、氮、磷、光照与光周期、细菌的共生等都会影响其产DA的量(Lelong et al, 2012)。
3.3 浮游动物对拟菱形藻产毒特征和水平的影响目前已经认识到有较多因素能够影响拟菱形藻的DA产毒特征和水平, 以往研究多集中在拟菱形藻的培养因子上, 如物理参数(温度、盐度、光照和pH)、营养参数(Si、P、N、Fe、Cu)和生物参数(细菌、病毒和真菌)(Lelong et al, 2012)。然而近年来有学者从捕食关系的角度, 分析了浮游动物对于拟菱形藻产毒的影响。如有学者将产毒的成列拟菱形藻(P. seriata)与不产毒的格式拟菱形藻(P. granii)分别与桡足类Calanus copepodites放在一起, 发现成列拟菱形藻产毒水平有所上升, 而在桡足类的诱导下格式拟菱形藻也能够产生DA(Tammilehto et al, 2015)。研究认为, 桡足类与拟菱形藻属于食物链中的捕食关系, 拟菱形藻增加DA水平, 可以降低捕食者的摄食率(Tammilehto et al, 2015)。本文进行的浮游动物诱导实验中, 也验证了上述观点。在浮游动物诱导实验中, 无论是加入卤虫, 还是褶皱臂尾轮虫, 均能够增加福氏拟菱形藻的产毒水平, 最高可增加28.5倍。本文的诱导实验说明, 浮游动物能够显著刺激有毒拟菱形藻的产毒水平, 而浮游动物的缺失, 也可导致有毒拟菱形藻的产毒能力大大降低, 这或许可以解释为什么我国拟菱形藻在实验室培养条件下极少检测到DA, 而在自然海域如浮游植物样品中却有高含量DA(Li et al, 2017)。
4 结论(1) 本研究结合形态学与分子生物学技术, 鉴定到我国拟菱形藻属的1个新记录种:福氏拟菱形藻, 增加了我国拟菱形藻属的物种多样性。
(2) 本文建立的5个福氏拟菱形藻株系中均能检测到DA, 单细胞产毒量为0.02—0.23pg, 这是我国报道的第二个能够产生DA的拟菱形藻物种。
(3) 利用卤虫和褶皱臂尾轮虫对福氏拟菱形藻的产毒特征与水平进行了诱导, 发现浮游动物能够促使拟菱形藻的DA水平, 增加幅度在4—28倍之间。
| 王恒, 2011. 舟山海域贝类海产品中软骨藻酸含量调查. 中国卫生检验杂志, 21(12): 2986–2988 |
| 邢小丽, 杨军霞, 康燕玉, 等, 2007. 大亚湾水域两种拟菱形藻的形态学鉴定及毒素分析. 台湾海峡, 26(4): 576–582 |
| 吉薇, 郑洁莹, 曾雪萍, 等, 2011. 南海海域软骨藻酸(DA)贝类毒素的HPLC方法检测. 现代食品科技, 27(1): 120–122, 116 |
| 吕颂辉, 齐雨藻, 1992. 南海大鹏湾的主要赤潮生物. 暨南大学学报(自然科学), 13(3): 130–133 |
| 李扬, 何利娜, 马艳艳, 等, 2010. 伪柔弱拟菱形藻复合群的形态分类学研究. 水生生物学报, 34(2): 302–311 |
| 宋琍琍, 张海琪, 侯镜德, 等, 2008. 液相色谱-串联质谱法测定贝类毒素软骨藻酸的残留. 水产学报, 32(6): 950–956 |
| 陈菊芳, 齐雨藻, 徐宁, 等, 2005. 大亚湾拟菱形藻水华及其在生物群落中的生态地位. 海洋学报, 27(1): 114–119 |
| 陈菊芳, 徐宁, 王朝晖, 等, 2002. 大亚湾拟菱形藻(Pseudo-nitzschia spp.)种群的季节变化与环境因子的关系. 环境科学学报, 22(6): 743–748 |
| 钱宏林, 梁松, 齐雨藻, 2000. 广东沿海赤潮的特点及成因研究. 生态科学, 19(3): 8–16 |
| 徐国双, 李扬, 2015. 我国沿海拟菱形藻属的2新记录种及其产毒特征分析. 热带亚热带植物学报, 23(6): 614–624 DOI:10.11926/j.issn.1005-3395.2015.06.002 |
| 黄春秀, 徐国双, 李扬, 2017. 大亚湾水域并基拟菱形藻的种类鉴定和产毒特征分析. 水生生物学报, 已录用 http://kns.cnki.net/KCMS/detail/detail.aspx?filename=sswx201705023&dbname=CJFD&dbcode=CJFQ |
| Bates S S, Bird C J, de Freitas A S W, et al, 1989. Pennate diatom Nitzschia pungens as the primary source of domoic acid, a toxin in shellfish from eastern Prince Edward Island, Canada. Canadian Journal of Fisheries and Aquatic Sciences, 46(7): 1203–1215 DOI:10.1139/f89-156 |
| Dao H V, Phan V B, Teng S T, et al, 2015. Pseudo-nitzschia fukuyoi (Bacillariophyceae), a domoic acid-producing species from Nha Phu Bay, Khanh Hoa Province, Vietnam. Fisheries Science, 81(3): 533–539 DOI:10.1007/s12562-015-0864-9 |
| Guillard R R L, Hargraves P E, 1993. Stichochrysis immobilis is a diatom, not a chrysophyte. Phycologia, 32: 234–236 DOI:10.2216/i0031-8884-32-3-234.1 |
| Lelong A, Hégaret H, Soudant P, et al, 2012. Pseudo-nitzschia (Bacillariophyceae) species, domoic acid and amnesic shellfish poisoning:revisiting previous paradigms. Phycologia, 51(2): 168–216 DOI:10.2216/11-37.1 |
| Li A F, Yu R C, Wang Y F, et al, 2005. Morphological and toxicity characteristics of Pseudo-nitzschia pungens strain PP0201-01 isolated from the East China Sea. Chinese Journal of Oceanology and Limnology, 23(4): 418–426 DOI:10.1007/BF02842686 |
| Li Y, Huang C X, Xu G X, et al, 2017. Pseudo-nitzschia simulans sp.nov. (Bacillariophyceae), the first domoic acid producer from Chinese waters. Harmful Algae,(67): 119–130 |
| Lim H C, Teng S T, Leaw C P, et al, 2013. Three novel species in the Pseudo-nitzschia pseudodelicatissima complex:P. batesiana sp. nov., P. lundholmiae sp. nov., and P. fukuyoi sp. nov. (Bacillariophyceae) from the Strait of Malacca, Malaysia. Journal of Phycology, 49(5): 902–916 |
| Lü S H, Li Y, Lundholm N, et al, 2012. Diversity, taxonomy and biogeographical distribution of the genus Pseudo-nitzschia (Bacillariophyceae) in Guangdong coastal waters, South China Sea. Nova Hedwigia, 95(1-2): 123–152 |
| Lundholm N, Daugbjerg N, Moestrup Ø, 2002. Phylogeny of the Bacillariaceae with emphasis on the genus Pseudo-nitzschia (Bacillariophyceae) based on partial LSU rDNA. European Journal of Phycology, 37(1): 115–134 DOI:10.1017/S096702620100347X |
| Lundholm N, Moestrup Ø, Hasle G R, et al, 2003. A study of the Pseudo-nitzschia pseudodelicatissima/cuspidata complex (Bacillariophyceae):what is P.pseudodelicatissima?. Journal of Phycology, 39(4): 797–813 DOI:10.1046/j.1529-8817.2003.02031.x |
| Lundholm N, Moestrup Ø, Kotaki Y, et al, 2006. Inter-and intraspecific variation of the Pseudo-nitzschia delicatissima complex (Bacillariophyceae) illustrated by rRNA probes, morphological data and phylogenetic analyses. Journal of Phycology, 42(2): 464–481 DOI:10.1111/jpy.2006.42.issue-2 |
| Miller M A, Pfeiffer W, Schwartz T, 2010. Creating the CIPRES science gateway for inference of large phylogenetic trees. In:Proceedings of Gateway Computing Environments Workshop (GCE). New Orleans, LA:IEEE, 2010:1-8, doi:10.1109/gce.2010.5676129 |
| Moestrup Ø, Akselmann R, Fraga S, et al, 2017. IOC-UNESCO taxonomic reference list of harmful micro algae. (2017-07-24). http://www.marinespecies.org/hab |
| Percopo I, Ruggiero M V, Balzano S, et al, 2016. Pseudo-nitzschia arctica sp.nov., a new cold-water cryptic Pseudo-nitzschia species within the P. pseudodelicatissima complex. Journal of Phycology, 52(2): 184–199 DOI:10.1111/jpy.2016.52.issue-2 |
| Ronquist F, Teslenko M, van der Mark P, et al, 2012. MrBayes 3.2:efficient Bayesian phylogenetic inference and model choice across a large model space. Systematic Biology, 61(3): 539–542 DOI:10.1093/sysbio/sys029 |
| Tammilehto A, Nielsen T G, Krock B, et al, 2015. Induction of domoic acid production in the toxic diatom Pseudo-nitzschia seriata by calanoid copepods. Aquatic Toxicology, 159: 52–61 DOI:10.1016/j.aquatox.2014.11.026 |
| Teng S T, Lim H C, Lim P T, et al, 2014. Pseudo-nitzschia kodamae sp.nov. (Bacillariophyceae), a toxigenic species from the Strait of Malacca, Malaysia. Harmful Algae, 34: 17–28 DOI:10.1016/j.hal.2014.02.005 |
| Teng S T, Tan S N, Lim H C, et al, 2016. High diversity of Pseudo-nitzschia along the northern coast of Sarawak (Malaysian Borneo), with descriptions of P. bipertita sp. nov. and P. limii sp. nov. (Bacillariophyceae). Journal of Phycology, 52(6): 973–989 DOI:10.1111/jpy.12448 |
| Trainer V L, Bates S S, Lundholm N, et al, 2012. Pseudo-nitzschia physiological ecology, phylogeny, toxicity, monitoring and impacts on ecosystem health. Harmful Algae, 14: 271–300 DOI:10.1016/j.hal.2011.10.025 |
| Wu H Y, Guo M M, Tan Z J, et al, 2014. Liquid chromatography quadrupole linear ion trap mass spectrometry for multiclass screening and identification of lipophilic marine biotoxins in bivalve mollusks. Journal of Chromatography A, 1358: 172–180 DOI:10.1016/j.chroma.2014.06.105 |
 2017, Vol. 48
2017, Vol. 48


