中国海洋湖沼学会主办。
文章信息
- 李晓洁, 唐建洲, 宋鹏, 伍琴, 瞿符发, 刘臻, 鲁双庆. 2018.
- LI Xiao-Jie, TANG Jian-Zhou, SONG Peng, WU Qing, QU Fu-Fa, LIU Zhen, LU Shuang-Qing. 2018.
- 鲫鱼(Carassius auratus)半胱亚磺酸脱酸酶CSAD基因克隆及其表达研究
- MOLECULAR CLONING AND EXPRESSION OF CSAD IN CARASSIUS AURATUS
- 海洋与湖沼, 49(1): 134-141
- Oceanologia et Limnologia Sinica, 49(1): 134-141.
- http://dx.doi.org/10.11693/hyhz20170500125
-
文章历史
- 收稿日期:2017-05-13
- 收修改稿日期:2017-06-23
2. 湖南省水产高效健康生产协同创新中心 常德 415000;
3. 长沙学院生物工程与环境科学院 长沙 410003
2. Collaborative Innovation Center for Efficient and Health Production of Fisheries in Hunan Province, Changde 415000, China;
3. Department of Biotechnology & Environment Science, Changsha University, Changsha 410003, China
牛磺酸(2-氨基乙烷磺酸)是动物生长发育的条件性必需氨基酸之一, 缺乏牛磺酸可能会导致大脑发育不全; 脂肪吸收不良、视网膜功能障碍以及肝脏功能受损。牛磺酸的合成是通过游离氨基酸在动物体内的代谢, 而且在鱼体内的合成最多。半胱亚磺酸脱酸酶(cysteine sulfinic acid decar-boxylase, CSAD)是氨基酸脱羧酶之一, 能催化蛋氨酸和半胱氨酸代谢途径的中间产物, 也是动物体内牛磺酸生物合成途径的关键酶, 在1955年大鼠肝脏中被发现(Hope, 1955)。目前关于CSAD的研究大多集中在畜禽和哺乳动物基因的分子结构与功能方面(Kim et al, 2006; Li et al, 2006; Park et al, 2015; Winge et al, 2015), 鱼类在这方面的研究还较少, 已见的报道仅有斑马鱼(Strausberg et al, 2002)、鲤鱼(Honjoh et al, 2010)等。有学者对CSAD基因在鲤鱼各组织中做了表达分析, 发现CSAD基因在肾脏中的表达水平最高, 其次是在脑、肝胰腺和鳃中(Goto et al, 2012)。这些研究为探讨鱼类CSAD基因的分子结构和生理功能奠定了基础。鲫鱼是我国淡水养殖的主要鱼类之一, 具有重要的经济价值, 目前有关其CSAD基因的分子特征及表达模式的研究尚未见报道, 因此本研究拟克隆鲫鱼CSAD基因, 研究鲫鱼CSAD基因时空表达模式, 探讨外源牛磺酸对鲫鱼肠道CSAD mRNA表达规律的影响, 以期为进一步认识鱼类CSAD基因及其功能奠定基础。
1 材料与方法 1.1 试验饲料参照鲫鱼的营养饲料配方(Matsunari et al, 2006; Xie et al, 2014; 伍琴等, 2015), 以鱼粉和豆粕作为蛋白源, 鱼油和豆油为脂肪源, 淀粉和面粉作为糖源, 配制四种等氮等能饲料(见表 1)。在鲫鱼基础饲粮中添加剂量分别为0.0、1.0、2.5和4.0g/kg的牛磺酸(牛磺酸由天根生化科技有限公司提供, 分析纯)。饲料原料拌匀粉碎后用40目筛过滤, 制粒前把过筛后的原料、豆油等脂肪源和水一起充分混合均匀, 然后制粒加工成直径为1.5mm的硬颗粒饲料, 风干后将其置于-20℃冰箱中储存备用。
| 原料 | 含量(%) |
| 淀粉 | 20.00 |
| 面粉 | 8.00 |
| 鱼粉 | 28.00 |
| 豆粕 | 32.00 |
| 鱼油 | 3.00 |
| 豆油 | 3.00 |
| 氯化胆碱 | 0.5 |
| 磷酸二氢钙Ca(H2PO4)2 | 1.0 |
| 三氧化二铬Cr2O3 | 0.5 |
| 甲基纤维素 | 2.00 |
| 预混料 | 2.00 |
| 合计 | 100.00 |
| 营养成分 | |
| 粗蛋白 | 32.18 |
| 粗灰分 | 7.67 |
| 粗脂肪 | 9.53 |
| 注:每千克预混料中含有: VA, 0.02g; VBl, 0.01g; VB2, 0.015g; VB6, 0.015g; VB12, 0.008g; VC(35%), 1g;泛酸钙, 0.04g;肌醇, 1.2g;叶酸, 0.01g;生物素, 0.002g; VE, 0.4g; VK, 0.32g; VD, 0.31g; MgSO4·7H2O, 0.6g; ZnSO4·7H2O, 0.6g; MnSO4·7H20, 0.08g; KI, 0.0015g; Na2SeO3, 0.003g; CoCl·6H2O(10%), 0.005g; CuSO4·5H2O, 0.03g; NaCl, 0.1g;次粉, 0.15g;沸石粉, 4.7805g;烟酸胺, 0.1g;抗氧化剂, 0.2g | |
选取大小规格一致、健康、初始体重为(29.07± 0.19)g的鲫鱼(Carassius auratus)(由湖南省水产科学研究所提供)为实验对象, 进行8周的摄食生长实验。试验以0.0g/kg牛磺酸为对照组, 1.0、2.5和4.0g/kg牛磺酸为实验组, 共4个实验组, 每个实验组4个重复, 每个重复50尾鱼, 养殖用缸容积约为0.3m3。试验时每日定时投喂饲料3次, 投喂量由每天的进食情况确定, 养殖缸24h增氧, 水温控制在24—27℃, pH值控制在6.5—7.5。每天记录鲫鱼的死亡情况、投喂量并观察摄食情况。本试验养殖在长沙学院产学研基地室内循环养殖系统中进行。
1.3 实验方法 1.3.1 鲫鱼CSAD基因cDNA序列克隆取鲫鱼鲜活肠组织, 用RNA提取试剂盒提取总RNA, –20℃保存备用。
从NCBI数据库中下载其他物种CSAD基因序列, 利用引物设计软件在保守区内设计鲫鱼CSAD基因特异性引物CaCSAD-F/R(表 2), 引物由铂尚生物合成。以鲫鱼肠道组织的总RNA为模板, 逆转录成第一条cDNA链。以cDNA链为模版进行PCR扩增, 扩增条件为94℃ 4min; 94℃ 30s, 56℃ 30s, 72℃ 3min, 32个循环; 72℃ 10min。PCR产物用1.2%琼脂糖凝胶电泳对产物进行检测分析, 切胶回收纯化目的产物后连接至pMDTM19-T载体, 转化到感受态细胞DH5α, 利用PCR检测阳性克隆送铂尚生物测序。
| 引物名称 | 序列(5’→3’) |
| CaCSAD-F | 5’-CCTGTCATCCTCGGTTCT-3’ |
| CaCSAD-R | 5’-AGAAACAACAACCATACGGAAGAAG-3’ |
| CaCSAD-3'F1 | 5’-AAACTCTGTGACTTGGAACCCTC-3’ |
| CaCSAD-3'F2 | 5’-ATGGTCTTTCAGAGCGAGTG-3’ |
| CaCSAD-5'R1 | 5’-GTCCGTTCCAATACCAAG-3’ |
| CaCSAD-5'R2 | 5’-CTATGCGGGTCAGAGGAT-3’ |
| 3'RACE Outer Primer | 5’-TACCGTCGTTCCACTAGTGATTT-3’ |
| 3'RACE Inner Primer | 5’-CGCGGATCCTCCACTAGTGATTTCACTATAGG-3’ |
| CaCSAD -qPCR-F | 5’-TTCTGGTTCATTCCACCCAG-3’ |
| CaCSAD-qPCR-R | 5’-TGCCACGCTTCATCATTCTC-3’ |
| β-actin-F | 5’-CCTATTGAGCACGGTATTG-3’ |
| β-actin-R | 5’-CTGTTGGCTTTGGGATTG-3’ |
根据已获得中间片段序列设计2条特异性引物CaCSAD-3’F1和CaCSAD-3’F2, 使用3’RACE接头引物进行反转录; 用CaCSAD-3’F1与3’RACE Outer Primer进行第一轮巢式PCR反应, 反应条件为: 94℃ 4min; 94℃ 30s, 59℃ 30s, 72℃ 1min, 循环数为25; 72℃ 10min。所得产物用无菌水稀释10倍后再用CaCSAD-3’F2与3’RACE Inner Primer进行第二轮PCR, 反应条件同上。PCR产物用琼脂糖凝胶电泳进行检测。
根据已知的鲫鱼CSAD基因序列设计特异性引物CaCSAD-5'R1和CaCSAD-5'R2, 利用5'RACE CDS Primer A接头引物进行反转录; 添加90μL Tricine-EDTA Buffer, –20℃保存备用。扩增时, 用CaCSAD-5'R1与通用引物10×UPA进行第一轮PCR, 扩增条件: 94℃ 30s, 72℃ 3min, 共5个循环; 94℃ 30s, 65℃ 30s, 72℃ 3min, 共5个循环; 94℃ 30s, 60℃ 30s, 72℃ 3min共25个循环; 产物稀释10倍后再用CaCSAD-5'R2与通用引物10×UPA做巢式PCR, 扩增条件及产物验证同上。
1.3.2 鲫鱼CSAD基因序列分析使用ORF finder程序(http://www.ncbi.nlm.nih.gov/projects/gorf)进行ORF区预测; 应用MatGat2.02软件进行序列相似性分析和同源性比对; 蛋白的分子量大小和等电点预测采用pI/Mw工具(http://web.expasy.org/compute_pi/); 系统进化树的构建则使用MEGA5.05软件(neighbor-joining)构建; 通过SMART预测其结构域。
1.3.3 鲫鱼CSAD基因组织表达差异性分析根据已得的鲫鱼CSAD核苷酸序列设计荧光定量引物CaCSAD-qPCR-F/R, 并利用鲫鱼的β-actin基因序列(AB039726)设计内参基因引物β-actin-F/R; 并从在添加量为0.0g/kg牛磺酸的对照组中随机抓取3尾鲫鱼, 分别提取肌肉、肝脏、肠道、心脏、脑、鳃等6个组织总RNA, 反转录成cDNA后进行荧光定量检测, 计算出样品中基因CSAD mRNA相对表达量并作图。
1.3.4 鲫鱼CSAD基因昼夜节律表达差异性分析分别在0:00、3:00、6:00、9:00、12:00、15:00、18:00、21:00、24:00时间点在添加量为0.0g/kg牛磺酸的对照组中随机抓取3尾, 取其肠道组织, –80℃保存, 用于鲫鱼Total RNA的提取, 进行鲫鱼CSAD基因的节律表达分析, 实验条件及数据处理同上。
1.3.5 牛磺酸对鲫鱼CSAD基因表达水平的影响养殖实验结束后, 每组鱼随机取3尾取其肠道组织, –80℃保存, 用于鲫鱼Total RNA的提取, 利用实时荧光定量PCR仪测定鲫鱼CSAD基因的表达水平, 反应条件及数据处理同上。
2 结果与分析 2.1 鲫鱼CSAD基因的克隆与分析以鲫鱼的CSAD cDNA为模板, 用RACE等技术克隆鲫鱼肠道组织的CSAD基因, 获得鲫鱼CSAD基因cDNA序列大小为2364bp (图 1为部分序列), ORF序列为1503bp, 5'非编码区(Untranslated region, UTR)为186bp, 3'UTR为675bp。CSAD蛋白由500个氨基酸组成, 其分子量和等电点分别为56.82kDa和5.77。通过SMART预测, 发现鲫鱼CSAD蛋白含有一个Pyridoxal_deC结构域。本研究中, 我们选取具有代表性物种的CSAD氨基酸序列(在NCBI中的登录号见表 3)与鲫鱼CSAD蛋白序列进行比对分析(如图 2)。结果显示, 与其他脊椎动物相比, 鲫鱼CSAD与鲤鱼同源性高达97.2%, 与大西洋鲱鱼为73.6%, 与人的只有61.0%。通过MEGA5.05软件用N-J法对来自不同物种的CSAD构建了系统进化树。结果如图 3所示, 哺乳动物、鸟类、爬行类及人形成一支, 第二支主要是鱼类, 系统进化树显示的亲缘关系与传统分类学基本一致。
| 物种名称 | GenBank序列号 | 序列一致性 |
| Homo sapiens | NP_057073 | 61.0% |
| Rattus norvegicus | ACF07922 | 61.2% |
| Ochotona princeps | XP_004583244 | 62.0% |
| Macaca nemestrina | XP_011727141 | 57.3% |
| Elephantulus edwardii | XP_006883946 | 63.2% |
| Ophiophagus hannah | ETE60237 | 58.7% |
| Parus major | XP_015507533 | 60.0% |
| Gallusgallus | XP_015128899 | 63.2% |
| Danio rerio | AAI64685 | 88.2% |
| Lepisosteus oculatus | XP_006629342 | 67.3% |
| Seriola quinqueradiata | ALF39406 | 67.8% |
| Oryzias latipes | XP_011475423 | 65.7% |
| Clupea harengus | XP_012697185 | 73.6% |
| Cyprinus carpio | BAE73113 | 97.2% |
 |
| 图 1 鲫鱼CSAD cDNA序列及蛋白序列预测 Fig. 1 The sequence of CSAD cDNA and the deduced protein sequence of C. auratus |
 |
| 图 2 不同物种CSAD蛋白序列比对分析 Fig. 2 The alignment of protein sequence of CSAD in different species |
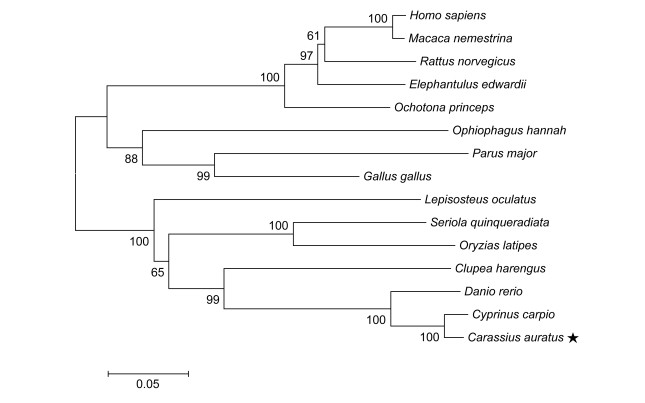 |
| 图 3 CSAD基因系统进化分析 Fig. 3 Phylogeny of the CSAD |
鲫鱼CSAD mRNA在肌肉、心脏、肠、鳃、脑和肝脏等组织中都有表达, 但在肌肉、心脏、肠道及肝脏中的表达较高, 差异不显著(P > 0.05);在脑和鳃组织中的相对表达量最低, 显著低于其他组织(P < 0.05) (图 4)。
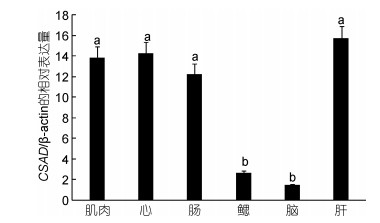 |
| 图 4 鲫鱼CSAD mRNA的各组织表达水平(n=3) Fig. 4 The expression levels of CSAD mRNA in different tissues from C. auratus |
鲫鱼肠道CSAD mRNA在一天24h中的相对表达量从0:00点开始呈现先上升后下降的趋势, 且上午表达量显著高于下午和晚上, 在6:00时CSAD基因表达水平最高(P < 0.05); 21:00时mRNA水平最低(图 5)。
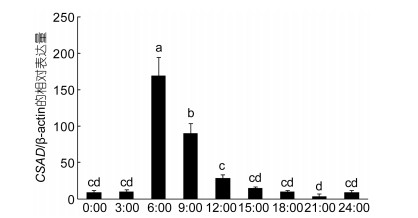 |
| 图 5 鲫鱼CSAD mRNA昼夜节律的表达水平(n=3) Fig. 5 The circadian rhythm of the expression level of C. auratus CSAD mRNA |
肠道CSAD mRNA的相对表达量逐步降低, 牛磺酸添加量为0.0g/kg的表达水平最高(P < 0.05);添加量为0.25、0.4g/kg的组相对表达量较低, 显著低于其他组(P < 0.05), 但其之间差异不显著(P > 0.05)(图 6)。
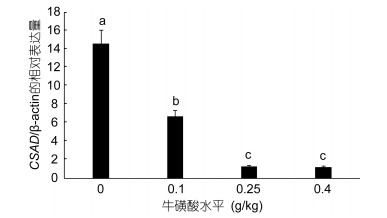 |
| 图 6 牛磺酸对鲫鱼肠道CSAD mRNA表达水平的影响 Fig. 6 Effect of taurine on CSAD mRNA expression level of C. auratus |
CSAD是哺乳动物自身合成牛磺酸的主要限速酶之一, 对半胱亚磺酸有很高的选择性和亲和力(Yang et al, 2010)。本研究以鲫鱼为材料, 成功克隆了CSAD基因cDNA序列, 通过生物信息学分析发现鲫鱼CSAD蛋白由500个氨基酸组成, 包含一个保守的Pyridoxal_deC结构域, 暗示了其可能具有高等动物同源基因相似的生物学功能。通过蛋白序列比对发现, 鲫鱼与鲤鱼的同源性很高; 与其他高等脊椎动物相比同源性偏低, 系统进化分析发现, 鲫鱼与鲤鱼亲缘关系最近, 这与系统分类学方法得到的结果基本一致。
高等动物中, 人们一直认为肝脏是动物机体合成牛磺酸的主要器官。近年来有研究表明, 脂肪组织(Ide et al, 2002)、视网膜(Lin et al, 1985)、动物脑(Dominy et al, 2004)内也有CSAD基因的存在。有资料显示, 通过半定量PCR检测CSAD在黄鰤鱼、日本石斑鱼、红鲷鱼、条斑星鲽中各组织的的表达, 发现CSAD在黄鰤鱼、日本石斑鱼和红鲷鱼的幽门盲囊、肝脏中均有较高表达, 而在条斑星鲽的肝脏中表达很微弱; 在黄鰤鱼和日本石斑鱼的脑、鳃、心脏中表达较低, 而在红鲷鱼和条斑星鲽中表达却较高; 在红鲷鱼骨骼肌中不表达, 而在条斑星鲽骨骼肌中表达(Haga et al, 2015)。本研究中鲫鱼CSAD mRNA在肌肉, 心脏, 肠道及肝脏广泛表达, 脑和鳃中表达较低, 说明来自不同鱼类的CSAD基因组织表达存在一定的差异。鲫鱼CSAD基因在肝脏中高表达, 暗示了肝脏是牛磺酸主要合成器官; 且鲫鱼CSAD在肠道的表达也较高, 可能是因为肠道也是牛磺酸吸收的场所之一。
在自然界中, 生物钟现象是普遍存在的, 生物的生命活动如生理生化功能和物质能量代谢等都与生物的节律相关, 它使生物呈现着规律性变化, 与自然的变化规律相适应。有资料表明, 小鼠胆酸合成酶Cyp7al和Cyp27al mRNA在18:00表达水平最高; 而Cyp8bl和Cyp7bl表达丰度最高的时间点是10:00am (徐亚沙等, 2015), 而CSAD基因在动物昼夜节律性方面尚未见报道。本实验结果显示, 鲫鱼肠道CSAD mRNA的相对表达量也是呈昼夜节律性变化的, 并且CSAD mRNA的表达量在6:00达到最高, 白天表达量高, 晚上比较低, 这可能是由于白天鲫鱼体内代谢活动较强, 牛磺酸的合成代谢加快, 从而导致CSAD mRNA的表达量升高。
牛磺酸是含硫非蛋白氨基酸之一, 对鱼体内的营养生理及其鱼体健康具有很大作用, 它能够影响鱼类的视力和神经系统, 并促进营养物质的消化吸收, 提高鱼的生长性能等。有研究表明, 在饲料中添加牛磺酸能够降低饲料系数, 提高鱼的生产性能(Yamamoto et al, 2000; Takagi et al, 2006); 牛磺酸添加量在一定范围时, 五条鰤的繁殖能力能得到提高(Matsunari et al, 2006); 在大菱鲆肝脏中, 随着牛磺酸添加水平的增加, CSAD mRNA的表达水平逐渐降低, 不添加牛磺酸组显著高于添加量为2%的牛磺酸组(齐国山, 2012)。本研究中鲫鱼CSAD mRNA随着牛磺酸添加水平的增加而表达水平逐渐降低, 与上述报道结果一致。我们实验室前期对牛磺酸的转运载体也做了研究, 实验结果表明随着牛磺酸添加量的增加, 牛磺酸转运载体的表达量先上升后逐渐下降, 暗示了鲫鱼牛磺酸转运载体和合成酶基因表达水平在体内可能存在相互调控, 其具体机制值得进一步的深入研究。
4 结论(1) 本文采用巢式PCR、RACE等技术克隆了鲫鱼肠道CSAD基因的CDS序列。
(2) 本文探讨分析了CSAD基因在鲫鱼不同成体组织、昼夜节律中的表达水平。CSAD基因在肌肉, 心脏, 肠道及肝脏中的相对表达量相对较高, 在脑和鳃组织中的相对表达量较低, 且呈现节律性变化, 在凌晨6点时相对表达量最高。
(3) 本研究结果表明饲料中添加适量的牛磺酸能使鲫鱼CSAD的相对表达量逐渐降低。
| 伍琴, 唐建洲, 刘臻, 等, 2015. 牛磺酸对鲫鱼(Carassius auratus)生长、肠道细胞增殖及蛋白消化吸收相关基因表达的影响. 海洋与湖沼, 46(6): 1516–1523 |
| 齐国山, 2012. 饲料中牛磺酸、蛋氨酸、胱氨酸、丝氨酸和半胱胺对大菱鲆生长性能及牛磺酸合成代谢的影响. 青岛: 中国海洋大学博士学位论文, 43-53 http://cdmd.cnki.com.cn/Article/CDMD-10423-1012505797.htm |
| 徐亚沙, 李书俊, 吴芹, 等, 2015. 小鼠肝脏胆酸合成及转运基因表达的昼夜节律. 遵义医学院学报, 38(5): 474–478 |
| Dominy J, Eller S, Dawson Jr R, 2004. Building biosynthetic schools:reviewing compartmentation of CNS taurine synthesis. Neurochemical Research, 29(1): 97–103 DOI:10.1023/B:NERE.0000010437.81860.d5 |
| Goto T, Endou Y, Kitaoka Y, et al, 2012. Distribution of cysteinesulfinate decarboxylase and cysteamine dioxygenase activities in internal organs of common carp Cyprinus carpio. Aquaculture Science, 56(4): 607–608 |
| Haga Y, Kondo H, Kumagai A, et al, 2015. Isolation, molecular characterization of cysteine sulfinic acid decarboxylase (CSD) of red sea bream Pagrus major and yellowtail Seriola quinqueradiata and expression analysis of CSD from several marine fish species. Aquaculture, 449: 8–17 DOI:10.1016/j.aquaculture.2015.04.004 |
| Honjoh K, Matsuura K, Machida T, et al, 2010. Enhancement of menadione stress tolerance in yeast by accumulation of hypotaurine and taurine:co-expression of cDNA clones, from Cyprinus carpio, for cysteine dioxygenase and cysteine sulfinate decarboxylase in Saccharomyces cerevisiae. Amino Acids, 38(4): 1173–1183 DOI:10.1007/s00726-009-0328-6 |
| Hope D B, 1955. Pyridoxal phosphate as the coenzyme of the mammalian decarboxylase for L-cysteine sulphinic and L-cysteic acids. Biochemical Journal, 59(3): 497–500 DOI:10.1042/bj0590497 |
| Ide T, Kushiro M, Takahashi Y, et al, 2002. mRNA expression of enzymes involved in taurine biosynthesis in rat adipose tissues. Metabolism Clinical and Experimental, 51(9): 1191–1197 DOI:10.1053/meta.2002.34036 |
| Kim H W, Yoon S H, Park T, et al, 2006. gene expressions of taurine transporter and taurine biosynthetic enzyme during mouse and chicken embryonic development. Advances in Experimental Medicine and Biology, 583: 69–77 DOI:10.1007/978-0-387-33504-9 |
| Li J H, Ling Y Q, Fan J J, et al, 2006. Expression of cysteine sulfinate decarboxylase (CSD) in male reproductive organs of mice. Histochemistry and Cell Biology, 125(6): 607–613 DOI:10.1007/s00418-005-0095-8 |
| Lin C T, Songg X, Wu J Y, 1985. Ultrastructural demonstration of L-glutamate decarboxylase and cysteinesulfinic acid decarboxylase in rat retina by immunocytochemistry. Brain Research, 331(1): 71–80 DOI:10.1016/0006-8993(85)90716-4 |
| Matsunari H, Hamada K, Mushiake K, et al, 2006. Effects of taurine levels in broodstock diet on reproductive performance of yellowtail Seriola quinqueradiata. Fisheries Science, 72(5): 955–960 DOI:10.1111/fis.2006.72.issue-5 |
| Park S Y, Schuller-Levisg, Park E, 2015. A novel cysteine sulfinic acid decarboxylase knock-out mouse: immune function. In: Marcinkiewicz J, Schaffer S eds. Taurine 9. Advances in Experimental Medicine and Biology. Cham: Springer International Publishing, 803: 89-98 |
| Strausberg R L, Feingold E A, Grouse L H, et al, 2002. generation and initial analysis of more than 15, 000 full-length human and mouse cDNA sequences. Proceedings of the National Academy of Sciences of the United States of America, 99(26): 16899–16903 DOI:10.1073/pnas.242603899 |
| Takagi S, Murata H, Goto T, et al, 2006. Hemolytic suppression roles of taurine in yellowtail Seriola quinqueradiata fed non-fishmeal diet based on soybean protein. Fisheries Science, 72(3): 546–555 DOI:10.1111/fis.2006.72.issue-3 |
| Winge I, Teigen K, Fossbakk A, et al, 2015. Mammalian CSAD andgADL1 have distinct biochemical properties and patterns of brain expression. Neurochemistry International, 90: 173–184 DOI:10.1016/j.neuint.2015.08.013 |
| Xie Zg, Wang F R, Liu H Y, et al, 2014. Effect of dietary taurine levels ongrowth performance and taurine content of Nibea albiflora larvae. Aquaculture International, 22(6): 1851–1862 DOI:10.1007/s10499-014-9787-1 |
| Yamamoto T, Unuma T, Akiyama T, 2000. The influence of dietary protein sources on tissue free amino acid levels of fingerling rainbow trout. Fisheries Science, 66(2): 310–320 DOI:10.1046/j.1444-2906.2000.00049.x |
| Yang J C, Wug F, Feng Y, et al, 2010. CSD mRNA expression in rat testis and the effect of taurine on testosterone secretion. Amino Acids, 39(1): 155–160 DOI:10.1007/s00726-009-0388-7 |
 2018, Vol. 49
2018, Vol. 49


