中国海洋湖沼学会主办。
文章信息
- 刘春胜, 刘小霞, 汪浩, 王爱民, 顾志峰. 2018.
- LIU Chun-Sheng, LIU Xiao-Xia, WANG Hao, WANG Ai-Min, GU Zhi-Feng. 2018.
- 光照强度和光色对番红砗磲(Tridacna crocea)氨氮、活性磷酸盐及氧代谢的影响
- EFFECTS OF LIGHT INTENSITY AND SPECTRA ON METABOLISM OF AMMONIA, ACTIVE PHOSPHATES, AND OXYGEN CONSUMPTION IN TRIDACNA CROCEA
- 海洋与湖沼, 49(2): 313-318
- Oceanologia et Limnologia Sinica, 49(2): 313-318.
- http://dx.doi.org/10.11693/hyhz20170700183
-
文章历史
- 收稿日期:2017-07-07
- 收修改稿日期:2017-08-12
2. 海南大学海洋学院 海口 570228
2. Ocean College, Hainan University, Haikou 570228, China
砗磲是海洋双壳贝中个体最大的种类, 从西太平洋到印度洋非洲东海岸的热带海域都有分布, 目前全世界已报道砗磲共13种, 分别隶属于砗磲属和砗蚝属(Richter et al, 2008; Huelsken et al, 2013; Penny et al, 2014; Su et al, 2014; Borsa et al, 2015)。在我国砗磲主要有6种, 其中番红砗磲(Tridacna crocea)是分布较为广泛, 外套膜颜色鲜艳的种类之一(董杨等, 2015)。与其它双壳贝类相比, 砗磲外套膜具共生虫黄藻, 可在一定光照条件下像植物一样吸收营养盐和制造氧气(Todd et al, 2009; Lucas et al, 2014; 张跃环等, 2016)。据报道, 壳长13.7cm的大砗磲(T. gigas)66%的能量来源于外套膜内共生虫黄藻光合作用(Klumpp et al, 1992; Norton et al, 1992)。砗磲这种直接吸收利用海水中无机营养盐的特性使其具有极高的生态意义。
呼吸与排泄是研究贝类代谢水平的重要指标, 也是贝类能量学、容纳量及海洋生态系统评估的重要内容(王俊等, 2001; 栗志民等, 2009)。这些代谢指标不但能够反映贝类本身生理活动强弱, 同时也是评判其对环境适应性的重要标准(王俊等, 2001; 孙忠等, 2004; 朱爱意等, 2007)。在各代谢参数中, 氨氮、活性磷酸盐及氧代谢水平是研究海洋生物新陈代谢的三个重要指标(孟学平等, 2005; 朱爱意等, 2007; 葛长字, 2010; 过锋等, 2012)。自上世纪70年代至今, 国内外已开展了大量贝类呼吸排泄和环境关系相关研究工作, 但对砗磲代谢研究相对较少(Jespersen et al, 1982; Fittwk, 1993; Klumpp et al, 1994; 王俊等, 2001)。基于此, 本研究以番红砗磲为实验动物, 以氨氮、活性磷酸盐及氧代谢水平为指标, 研究光照强度和光色对番红砗磲代谢的影响, 以期为珊瑚礁生态系统资源增殖提供基础资料。
1 材料与方法 1.1 实验材料实验所用番红砗磲于2016年11月采自三沙市周边珊瑚礁区, 挑选壳长80—85mm、健壮无损伤个体(实验所用番红砗磲具体生物学参数见表 1), 除去表面附着物后, 放置于循环水养殖系统中暂养1周后开始实验。循环水养殖玻璃缸规格为1.8m×0.6m×0.8m, 水温26±1℃, 盐度32±0.5, pH 7.5—8.0, 养殖缸上部加500W卤素灯(光周期12:12h)。
| 壳长(mm) | 壳高(mm) | 全重(g) | 软体部干重(g) | |
| 生物学参数 | 82.0±4.8 | 63.62±3.4 | 125.9±5.8 | 2.3±0.2 |
实验采用静水系统, 具体如下: 15L白色塑料圆桶中加入6L经0.45µm硝酸纤维素膜过滤的天然海水(水温26±0.5℃, 盐度31—33, pH 7.8—8.2)。实验过程中将砗磲外套膜向上竖直放置, 海水表面用保鲜膜密封, 膜中央开一直径0.5cm的小口, 用于水样采集, 在距水面正上方45cm处固定光源(全光谱卤素灯)。光强实验共设11组, 其中1组为对照(黑暗、无砗磲), 其余10组为实验组, 光照强度(为砗磲外套膜表面所在水位的光照强度, JXYB-10W水下照度计)分别为0、2000、4000、6000、8000、10000、12000、14000、16000和18000lx。每实验组随机放置相同规格砗磲3个, 实验开始前各组均为黑暗处理, 而后分别给于不同光照强度光源处理, 每2h取水样一次, 持续6h, 用以氨氮、活性磷酸盐及溶氧测定。每个组至少重复3次。
1.3 光色对番红砗磲代谢的影响光色实验所采用静水系统与光强实验类似, 仅所用光源为LED灯(因蓝色和红色光源为LED灯, 白光亦改用相同光源)。光色实验共设3组, 分别为蓝光、红光和白光, 光照强度(为砗磲外套膜表面所在水位的光照强度, JXYB-10W水下照度计)均为2000lx。每组实验随机放置相同规格砗磲3个, 实验开始前各组均为黑暗处理, 而后分别给于不同光色光源照射, 每2h取水样一次, 持续6h, 用以氨氮、活性磷酸盐及溶氧测定。每个组至少重复3次。
1.4 氨氮、活性磷酸盐及溶氧测定各水质指标测定依照《海洋监测规范》(GB17378.4-2007)进行, 其中氨氮采用次溴酸钠氧化法测定, 活性活性磷酸盐采用抗坏血酸还原磷钼蓝法测定, 溶解氧采用Winkler碘量法测定(中华人民共和国国家质量监督检验检疫总局, 2008)。
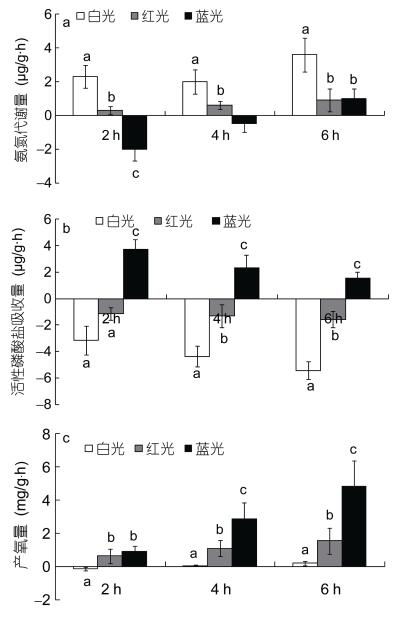
氨氮、活性磷酸盐和溶解代谢计算公式如下:
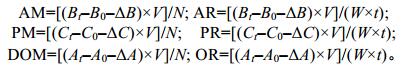
其中, AM为个体氨氮代谢量(µg/ind); AR为软体部单位干重排氨率[µg/(g·h)]; PM为个体活性磷酸盐代谢量(µg/ind); PR为软体部单位干重活性磷酸盐代谢率[µg/(g·h)]; DOM为个体溶代谢氧量(mg/ind); OR为软体部单位干重耗氧率[mg/(g·h)]; B0、Bt为实验开始和实验持续时间为t时水体氨氮含量(µg/L); C0、Ct为实验开始和实验持续时间为t时水体活性磷酸盐含量(µg/L); A0、At为实验开始和实验持续时间为t时水体溶解氧含量(mg/L); t为实验持续时间; Δ值为对照组中溶解氧、氨氮和活性磷酸盐的变化值; V为桶中海水体积(L); N为实验番红砗磲个数(ind); W为番红砗磲软体部干重(g)。
1.5 数据处理与分析各实验数据均表示为平均值±标准差(Mean±SD), 所有数据采用Excel和SPSS 17.0软件进行处理。各处理组间显著性分析采用单因素方差法进行分析, 显著性水平为p < 0.05。
2 结果 2.1 光照强度与番红砗磲氨氮、活性磷酸盐及溶氧代谢的关系如表 2所示, 在无光照条件下, 番红砗磲排放氨氮、磷酸盐, 并消耗氧气。番红砗磲在0—10000lx光照强度下释放氨氮, 但排氨量逐渐减少。在12000—16000lx条件下, 番红砗磲吸收同化海水中的氨氮, 且吸收量逐渐增强, 至16000lx达到最高(11.31µg/ind), 当光照强度继续增强至18000lx后, 其对氨氮吸收能力开始减弱; 番红砗磲在光照2000—18000lx条件下均可吸收海水中活性磷酸盐, 且在16000lx达到最高(37.84µg/ind), 随后减弱; 当光照强度为2000lx时, 平均壳长82.0mm的番红砗磲6h可净释放氧气2.93mg, 且其产氧率在光照2000—18000lx范围内逐渐增加。
| 光照强度(lx) | 氨氮(µg/ind) | 活性磷酸盐(µg/ind) | 溶氧(mg/ind) |
| 对照 | — | — | — |
| 0 | 99.24±31.45 | 2.36±2.01 | –7.60±0.8 |
| 2000 | 19.48±5.79 | –17.69±5.48 | 2.93±0.6 |
| 4000 | 17.91±8.44 | –17.46±6.63 | 8.44±1.2 |
| 6000 | 16.48±5.76 | –18.76±6.98 | 17.00±2.2 |
| 8000 | 11.44±4.53 | –20.09±4.95 | 20.50±2.4 |
| 10000 | 4.69±1.91 | –23.89±8.87 | 22.86±1.5 |
| 12000 | –4.19±2.18 | –26.19±4.13 | 32.80±2.3 |
| 14000 | –7.87±2.35 | –29.89±4.33 | 45.33±3.2 |
| 16000 | –11.31±4.56 | –37.84±6.99 | 52.80±3.6 |
| 18000 | 1.92±2.01 | –22.91±5.91 | 56.67±4.2 |
| 注:为光照6h番红砗磲各代谢产物代谢量; 正值表示产生代谢产物; 负值代表吸收代谢产物。 | |||
进一步分析表明, 番红砗磲由黑暗至光照过程中, 其对氨氮、活性磷酸盐及溶氧代谢率也发生显著变化(图 1)。在同一光照强度下, 番红砗磲在光照2h, 2—4h, 以及4—6h, 其软体部单位干重的氨氮排出率逐渐升高(0—10000lx), 吸收率逐渐下降(12000— 18000lx)。在假设番红砗磲分解产生氨氮代谢率与光照无关的条件下, 通过上述结果可推导获得在0—18000lx光照条件下, 番红砗磲对氨氮的绝对吸收率AR2h > AR4h > AR6h(图 1a)。与之相同, 番红砗磲对活性磷酸盐吸收率亦表现为PR2h > PR4h > PR6h(图 1b)。如图 1c, 在光照不同时间范围内, 番红砗磲产氧率呈现逐渐增强趋势, 即OR2h<OR4h<OR6h。
 |
| 图 1 不同光照强度下番红砗磲单位干重软体部氨氮(a)、活性磷酸盐(b)及溶氧(c)代谢率 Fig. 1 The metabolic rates of ammonia (a), active phosphates (b) and dissolved oxygen (c) in T. crocea (per dry weight of edible part) at a different light intensity 注:上标字母表示不同光照强度间存在显著差异 |
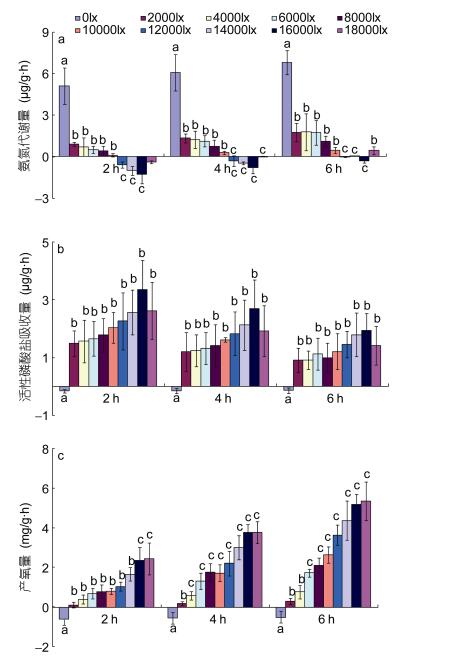
光色显著影响番红砗磲的氨氮、活性磷酸盐及溶氧代谢水平。如表 3所示, 在2000lx白光、蓝光和红光(均为LED光源)条件下, 每一番红砗磲个体氨氮6h代谢量分别为30.49、–6.08和8.01µg/ind, 即蓝光条件下, 砗磲对氨氮的净吸收量最高, 其次为红光, 白光最差; 对活性磷酸盐的吸收和溶氧的产生亦有相似的结果。对不同光色条件下, 氨氮、活性磷酸盐及溶氧代谢率亦呈现出同光强实验相似的结果, 即氨氮、活性磷酸盐绝对吸收率随时间逐渐降低, 而产氧率随时间逐渐增强(图 2)。另外, 通过对比发现, 在2000lx全光谱卤素灯条件下, 单位个体番红砗磲排氨、活性磷酸盐吸收及溶氧产生量分别19.48µg/ind、17.69µg/ind和2.93 mg/ind, 而在给予2000lx LED光源照射时, 其番红砗磲排氨、活性磷酸盐吸收及溶氧产生量分别为30.49µg/ind、13.49µg/ind和–0.13mg/ind, 即全光谱卤素灯光源显著好于LED灯。
| 光色 | 氨氮(µg/ind) | 活性磷酸盐(µg/ind) | 溶氧(mg/ind) |
| 白色 | 30.49±5.98a | –13.49±3.39a | –0.13±0.03c |
| 蓝色 | –6.08±0.91c | –24.01±4.19c | 38.80±2.1a |
| 红色 | 8.01±1.87b | –17.81±3.00b | 16.27±1.9b |
| 注:为光照6h砗磲各代谢产物代谢量; 正值表示产生代谢产物; 负值代表吸收代谢产物。上标字母表示不同光色间存在显著差异 | |||
 |
| 图 2 不同光色条件下番红砗磲单位干重软体部氨氮(a)、活性磷酸盐(b)及溶氧(c)代谢率 Fig. 2 The metabolic rates of ammonia (a), active phosphates (b) and dissolved oxygen (c) in T. crocea (per dry weight of edible part) at different light spectra 注:上标字母表示不同光色间存在显著差异 |
砗磲是珊瑚礁生态系统的重要功能生物, 其外套膜细胞间隙中含有大量共生虫黄藻, 因而砗磲既可像贝类一样通过滤食获取能量, 又能够像植物一样利用光能进行自养生长(Klumpp et al, 1992; Norton et al, 1992; Lucas, 2014)。贝类能量学研究起始于20世纪60年代, 其研究的关键即为能量收支各组分的量化, 以及影响能量收支的环境因子(王俊等, 2001)。本文以影响砗磲能量代谢的关键生态因子光照为研究对象, 首次量化了不同光照强度和光色下番红砗磲的氨氮、活性磷酸盐及溶氧代谢变化, 获得了不同光照强度和光色下番红砗磲的代谢规律。
3.1 光照强度对番红砗磲氨氮、活性磷酸盐及溶氧代谢的影响因需共生虫黄藻光合作用提供能量, 砗磲在自然环境中的分布与光照强度密切相关。据报道, 砗磲主要分布在20m以浅水域, 其中番红砗磲栖息于1—4m的珊瑚礁中, 而光照强度随水深增加而呈递减趋势, 进而影响砗磲分布(Copland et al, 1988; Calumpong, 1992; Richter et al, 2008)。共生虫黄藻可吸收砗磲体内和周边海水中的氨氮, 因此氨氮含量的变化是衡量砗磲同化作用的重要指标(Hawkins et al, 1995)。与溶氧代谢相比, 番红砗磲对氨氮吸收能力相对较弱, 在光照强度12000lx时, 其对氨氮的吸收大于排放, 每个个体6h净产生氧气4.19µg/ind, 在光照16000lx达到最高。基于此, 初步推断平均壳长82.0mm番红砗磲最大适应光强应为16000—18000lx之间。而Ip等(2006)报道在光照600lx条件下, 鳞砗磲对氨氮(NH3及NH4+)具有显著的吸收现象, 因此初步推断不同种类砗磲最适光照强度具有差异。而在砗磲人工养殖过程中添加一定量的铵盐来促进其生长也直接证明了砗磲可吸收利用海水中氨氮(Ellis, 2000)。
对珊瑚、砗磲及其他具共生虫黄藻生物而言, 溶氧消耗或产生速率是反映其生物体呼吸或光合代谢效率的指标之一, 因而受光照强度影响(Ip et al, 2006)。本研究结果表明无光条件下, 番红砗磲与其它双壳贝类相似消耗氧气。当光强为2000lx时, 每个个体6h净产生氧气2.93mg, 表明在该光照条件下, 砗磲光合代谢率大于呼吸代谢率, 且在光照18000lx强度下仍未达到光饱和值, 该结果与番红砗磲分布水深较浅喜强光的生态习性相一致。
本研究表明, 当番红砗磲由无光转移至有光条件后, 其对氨氮吸收速率随时间逐渐降低(AR2h > AR4h > AR6h)。Ip等(2006)检测人工注射NH4Cl后的外套膜周边氨氮浓度亦表明其浓度在1h迅速下降, 6h后几乎无显著变化。通过该研究结果, 我们可以推断砗磲外套膜对氨氮转运与光照密切相关。其后吸收速率降低的原因或许与氨氮浓度逐渐降低至NH4+转运载体要求阈值浓度之下有关, 但该机制需进一步验证。与氨氮吸收相比, 番红砗磲光合产氧率却随时间显著增强, 该结果或许与早期氨氮、磷酸根等离子转运耗氧量大, 后期耗氧量逐渐降低有关。
3.2 光色对番红砗磲氨氮、活性磷酸盐及溶氧代谢的影响外套膜是砗磲与光合作用密切相关的器官, 组织学研究表明砗磲外套膜色素细胞具聚光色素片晶, 以实现共生虫黄藻光合作用(Griffiths et al, 1992)。本实验研究了不同光色照射下番红砗磲的氨氮、活性磷酸盐及溶氧代谢状况, 结果表明蓝光最佳, 红光次之, 白光最差。番红砗磲对氨氮、活性磷酸盐吸收及溶氧产生是外套膜共生虫黄藻光合作用的结果。虫黄藻在分类上隶属甲藻门, 是珊瑚礁中必不可少的共生藻, 其对不同波长可见光的吸收与体内叶绿体的色素组成密切相关(Lin et al, 2015)。叶绿素α是包括虫黄藻在内的几乎所有海洋藻类色素的重要组成部分, 其可见光吸收光谱主要为蓝紫光和红光(Johnson et al, 2007)。因此, 在光照强度相同情况下, 番红砗磲在蓝光和红光条件下同化代谢要显著高于白光。另外在不同光色的长期实验结果中, 番红砗磲的净生长率亦呈现蓝光 > 红光 > 白光的现象(结果未发表)。
4 结论砗磲因具共生虫黄藻而能够利用光能和无机盐合成自身物质, 本研究以氨氮、活性磷酸盐和氧代谢率为指标, 首次系统开展了光照强度和光色与番红砗磲代谢的关系。番红砗磲合成代谢与光照密切相关, 在光照大于2000lx时其能够吸收活性磷酸盐并释放氧气, 当大于12000lx时其氨氮代谢亦由释放转变为净吸收, 大约在16000lx番红砗磲合成代谢效率达到最高。番红砗磲的合成效率与光色密切相关, 其中蓝光最优, 红光次之, 白光最差。综上所述, 在利用光能进行合成代谢机制方面, 番红砗磲与植物相似, 受光强和光色影响, 并存在光补偿点(约2000lx)和光饱和点(约16000lx)。
| 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2008. 2008. GB 17378.4-2007海洋监测规范第4部分:海水分析. 北京: 中国标准出版社, |
| 王俊, 唐启升, 2001. 双壳贝类能量学及其研究进展. 渔业科学进展, 22(3): 80–83 |
| 孙忠, 余方平, 姚海富, 等, 2004. 网箱养殖大黄鱼和美国红鱼的耗氧率与氮排泄率. 浙江海洋学院学报(自然科学版), 23(3): 207–210, 217 |
| 朱爱意, 谢佳彦, 陈金海, 2007. 温度和个体大小对单齿螺耗氧率和排氨率的影响. 生态科学, 26(3): 232–236 |
| 过锋, 赵俊, 陈聚法, 等, 2012. 胶州湾贝类养殖区氮、磷污染现状及动态变化. 渔业科学进展, 33(5): 116–122 |
| 张跃环, 肖述, 李军, 等, 2016. 鳞砗磲的人工繁育和早期发生. 水产学报, 40(11): 1713–1723 |
| 孟学平, 董志国, 程汉良, 等, 2005. 西施舌的耗氧率与排氨率研究. 应用生态学报, 16(12): 2435–2438 DOI:10.3321/j.issn:1001-9332.2005.12.042 |
| 栗志民, 刘志刚, 谢丽, 等, 2009. 企鹅珍珠贝耗氧率和排氨率的研究. 海洋学报, 31(6): 129–135 |
| 葛长字, 2010. 鱼类养殖对水体磷酸盐的影响:源、汇的半现场实验例证. 环境科学与管理, 35(7): 29–32, 45 |
| 董杨, 李向民, 2015. 砗磲资源保护、开发及其产业化发展前景. 水产科学, 34(3): 195–200 |
| Borsa P, Fauvelot C, Tiavouane J, et al, 2015. Distribution of Noah's giant clam, Tridacna noae. Marine Biodiversity, 45(2): 339–344 DOI:10.1007/s12526-014-0265-9 |
| Calumpong H P, 1992. The Giant Clam:An Ocean Culture Manual. Canberra: Australian Centre for International Agricultural Research, 7-13 |
| Copland J W, Lucas J S, 1988. Giant Clams in Asia and the Pacific. Canberra: Australian Centre for International Agricultural Research, 21-32 |
| Ellis S, 2000. Nursery and grow-out techniques for Giant Clams (Bivalvia:Tridacnidae). Center for Tropical and Subtropical Aquaculture, 143: 1–99 |
| Fitt W K, 1993. Nutrition of Giant Clams. Canberra: Australian Centre for International Agricultural Research, 31-40 |
| Griffiths D J, Winsor H, Luongvan T, 1992. Iridophores in the mantle of giant clams. Australian Journal of Zoology, 40(3): 319–326 DOI:10.1071/ZO9920319 |
| Hawkins A J S, Klumpp D W, 1995. Nutrition of the giant clam Tridacna gigas (L.). Ⅱ. Relative contributions of filter feeding and the ammonium-nitrogen acquired and recycled by symbiotic alga towards total nitrogen requirements for tissue growth and metabolism. Journal of Experimental Marine Biology and Ecology, 190(2): 263–290 DOI:10.1016/0022-0981(95)00044-R |
| Huelsken T, Keyse J, Liggins L, et al, 2013. A novel widespread cryptic species and phylogeographic patterns within several giant clam species (Cardiidae:Tridacna) from the Indo-Pacific Ocean. PLoS One, 8(11): e80858 DOI:10.1371/journal.pone.0080858 |
| Ip Y K, Loong A M, Hiong K C, et al, 2006. Light induces an increase in the ph of and a decrease in the ammonia concentration in the extrapallial fluid of the giant clam Tridacna squamosa. Physiological and Biochemical Zoology, 79(3): 656–664 DOI:10.1086/501061 |
| Jespersen H, Olsen K, 1982. Bioenergetics in veliger larvae of Mytilusedulis L. Ophelia, 21(1): 101–113 DOI:10.1080/00785236.1982.10426580 |
| Johnson C E, Goulet T L, 2007. A comparison of photographic analyses used to quantify zooxanthella density and pigment concentrations in Cnidarians. Journal of Experimental Marine Biology and Ecology, 353(2): 287–295 DOI:10.1016/j.jembe.2007.10.003 |
| Klumpp D W, Bayne B L, Hawkins A J S, 1992. Nutrition of the giant clam Tridacna gigas (L.) I. Contribution of filter feeding and photosynthates to respiration and growth. Journal of Experimental Marine Biology and Ecology, 155(1): 105–122 DOI:10.1016/0022-0981(92)90030-E |
| Klumpp D W, Griffiths C L, 1994. Contributions of phototrophic and heterotrophic nutrition to the metabolic and growth requirements of four species of giant clam (Tridacnidae). Marine Ecology Progress Series, 115: 103–115 DOI:10.3354/meps115103 |
| Lin S J, Cheng S F, Song B, et al, 2015. The Symbiodinium kawagutii genome illuminates dinoflagellate gene expression and coral symbiosis. Science, 350(6261): 691–694 DOI:10.1126/science.aad0408 |
| Lucas J S, 2014. Giant clams. Current Biology, 24(5): R183–R184 DOI:10.1016/j.cub.2013.11.062 |
| Norton J H, Shepherd M A, Long H M, et al, 1992. The zooxanthellal tubular system in the giant clam. The Biological Bulletin, 183(3): 503–506 DOI:10.2307/1542028 |
| Penny S S, Willan R C, 2014. Description of a new species of giant clam (Bivalvia:Tridacnidae) from Ningaloo Reef, Western Australia. Molluscan Research, 34(3): 201–211 DOI:10.1080/13235818.2014.940616 |
| Richter C, Roa-Quiaoit H, Jantzen C, et al, 2008. Collapse of a new living species of giant clam in the Red Sea. Current Biology, 18(17): 1349–1354 DOI:10.1016/j.cub.2008.07.060 |
| Su Y, Hung J H, Kubo H, et al, 2014. Tridacna noae (R ding, 1798)-a valid giant clam species separated from T. maxima (R ding, 1798) by morphological and genetic data. Raffles Bulletin of Zoology, 62: 124–135 |
| Todd P A, Lee J H, Chou L M, 2009. Polymorphism and crypsis in the boring giant clam (Tridacna crocea):potential strategies against visual predators. Hydrobiologia, 635(1): 37–43 DOI:10.1007/s10750-009-9859-9 |
 2018, Vol. 49
2018, Vol. 49


