中国海洋湖沼学会主办。
文章信息
- 吕芳, 丁刚, 吴海一, 辛美丽, 郭文. 2018.
- LÜ Fang, DIND Gang, WU Hai-Yi, XIN Mei-Li, GUO Wen. 2018.
- 烯效唑对铜藻(Sargassum horneri)生长及抗氧化系统的影响
- EFFECTS OF UNICONAZOLE ON GROWTH AND ACTIVITY OFANTIOXIDATION SYSTEM IN SARGASSUM HORNERI
- 海洋与湖沼, 49(2): 361-367
- Oceanologia et Limnologia Sinica, 49(2): 361-367.
- http://dx.doi.org/10.11693/hyhz20170500137
-
文章历史
- 收稿日期:2017-05-19
- 收修改稿日期:2017-12-22
2. 青岛市大型海藻工程技术研究中心 青岛 266104
2. Qingdao Macroalgae Engineering Technology Research Center, Qingdao 266104, China
铜藻Sargassum horneri (Turner) C. Agardh是一种具有较高经济价值的褐藻新资源, 在养殖、医药保健、生物制品、食品加工、水产饲料、海藻肥料、化工以及海洋生态环境保护等领域具有重要的开发和应用前景。近年来, 由于近岸海区的污染和过量采收, 导致铜藻的资源量急剧下降, 优良种源匮乏, 严重制约了整个产业的发展。因此, 将具有优良性状的种质资源进行规模化繁育是发展铜藻产业的关键途径。
植物生长调节剂通过调节植株体内的激素水平, 可以有效控制植物的生长, 显著提高植物的光合能力, 增加产量, 改善品质, 对产业的发展具有重要意义。近年来有关植物生长调节剂对藻类生长影响的研究引起了国内外学者的广泛重视。研究结果表明, 不同的植物生长调节剂对不同的藻类的生长、生理、光合作用和呼吸作用具有广泛的调节作用(Yokoya et al, 1999; 张欢欢等, 2013), 能够高效地诱导藻类愈伤组织的形成, 并对其生长与分化有一定的影响作用(Bradley et al, 1990; Yokoya, 2000; Uji et al, 2016)。烯效唑(uniconazole)是一种植物生长延缓剂, 对植物具有控制旺长, 促进分蘖, 调节生理代谢, 提高抗逆性和光合作用, 增加干物质积累等作用, 现已广泛应用于作物、果树和观赏植物等的生长调节(朱木兰等, 1999; Qiu et al, 2005; 李宁毅等, 2008; 常瑞丰等, 2013)。目前, 国内外关于烯效唑对水生生物影响的研究较少, 而且主要集中在对水生动物的毒性效应研究(尹大强等, 1997)以及海洋微藻生长的影响(Mei et al, 2014), 而烯效唑对大型海藻的生长和生理影响的研究尚未见报道。
大型海藻的生长受到温度、光照和营养盐等多种环境因素的制约, 是一系列生理生化指标变化的综合表现, 植物生长调节剂的添加势必会对其生长造成一定的影响。研究表明, 藻类抗氧化酶系统的活性, 能够反映机体生长发育的特点、体内代谢状况以及对外界环境的适应性。逆境胁迫能导致藻体内活性氧代谢的失调与自由基的积累, 并进一步导致细胞膜结构损伤, 所以藻体的抗逆性与其抗氧化系统的活性密切相关(Dummermuth et al, 2003; 鹿宁等, 2012)。因此, 藻类抗氧化系统的研究对于指导藻类养殖和育种具有非常重大的意义。
为了评价烯效唑使用的安全性以及对大型海藻生长的影响, 本文以黄海近海海域漂浮铜藻为材料, 研究了烯效唑对其生长、生理生化指标(光合色素、可溶性糖、可溶性蛋白)以及抗氧化系统的影响, 以期为烯效唑等植物生长调节剂的合理应用提供科学依据。
1 材料与方法 1.1 实验材料漂浮铜藻采自山东省荣成市海域的海带养殖筏架(37°15′N, 122°35′E), 用低温箱运回实验室, 海水反复清洗去除泥沙及杂质后, 置于温度15℃, 光照5000 lx, 光周期为12L︰12D的循环水箱中充气培养, 5天后用于实验。选取生长健壮、形态较一致, 分枝尖端的藻体用于实验。
1.2 培养方法实验用培养液是加烯效唑的过滤海水, 烯效唑浓度设为0.1、1.0、4.0和8.0mg/L四个梯度, 以天然过滤海水作为对照组。
实验在容积为1000mL的三角瓶中进行, 每个三角瓶装800mL培养液。放置3株藻体, 长度为(10±0.5)cm, 质量为(3±0.1)g。实验在温度15℃、光周期为12L︰12D、光照强度为5000lx的植物培养箱内充气进行, 每两天更换培养液。每个实验处理组设置12个重复, 于实验的第0、5、10、15、20天取三个平行样进行如下指标的测定。
1.3 生长指标的测定测定的生长指标包括藻体的鲜质量(fresh weight, FW)、藻体长度以及表观症状等, 其中各处理组的藻体, 用滤纸吸干藻体表面的水分, 称得鲜重。鲜质量的增加量以比生长速率(relative growth rate, RGR)表示, 计算公式如下:

式中, Wt为实验中期或结束时藻体鲜重(g), W0为实验开始时藻体鲜重(g), t为培养时间(d) (Lignell et al, 1989)。
藻体长度以培养20d时的单株均值进行统计分析。
1.4 光合色素[叶绿素a (chlorphyll a, Chl-a)和类胡萝卜素(carotenoid, Car)]、可溶性糖(soluble sugar, SS)和可溶性蛋白(soluble protein, SP)的测定光合色素参照Wellburn (1994)的方法测定, 取0.1g新鲜藻体研磨成匀浆状, 加入8mL 80%丙酮置于4℃黑暗处抽提24h。4000r/min, 4℃离心10min弃沉淀, 上清用80%丙酮定容至10mL。以80%丙酮作为空白对照, 测定665、652、510、480nm波长处的吸光值。重复3次以上, 计算平均值。叶绿素a的含量按照公式w(Chl-a) = (16.29OD665–8.54OD652)× V/W/1000计算, 类胡萝卜素的含量按照公式w(Car) = 7.6×(OD480–1.49×OD510)×V/W/1000, 式中V为浸提丙酮的体积(mL), W为藻体质量(g), 单位为mg/g。
可溶性糖(SS)采用南京建成植物可溶性糖检测试剂盒蒽酮比色法测定, 取0.2g新鲜藻体用液氮中研磨成匀浆状, 加8mL蒸馏水后于80℃水浴30min, 冷却后离心定容至10mL, 作为待测溶液。
可溶性蛋白(SP)采用南京建成蛋白检测试剂盒考马斯亮蓝法测定, 取1g新鲜藻体用液氮中研磨成匀浆状, 加蒸馏水后离心定容到10mL, 作为待测溶液。
1.5 抗氧化系统相关指标的测定超氧化物歧化酶(total superoxide dismutase, T-SOD)、过氧化氢酶(catalase, CAT)的活性和丙二醛(malondialdehyde, MDA)含量的测定均用南京建成生物工程研究所试剂盒测定。取1g新鲜藻体用液氮研磨成匀浆状, 加入4mL提取液(50mmol/L磷酸缓冲液, pH 7.0; 0.1% Triton X-100; 1% PVP) (Beauchamp et al, 1971), 离心取上清作为待测溶液。
1.6 数据分析所得数值以平均值±标准误差表示。显著性差异用单因素方差分析, 分析软件为SPSS 13.0, 当P < 0.05时为显著性差异。
2 结果与分析 2.1 不同浓度烯效唑对铜藻生长的影响添加了不同浓度(0—8.0mg/L)烯效唑的海水中培养20d铜藻的生长状况见图 1。烯效唑处理显著抑制了藻体的生长, 各处理组藻体的SGR在实验期间均低于对照组, 且烯效唑处理浓度越高, SGR越低, 至20d时分别比对照降低23.22%、45.36%、57.57%和72.60%。在实验20d内各处理组SGR的变化趋势却呈现差异性, 其中0.1和1.0mg/L处理组的SGR在实验前10d内逐渐降低, 然后保持稳定至20d (P > 0.05), 4.0mg/L处理组的SGR在实验期间保持稳定, 而8.0mg/L处理组的SGR在实验前5d内出现负增长, 然后有所回升(图 1b)。
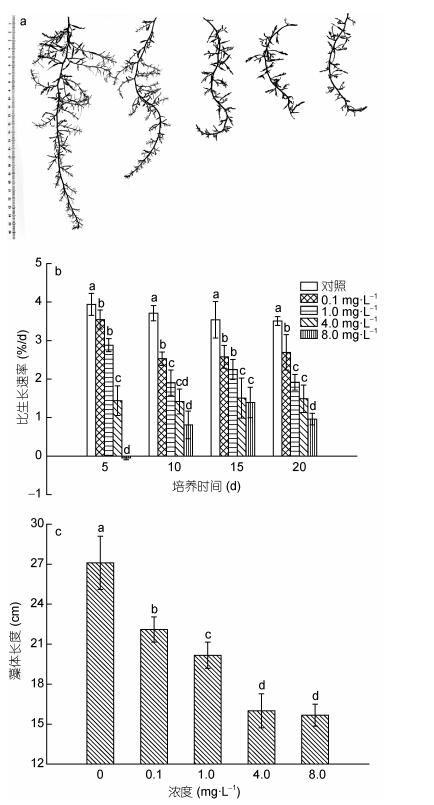 |
| 图 1 不同浓度烯效唑对铜藻生长的影响 Fig. 1 Effects of uniconazole in different concentrations on growth of S. horneri 注:同列中标有不同小写字母者表示组间有显著性差异(P < 0.05), 标有相同小写字母者表示组间无显著性差异(P > 0.05), 下同 |
藻体的长度随烯效唑浓度的增加逐渐下降, 至20d时各处理组藻体长度分别比对照低18.45%、25.58%、40.96%和42.19%(图 1c)。烯效唑浓度超过1.0mg/L处理组的藻体主茎与对照相比明显增粗, 分化新芽数却显著低于对照组, 而0.1mg/L处理组分化新芽数与对照组差异不显著(图 1a)。
2.2 不同浓度烯效唑对光合色素、SS和SP含量的影响各处理组的Chl-a含量在实验前10d内均显著低于对照组(P < 0.05), 且烯效唑浓度越高, Chl-a含量越低; 15d时, 0.1和1.0mg/L处理组的Chl-a含量显著高于对照组(P < 0.05), 4.0mg/L处理组与对照组无显著差异(P > 0.05), 而8.0mg/L处理组显著低于对照组(P < 0.05); 20d时, 0.1和1.0mg/L处理组的Chl-a含量仍显著高于对照组(P < 0.05), 且0.1mg/L处理组最高, 4.0和8.0mg/L处理组的Chl-a含量却显著低于对照组(P < 0.05) (图 2a)。
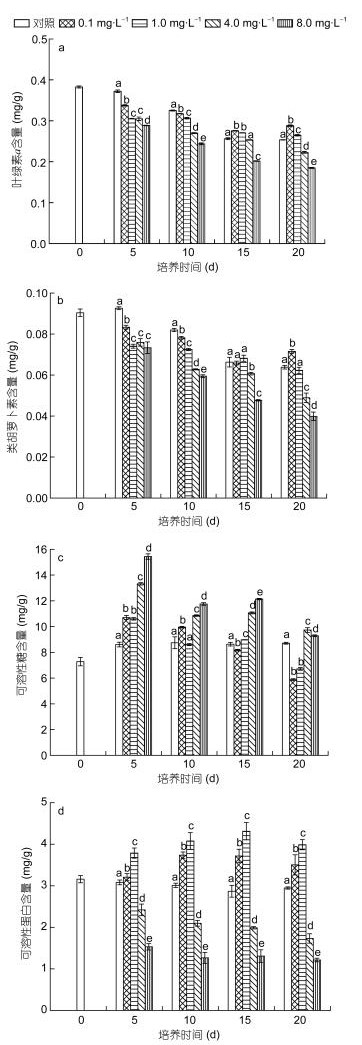 |
| 图 2 不同浓度烯效唑对铜藻叶绿素a、类胡萝卜素、可溶性糖、可溶性蛋白含量的影响 Fig. 2 Effects of uniconazole in different concentrations on Chl-a, Car, SS and SP content of S. horneri |
各处理组的Car含量在实验前10d内均显著低于对照组(P < 0.05), 随后随着培养时间的延长而呈现差异性, 0.1mg/L处理组在15d时与对照组无显著差异, 随后显著升高, 1.0mg/L处理组与对照组无显著差异(P > 0.05), 其余两组均显著低于对照组(P < 0.05) (图 2b)。
SS含量的变化呈现差异性, 在实验第5d时, 各处理组均显著高于对照组(P < 0.05); 10d时, 除1.0mg/L处理组SS水平与对照组无显著差异外(P > 0.05), 其余均显著高于对照组; 15d时, 除0.1mg/L处理组SS水平低于对照外(P < 0.05), 其余均显著高于对照组; 20d时, 0.1和1.0mg/L处理组SS含量低于对照组(P < 0.05), 其余两组显著高于对照组(P < 0.05) (图 2c)。
实验期间0.1和1.0mg/L处理组的SP含量均显著高于对照组(P < 0.05), 其中1.0mg/L处理组最高, 而4.0和8.0 mg/L处理组的SP含量却显著低于对照组(P < 0.05) (图 2d)。
2.3 不同浓度烯效唑对SOD、CAT活性和MDA含量的影响各处理组的SOD活性在实验前5d内均显著高于对照组(P < 0.05), 但各处理组之间无显著差异(P > 0.05); 10d时, 除1.0mg/L处理组SOD活性与对照组无显著差异外(P < 0.05), 其余均显著高于对照组, 且随着烯效唑浓度的提高呈不断增加的趋势; 至20d时, 0.1和1.0mg/L处理组SOD活性与对照组无显著差异(P < 0.05), 其余两组显著高于对照组(P < 0.05) (图 3a)。
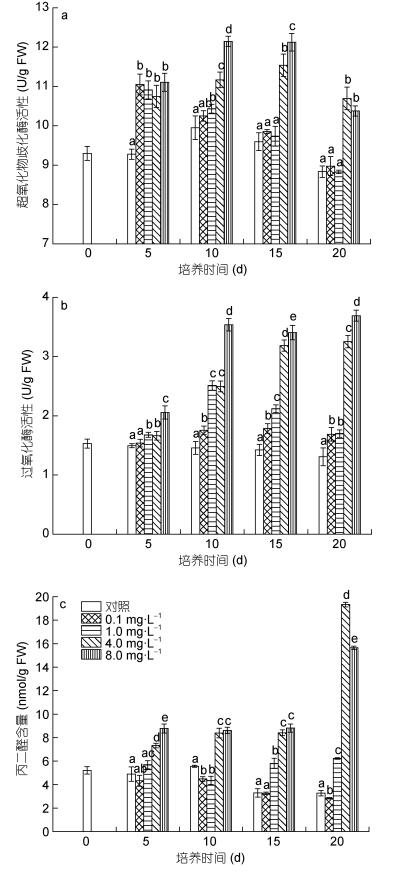 |
| 图 3 不同浓度烯效唑对铜藻抗氧化系统的影响 Fig. 3 Effects of uniconazole in different concentrations on antioxidant system of S. horneri |
CAT活性除1.0mg/L处理组在第5d时与对照组无显著差异外(P > 0.05), 其他均显著高于对照组(P < 0.05), 至20d时, 4.0和8.0mg/L处理组的CAT活性分别比对照增加148.66%和182.13% (图 3b)。
各处理组MDA含量的变化呈现差异性, 0.1mg/L处理组在前10d无显著变化, 随后略有下降, 1.0mg/L处理组随着培养时间呈波动状态, 至20d时显著高于对照组(P < 0.05), 而4.0和8.0mg/L处理组在实验期间均显著高于对照组(P < 0.05) (图 3c)。
3 讨论烯效唑属于三唑类植物生长调节剂, 它能够抑制植物内源赤霉素(Gibberellic acid, GA)的合成, 减少生长素(Indole-3-acetic acid, IAA)的含量, 增加玉米素、脱落酸(Abscisic acid, ABA)和乙烯的含量(Izumi et al, 1988), 从而延缓植物的生长。Uji等(2016)研究发现5µm的烯效唑能够高效诱导铜藻愈伤组织的形成, 但对其不定芽的形成有抑制作用。本研究结果表明, 烯效唑对铜藻的生长和形态产生了明显影响, 处理组藻体的长度显著下降, 新芽萌发个数显著降低, SGR的变化与烯效唑的处理浓度有明显的相关性, 烯效唑处理浓度越高, SGR越低。0.1和1.0mg/L处理组藻体在实验期间生长健壮, 而4.0和8.0mg/L处理组藻体在培养20d时, 尖端出现部分发白、脱落等表观性状, 表明铜藻的生长受到了显著抑制, 这与一些研究者以高等植物为研究对象所得出的研究结果类似(李青苗等, 2003; 龚万灼等, 2007)。因此, 烯效唑对大型海藻铜藻形态的影响也是抑制藻体的纵向生长, 而促进主枝的增粗生长, 对藻体的生长有明显的延缓作用。
为了进一步研究烯效唑对铜藻生长影响的机理, 本实验测定了铜藻经不同浓度烯效唑处理20d生理生化指标的变化。Chl-a和Car是大型海藻光合作用的主要色素, 其含量的变化将直接导致光合作用及物质合成速率的变化, 从而对藻类的生理生化代谢产生影响, 是衡量海藻生长状况的重要指标。由图 2可见, 铜藻经烯效唑处理后其Chl-a和Car含量均表现为低浓度促进, 高浓度抑制的现象, 其中0.1mg/L烯效唑促进作用最明显, 当烯效唑的浓度大于4.0mg/L时, 铜藻的Chl-a和Car含量显著下降。SS和SP的含量是衡量藻类代谢水平的重要指标, SS的变化与光合作用产物的合成与消耗速率有关, SP大多数是功能蛋白和参与各种代谢的酶类, 其含量的变化与海藻的抗逆性有关。本研究结果表明, 低浓度(≤1.0mg/L)的烯效唑能显著提高藻体的SP含量, 而对SS只有短暂的促进作用, 高浓度(≥4.0mg/L)的烯效唑则显著抑制了SP的合成, 促进了SS的合成。低浓度的烯效唑对铜藻产生的促进作用, 原因可能是生物的一种“毒物的兴奋效应”(Hormesis)而产生的增益现象, 是自我保护的一种机制(Stebbing, 1982), 藻体通过合成光合色素吸收更多光能进行光合作用以抵御胁迫, 通过提高功能蛋白的数量和激活藻细胞内一些相关酶的活性, 进而促进藻细胞的代谢。而高浓度的烯效唑则破坏了藻体叶绿素和类胡萝卜素的合成, 降低了藻体捕获光能的能力, 影响了蛋白质的合成或促使蛋白变性而降解, 致使藻体中光合色素和SP含量的降低, 同时藻体内SS含量升高, 表明体内积累了大量的碳水化合物。
研究表明, 当藻类处于逆境时, 细胞内自由基产生和清除的平衡系统受到破坏导致自由基积累, 由此加剧细胞膜脂过氧化, 而藻体内存在着清除自由基的多种途径, 其中最主要的就是保护酶系统。SOD是藻体内清除活性氧系统的首道防线, 其主要功能是清除超氧自由基, 提高抗氧化能力(Bowler et al, 1992), 而CAT的主要功能是清除细胞质中产生的H2O2。本研究结果表明, 不同浓度的烯效唑处理5d对铜藻的SOD活性均有明显的促进作用, 而随着处理时间的延长, 低浓度(≤1.0mg/L)处理组SOD活性恢复到对照组水平, 高浓度(≥4.0mg/L)处理组SOD活性仍保持在较高水平, 显著高于对照组。0.1mg/L烯效唑处理组的CAT活性在实验10d时才显著升高, 表现为逐渐诱导的现象, 而其他三个高浓度的处理组在实验期间, CAT活性均显著升高。本文推测发生此种变化的原因可能是:低浓度烯效唑使藻细胞产生活性氧(ROS)的量上升, 从而迅速激活更多的SOD来清除活性氧, 超氧化物歧化为H2O2, 受到高含量H2O2的诱导CAT活性升高, 随着处理时间的延长, 细胞内的活性氧达到平衡, SOD活性恢复至正常水平。而在高浓度烯效唑处理下, 藻细胞内正常的活性氧代谢机制失去平衡, 活性氧在细胞内大量积累, 表现为SOD和CAT活性的显著升高, 这也表明抗氧化酶系统能够协调有效地清除活性氧物质, 对藻体起到保护作用。
MDA是常用的膜脂过氧化指标, 是藻类在衰老或逆境条件下, 发生膜脂过氧化的产物之一, 其含量的高低表示细胞膜脂过氧化程度和对逆境条件耐受的强弱(冯琛等, 2004; Liu et al, 2010)。本实验研究发现, 0.1mg/L烯效唑处理下, 藻体MDA的含量在实验第20d时略低于对照组, 表明藻细胞内活性氧可能没有大量积累, 膜脂过氧化程度较低, 而烯效唑浓度≥1.0mg/L的三个处理组MDA的含量显著升高, 表明胁迫促使藻体内活性氧大量生成, 造成膜脂过氧化程度较大, 这种现象随烯效唑浓度的增大表现愈加明显。研究表明植物抗氧化酶系统的活性与其抗逆性之间有着重要的相关性(Seel et al, 1992; Dummermuth et al, 2003), 烯效唑处理可提高植株SOD、POD、CAT等酶活性及降低MDA含量的积累, 提高自我保护能力, 增加植物抗逆性(姚雄等, 2008; 闫艳红等, 2009)。本研究结果也显示大型海藻铜藻经低浓度的烯效唑(0.1mg/L)处理后SOD和CAT活性高于对照, MDA含量则低于对照, 表明一定浓度的烯效唑处理可提高铜藻对自由基的清除能力, 提高藻体的抗逆能力, 这对海洋经济藻类人工繁育的养殖实践具有重要的意义。
4 结论铜藻对植物生长调节剂烯效唑的响应是一个复杂的过程, 低浓度下虽抑制藻体的生长, 但对其生理生化指标起到一定的促进作用, 而当烯效唑的浓度超过某一临界值时, 铜藻的生长及各项生理生化指标开始受到显著抑制, 并逐渐发生过氧化损伤, 从而导致蛋白质、膜脂及其他细胞组分的损伤, 进而造成植株的衰老。我们推测烯效唑也是通过调节大型海藻内源激素的变化与平衡而影响其生理代谢过程, 从而调节海藻的生长发育, 但详细的作用机制仍有待进一步的实验研究。
| 尹大强, 陆根法, 孙爱龙, 等, 1997. 农药多效唑和烯效唑对大型溞(Daphnia magna)繁殖和发育的影响. 南京大学学报(自然科学), 33(4): 556–561 |
| 冯琛, 路新枝, 于文功, 2004. 逆境胁迫对条斑紫菜生理生化指标的影响. 海洋湖沼通报,(3): 22–26 |
| 朱木兰, 何觉民, 1999. 烯效唑对农作物的生理效应及应用效果. 作物研究,(2): 40–43 |
| 闫艳红, 李波, 杨文钰, 2009. 烯效唑浸种对大豆苗期抗旱性的影响. 中国油料作物学报, 31(4): 480–485 |
| 李宁毅, 李之璞, 2008. 烯效唑在园艺植物上的应用. 北方园艺,(6): 62–64 |
| 李青苗, 杨文钰, 2003. 烯效唑浸种对玉米苗期形态的调控效应. 中国农学通报, 19(6): 84–86, 93 |
| 张欢欢, 李琳, 严兴洪, 2013. 三十烷醇对坛紫菜叶状体生长的影响. 上海海洋大学学报, 22(6): 876–881 |
| 姚雄, 任万军, 杨文钰, 等, 2008. 烯效唑对水稻秧苗抵御不同类型低温胁迫能力的影响. 草业学报, 17(5): 68–75 DOI:10.11686/cyxb20080511 |
| 龚万灼, 张正翼, 杨文钰, 等, 2007. 烯效唑干拌种对大豆形态特征和产量的影响. 大豆科学, 26(3): 369–372, 376 |
| 常瑞丰, 王召元, 张立莎, 等, 2013. 烯效唑在果树上应用的研究进展. 安徽农学通报, 19(3): 61–63 |
| 鹿宁, 臧晓南, 张学成, 等, 2012. 逆境胁迫对藻类抗氧化酶系统的影响. 武汉大学学报(理学版), 58(2): 119–124 |
| Beauchamp C, Fridovich I, 1971. Superoxide dismutase:improved assays and an assay applicable to acrylamide gels. Analytical Biochemistry, 44(1): 276–287 DOI:10.1016/0003-2697(71)90370-8 |
| Bowler C, Montagu M V, Inze D, 1992. Superoxide dismutase and stress tolerance. Annual Review of Plant Physiology and Plant Molecular Biology, 43(1): 83–116 DOI:10.1146/annurev.pp.43.060192.000503 |
| Bradley P M, Cheney D P, 1990. Some effects of plant growth regulators on tissue cultures of the marine red alga Agardhiella subulata (Gigartinales, Rhodophyta). Hydrobiologia, 204-205(1): 353–360 DOI:10.1007/BF00040256 |
| Dummermuth A L, Karsten U, Fisch K M, et al, 2003. Responses of marine macroalgae to hydrogen-peroxide stress. Journal of Experimental Marine Biology and Ecology, 289(1): 103–121 DOI:10.1016/S0022-0981(03)00042-X |
| Izumi K, Nakagawa S, Kobayashi M, et al, 1988. Levels of IAA, cytokinins, ABA and ethylene in rice plants as affected by a gibberellin biosynthesis inhibitor, uniconazole-P. Plant & Cell Physiology, 29(1): 97–104 |
| Lignell Å, Pedersén M, 1989. Agar composition as a function of morphology and growth rate. Studies on some morphological strains of Gracilaria secundata and Gracilaria verrucosa (Rhodophyta). Botanica Marina, 32(3): 219–227 |
| Liu J G, Zhang X L, Sun Y H, et al, 2010. Antioxidative capacity and enzyme activity in Haematococcus pluvialis cells exposed to superoxide free radicals. Chinese Journal of Oceanology and Limnology, 28(1): 1–9 DOI:10.1007/s00343-010-9244-6 |
| Mei X Q, Zheng K, Wang L D, et al, 2014. Studies on the effects on growth and antioxidant responses of two marine microalgal species to uniconazole. Journal of Ocean University of China, 13(5): 877–882 DOI:10.1007/s11802-014-2326-x |
| Qiu J, Wang R M, Yan J Z, et al, 2005. Seed film coating with uniconazole improves rape seedling growth in relation to physiological changes under waterlogging stress. Plant Growth Regulation, 47(1): 75–81 DOI:10.1007/s10725-005-2451-z |
| Seel W E, Hendry G A F, Lee J A, 1992. Effects of desiccation on some activated oxygen processing enzymes and anti-oxidants in mosses. Journal of Experimental Botany, 43(8): 1031–1037 DOI:10.1093/jxb/43.8.1031 |
| Stebbing A R D, 1982. Hormesis-the stimulation of growth by low levels of inhibitors. Science of the Total Environment, 22(3): 213–234 DOI:10.1016/0048-9697(82)90066-3 |
| Uji T, Nanaumi D, Kawagoe C, et al, 2016. Factors influencing the induction of adventitious bud and callus in the brown alga Sargassum horneri (Turner) C. Agardh. Journal of Applied Phycology, 28(4): 2435–2443 DOI:10.1007/s10811-015-0745-8 |
| Wellburn A R, 1994. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution. Journal of Plant Physiology, 144(3): 307–313 DOI:10.1016/S0176-1617(11)81192-2 |
| Yokoya N S, 2000. Apical callus formation and plant regeneration controlled by plant growth regulators on axenic culture of the red alga Gracilariopsis tenuifrons (Gracilariales, Rhodophyta). Phycological Research, 48(3): 133–142 DOI:10.1111/pre.2000.48.issue-3 |
| Yokoya N S, Kakita H, Obika H, et al, 1999. Effects of environmental factors and plant growth regulators on growth of the red alga Gracilaria vermiculophylla from Shikoku Island, Japan. Hydrobiologia, 398-399: 339–347 DOI:10.1023/A:1017072508583 |
 2018, Vol. 49
2018, Vol. 49


