中国海洋湖沼学会主办。
文章信息
- 董训赞, 车绕琼, 赵永腾, 赵鹏, 徐军伟, 李涛, 余旭亚. 2018.
- DONG Xun-Zan, CHE Rao-Qiong, ZHAO Yong-Teng, ZHAO Peng, XU Jun-Wei, LI Tao, YU Xu-Ya. 2018.
- 黄腐酸对Monoraphidium sp.FXY-10油脂合成的影响
- EFFECTS OF FULVIC ACID ON LIPID ACCUMULATION OF MONORAPHIDIUM SP. FXY-10
- 海洋与湖沼, 49(4): 815-820
- Oceanologia et Limnologia Sinica, 49(4): 815-820.
- http://dx.doi.org/10.11693/hyhz20171200304
-
文章历史
- 收稿日期:2017-12-02
- 收修改稿日期:2018-03-23
我国是世界上重要的能源生产大国, 也是能源消费大国(Pienkos et al, 2009)。然而, 化石燃料的过度开发和使用, 造成了严重的能源危机和环境问题。因此, 寻找一种清洁、可再生的能源十分重要(Chen et al, 2011)。生物柴油是化石能源的良好的替代品, 是一种清洁环保的可再生能源。
微藻具备固碳和产油的功能(康永锋等, 2013; 姜加伟等, 2014)。利用微藻制备生物柴油具有诸多优势: (1)生产效率高, 通常是其他油料作物的10—100倍; (2)光合效率高; (3)脂质与淀粉的含量高; (4)不与粮食作物争地; (5)可利用废水, 净化环境; (6)生产周期短, 全年不间断生产等(Chisti, 2008; Carioca et al, 2009; Stephenson et al, 2011)。从微藻中提取的油脂成分, 可作为生物柴油直接应用于工业上, 具有广泛的应用价值(赵婷等, 2016)。因此, 利用微藻制备生物柴油受到越来越多国内外学者的关注(张冀翔等, 2016)。
不同浓度的植物生长调节剂可以影响微藻的生长和油脂含量的积累。研究表明, 外源添加5mmol/L的甜菜碱可以显著提高微藻中油脂含量(Zhao et al, 2016)。胺鲜酯(0.001μmol/L)结合氮缺陷(12.5%)可抑制微藻的生长, 但油脂含量高达57.1% (Babu et al, 2017)。黄腐酸是一种植物生长调节剂, 能够改变细胞的通透性, 提高植物细胞对氮、磷等营养物质的吸收, 促进植物的生长和代谢产物的积累(Piccolo et al, 1992), 影响植物的发育, 提高产量等(Heil, 2005; 袁瑞江等, 2009; Shahid et al, 2012)。研究表明, 外源添加黄腐酸(5mmol/L)可以促进雨生红球藻中虾青素的积累(Zhao et al, 2015)。
本实验以Monoraphidium sp. FXY-10为对象, 研究了黄腐酸诱导作用下, 单针藻的生物量、油脂含量、叶绿素、蛋白质及油脂合成相关酶[磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase, PEPC)、乙酰辅酶A羧化酶(acetyl coenzyme A carboxylase, ACCase)、苹果酸酶(malic enzyme, ME)]活性的变化, 为提高微藻油脂产量提供了理论参考。
1 材料与方法 1.1 微藻的培养以单针藻Monoraphidium sp. FXY-10(本实验室筛选、保存)为研究对象, Kuh1培养基作为基础培养基, 并以10g/L葡萄糖为碳源, 培养温度: (25±1)℃, 摇床转速150r/min, 异养培养单针藻至第8天, 然后将异养藻液分别接种到含有黄腐酸0和25mg/L的自养培养基中。接种量为7×107cells/mL, 光照强度: 3.5×103lx, 培养温度: (25±1)℃, 摇床转速150r/min。每组设置三个平行。
1.2 细胞干重和油脂的测定根据藻细胞与吸光度A750值在一定的范围内成线性关系, 得出单针藻的生物量与750nm处的吸光度的关系(Che et al, 2016):
 (1)
(1)式中, R2=0.9997, Y为生物量(g/L), X为吸光度值。
新鲜藻液12000g离心5min, -80℃冷冻过夜, 冻干。干藻粉(0.3—0.5g)与石英砂1:2 (w/w)混合研磨, 用3mL的氯仿-甲醇溶液(2:1, v/v)清洗, 转移至50mL的离心管中, 150r/min震荡20min后, 20℃、8000g离心5min, 上清液收集于另一个离心管中。重复上述步骤两次, 合并三次上清液, 并转移至已称重的干燥离心管中, 40 ℃烘干至恒重。
1.3 叶绿素和蛋白质的测定2mL新鲜的培养液用于叶绿素含量的测定, 12000g离心5min, 弃上清。用蒸馏水重悬两次, 加入1mL的DMSO重悬, 20℃、150r/min震荡30min, 离心, 留上清。分别测量上清液在665.1和649.1nm的吸光度。叶绿素计算公式(Wellburn, 1994)如公式(2):
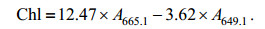 (2)
(2)蛋白质测定时, 称取10mg干藻粉, 加入200μL氢氧化钠溶液(1mol/L), 80℃静置10min, 蒸馏水定容至1mL, 12000g离心30min, 留上清。重复上述提取过程两次, 合并三次上清液。以牛血清蛋白建立标准曲线, 用考马斯亮蓝法测定蛋白质浓度(Berges et al, 1993)。
1.4 酶活性的测定20mL新鲜藻液, 4℃, 12000g离心5min, 弃上清, 蒸馏水重悬, 重复离心两次。液氮速冻, 加入提取液, 用研钵磨成粉。收集在1.5mL的离心管中, 4℃, 10000g离心10min, 上清转移至新的离心管中, 使用比色定量试剂盒(苏州科铭生物技术有限公司)测定ME、ACCase、PEPC的活性。一个酶活单位定义为在特定条件下, 1min内能转化1μmol底物的酶量(Ma et al, 2016)。
1.5 统计分析本文全部试验均设置三组平行, 利用ANOVA (SPSS19.0)一步法分析实验数据。最小显著性差异进行多重比较检验调查不同试验的组间差异, *P<0.05表示差异显著。
2 结果与讨论 2.1 黄腐酸诱导对微藻中油脂含量的影响黄腐酸诱导对Monoraphidium sp. FXY-10油脂含量的影响见图 1。第6天, 对照组中油脂含量从44.3%增加到48.4%, 黄腐酸诱导作用下, 油脂含量达到54.3%, 是对照组的1.1倍。蛋白质、叶绿素、脂类等是藻细胞的主要成分。在异样培养的Chlorella vulgaris中, 碳水化合物的含量从55.3%下降到32.8%, 而脂质从9.10%增加到28.9%, 蛋白质从32.2%增加到34.8%, 叶绿素从1.22 %增加至2.26% (Han et al, 2012)。研究表明, 外源添加甜菜碱能使微藻油脂含量显著增加, 而生物量保持基本不变(Zhao et al, 2016)。诱导后期, 油脂含量呈下降趋势, 但与对照组相比增加显著(P<0.05)。本实验结果表明, 黄腐酸可以显著促进微藻油脂的积累。
 |
| 图 1 黄腐酸诱导微藻中油脂含量的变化 Fig. 1 Changes in oil content in microalgae induced by fulvic acid |
图 2显示了黄腐酸诱导作用下微藻生物量的变化趋势。诱导过程中, 对照组与诱导组的生物量无明显差异。诱导前6天生长缓慢, 第10天时, 诱导组和对照组细胞浓度从1.83g/L分别增加到2.29和2.28g/L。Zhao等(2016)对Monoraphidium sp. QLY-1的研究表明, 外源添加甜菜碱诱导培养, 微藻的生物量基本保持不变。本实验中诱导培养至第10天时, 实验组和对照组的生物量分别增加了25.14%和24.60%。实验结果表明, 外源添加黄腐酸诱导培养, 不能增加单针藻Monoraphidium sp. FXY-10的生物量。
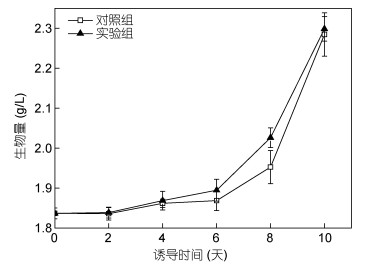 |
| 图 2 黄腐酸诱导对微藻生物量的影响 Fig. 2 Effect of fulvic acid on the biomass of microalgae |
光合作用固定的CO2可用来合成碳水化合物、脂质、蛋白质等生物大分子。研究表明, 在受到环境胁迫时, 细胞可能会合成逆境蛋白用以抵抗环境(王赛君等, 2017)。黄腐酸诱导作用下, 单针藻中蛋白质含量从31.4%增加到39.7%, 第2、4、6、8天时的蛋白质含量分别是31.4%、32.7%、33.7%, 和38.8%;对照组中的蛋白质含量从28.8%增加到38.9%。(图 3)。有研究表明, 异养种子自养培养, 在最初的几个小时内, 蛋白质迅速积累, 然后缓慢增加, 最终达到55% (Fan et al, 2012)。添加植物生长调节物质, 可以提高饵料微藻中蛋白质的含量(周辉等, 2003)。小球藻在光自养培养的条件下, 迅速启用光合作用, 合成蛋白质和叶绿素, 从而快速提高了小球藻蛋白质和叶绿素的含量(魏东等, 2017)。外源添加黄腐酸, 可显著(P<0.05)提高单针藻中的蛋白质含量。
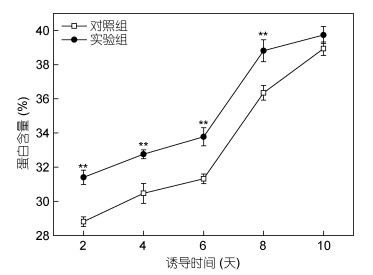 |
| 图 3 黄腐酸诱导单针藻蛋白质的变化趋势 Fig. 3 Changes in algae protein that induced by fulvic acid |
图 4表明, 黄腐酸诱导培养第6天, 叶绿素含量迅速增加至21.46μg/mL, 然后缓慢增长, 最终达到23.06μg/mL; 对照组中, 叶绿素含量从5.25μg/mL增加到23.88μg/mL。由于细胞浓度不断增加, 阻碍了光进入培养基内部, 微藻光合作用降低, 叶绿素的积累变缓。减少氮、磷两种元素含量, 会抑制微藻中叶绿素的积累(王昭玉等, 2013)。在氮缺陷的条件下, 微藻细胞内叶绿素不能正常合成(Fan et al, 2014b)。本实验结果表明, 黄腐酸诱导培养不会影响单针藻细胞内叶绿素的合成。
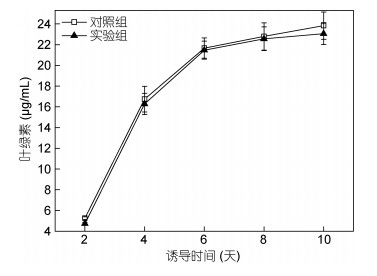 |
| 图 4 微藻中叶绿素含量的变化趋势 Fig. 4 The trend of change in chlorophyll content in microalgae |
ACCase、ME、PEPC的活性影响油脂的合成与积累, 是油脂合成过程中的关键性酶(Sugimoto et al, 1989; Shintani et al, 1995; Courchesne et al, 2009; 丁柯等, 2016)。将胞质溶胶ACCase导入油菜叶绿体中, 提高了成熟种子中ACCase的活性, 含油量增加5% (Roesler et al, 1997)。图 5显示了ACCase活性的变化趋势。黄腐酸诱导培养显著(P<0.01)提高了ACCase的活性。诱导培养第4天, ACCase的活性最高(152μmol/h/g), 第6天下降至131μmol/h/g, 然后逐渐上升。ACCase处于活跃的还原状态时, 催化脂肪酸的合成, 处于不活跃的氧化状态, 催化效率较低(王伏林等, 2006)。藻中ACCase的活性受到反馈抑制时, 脂肪酸合成速率下降(Shintani et al, 1995)。黄腐酸上调ACCase的活性, 有利于微藻油脂的积累。
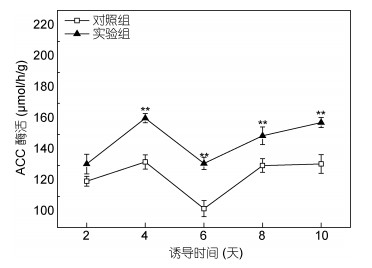 |
| 图 5 黄腐酸诱导作用下ACC酶活性的变化 Fig. 5 Activity of ACC enzyme under the induction of fulvic acid |
图 6显示了黄腐酸诱导培养过程中ME活性的变化趋势。诱导培养第2天, ME的活性(3.66mmol/min/g)比对照组(1.73mmol/min/g)提高了1.12倍, 第4天是对照组(0.24mmol/min/g)的3.4倍。焦进安(1987)指出, PEPC、ME和苹果酸脱氢酶组成的羧化-脱羧化系统称为植物细胞的生物化学pH稳定器, 有利于TCA循环不断地将苹果酸释放出的CO2转化为光合产物。研究发现, 在产油微生物油脂合成代谢调控中, ME为脂肪酸合成提供NADPH (还原型辅酶Ⅱ)(Song et al, 2001)。ME活性的增强可以促进油脂的快速积累(Courchesne et al, 2009)。而第6天ME活性降低, 但依然高于对照组, 这与ACCase活性及藻细胞油脂的变化保持一致(图 5, 图 1)。诱导后期, 微藻的快速生长导致培养基中CO2浓度下降, 藻细胞光合作用降低, ME活性下降, 使得微藻利用储备的油脂供给自身生长需求, 从而导致油脂含量下降(Davis et al, 2017; Xue et al, 2015)。本实验结果表明, 黄腐酸诱导培养下, ME的活性显著(P<0.05)增强。
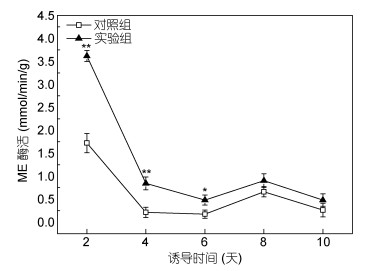 |
| 图 6 黄腐酸诱导对ME活性的影响 Fig. 6 Effect of fulvic acid on ME activity |
PEPC是植物光合作用、呼吸作用中的关键性酶, 催化磷酸烯醇式丙酮酸在体内转化为苹果酸或天冬氨酸(焦进安, 1987)。即便是在CO2浓度很低的情况下, PEPC也有很强的固定CO2的能力(Davies, 1980)。PEPC活性变化如图 7所示, 诱导组中PEPC活性变化趋势与对照组一致。与对照组相比, 诱导培养第2天, PEPC的活性降低最少(29%), 第6天活性最低(139 nmol/min/g), 下调44%。诱导培养前期, PEPC活性较高, 有利于微藻固定CO2, 进行光合作用。第6天, PEPC活性下调, 研究表明, pepc表达量降低可以促进植物、微生物等物种中甘油三酯的生物合成(Sugimoto et al, 1989; Fan et al, 2012)。随着油脂的积累, pepc的表达量逐渐降低, 特别是在油脂积累后期尤为明显(Fan et al, 2014a)。外源添加黄腐酸诱导培养, PEPC的活性下调, 有利于微藻油脂的积累。
 |
| 图 7 黄腐酸诱导作用下PEPC活性的变化 Fig. 7 Changes in the activity of PEPC under the induction of fulvic acid |
Monoraphidium sp. FXY-10是一种生产生物柴油的良好原料。外源添加黄腐酸(25mg/L)诱导培养, 微藻生物量和叶绿素无显著变化, 藻细胞内蛋白质含量出现不同程度的上调。培养至第6天, 油脂含量高达54.3%, 是对照组的1.12倍。此外, 诱导过程中, ME、ACCase活性上调, PEPC活性下调, 这些变化都和藻细胞中油脂积累有关。在黄腐酸的诱导下, 与油脂合成相关的分子机制值得进一步的研究。
| 丁柯, 李涛, 徐军伟, 等, 2016. 产油微藻油脂代谢相关酶基因研究进展. 化工新型材料, 44(4): 32–34 |
| 王伏林, 吴关庭, 郎春秀, 等, 2006. 植物中的乙酰辅酶A羧化酶(AACase). 植物生理学报, 42(1): 10–14 |
| 王昭玉, 王江涛, 2013. 7种海洋微藻叶绿素荧光对N、P限制的响应. 海洋环境科学, 32(2): 165–170 |
| 王赛君, 吴湘, 王奕棉, 等, 2017. 水生入侵植物对常见水华的抑藻效应及其影响机理. 海洋与湖沼, 48(4): 798–805 |
| 张冀翔, 王东, 魏耀东, 2016. 微藻水热液化生物油物理性质与测量方法综述. 化工进展, 35(1): 98–104 |
| 周辉, 黄旭雄, 周洪琪, 等, 2003. 植物生长调节物质对饵料微藻蛋白质和氨基酸的影响. 上海海洋大学学报, 12(3): 215–218 |
| 姜加伟, 程丽华, 徐新华, 等, 2014. 微藻固定转化烟气CO2强化技术. 化工进展, 33(7): 1884–1894 |
| 赵婷, 韩笑天, 詹天荣, 等, 2016. 温度对四种产油微藻生长和油脂特性的影响. 海洋与湖沼, 47(6): 1140–1148 |
| 袁瑞江, 姚银娟, 王丽乔, 等, 2009. 生物腐植酸(黄腐酸)及其在农业中的应用. 河北农业科学, 13(7): 36–38, 133 |
| 康永锋, 史华进, 胡文振, 等, 2013. 利用海洋微藻制备生物柴油的研究进展. 化工新型材料, 41(12): 22–24, 49 |
| 焦进安, 1987. 植物磷酸烯醇式丙酮酸羧化酶的多生理功能. 植物生理学报,(1): 42–45 |
| 魏东, 张会贞, 陈娇敏, 2017. 优化营养方式强化蛋白核小球藻生物量及蛋白质和叶绿素生产. 现代食品科技, 33(4): 160–167 |
| Babu A G, Wu X G, Kabra A N, et al, 2017. Cultivation of an indigenous Chlorella sorokiniana with phytohormones for biomass and lipid production under N-limitation. Algal Research, 23: 178–185 DOI:10.1016/j.algal.2017.02.004 |
| Berges J A, Fisher A E, Harrison P J, 1993. A comparison of Lowry, Bradford and Smith protein assays using different protein standards and protein isolated from the marine diatom Thalassiosira pseudonana. Marine Biology, 115(2): 187–193 DOI:10.1007/BF00346334 |
| Carioca J O B, Hiluy Filho J J, Leal M R L V, et al, 2009. The hard choice for alternative biofuels to diesel in Brazil. Biotechnology Advances, 27(6): 1043–1050 DOI:10.1016/j.biotechadv.2009.05.012 |
| Che R Q, Ding K, Huang L, et al, 2016. Enhancing biomass and oil accumulation of Monoraphidium sp.FXY-10 by combined fulvic acid and two-step cultivation. Journal of the Taiwan Institute of Chemical Engineers, 67: 161–165 DOI:10.1016/j.jtice.2016.06.035 |
| Chen C Y, Yeh K L, Aisyah R, et al, 2011. Cultivation, photobioreactor design and harvesting of microalgae for biodiesel production:a critical review. Bioresource Technology, 102(1): 71–81 DOI:10.1016/j.biortech.2010.06.159 |
| Chisti Y, 2008. Biodiesel from microalgae beats bioethanol. Trends in Biotechnology, 26(3): 126–131 DOI:10.1016/j.tibtech.2007.12.002 |
| Courchesne N M D, Parisien A, Wang B, et al, 2009. Enhancement of lipid production using biochemical, genetic and transcription factor engineering approaches. Journal of Biotechnology, 141(1-2): 31–41 DOI:10.1016/j.jbiotec.2009.02.018 |
| Davies D, 1980. The Biochemistry of plants. New York: Academic Press, |
| Davis A, Abbriano R, Smith S R, et al, 2017. Clarification of photorespiratory processes and the role of malic enzyme in diatoms. Protist, 168(1): 134–153 DOI:10.1016/j.protis.2016.10.005 |
| Fan J H, Cui Y B, Wan M X, et al, 2014a. Lipid accumulation and biosynthesis genes response of the oleaginous Chlorella pyrenoidosa under three nutrition stressors. Biotechnology for Biofuels, 7(1): 17 DOI:10.1186/1754-6834-7-17 |
| Fan J H, Cui Y B, Zhou Y, et al, 2014b. The effect of nutrition pattern alteration on Chlorella pyrenoidosa growth, lipid biosynthesis-related gene transcription. Bioresource Technology, 164: 214–220 DOI:10.1016/j.biortech.2014.04.087 |
| Fan J H, Huang J, Li Y G, et al, 2012. Sequential heterotrophy-dilution-photoinduction cultivation for efficient microalgal biomass and lipid production. Bioresource Technology, 112: 206–211 DOI:10.1016/j.biortech.2012.02.046 |
| Han F F, Huang J K, Li Y G, et al, 2012. Enhancement of microalgal biomass and lipid productivities by a model of photoautotrophic culture with heterotrophic cells as seed. Bioresource Technology, 118: 431–437 DOI:10.1016/j.biortech.2012.05.066 |
| Heil C A, 2005. Influence of humic, fulvic and hydrophilic acids on the growth, photosynthesis and respiration of the dinoflagellate Prorocentrum minimum (Pavillard) Schiller. Harmful Algae, 4(3): 603–618 DOI:10.1016/j.hal.2004.08.010 |
| Ma X N, Liu J, Liu B, et al, 2016. Physiological and biochemical changes reveal stress-associated photosynthetic carbon partitioning into triacylglycerol in the oleaginous marine alga Nannochloropsis oculata. Algal Research, 16: 28–35 DOI:10.1016/j.algal.2016.03.005 |
| Piccolo A, Nardi S, Concheri G, 1992. Structural characteristics of humic substances as related to nitrate uptake and growth regulation in plant systems. Soil Biology and Biochemistry, 24(4): 373–380 DOI:10.1016/0038-0717(92)90197-6 |
| Pienkos P T, Darzins A, 2009. The promise and challenges of microalgal-derived biofuels. Biofuels, Bioproducts and Biorefining, 3(4): 431–440 DOI:10.1002/bbb.v3:4 |
| Roesler K, Shintani D, Savage L, et al, 1997. Targeting of the arabidopsis homomeric acetyl-coenzyme a carboxylase to plastids of rapeseeds. Plant Physiology, 113(1): 75–81 DOI:10.1104/pp.113.1.75 |
| Shahid M, Dumat C, Silvestre J, et al, 2012. Effect of fulvic acids on lead-induced oxidative stress to metal sensitive Vicia faba L.plant. Biology and Fertility of Soils, 48(6): 689–697 DOI:10.1007/s00374-012-0662-9 |
| Shintani D K, Ohlrogge J B, 1995. Feedback inhibition of fatty acid synthesis in tobacco suspension cells. The Plant Journal, 7(4): 577–587 DOI:10.1046/j.1365-313X.1995.7040577.x |
| Song Y D, Wynn J P, Li Y H, et al, 2001. A pre-genetic study of the isoforms of malic enzyme associated with lipid accumulation in Mucor circinelloides. Microbiology, 147(6): 1507–1515 DOI:10.1099/00221287-147-6-1507 |
| Stephenson P G, Moore C M, Terry M J, et al, 2011. Improving photosynthesis for algal biofuels:toward a green revolution. Trends in Biotechnology, 29(12): 615–623 DOI:10.1016/j.tibtech.2011.06.005 |
| Sugimoto T, Tanaka K, Monma M, et al, 1989. Phosphoenolpyruvate carboxylase level in soybean seed highly correlates to its contents of protein and lipid. Agricultural and Biological Chemistry, 53(3): 885–887 |
| Wellburn A R, 1994. The Spectral Determination of chlorophylls a, and b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution. Journal of Plant Physiology, 144(3): 307–313 DOI:10.1016/S0176-1617(11)81192-2 |
| Xue J, Niu Y F, Huang T, et al, 2015. Genetic improvement of the microalga Phaeodactylum tricornutum for boosting neutral lipid accumulation. Metabolic Engineering, 27: 1–9 DOI:10.1016/j.ymben.2014.10.002 |
| Zhao Y T, Li D F, Ding K, et al, 2016. Production of biomass and lipids by the oleaginous microalgae Monoraphidium sp.QLY-1 through heterotrophic cultivation and photo-chemical modulator induction. Bioresource Technology, 211: 669–676 DOI:10.1016/j.biortech.2016.03.160 |
| Zhao Y T, Shang M M, Xu J W, et al, 2015. Enhanced astaxanthin production from a novel strain of Haematococcus pluvialis using fulvic acid. Process Biochemistry, 50(12): 2072–2077 DOI:10.1016/j.procbio.2015.09.004 |
 2018, Vol. 49
2018, Vol. 49


