中国海洋湖沼学会主办。
文章信息
- 刘峰, 刘兴凤, 金柘, 于仁成, 孔凡洲, 颜天. 2018.
- LIU Feng, LIU Xing-Feng, JIN Zhe, YU Ren-Cheng, KONG Fan-Zhou, YAN Tian. 2018.
- 苏北浅滩沉积物中的大型绿藻微观繁殖体的垂直分布和物种多样性
- VERTICAL DISTRIBUTION AND SPECIES DIVERSITY OF MICROSCOPIC PROPAGULES OF GREEN MACROALGAE IN SEDIMENTS OF SUBEI SHOAL, CHINA
- 海洋与湖沼, 49(5): 983-990
- Oceanologia et Limnologia Sinica, 49(5): 983-990.
- http://dx.doi.org/10.11693/hyhz20180200030
-
文章历史
- 收稿日期:2018-02-07
- 收修改稿日期:2018-02-27
2. 青岛海洋科学与技术国家实验室 海洋生物学与生物技术功能实验室 青岛 266237;
3. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
从2007年至2018年, 浒苔绿潮在我国黄海已连续发生了12年, 已经成为一种由大型绿藻引发的常态化生态灾害, 对我国黄海海域的生态健康安全构成了严重威胁, 也给我国黄海沿岸多个城市的水产养殖业和旅游业造成重大经济损失(Ye et al, 2011; Liu et al, 2013b; Wang et al, 2015)。结合现场调查和卫星遥感数据等, 目前发现黄海浒苔绿潮最初形成于苏北辐射沙洲的紫菜养殖区(Liu et al, 2010a), 大规模的紫菜养殖筏架为水体中石莼属等绿藻微观繁殖体提供了附着生长的基质, 分布在水体和沉积物中的浒苔繁殖体构成了黄海浒苔绿潮连年暴发的“种子库”(Zhang et al, 2010; Liu et al, 2012, 2013b)。
石莼属等绿藻微观繁殖体是对环境中处于微观阶段藻体的统称, 包含孢子、配子、合子等生殖细胞、处于早期微观发育阶段的藻体、显微藻段或断枝等(Schories, 1995; Lotze et al, 2001; Liu et al, 2010b, c; Pang et al, 2010)。这一概念的提出为我们定量研究自然环境中绿潮藻在微观阶段的动态变化和物种多样性提供了重要的思路。2008—2009年首次通过石莼属绿藻微观繁殖体培养定量的技术方法系统调查了青岛沿岸水体中石莼属绿藻微观繁殖体的丰度变化和物种组成(Liu et al, 2010b), 分析发现绿潮浒苔并非青岛本地种, 也没有在青岛形成定生种群。2009年在多个黄海绿潮调查航次中, 通过培养定量的方法发现绿潮浒苔在北漂的过程中, 会放散大量的孢子、配子等生殖细胞(Liu et al, 2010c); 同时发现石莼属绿藻微观繁殖体丰度随着海水深度的增加有逐渐降低的趋势(刘峰等, 2010)。石莼属绿藻微观繁殖体的丰度作为绿潮调查的一项重要的生物学指标被广泛的接受和认可, 相关的定量方法在随后的绿潮调查中被普遍的采用(方松等, 2012; Huo et al, 2013, 2014; Li et al, 2014; Song et al, 2015; 刘湘庆等, 2015a, b; Liu et al, 2017; Miao et al, 2018), 这一技术方法在预测海水中潜在的绿潮生物量以及预测绿潮规模和种源等方面可提供重要的生物学数据。
2009—2010年通过对江苏沿岸多个站位表层沉积物的定量检测, 均发现沉积物中存在石莼属绿藻微观繁殖体, 值得指出的是在2010年冬季苏北辐射沙洲的沉积物中首次发现了绿潮浒苔的微观繁殖体, 这一发现对我们认识黄海绿潮的“种子库”或“繁殖体库”提供了重要的线索(Liu et al, 2012)。随后对苏北辐射沙洲水体和沉积物中浒苔微观繁殖体的定量检测进一步证实在苏北辐射沙洲区存在绿潮浒苔的种源(Liu et al, 2013b)。
然而, 我们对秋冬季苏北浅滩沉积物中大型绿藻微观繁殖体的垂直分布特征和物种多样性并不清楚, 这些繁殖体维持着苏北浅滩绿藻的物种多样性, 其中浒苔微观繁殖体是浒苔绿潮连续发生的“种子库”。本研究针对苏北浅滩辐射沙洲的紫菜养殖区, 在2017年秋冬季组织实施了2个绿潮种源调查航次, 研究苏北浅滩紫菜养殖区沉积物中大型绿藻微观繁殖体的垂直分布特征和物种多样性。
1 材料与方法 1.1 航次组织和样品采集为认识苏北浅滩沉积物中大型绿藻微观繁殖体的分布特征, 在2017年9月12—20日和11月4—11日分别组织绿潮种源调查航次。9月份航次通过苏通渔01026完成, 取样地点为紫菜养殖区(32°39N, 121°12′E); 11月份航次通过苏如渔运288完成, 取样地点为紫菜养殖区(32°46′N, 121°18′E)。不同深度的沉积物样品通过专门设计开发的泥样采集器采集(图 1)。具体沉积物样品采集方法为:退潮后, 将采泥器垂直插入沙洲沉积物中, 然后取出采泥器, 通过设定的不同深度采泥孔, 获取各层沉积物的泥样, 放到4℃恒温箱中保存。航次结束后, 将样品带回实验室分析。
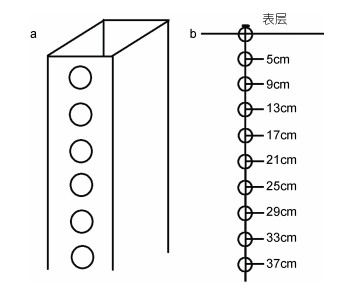 |
| 图 1 垂直泥样采泥器模式图(a)和苏北浅滩沉积物采集深度(b) Fig. 1 Diagrammatic sketch of the vertical sediment sampler (a) and sampling depth in the Subei Shoal (b) |
对获得的每层沉积物样品, 分别称取湿重1.0g样品, 放于直径为9.0cm的培养皿中(n=4), 加入50mL的f/2海水培养液。用玻璃棒缓慢充分搅拌后, 静置GXZ-380C型光照培养箱(宁波江南)中培养观察。培养温度为18℃, 光辐射为100—120μmol photons/(m2s), 光暗周期为12h:12h。使用前, 每升f/2海水培养液中加入500μL饱和二氧化锗(GeO2)水溶液。培养约20d后, 通过光学和解剖显微镜进行绿藻幼苗的数量统计和形态记录(图 2)。绿藻幼苗的数量即为泥样中微观繁殖体的丰度。
 |
| 图 2 沉积物经培养获得的绿藻(a和b图为表层沉积物中生长出的绿藻; c图为曲浒苔; d图为绿潮浒苔) Fig. 2 The green macroalgal thalli derived from microscopic propagules in sediment (a and b, green macroalgae derived from the surface sediment; c, Ulva flexuosa; d, Ulva prolifera) 注:比例尺分别为: a. 1500μm; b. 600μm; c. 1500μm; d. 2000μm |
分离培养获得的绿藻幼苗于新的培养皿中, 继续培养。对9月份航次获得的绿藻幼苗, 依据形态特点挑选21株进行分子鉴定; 对11月份航次获得的幼苗, 依据形态特点挑选30株进行分子鉴定(表 1)。幼苗通过液氮处理后, 在SCIENTZ-48高通量组织研磨器(宁波新芝)上打碎, 然后通过TIANGEN植物基因组DNA提取试剂盒提取幼苗的总基因组DNA。
| 航次 | 时间 | 调查船 | 样品编号 | 样品数量(n) | 样品来源 |
| 航次Ⅰ | 2017年9月12—20日 | 苏通渔01026 | S1-S7 | 9 | 表层 |
| S8-S13 | 6 | 5cm层 | |||
| S14-S17 | 4 | 9cm层 | |||
| S18-S21 | 2 | 13cm层 | |||
| 航次Ⅱ | 2017年11月4—11日 | 苏如渔运288 | N1-N10 | 10 | 表层 |
| N11-N16 | 6 | 5cm层 | |||
| N17-N21 | 5 | 9cm层 | |||
| N22-N26 | 5 | 13cm层 | |||
| N27-N30 | 4 | 17cm层 |
分子鉴定选择核基因组的ITS序列(ITS1+5.8S+ITS2)和5S核糖体基因间隔区序列。ITS序列是石莼属绿藻中广泛使用的分子标记, GenBank中数据量大; 扩增ITS序列所用引物FM/RM和PCR反应条件参考Leskinen等(1997)。5S核糖体基因间隔区序列用来区分浒苔和缘管浒苔, 扩增5S核糖体基因间隔区序列所用的引物5S-F/5S-R和PCR反应条件参考Shimada等(2008)。将51个绿藻样品的扩增序列和来自GenBank的数据通过Clustal W进行多重比对分析(Thompson et al, 1997), 并辅以手工校正。通过Mega 7.0软件的最大似然法(ML)进行进化树的构建(Kumar et al, 2016)。通过Bootstrap方法计算支持率, ML分析重复1000次; 支持率小于75%的进化枝, 数值省略。
1.4 数据分析使用SPSS13.0软件进行数据分析, 采用单因素方差分析(one-way AVONA)和T检验(T-test)比较不同组之间的显著性差异, 显著水平设为P<0.05。
2 结果与讨论 2.1 浅滩沉积物中绿藻微观繁殖体随深度变化的分布特征对浅滩不同深度沉积物中进行绿藻微观繁殖体定量, 主要发现: (1)表层泥样中绿藻微观繁殖体的丰度最高, 在9月份丰度为9±2ind./g, 而11月份达到98±25ind./g; 与9月份相比, 11月份浅滩沉积物中绿藻繁殖体数量呈现出显著升高的趋势(P<0.05); (2)绿藻繁殖体的数量随着深度的增加迅速降低(P<0.05), 在9月份的调查中, 从表层到深度为13cm的泥样中均可检出绿藻微观繁殖体, 但是再深的泥样中, 未发现绿藻繁殖体; 在11月份的调查中, 从表层到深度为17cm的泥样可以检出绿藻繁殖体(图 3)。
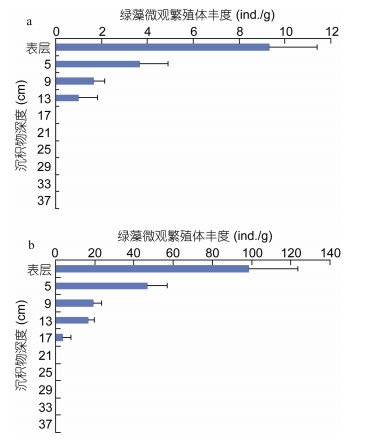 |
| 图 3 绿藻微观繁殖体丰度在苏北浅滩沉积物中的垂直分布 Fig. 3 Vertical distribution of microscopic propagules of green macroalgae in sediments of Subei Shoal 注: a. 9月份航次, b. 11月份航次 |
通过比较发现, 在9月份沉积物中绿藻微观繁殖体数量显著少于绿潮发生阶段(如4—6月份)(Liu et al, 2013b)。这个时期微观繁殖体丰度的降低, 一个重要原因是由于繁殖体来源或补充机制的限制。苏北辐射沙洲的紫菜养殖季结束于每年5月份, 养殖设施包括梗绳和筏架会在每年的4月底到5月底这个时期回收到岸上进行处理; 然后, 在每年的9月初新的养殖季开始后, 养殖设施将在苏北辐射沙洲进行重新的布置, 进行紫菜的人工养殖。从6—9月初, 紫菜养殖设施的撤离, 造成绿藻缺少人工附着基质, 也严重影响着石莼属等绿藻的生长生殖, 制约着水体和沉积物中繁殖体的丰度。在这个时期, 水体和沉积物中绿藻微观繁殖体在种源维持中扮演着重要的角色(Park et al, 2011; Liu et al, 2013a, b)。
野外调查发现, 9月份绿藻微观繁殖体的丰度虽然较低, 但11月份数量显著升高。紫菜养殖梗绳安置约2周后, 有大量的石莼属绿藻开始在梗绳上附着和生长。石莼属海藻具有机会主义生长特性, 可以有效的吸收营养盐, 并具备独特的生殖节律(Lüning et al, 2008; Gao et al, 2010; Luo et al, 2012)。养殖设施(梗绳和筏架)的重新按置, 为水体中石莼属海藻微观繁殖体的附着提供了重要的基质, 也摆脱了环境因子(如光强)对石莼属海藻生长的制约, 进而通过节律性的生殖补充大量的繁殖细胞到水体和沉积物中。
随着浅滩沉积物深度的增加, 石莼属海藻繁殖体的数量迅速减少。石莼属绿藻虽然是广温广盐性大型海藻, 它们的藻体以及生殖细胞(孢子、配子等)能够耐受一定范围的环境胁迫, 但是并没有发现石莼属海藻可以像甲藻一样的形成孢囊或者休眠细胞。
2.2 沉积物中绿藻微观繁殖体的物种多样性依据基于ITS序列构建的ML系统进化树, 51个样品聚为5个进化枝中, 分别为曲浒苔(Ulva flexuosa)进化枝(39个样品)、缘管浒苔-浒苔复合(Ulva linza- prolifera)进化枝(5个)、扁浒苔(Ulva compressa)进化枝(2个)、尾孢藻属(Urospora)进化枝(3个)、盘苔属(Blidingia)进化枝(2个)(图 4)。依据基于5S核糖体基因间隔区序列构建的系统进化树, 缘管浒苔-浒苔进化枝的样品可以分为浒苔(Ulva prolifera)进化枝(3个样品)和缘管浒苔(Ulva linza)进化枝(2个)(图 5)。
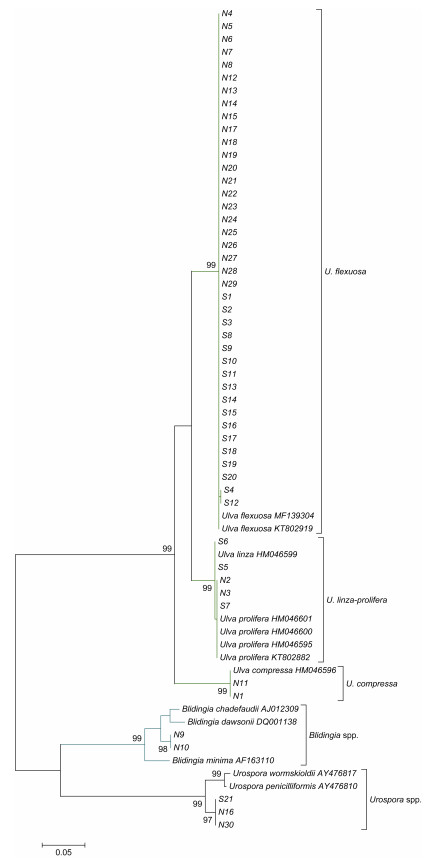 |
| 图 4 通过Mega 7.0软件基于ITS序列构建的ML进化树 Fig. 4 The ML tree constructed with Mega 7.0 based on the ITS dataset |
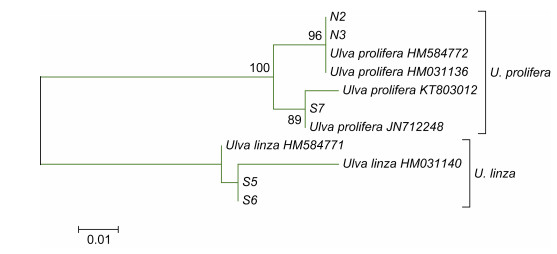 |
| 图 5 通过Mega 7.0软件基于5S核糖体基因间隔区序列构建的ML进化树 Fig. 5 The ML tree constructed with Mega 7.0 based on the 5S rDNA spacer dataset |
分子鉴定结果表明:沉积物中存在石莼属(Ulva)、尾孢藻属(Urospora)、盘苔属(Blidingia)等大型绿藻的微观繁殖体, 而数量占优是石莼属绿藻繁殖体。石莼属繁殖体主要包括曲浒苔(U. flexuosa)、浒苔(U. prolifera)、扁浒苔(U. compressa)、缘管浒苔(U. linza)。其中, 曲浒苔占据的比例最高, 在9和11月份航次调查中分别达到80.94%和73.33%(表 2); 此外, 浒苔、扁浒苔、缘管浒苔等石莼属绿藻的微观繁殖体都可以在沉积物中检出, 但它们的丰度都很低(4.76%—9.52%)。
| 航次 | n | Ulva spp. (%) | Urospora spp. (%) | Blidingia spp. (%) | |||
| U. flexuosa | U. prolifera | U. compressa | U. linza | ||||
| 航次Ⅰ | 21 | 80.95 | 4.76 | 0.00 | 9.52 | 4.76 | 0.00 |
| 航次Ⅱ | 30 | 73.33 | 6.67 | 6.67 | 0.00 | 6.67 | 6.67 |
在之前的现场调查中发现, 紫菜筏架上附着者包括石莼属、尾孢藻属、盘苔属等大型绿藻(Liu et al, 2013b), 本研究发现这些绿藻的繁殖体都可以在沉积物中检测到。这些绿藻能够栖息在苏北浅滩海域, 说明它们具备适应苏北浅滩独特环境条件的生长和繁殖习性, 可以周而复始的在苏北海域繁衍生息。9月份野外调查发现曲浒苔是紫菜筏架上主要的石莼属绿藻, 同时曲浒苔繁殖体也是沉积物中的绝对优势种。虽然曲浒苔在筏架上和沉积物中都占有绝对优势的比例, 但它并不是黄海绿潮的构成种。我们在2个航次的沉积物中都检测到了绿潮浒苔, 虽然它们的数量很少, 但是绿潮浒苔具有较长的营养生长期; 在每年的3—5月份可以暴发性生长成为优势种, 形成大规模的绿潮灾害(Liu et al, 2010b)。
3 结论本研究通过2个绿潮种源调查航次研究了苏北浅滩紫菜养殖区沉积物中大型绿藻微观繁殖体的垂直分布特点和物种多样性。对沉积物中微观繁殖体的定量实验结果表明表层泥样中绿藻微观繁殖体的丰度最高, 随着深度的增加迅速降低。通过分子分析发现沉积物中存在绿潮浒苔的微观繁殖体, 这些微观繁殖体是构成了黄海浒苔绿潮连年暴发的“种子库”。这些结果对准确认识黄海绿潮连续发生的生物生态学过程有重要的科学意义, 同时对进行科学有效的浒苔绿潮防控提供重要的思路。
| 方松, 王宗灵, 李艳, 等, 2012. 南黄海及长江口附近海域绿潮暴发前期微观繁殖体的动态变化. 海洋学报, 34(4): 147–154 |
| 刘峰, 逄少军, 单体锋, 等, 2010. 一种新的海水中石莼属海藻显微阶段个体数定量方法及在黄海绿潮爆发过程中的应用. 科学通报, 55(6): 468–473 |
| 刘湘庆, 王宗灵, 李艳, 等, 2015a. 温度对沉积物中绿藻微观繁殖体萌发的影响. 海洋科学进展, 33(2): 219–226 |
| 刘湘庆, 王宗灵, 张学雷, 等, 2015b. 2012年秋季江苏南部紫菜养殖区绿藻微观繁殖体现状. 中国海洋大学学报, 45(7): 58–63 |
| Gao S, Chen X Y, Yi Q Q, et al, 2010. A strategy for the proliferation of Ulva prolifera, main causative species of green tides, with formation of sporangia by fragmentation. PLoS One, 5(1): e8571 DOI:10.1371/journal.pone.0008571 |
| Huo Y Z, Hua L, Wu H L, et al, 2014. Abundance and distribution of Ulva microscopic propagules associated with a green tide in the southern coast of the Yellow Sea. Harmful Algae, 39: 357–364 DOI:10.1016/j.hal.2014.09.008 |
| Huo Y Z, Zhang J H, Chen L P, et al, 2013. Green algae blooms caused by Ulva prolifera in the southern Yellow Sea:Identification of the original bloom location and evaluation of biological processes occurring during the early northward floating period. Limnology and Oceanography, 58(6): 2206–2218 DOI:10.4319/lo.2013.58.6.2206 |
| Kumar S, Stecher G, Tamura K, 2016. MEGA7:Molecular evolutionary genetics analysis version 7.0 for bigger datasets. Molecular Biology and Evolution, 33(7): 1870–1874 DOI:10.1093/molbev/msw054 |
| Leskinen E, Pamilo P, 1997. Evolution of the ITS sequences of ribosomal DNA in Enteromorpha (Chlorophyceae). Hereditas, 126(1): 17–23 |
| Li Y, Song W, Xiao J, et al, 2014. Tempo-spatial distribution and species diversity of green algae micro-propagules in the Yellow Sea during the large-scale green tide development. Harmful Algae, 39: 40–47 DOI:10.1016/j.hal.2014.05.013 |
| Liu D Y, Keesing J K, Dong Z J, et al, 2010a. Recurrence of the world's largest green-tide in 2009 in Yellow Sea, China:Porphyra yezoensis aquaculture rafts confirmed as nursery for macroalgal blooms. Marine Pollution Bulletin, 60(9): 1423–1432 DOI:10.1016/j.marpolbul.2010.05.015 |
| Liu F, Pang S J, Chopin T, et al, 2010b. The dominant Ulva strain of the 2008 green algal bloom in the Yellow Sea was not detected in the coastal waters of Qingdao in the following winter. Journal of Applied Phycology, 22(5): 531–540 DOI:10.1007/s10811-009-9489-7 |
| Liu F, Pang S J, Chopin T, et al, 2013b. Understanding the recurrent large-scale green tide in the Yellow Sea:temporal and spatial correlations between multiple geographical, aquacultural and biological factors. Marine Environmental Research, 83: 38–47 DOI:10.1016/j.marenvres.2012.10.007 |
| Liu F, Pang S J, Xu N, et al, 2010c. Ulva diversity in the Yellow Sea during the large-scale green algae blooms in 2008-2009. Phycological Research, 58(4): 270–279 DOI:10.1111/pre.2010.58.issue-4 |
| Liu F, Pang S J, Zhao X B, 2013a. Molecular phylogenetic analyses of Ulva (Chlorophyta, Ulvophyceae) mats in the Xiangshan Bay of China using high-resolution DNA markers. Journal of Applied Phycology, 25(5): 1287–1295 DOI:10.1007/s10811-012-9955-5 |
| Liu F, Pang S J, Zhao X B, et al, 2012. Quantitative, molecular and growth analyses of Ulva microscopic propagules in the coastal sediment of Jiangsu province where green tides initially occurred. Marine Environmental Research, 74: 56–63 DOI:10.1016/j.marenvres.2011.12.004 |
| Liu X Q, Wang Z L, Fan S L, et al, 2017. The distribution of green algal micro-propagules and macroalgae at the early stage of green tide in the coastal area of South Jiangsu Province in 2014. Journal of Ocean University of China, 16(1): 81–86 DOI:10.1007/s11802-017-3008-2 |
| Lotze H K, Worm B, Sommer U, 2001. Strong bottom-up and top-down control of early life stages of macroalgae. Limnology and Oceanography, 46(4): 749–757 DOI:10.4319/lo.2001.46.4.0749 |
| Lüning K, Kadel P, Pang S J, 2008. Control of reproduction rhythmicity by environmental and endogenous signals in Ulva pseudocurvata (Chlorophyta). Journal of Phycology, 44(4): 866–873 DOI:10.1111/jpy.2008.44.issue-4 |
| Luo M B, Liu F, Xu Z L, 2012. Growth and nutrient uptake capacity of two co-occurring species, Ulva prolifera and Ulva linza. Aquatic Botany, 100: 18–24 DOI:10.1016/j.aquabot.2012.03.006 |
| Miao X X, Xiao J, Pang M, et al, 2018. Effect of the large-scale green tide on the species succession of green macroalgal micro-propagules in the coastal waters of Qingdao, China. Marine Pollution Bulletin, 126: 549–556 DOI:10.1016/j.marpolbul.2017.09.060 |
| Pang S J, Liu F, Shan T F, et al, 2010. Tracking the algal origin of the Ulva bloom in the Yellow Sea by a combination of molecular, morphological and physiological analyses. Marine Environmental Research, 69(4): 207–215 DOI:10.1016/j.marenvres.2009.10.007 |
| Park C S, Hwang E K, 2011. An investigation of the relationship between sediment particles size and the development of green algal mats (Ulva prolifera) on the intertidal flats of Muan, Korea. Journal of Applied Phycology, 23(3): 515–522 DOI:10.1007/s10811-010-9620-9 |
| Schories D, 1995. Sporulation of Enteromorpha spp. (Chlorophyta) and overwintering of spores in sediments of the Wadden Sea, island Sylt, North Sea. Netherland Journal of Aquatic Ecology, 29(3-4): 341–347 DOI:10.1007/BF02084233 |
| Shimada S, Yokoyama N, Arai S, et al, 2008. Phylogeography of the genus Ulva (Ulvophyceae, Chlorophyta), with special reference to the Japanese freshwater and brackish taxa. Journal of Applied Phycology, 20(5): 979–989 DOI:10.1007/s10811-007-9296-y |
| Song W, Li Y, Fang S, et al, 2015. Temporal and spatial distributions of green algae micro-propagules in the coastal waters of the Subei Shoal, China. Estuarine, Coastal and Shelf Science, 163: 29–35 DOI:10.1016/j.ecss.2014.08.006 |
| Thompson J D, Gibson T J, Plewniak F, et al, 1997. The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research, 25(24): 4876–4882 DOI:10.1093/nar/25.24.4876 |
| Wang Z L, Xiao J, Fan S L, et al, 2015. Who made the world's largest green tide in China?——an integrated study on the initiation and early development of the green tide in Yellow Sea. Limnology and Oceanography, 60(4): 1105–1117 DOI:10.1002/lno.10083 |
| Ye N H, Zhang X W, Mao Y Z, et al, 2011. 'Green tides' are overwhelming the coastline of our blue planet:taking the world's largest example. Ecological Research, 26(3): 477–485 DOI:10.1007/s11284-011-0821-8 |
| Zhang X W, Wang H X, Mao Y Z, et al, 2010. Somatic cells serve as a potential propagule bank of Enteromorpha prolifera forming a green tide in the Yellow Sea, China. Journal of Applied Phycology, 22(2): 173–180 DOI:10.1007/s10811-009-9437-6 |
 2018, Vol. 49
2018, Vol. 49

