中国海洋湖沼学会主办。
文章信息
- 薛素燕, 毛玉泽, 丁敬坤, 蒋增杰, 方建光. 2018.
- XUE Su-Yan, MAO Yu-Ze, DING Jing-Kun, JIANG Zeng-Jie, FANG Jian-Guang. 2018.
- 中华原钩虾(Eogammarus possjeticus)对浒苔(Ulva prolifera)及其他类型饵料的摄食研究
- FEEDING OF AMPHIPOD EOGAMMARUS POSSJETICUS ON ULVA PROLIFERA AND OTHER TYPES OF BAITS
- 海洋与湖沼, 49(5): 1109-1115
- Oceanologia et Limnologia Sinica, 49(5): 1109-1115.
- http://dx.doi.org/10.11693/hyhz20180300073
-
文章历史
- 收稿日期:2018-03-31
- 收修改稿日期:2018-05-11
2. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China
钩虾(Gammaridae)隶属于甲壳动物纲(Crustacea)、端足目(Amphipoda)、钩虾亚目(Gammaridea), 约有近1000属, 6000余种, 大多是海水种, 数量约占端足类总量的80% (Cruz-Rivera et al, 2000)。我国迄今共记录的海水钩虾有139种, 隶属于21科54属(任先秋, 2002)。中华原钩虾(Eogammarus possjeticus)是山东半岛潮间带及海水池塘等处端足类的重要优势种, 近年作为山东沿海地区养殖对虾的动物性活饵受到广泛关注和重视(Xue et al, 2013;薛素燕等, 2016)。
在潮间带、温带河口以及封闭或半封闭水域中, 钩虾往往成为优势种群(Jeong et al, 2007), 主要以大型海藻(藻丛)为食, 是海藻群落中最主要的初级消费者(Balducci et al, 2001)。通过摄食作用, 钩虾对大型海藻的生长、生物量和群落结构起着重要调控作用(Valentine et al, 2006; Duffy et al, 2015)。在某些富营养化水域, 钩虾的摄食量甚至超过大型海藻的生长量(Valiela et al, 1997), 它们的摄食压力甚至决定某些大型海藻的存在与否(Geertz-Hansen et al, 1993), 是影响大型海藻生物量的关键因子(Hauxwell et al, 1998; Balducci et al, 2001)。但是, 钩虾对大型海藻并非不加区分的摄食(Cruz-Rivera et al, 2001; Goecker et al, 2003), 大型海藻的营养价值(Cruz-Rivera et al, 2003)、分泌的次生代谢物(Toth et al, 2005; Yun et al, 2007)、形态特征(Sotka, 2007)都会影响钩虾摄食及摄食的选择性。另外, 除了摄食大型海藻, 钩虾也摄食一些有机碎屑, 在人工投喂条件下, 可摄食豆粕、花生粕、麸皮、对虾饲料等(刘艳春等, 2007)。
本研究以中华原钩虾为研究对象, 通过室内对浒苔及海水池塘常见大型海藻和其他不同类型饵料的摄食, 以及对浒苔的现场摄食实验, 旨在揭示钩虾的摄食习性及其在生态系统中的生态功能。
1 材料与方法 1.1 材料来源实验材料采自山东下营浅海附近的养殖池塘, 选取健壮活泼的个体进行实验室水槽饲育, 培育水温为10—18℃, 盐度为28—33, pH 8.0—8.2, 溶氧6.5—7.2mg/L, 饲育期间饲喂浒苔及虾饲料等饵料, 每天换水1/2。实验中所用浒苔(Ulva prolifera)、肠浒苔(Ulva intestinalis)、扁浒苔(Ulva compressa)、线形硬毛藻(Chaetomorpha linum)、丝毛藻(Cloniophora sp.)、金膜藻(Chrysymenia wrightii)、竹节草(Chrysopogon aciculatus)等海藻或海草均采自青岛近岸海域和海水养殖池塘, 豆粕和虾饲料均购买自市场。
1.2 摄食实验 1.2.1 室内实验饵料种类选择:饵料种类选择分2次实验完成: (1)采用绿藻类进行钩虾的摄食研究, 饵料主要包括浒苔、肠浒苔、扁浒苔、线形硬毛藻和丝毛藻各2g(湿重), 置于水族箱20cm×15cm×10cm中, 每个水族箱放入钩虾0.4g (湿重, 约100尾), 设置3个重复, 2个对照(不放钩虾)。实验开始前, 测定5种绿藻的含水率, 每种藻取5g(湿重), 3个平行, 然后放入70℃烘箱48h至恒重, 分析天平称重。实验于每日8:00开始, 翌日8:00采用虹吸法分别收集残饵及粪便, 将残饵用滤纸吸干, 分析天平称重, 然后补充新鲜饵料, 实验重复5次。将每次收集的粪便、残饵分别以铝箔纸包封, 70℃烘干48h至恒重, 分析天平称重。(2)实验选择浒苔、金膜藻、竹节草、豆粕和对虾饲料分别5g(湿重)、7g(湿重)、3g(湿重)、1g(干重)和1g(干重), 置于水族箱(40cm×30cm×30cm)中, 每个水族箱放入钩虾5g(湿重, 约280尾), 设置3个重复, 2个对照(不放钩虾)。每日8:00开始实验, 翌日8:00收集残饵及粪便, 重量测定等操作同上(下同), 实验重复5次。
昼夜摄食节律:在上述第2次不同类型饵料摄食实验过程中, 将7:00—19:00定为白天, 19:00—翌日7:00定为黑夜。记录投喂饵料的初始重量, 实验于每日8:00开始, 20:00收集残饵及粪便并测定重量, 然后补充新鲜饵料, 至翌日8:00收集残饵及粪便并测定重量, 实验重复5次。
摄食指标公式:
日摄食率(%)=日摄食量(干重) /钩虾湿重
饵料吸收率(%)=(摄食量干重-排便量干重) /摄食量干重
日排粪率(%)=日排粪量(干重) /钩虾湿重
1.2.2 现场实验设计3个钩虾密度组(100, 150, 200g/m2), 每个密度3个平行, 放置于80cm×80cm× 60cm (约0.4m3)不锈钢网箱内, 网箱外面包一层网眼规格为1mm的网衣。每个网箱放置2个立方体网笼(25cm×25cm×25cm), 网眼规格分1mm和5mm大小2种, 小网眼为对照组, 大网眼利于钩虾进入网笼内摄食。每个网笼内放入500g新鲜浒苔。每5天测定一次指标参数:浒苔生长率、钩虾摄食率, 并收集网箱内钩虾称重。样品取完后, 将网笼清理干净, 用于新一轮实验, 持续20d。用YSI现场测定网箱内温度、盐度、pH和溶氧等参数。
日摄食量(g)=[实验组浒苔初始湿重×(对照组浒苔末湿重/对照组浒苔初始湿重)-实验组浒苔末湿重] /实验天数
日摄食率(%)=日摄食量(湿重) /钩虾湿重
死亡率(%/d)=(钩虾初始平均体重×初始单位体重个体数-钩虾末平均湿重×末单位体重个体数) /(钩虾初始平均体重×初始单位体重个体数)×实验天数
1.3 数据处理与分析使用Excel 2013进行数据作图, 实验数据采用SPSS 18.0软件进行单因素方差(one-way ANOVA)、双因素方差(Univariate)和相关性分析, 不同处理组间采用Turkey方法进行多重比较, P < 0.05作为不同处理间差异显著标准。
2 结果 2.1 室内实验 2.1.1 5种绿藻的含水率比较单因素方差分析结果表明, 5种绿藻的含水率存在显著性差异(P < 0.05)。如图 1所示, 浒苔的含水率较高, 其中浒苔含水率高达91.62%±5.54%, 其次为肠浒苔90.82%± 4.51%, 含水率最低的是丝毛藻, 为71.43%±2.52%。
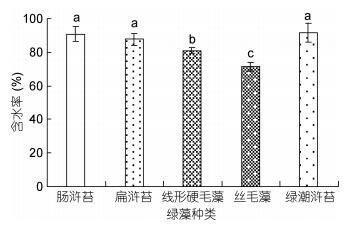 |
| 图 1 5种绿藻的含水率 Fig. 1 The water content in five species of green algae 注:不同字母表示组间差异显著(P < 0.05), 下同 |
单因素方差分析结果表明, 中华原钩虾对不同绿藻的摄食率存在显著性差异(P < 0.05, 图 2), 其中, 对浒苔的日摄食率最高, 为7.61%±0.26%, 对线性硬毛藻的日摄食率最低, 为3.70%±0.40%;中华原钩虾对不同绿藻的饵料吸收率存在显著性差异(P < 0.05), 且与摄食率的趋势相似(图 3), 对浒苔的饵料吸收率最高, 为69.92%±2.66%, 其次为肠浒苔, 饵料吸收率为68.52%±1.72%, 对线性硬毛藻的饵料吸收率最低, 为39.28%±3.17%;而中华原钩虾摄食不同绿藻后的排粪率差异不显著(P > 0.05, 图 4)。
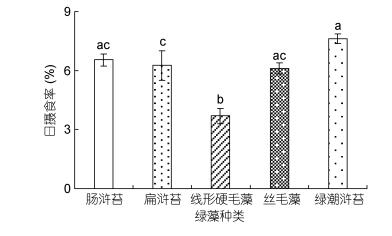 |
| 图 2 中华原钩虾对不同绿藻的日摄食率 Fig. 2 The feeding rate of E. possjeticus on the green algae |
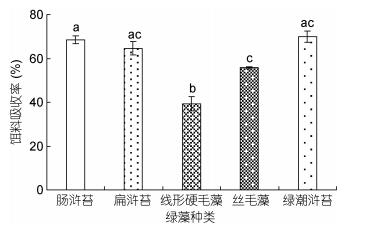 |
| 图 3 中华原钩虾对不同绿藻的饵料吸收率 Fig. 3 The assimilation efficiency of E. possjeticus on the green algae |
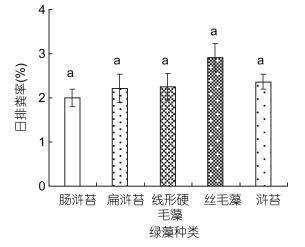 |
| 图 4 中华原钩虾对摄食不同绿藻的日排粪率 Fig. 4 The faecal egestion rate of E. possjeticus for the green algae |
如图 5所示, 中华原钩虾对不同类型饵料的摄食率存在显著性差异(P < 0.05), 其中, 对浒苔的日摄食率最高, 为15.06%±2.85%, 而对竹节草的日摄食率最低, 为8.26%±0.88%;中华原钩虾对不同类型饵料的吸收率存在显著性差异(P < 0.05, 图 6), 对虾饲料的饵料吸收率最高, 为87.68%±2.86%, 其次为豆粕, 其饵料吸收率为86.67%±0.81%, 对竹节草的饵料吸收率最低, 为56.28%±2.14%;中华原钩虾摄食不同类型饵料后的排粪率存在显著性差异(P < 0.05, 图 7), 其中, 摄食浒苔后的排粪率最高, 为5.06%±0.45%, 摄食竹节草后的排粪率最低, 为0.82%±0.17%。
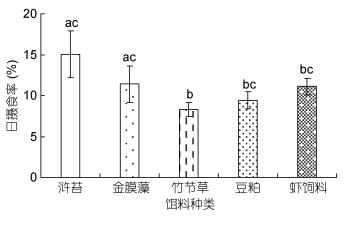 |
| 图 5 中华原钩虾对不同类型饵料的日摄食率 Fig. 5 The feeding rate of E. possjeticus for different types of baits |
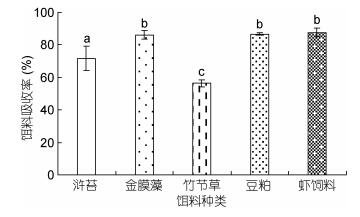 |
| 图 6 中华原钩虾对不同类型饵料的饵料吸收率 Fig. 6 The assimilation efficiency of E. possjeticus for different types of baits |
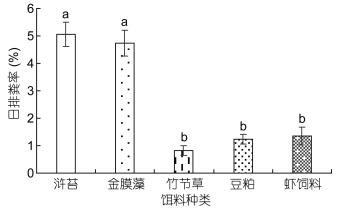 |
| 图 7 中华原钩虾对不同类型饵料的日排粪率 Fig. 7 The faecal egestion rate of E. possjeticus for different types of baits |
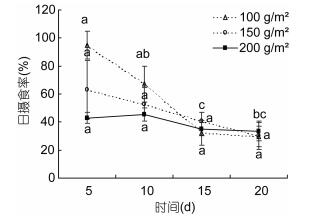
摄食节律实验结果表明, 中华原钩虾对不同类型饵料的摄食均存在一定的摄食规律, 白昼摄食率均低于黑夜摄食率, 但无显著性差异(P > 0.05), 显著性差异主要存在于对不同类型饵料的摄食率(P < 0.05, 图 8)。
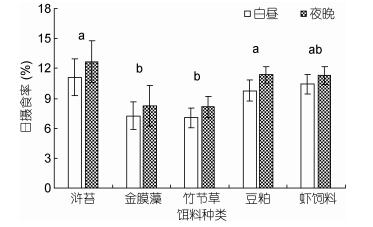 |
| 图 8 中华原钩虾对不同类型饵料的昼夜日摄食率 Fig. 8 Day and night rhythm of feeding rate of E. possjeticus for different types of baits |
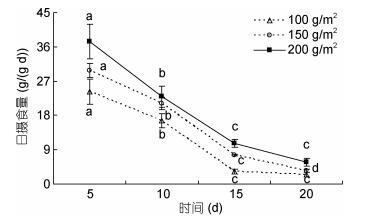
双因素方差分析结果表明, 不同密度组中华原钩虾对浒苔的日摄食量随时间的延长存在显著性差异(P < 0.05, 图 9), 各密度组钩虾日摄食量随着时间的延长逐渐降低, 其中, 200g/m2密度组中华原钩虾的日摄食量在每个时间点均高于其它两个密度组, 100g/m2密度组中华原钩虾的日摄食量在每个时间点均为最低; 不同密度组中华原钩虾对浒苔的日摄食率随时间的延长存在显著性差异(P < 0.05, 图 10), 每个密度组的日摄食率均随时间的延长而降低, 其中, 100g/m2密度组中华原钩虾的日摄食率在前10 d均高于其他两个密度组, 而在15d后均低于其它两个密度组。实验期间中华原钩虾的存活率随时间延长而降低(图 11), 其中, 200g/m2密度组中华原钩虾的存活率降低较快, 前5d均高于其他两个密度组, 而至实验结束(即20d)时, 与其他两个密度组的存活率差异不显著, 均在20%以下。
 |
| 图 9 不同密度中华原钩虾在不同时间的日摄食量 Fig. 9 The daily feed intake of E. possjeticus at different densities and times |
 |
| 图 10 不同密度中华原钩虾在不同时间的日摄食率 Fig. 10 The feeding rate of E. possjeticus at different densities and times |
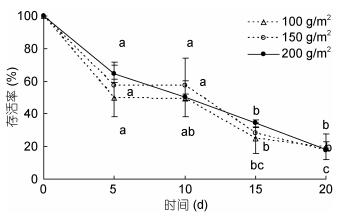 |
| 图 11 不同密度中华原钩虾的存活率 Fig. 11 The survival rate of E. possjeticus at different densities |
Cruz-Rivera等(2001)认为, 海藻的含水量会降低海藻内营养物质的浓度, 从而影响端足类的摄食量。本研究结果显示, 中华原钩虾对含水量高的浒苔、肠浒苔及扁浒苔日摄食率较大, 饵料吸收率也较高, 而对含水量低的丝毛藻、线性硬毛藻的摄食率较低, 饵料吸收率也较低, 这与郑新庆等的结果相似。郑新庆等(2013)开展了强壮藻钩虾Ampithoe valida对3种海藻的摄食实验, 结果表明, A. valida的摄食率和海藻的干湿比密切相关, 即含水量高的海藻, 摄食率也相应增加。由于钩虾等端足类消化道自身的物理局限性(只能容纳一定体积的食物)(Slansky, 1993), 因此, 对高含水量、低营养物质的藻类, 只能通过增加摄食来满足自身代谢需求, 即补偿性摄食, 这是它们对食物环境的一种适应, 也是维持种群繁衍的一种方式(Cruz-Rivera et al, 2000;郑新庆等, 2013)。一般研究认为, 一些海洋无脊椎动物(如鱼类), 表现出对高营养价值(氮、磷和蛋白质含量等)植物的摄食偏好, 但对于底栖端足类来说, 这种观点似乎并不完全成立(Valentine et al, 2006)。Cruz-Rivera等(2000)研究表明, 钩虾A. logimana对海藻的摄食选择性与海藻的营养价值并不密切相关。另外, 海藻纤维含量不同可能也会造成钩虾摄食难度不一, 我们将进一步研究海藻成分对钩虾摄食的影响。
钩虾对大型海藻群落的影响主要通过选择性摄食来实现的。Brawley等(1981)报道雷氏藻钩虾A. raimondi能明显减少浒苔、水芸等一些附生丝状藻类的蔓生, 当钩虾密度 > 1 ind/cm2, 丝状海藻消失。Duffy等(2000)的研究结果也显示, A. longimana能强烈抑制丝状绿藻的生长。已有的研究数据表明, 浒苔是钩虾喜食的藻类(Balducci et al, 2001; Goecker et al, 2003)。本研究也得出了相似的结论, 在常见的绿藻中, 中华原钩虾对浒苔的摄食率比其他绿藻更高, 虽然不同规格钩虾对浒苔的日摄食率有所不同, 但均表现出对浒苔的青睐, 原因可能是浒苔交错缠绕为钩虾提供理想的栖息环境, 而且其含水率高, 适于钩虾的啃食。近年来, 我国北方越来越多的养殖业者对钩虾进行海水池塘粗放式养殖, 即利用浒苔等藻类作为饵料培养钩虾, 为对虾提供优质天然生物饵料。可见, 钩虾是初级生产向更高营养级流动的重要通道(Poltermann et al, 2000), 利用钩虾的摄食压力抑制或控制养殖池塘里的浒苔等藻类, 可能是未来池塘丛生绿藻防控的有效手段。
3.2 中华原钩虾对其他类型饵料的摄食钩虾在池塘生态系统中具有较好的生态功能, 其作为养殖经济鱼虾的饵料生物, 也发挥了良好的蛋白源作用。韩永望等研究表明(2012), 钩虾为养虾前期提供了丰富的优质天然饵料, 不仅增强了对虾体质, 增加了防疫抗病能力, 减少了病害的发生, 而且达到了健康养殖的目的, 为健康生态养殖模式提供了新途径。中华原钩虾除了能够摄食大型海藻, 也能摄食豆粕、虾饲料等人工配合饵料, 而且对虾饲料、豆粕的饵料吸收率较高, 说明中华原钩虾在藻类不丰富的季节也可通过人工投喂进行培育, 这也与韩永望等(2012)研究结果相似。
钩虾有昼伏夜出的习性(刘艳春等, 2007), 白天受光照影响, 多数个体栖息于海藻丛中或遮蔽物下, 夜晚活动较频繁, 因而其摄食量也随着觅食活动的增强而增加。本实验中, 中华原钩虾白昼和夜晚摄食率差异不显著, 但夜间摄食量要高于白天, 根据其昼夜摄食规律, 我们在中华原钩虾人工培育中可调整早晚饲料投喂比例, 避免造成不必要的资源浪费, 减少饵料污染, 有利于清洁生产。
3.3 不同养殖密度中华原钩虾对浒苔的摄食养殖密度是影响水体生产力的重要因素, 一般认为, 随着养殖密度的增加, 单位水体的产量也随之上升, 养殖个体对资源、空间的竞争加剧, 引起动物生理指标等产生相应的变化, 导致动物摄食、存活、能量代谢等一系列变化(柳敏海等, 2012)。Williams等(1996)研究发现凡纳滨对虾Litopenaeus pannamei存活率与养殖密度呈负相关, 摄食率随养殖密度增加而降低。丁厚猛等(2015)研究认为, 密度过高会降低西伯利亚杂交鲟(Siberia hybrid sturgeon)幼鱼的饵料吸收效率, Fagerlund等(1981)也发现低密度银大马哈鱼Oncorhynchus keta幼鱼更为有效的吸收利用饵料。本研究不同养殖密度的实验结果与上述研究一致, 随着中华原钩虾养殖密度的增加, 其日摄食量增加, 但是日摄食率及存活率随养殖密度增大呈降低趋势, 可能是高密度时中华原钩虾竞争摄食, 增加了饵料的消耗, 同时中华原钩虾为抵抗养殖密度过高造成的竞争而增加能量等消耗。由此, 我们推测如果要发挥中华原钩虾的生态功能, 可以通过短时间增加其养殖密度来防控池塘等封闭水域的浒苔等丛生藻类; 如果要利用其作为蛋白源, 则需要结合实际, 根据环境因素、养殖条件、产量需求等确定合适的养殖密度。
4 结论综上所述, 中华原钩虾偏爱摄食含水率高的丛生绿藻(如浒苔), 在封闭半封闭水域(尤其是海水池塘), 利用钩虾的摄食压力抑制或控制浒苔等大型海藻, 可能作为防控海水池塘浒苔暴发的有效手段。在大型海藻不丰富的季节, 通过投喂人工饵料进行中华原钩虾培育, 可为养殖经济鱼虾提供优质天然饵料。中华原钩虾在初级生产者到高层捕食者的能量传递中具有重要的生态作用。
| 丁厚猛, 李吉方, 温海深, 等, 2015. 放养密度对西伯利亚杂交鲟摄食、生长以及肌肉组分的影响. 海洋湖沼通报,(1): 79–84 |
| 任先秋, 2002. 中国动物志. 北京: 科学出版社, 252 |
| 刘艳春, 苑春亭, 蒋万钊, 等, 2007. 藻钩虾在池塘生态养虾中的利用. 齐鲁渔业, 24(1): 28–29 |
| 郑新庆, 黄凌风, 李元超, 等, 2013. 啃食性端足类强壮藻钩虾对筼筜湖三种大型海藻的摄食选择性. 生态学报, 33(22): 7166–7172 |
| 柳敏海, 彭志兰, 张凤萍, 等, 2012. 养殖密度对条石鲷生长、摄食和行为的影响. 上海海洋大学学报, 21(4): 530–534 |
| 韩永望, 李健, 李吉涛, 等, 2012. 强壮藻钩虾对中国明对虾与日本囊对虾生长和抗病力的影响. 水产学报, 36(9): 1443–1449 |
| 薛素燕, 毛玉泽, 方建光, 等, 2016. 中华原钩虾的胚胎发育及其与水温的关系. 水产学报, 40(11): 1705–1712 |
| Balducci C, Sfriso A, Pavoni B, 2001. Macrofauna impact on Ulva rigida C. Ag. production and relationship with environmental variables in the lagoon of Venice. Marine Environmental Research, 52(1): 27–49 |
| Brawley S H, Adey W H, 1981. The effect of micrograzers on algal community structure in a coral reef microcosm. Marine Biology, 61(2-3): 167–177 DOI:10.1007/BF00386656 |
| Cruz-Rivera E, Hay M E, 2000. Can quantity replace quality? Food choice. Compensatory feeding, and fitness of marine mesograzers. Ecology, 81(1): 201–219 |
| Cruz-Rivera E, Hay M E, 2001. Macroalgal traits and the feeding and fitness of an herbivorous amphipod:the roles of selectivity, mixing, and compensation. Marine Ecology-Progress Series, 218: 249–266 DOI:10.3354/meps218249 |
| Cruz-Rivera E, Hay M E, 2003. Prey nutritional quality interacts with chemical defenses to affect consumer feeding and fitness. Ecological Monographs, 73(3): 483–506 DOI:10.1890/0012-9615(2003)073[0483:PNQIWC]2.0.CO;2 |
| Duffy J E, Hay M E, 2000. Strong Impacts of grazing amphipods on the organization of a benthic community. Ecological Monographs, 70(2): 237–263 DOI:10.1890/0012-9615(2000)070[0237:SIOGAO]2.0.CO;2 |
| Duffy J E, Reynolds P L, Boström C, et al, 2015. Biodiversity mediates top-down control in eelgrass ecosystems:a global comparative-experimental approach. Ecology Letters, 18(7): 696–705 DOI:10.1111/ele.2015.18.issue-7 |
| Fagerlund U H M, McBride J R, Stone E T, 1981. Stress-related effects of hatchery rearing density on coho salmon. Transactions of the American Fisheries Society, 110(5): 644–649 DOI:10.1577/1548-8659(1981)110<644:SEOHRD>2.0.CO;2 |
| Geertz-Hansen O, Sand-Jensen K, Hansen D F, et al, 1993. Growth and grazing control of abundance of the marine macroalga, Ulva lactuca L. in a eutrophic Danish estuary. Aquatic Botany, 46(2): 101–109 |
| Goecker M E, Kåll S E, 2003. Grazing preferences of marine isopods and amphipods on three prominent algal species of the Baltic Sea. Journal of Sea Research, 50(4): 309–314 DOI:10.1016/j.seares.2003.04.003 |
| Hauxwell J, McClelland J, Behr P J, et al, 1998. Relative importance of grazing and nutrient controls of macroalgal biomass in three temperate shallow estuaries. Estuaries, 21(2): 347–360 DOI:10.2307/1352481 |
| Jeong S J, Yu O H, Suh H L, 2007. Life history and reproduction of Jassa slatteryi (Amphipoda, Ischyroceridae) on a seagrass bed (Zostera marina L.) in southern Korea. Journal of Crustacean Biology, 27(1): 65–70 DOI:10.1651/S-2739.1 |
| Poltermann M, Hop H, Falk-Petersen S, 2000. Life under Arctic sea ice-reproduction strategies of two sympagic (ice-associated) amphipod species, Gammarus wilkitzkii and Apherusa glacialis. Marine Biology, 136(5): 913–920 DOI:10.1007/s002270000307 |
| Slansky Jr F, 1993. Nutritional ecology: the fundamental quest for nutrients. In: Stamp N E, Casey T M eds. Caterpillars: Ecological and Evolutionary Constraints on Foraging. New York: Chapman and Hall, 29-91 |
| Sotka E E, 2007. Restricted host use by the herbivorous amphipod Peramphithoe tea is motivated by food quality and abiotic refuge. Marine Biology, 151(5): 1831–1838 DOI:10.1007/s00227-007-0612-5 |
| Toth G B, Langhamer O, Pavia H, 2005. Inducible and constitutive defenses of valuable seaweed tissues:consequences for herbivore fitness. Ecology, 86(3): 612–618 DOI:10.1890/04-0484 |
| Valentine J F, Duffy J E, 2006. The central role of grazing in seagrass ecology. In: Larkum A W D, Orth R J, Duarte C M eds. Seagrasses: Biology, Ecology and Conservation. Dordrecht: Springer, 463-501 |
| Valiela I, McClelland J, Hauxwell J, et al, 1997. Macroalgal blooms in shallow estuaries:controls and ecophysiological and ecosystem consequences. Limnology and Oceanography, 42: 1105–1118 DOI:10.4319/lo.1997.42.5_part_2.1105 |
| Williams A S, Davis D A, Arnold C R, 1996. Density-dependent growth and survival of Penaeus setiferus and Penaeus vannamei in a semi-closed recirculating system. Journal of the Word Aquaculture Society, 27(1): 107–112 DOI:10.1111/jwas.1996.27.issue-1 |
| Xue S Y, Fang J G, Zhang J H, et al, 2013. Effects of temperature and salinity on the development of the amphipod crustacean Eogammarus sinensis. Chinese Journal of Oceanology and Limnology, 31(5): 1010–1017 DOI:10.1007/s00343-013-2302-0 |
| Yun H Y, Cruz J, Treitschke M, et al, 2007. Testing for the induction of anti-herbivory defences in four Portuguese macroalgae by direct and water-borne cues of grazing amphipods. Helgoland Marine Research, 61(3): 203–209 DOI:10.1007/s10152-007-0067-6 |
 2018, Vol. 49
2018, Vol. 49


