中国海洋湖沼学会主办。
文章信息
- 蔡阳, 陆欣鑫, 巴秋爽, 范亚文. 2019.
- CAI Yang, LU Xin-Xin, BA Qiu-Shuang, FAN Ya-Wen. 2019.
- 镜泊湖春、夏两季浮游生物群落结构及其与环境因子的关系
- PLANKTON COMMUNITY STRUCTURE IN JINGPO LAKE AND THE RELATIONSHIP WITH ENVIRONMENTAL FACTORS
- 海洋与湖沼, 50(1): 116-128
- Oceanologia et Limnologia Sinica, 50(1): 116-128.
- http://dx.doi.org/10.11693/hyhz20180200040
-
文章历史
- 收稿日期:2018-02-20
- 收修改稿日期:2018-09-22
浮游生物(浮游植物和浮游动物)是水域生态系统中能量和物质传递的重要环节, 是承接上行效应和下行效应的关键枢纽, 在调节水域生态系统初级生产力及渔业资源方面具有重要作用(George et al, 1995; 刘建康, 1999)。浮游植物作为水域生态系统的初级生产者, 群落结构及组成的改变可影响湖泊生态系统的生态功能(Elliott et al, 2001; 巴秋爽等, 2016)。浮游动物作为消费者则以浮游植物(微藻)为食, 在水生食物链中占有重要的地位(Landry et al, 1982)。浮游生物群落对水域环境条件变化敏感, 同时具有繁殖快、分布广、种类与数量分布易受环境变化影响等特点, 国际上常将其作为反映由农业、工业以及水产养殖过程所造成的湖泊环境变化的指示生物(Paerl, 1988; Phlips et al, 2006; 张达娟等, 2008; Lizotte Jr et al, 2012)。
湖泊在维持生态系统能量转移、信息传递以及区域气候变化中具有特殊的生态作用(秦伯强等, 2005; Diovisalvi et al, 2015)。湖泊富营养化是目前受到世界广泛关注的水质问题之一, 可导致生物多样性骤降、鱼类死亡以及有害藻华暴发, 并可能通过食物链对人类健康造成威胁(Cloern, 2001; Chang et al, 2008)。温带地区湖泊生态系统季节间水环境因子多变, 浮游生物种类丰富, 水体中的浮游生物群落同时受周围多种环境因素(如物理、化学和生物等)的影响, 是水体富营养化的高发生态区之一(吴锋等, 2012; Schütz et al, 2017)。镜泊湖(43°30′—44°20′N, 128°07′—129°06′E)位于黑龙江省东南部, 是中国最大的高山堰塞湖, 镜泊湖水域面积91.5km2, 库容量11.8亿m3, 受温带季风性气候影响, 季节间气温变化明显(庄道阔, 2015)。湖区南部以水产养殖为主, 中部的主要功能是水运, 北部的主要功能是旅游和发电。镜泊湖的水体质量与下游居民的饮用水安全息息相关, 然而近年来, 由于湖区周围工业和旅游业的发展迅速, 致使湖区承受的排污量增多, 水体营养负荷增加明显(刘鸿雁等, 1996; 张新刚等, 2007)。近年对镜泊湖浮游生物进行的生态研究报道指出, 镜泊湖水体浮游生物群落结构演替具有一定的季节特征, 并且水体有富营养化的趋势(王杨, 2009; 汪星等, 2015a)。针对浮游生物群落结构的季节间演替、浮游生物与环境因子之间的关系以及对营养状态的指示作用等方面的研究, 亟待深入与加强。本研究以镜泊湖水域为主体, 基于多元统计分析, 揭示镜泊湖水域春、夏两季之间浮游生物群落生态演替情况, 探索驱动浮游生物演替的主要环境因子, 为湖泊可持续开发利用、水域生态系统稳定性保护及动态变化机制提供可靠的生物学及生态学资料和理论依据。
1 材料与方法 1.1 采样时间和点位布置本研究于2015年春季(5月)和夏季(7月)对镜泊湖进行了浮游生物标本的采集及相关环境因子的测定。通常春、夏两季分别为镜泊湖的枯水期和丰水期(马成学等, 2010), 根据湖泊流向, 在研究区域(从上游到下游)内共布设了7个采样点(S1—S7), 老咕砬子(S1)、养殖区出水(S2)、航运区进水(S3)、航运区中上段(S4)、航运区中下段(S5)、航运区出水(S6)和电视塔(S7)。其中S1为湖泊上游旅游区区域, S2为湖泊养殖区区域, S3—S6为湖泊航运区区域, S7为湖泊下游区域。所设置的样点基本代表了镜泊湖湖区的各个生态特征, 采样点分布见图 1。
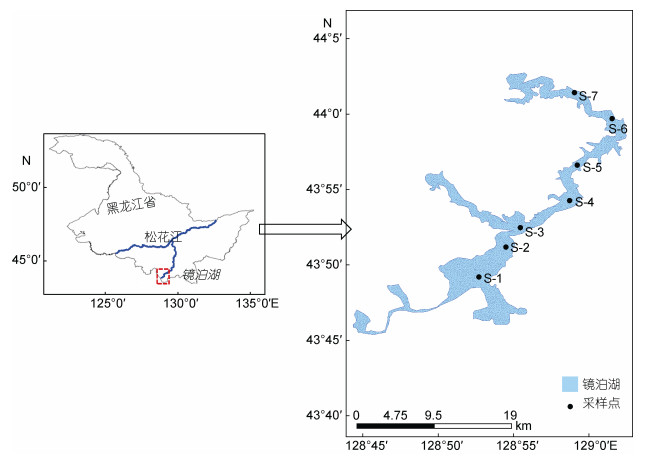 |
| 图 1 镜泊湖采样点地图 Fig. 1 Sample sites in Jingpo Lake |
用5L不锈钢采水器对浮游生物进行定量采集, 采集表层(水下0.5m)、中层(水下1.5m)和底层(底泥界面以上0.5m)水样混合, 静置48h后吸除上清液浓缩至50mL保存。使用25#和13#浮游生物网呈“∞”字缓慢捞取表层水体, 收集于50mL棕色塑料瓶中保存, 现场用1%鲁格试剂对浮游生物样品进行固定(金相灿等, 1990; 章宗涉等, 1991)。据相关文献使用ZEISSA2显微镜对所有定性、定量浮游生物样品进行种类的鉴定并计数, 浮游植物中硅藻样品经强酸处理后进行封片标本观察(蒋燮治等, 1979; 沈嘉瑞, 1979; 黎尚豪等, 1998; 胡鸿钧等, 2006)。水体环境因子数据的测定包括水温(WT)、pH、电导率(SpCond)、化学需氧量(CODCr)、氨氮(NH3-N)、总氮(TN)、总磷(TP)以及高锰酸盐指数(CODMn), 测定方法参照湖泊富营养化评价方法及分级标准(王明翠等, 2002)。
1.3 数据处理与分析 1.3.1 营养状态指数(TLI)评价利用营养状态指数评价(TLI)对湖区的水体质量进行湖泊富营养水平进行初步评价(金相灿等, 1990)。
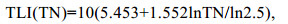 (1)
(1)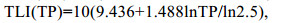 (2)
(2)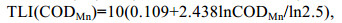 (3)
(3)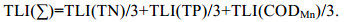 (4)
(4)评价标准为: 0 < TLI≤30为贫营养状态, 30 < TLI≤50为中营养状态, TLI > 50为富营养状态。
1.3.2 优势种的判定优势种根据调查的浮游生物优势度(Y)来判定。
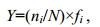 (5)
(5)式中, ni为i种的个体数, N为所有种类总个体数, fi为该种出现的频率。Y值大于0.02的种类为优势种(Lampitt et al, 1993)。
1.3.3 多元统计分析使用CANOCO 4.5软件对浮游生物种类数据与环境数据进行多元统计分析, 通过排序寻找浮游生物群落的演替规律及驱动浮游生物生态分布的环境因子。本次排序中将优势种浮游生物作为响应变量引入排序分析, 在进行排序分析前, 将响应变量和除pH外的解释变量数据进行log(x+1)转化, 使数据趋于正态分布(Ter Braak et al, 1998)。通过对响应变量进行去趋势分析(detrended correspondence analysis, DCA)筛选排序模型, 若DCA分析中长度梯度(lengths of gradient)大于4, 择单峰模型(canonical correspondence analysis, CCA)进行排序分析, 若长度梯度小于3, 择线性模型(redundancy analysis, RDA)可更有效的解释浮游生物生态分布特点, 长度梯度在3—4之间, 两种模型均可。通过蒙特卡洛置换检验, 来验证驱动浮游生物群落生态分布的主要环境因子(Ter Braak et al, 1998)。使用SPSS 22.0软件判断数据的正态性, 若处于正太分布则使用Pearson相关性分析, 若不符合正态分布, 则使用Spearman相关性分析。独立样本t检验通过SPSS 22.0完成。使用AcrMap 10.2软件绘制采样点地图及浮游生物丰度空间分布图。
2 结果与分析 2.1 水体环境因子调查期间水体环境因子结果如表 1所示。通过独立样本t检验, WT、pH、SpCond和TN在春、夏两季差异显著(P < 0.05或P < 0.01)。虽然TP、CODCr、NH3-N和CODMn在统计学上差异不显著, 但季节间也有一定的浮动。WT变化范围在13.0—24.0℃之间, 平均值为19.1℃; 水体pH变化范围在7.79—8.98之间, 平均pH为8.25, 整体来看湖区内的水体偏碱性; SpCond和TN从春季到夏季呈现下降的趋势, 分别从春季的136.11μs/cm2和1.58mg/L下降为夏季的119.89μs/cm2和0.99mg/L, 另外, CODCr、NH3-N、TP和CODMn呈现上升的趋势, 调查期间平均值分别为17.51、0.14、0.03和5.49mg/L(表 1)。
| 采样点 | WT(℃) | pH | SpCond(μs/cm2) | CODCr(mg/L) | NH3-N(mg/L) | TN(mg/L) | TP(mg/L) | CODMn(mg/L) | |
| 春季 | S1 | 14.93 | 8.46 | 136.04 | 15.39 | 0.14 | 1.57 | 0.02 | 5.16 |
| S2 | 17.00 | 8.56 | 123.00 | 18.48 | 0.16 | 1.61 | 0.02 | 5.80 | |
| S3 | 17.00 | 8.98 | 126.30 | 14.45 | 0.15 | 1.71 | 0.02 | 5.40 | |
| S4 | 14.50 | 8.54 | 136.10 | 13.04 | 0.17 | 1.71 | 0.04 | 5.20 | |
| S5 | 15.00 | 8.28 | 134.70 | 15.70 | 0.10 | 2.05 | 0.03 | 5.10 | |
| S6 | 13.00 | 8.02 | 145.30 | 16.85 | 0.12 | 1.17 | 0.01 | 4.80 | |
| S7 | 13.00 | 8.37 | 151.30 | 14.70 | 0.15 | 1.21 | 0.03 | 4.90 | |
| 平均 | 14.92 | 8.46 | 136.11 | 15.52 | 0.14 | 1.58 | 0.02 | 5.19 | |
| 夏季 | S1 | 23.00 | 7.79 | 128.50 | 20.08 | 0.33 | 0.94 | 0.04 | 9.50 |
| S2 | 23.00 | 7.79 | 114.10 | 23.82 | 0.26 | 0.65 | 0.11 | 5.70 | |
| S3 | 23.00 | 7.82 | 121.50 | 18.96 | 0.17 | 0.86 | 0.02 | 5.50 | |
| S4 | 23.00 | 8.03 | 116.80 | 16.31 | 0.10 | 0.97 | 0.02 | 5.20 | |
| 夏季 | S5 | 24.00 | 8.05 | 121.10 | 17.24 | 0.06 | 1.17 | 0.01 | 5.00 |
| S6 | 24.00 | 8.35 | 117.60 | 22.86 | 0.06 | 1.12 | 0.02 | 5.00 | |
| S7 | 22.90 | 8.44 | 119.60 | 17.25 | 0.07 | 1.22 | 0.01 | 4.80 | |
| 平均 | 23.27 | 8.04 | 119.89 | 19.50 | 0.15 | 0.99 | 0.03 | 5.81 | |
| t检验 | |||||||||
| 春季×夏季 | P < 0.05 | P < 0.05 | P < 0.01 | P > 0.05 | P > 0.05 | P < 0.01 | P > 0.05 | P > 0.05 | |
| 注: WT:水温; pH:酸碱度; SpCond:电导率; CODCr:化学需氧量; NH3-N:氨氮; TN:总氮; TP:总磷; CODMn:高锰酸盐指数; P < 0.05和P < 0.01表示差异性显著 | |||||||||
根据加权的营养状态指数对湖区内的水体营养状态进行初步评价, 结果如表 2所示。表明研究水域整体上处于中营养状态, 春、夏两季之间TLI得分变化差异不显著(P > 0.05)。值得注意的是, 春季的S4样点, 夏季的S1和S2样点TLI得分指示为富营养状态。
| 季节 | 采样点 | TLI(TN) | TLI(TP) | TLI(CODMn) | TLI(∑) |
| 春季 | S1 | 62.60 | 30.00 | 47.86 | 46.82 |
| S2 | 63.62 | 33.10 | 45.96 | 47.56 | |
| S3 | 61.73 | 26.16 | 43.38 | 43.76 | |
| S4 | 63.62 | 43.26 | 44.96 | 50.61 | |
| S5 | 66.69 | 35.70 | 44.44 | 48.94 | |
| S6 | 57.19 | 21.12 | 42.83 | 40.38 | |
| S7 | 57.76 | 37.95 | 43.38 | 46.36 | |
| 夏季 | S1 | 53.41 | 43.26 | 60.99 | 52.55 |
| S2 | 47.10 | 58.66 | 47.40 | 51.05 | |
| S3 | 51.90 | 30.00 | 46.45 | 42.78 | |
| S4 | 53.94 | 26.16 | 44.96 | 41.69 | |
| S5 | 57.19 | 19.57 | 43.91 | 40.23 | |
| S6 | 56.45 | 26.16 | 43.91 | 42.17 | |
| S7 | 57.90 | 19.57 | 42.83 | 40.10 | |
| t检验 | |||||
| 春季×夏季 | P < 0.05 | P > 0.05 | P > 0.05 | P > 0.05 | |
在研究期间共鉴定浮游植物152个分类单位, 隶属于6门8纲15目29科66属。其中春季6门117个分类单位, 种类组成主要以绿藻门、硅藻门为主。其中绿藻门54种, 占浮游植物总数的46.15%;硅藻门42种, 占浮游植物总数的35.90%;其他门类藻类占17.95%。夏季共鉴定浮游植物6门94个分类单位, 与春季的种类组成相类似, 夏季仍以绿藻门和硅藻门种类数最多, 其中绿藻门51种, 硅藻门25种, 分别占浮游植物总数的54.26%和26.60%, 其他门类藻类占19.14%。镜泊湖湖区浮游植物优势种季节间变化明显, 除河生集星藻(Actinastrum fluviatile (Schroed.) Fott)、梅尼小环藻(Cyclotella meneghiniana Kütz.)和谷皮菱形藻(Nitzschia palea (Kütz.) W. Smith)为调查期间共同优势种外, 浮游植物由春季的华丽四星藻(Tetrastrum elegans Playfair)、镰形纤维藻(Ankistrodesmus falcatus (Corda) Ralfs.)、狭形纤维藻(Ankistrodesmus angustus Bernard)、四刺顶棘藻(Chodatella quadriseta Lemmermann)、四尾栅藻(Scenedesmus quadricauda (Turp.) Brebisson)、蹄形藻(Kirchneriella lunaris (Kirch.) Moebius)、微小色球藻(Chroococcus minutus (Kütz.) Näg.)、纤细月牙藻(Selenastrum gracile Reinsch)、月牙藻(Selenastrum bibraianum Reinsch)演替为夏季的椭圆卵囊藻(Oocystis elliptica W. West)、Fragilaria tenera (W. Smith) Lange-Bertalot、Fragilaria nanana Lange-Bertalot和Aulacoseria granulata (Ehr.) Simonsen (表 3)。
| 季节 | 门类 | 优势种 | ||
| 四尾栅藻 | Scenedesmus quadricauda (Turp.)Breb. | |||
| 河生集星藻 | Actinastrum fluviatile (Schroed.) Fott | |||
| 华丽四星藻 | Tetrastrum elegans Playfair | |||
| 镰形纤维藻 | Ankistrodesmus falcatus (Corda) Ralfs. | |||
| 绿藻门 | 蹄形藻 | Kirchneriella lunaris (Kirch.) Moebius | ||
| 纤细月牙藻 | Selenastrum gracile Reinsch | |||
| 浮游植物 | 四刺顶棘藻 | Chodatella quadriseta Lemmermann | ||
| 月牙藻 | Selenastrum bibraianum Reinsch | |||
| 狭形纤维藻 | Ankistrodesmus angustus Bernard | |||
| 春季 | 硅藻门 | 谷皮菱形藻 | Nitzschia palea (Kütz.) W.Smith | |
| 梅尼小环藻 | Cyclotella meneghiniana Kütz. | |||
| 蓝藻门 | 微小色球藻 | Chroococcus minutus (Kütz.) Näg. | ||
| 隐藻门 | 啮噬隐藻 | Cryptomonas erosa Ehr. | ||
| 前节晶囊轮虫 | Asplanchna priodonta | |||
| 轮虫 | 针簇多枝轮虫 | Polyarthra trigla | ||
| 螺形龟甲轮虫 | Keratella cochlearis | |||
| 浮游动物 | 卓变虫 | Chaos sp. | ||
| 原生动物 | 小单环栉毛虫 | Didinium balbianii nanum | ||
| 瓶砂壳虫 | Difflugia urceolata | |||
| 桡足类 | 虫宿温剑水蚤 | Thermocyclops vermifer | ||
| 绿藻门 | 椭圆卵囊藻 | Oocystis elliptica W.West | ||
| 河生集星藻 | Actinastrum fluviatile (Schroed.) Fott | |||
| 尖针杆藻 | Synedra acus Kütz. | |||
| 浮游植物 | 颗粒直链藻极狭变种螺旋变型 | Melosira granulata var. angustissima f. spiralis Hustedt | ||
| 夏季 | 硅藻门 | 谷皮菱形藻 | Nitzschia palea (Kütz.) W. Smith | |
| 脆杆藻 | Fragilaria spp. | |||
| 梅尼小环藻 | Cyclotella meneghiniana Kütz. | |||
| 浮游动物 | 轮虫 | 前节晶囊轮虫 | Asplanchna priodonta | |
| 尖刺间盘轮虫 | Dissotrocha aculeata | |||
| 原生动物 | 瓶砂壳虫 | Difflugia urceolata |
调查期间共鉴定浮游动物4大类38个分类单位(种)。其中春季21种包括原生动物5种, 轮虫10种, 桡足类4种, 枝角类2种; 夏季13种, 包括原生动物4种, 轮虫5种, 桡足类2种, 枝角类2种。原生动物优势种主要有瓶砂壳虫(Difflugia urceolata)、小单环栉毛虫(Didinium balbianit-nanum)、卓变虫(Chaos sp.)。其中, 瓶砂壳虫为春、夏两季的优势种, 小单环栉毛虫和卓变虫仅在春季占据优势; 轮虫优势种为前节晶囊轮虫(Asplanchna priodonta)、螺形龟甲轮虫(Keratella cochlearis)、针簇多枝轮虫(Polyarthra trigla)和尖刺间盘轮虫(Dissotrocha aculeata)。其中, 前节晶囊轮虫为春季和夏季的共同优势种, 其演替表现为夏季占优势地位的尖刺间盘轮虫代替了春季占优势地位的螺形龟甲轮虫和针簇多枝轮虫, 成为夏季的优势种, 春季桡足类优势种为虫宿温剑水蚤(Thermocyclops vermifer)(表 3)。
2.3.2 浮游生物丰度浮游植物春季全湖平均丰度为6.26×106cell/L, 变化范围在3.13×106— 10.37×106cell/L之间。夏季全湖平均丰度为9.93×105cell/L, 变化范围在1.32×105—2.58×106cell/L之间(图 2)。经过独立样本t检验, 镜泊湖浮游植物丰度在春、夏两季间差异性显著(P < 0.05)。硅藻门和绿藻门的种类为春季的主要类群, 分别占据总丰度的61.92%和30.79%;硅藻门类群在夏季占据绝对的优势, 平均达到总丰度的83.58%。
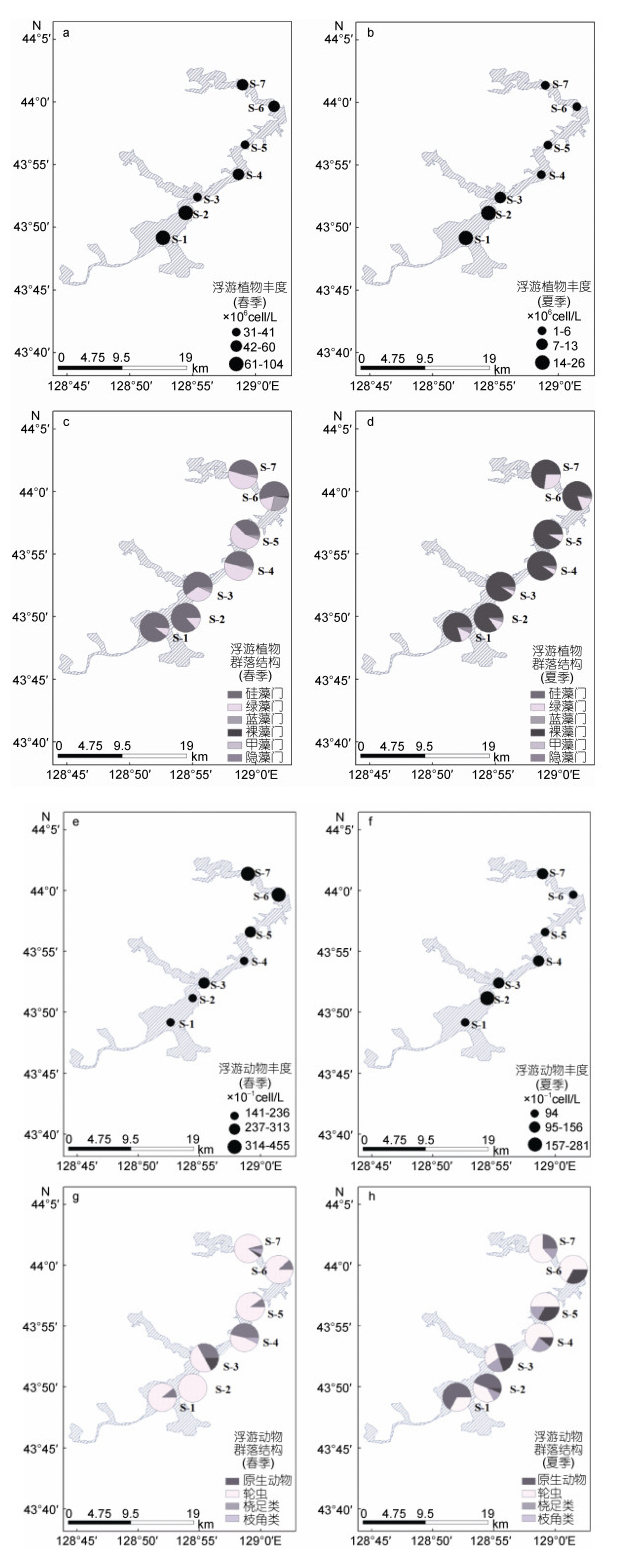 |
| 图 2 镜泊湖春、夏两季浮游生物群落结构 Fig. 2 The community structure of plankton of Jingpo Lake in spring and summer |
浮游动物春季平均丰度为291.14cell/L, 变化范围在141—455cell/L之间; 夏季平均丰度为140.71cell/L, 变化范围在94—281cell/L之间, 春、夏两季之间浮游动物丰度差异显著, 夏季与春季丰度相比降低一倍之余(图 2)。春季以轮虫和原生动物为绝对优势类群, 分别占总浮游动物的79%和15%。夏季则演替为以轮虫为主, 而原生动物、枝角类和桡足类分布较为平均, 其所占比例分别为47%、27%、13%和13% (图 2)。
2.4 镜泊湖浮游生物群落演替驱动因子分析将浮游生物优势种与WT、pH、SpCond、TP、TN、CODCr、CODMn和NH3-N进行排序分析, 探索镜泊湖浮游生物在春、夏两季之间的演替规律以及驱动浮游生物生态分布的主要环境因子。以浮游生物优势种丰度数据作为响应变量, 进行去趋势分析(DCA)。DCA分析结果显示, 4个排序轴中最大的长度梯度为2.45, 因此线性模型冗余分析(redundancy analysis, RDA)可更好的解释镜泊湖环境因子对于浮游生物生态分布的驱动作用。RDA排序显示, 轴1和轴2的特征值分别为0.623和0.115, 优势种浮游生物与环境因子相关系数达到0.978和0.959, 前四个排序轴共解释了94.6%的累计种类环境因子百分比, 基本反映了春、夏两季镜泊湖浮游生物演替与环境因子之间的生态关系。蒙特卡洛置换检验表明WT (F=9.926, P < 0.01)和SpCond (F=6.275, P < 0.01)是共同驱动镜泊湖浮游生物群落演替的主要环境因子(图 3a)。分别将浮游植物和浮游动物丰度作为环境变量进行RDA排序, 以探究浮游植物和浮游动物群落生态分布之间的关系。RDA排序分析表明, 作为食物链上的两个重要环节, 浮游动物群落同浮游植物群落在演替过程中, 既存在一定的耦合, 但又存在不同, 如某些硅藻门的种类与浮游动物的耐受特点呈现明显的差异(图 3b, 3c)。浮游动物种类数、浮游植物种类数以及浮游生物丰度与环境因子的Spearman相关性分析表明, WT与浮游动物种类数、浮游植物种类数及浮游生物丰度极其显著负相关(P < 0.01), SpCond与浮游动物种类数、浮游植物种类数以及浮游生物丰度显著正相关或极其显著正相关(P < 0.05或P < 0.01), CODCr与浮游动物种类数显著负相关(P < 0.05), 其他环境因子与浮游生物群落结构相关性不强(P > 0.05)(表 4)。
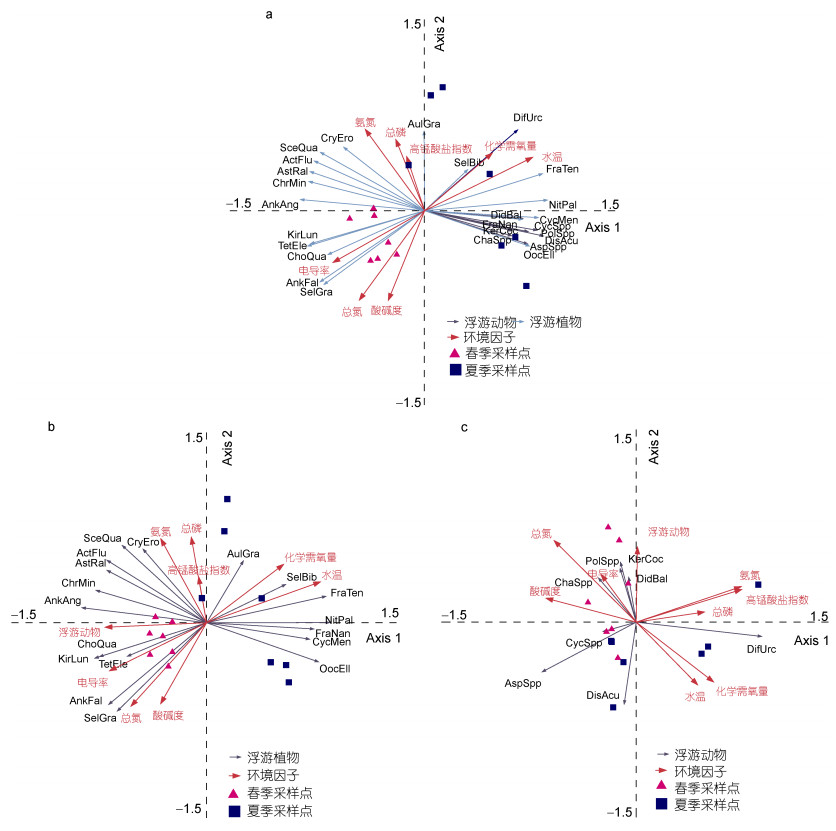 |
| 图 3 镜泊湖春季和夏季的优势浮游生物与环境因子的冗余分析排序图 Fig. 3 Redundancy analysis of dominant plankton and environmental factors of Jingpo Lake in spring and summer. 注: a:浮游生物与环境因子; b:浮游植物与环境因子; c:浮游动物与环境因子NitPal:谷皮菱形藻Nitzschia palea (Kütz.) W.Smith; CycMen:梅尼小环藻Cyclotella meneghiniana Kütz.; AstRal: Asterionella ralfsii; FraTen: Fragilaria tenera; FraNan: Fragilaria nanana; AulGra: Aulacoseria granulatal; ActFlu:河生集星藻Actinastrum fluviatile (Schroed.) Fott; TetEle:华丽四星藻Tetrastrum elegans Playfair; AnkFal:镰形纤维藻Ankistrodesmus falcatus(Corda)Ralfs.; ChoQua:四刺顶棘藻Chodatella quadriseta Lemmermann; SceQua:四尾栅藻Scenedesmus quadricauda; KirLun:蹄形藻Kirchneriella lunaris (Kirch.) Moebius; AnkAng:狭形纤维藻Ankistrodesmus angustus Bernard; SelGra:纤细月牙藻Selenastrum gracile Reinsch; SelBib:月牙藻Selenastrum bibraianum Reinsch; OocEll:椭圆卵囊藻Oocystis elliptica W. West; CryEro:啮噬隐藻Cryptomonas erosa Ehr.; ChrMin:微小色球藻Chroococcus minutus (Kütz.) Näg.; AspSpp:前节晶囊轮虫Asplanchna priodonta; PolSpp:针簇多枝轮虫Polyarthra trigla; KerCoc:螺形龟甲轮虫Keratella cochlearis; DisAcu:尖刺间盘轮虫Dissotrocha aculeate: ChaSpp:卓变虫Chaos: DidBal:小单环栉毛虫Didinium balbianii nanum; DifUrc:瓶砂壳虫Difflugia urceolata: CycSpp:虫宿温剑水蚤Thermocyclops vermifer |
| 浮游动物种类数 | 浮游植物种类数 | 浮游生物丰度 | ||||||
| R2 | P | R2 | P | R2 | P | |||
| WT | –0.833** | 0.000 | –0.734** | 0.003 | –0.734** | 0.003 | ||
| SpCond | 0.628* | 0.016 | 0.684** | 0.007 | 0.684** | 0.007 | ||
| pH | 0.095 | 0.746 | 0.414 | 0.142 | 0.414 | 0.142 | ||
| CODCr | –0.566* | 0.035 | –0.498 | 0.070 | –0.498 | 0.070 | ||
| CODMn | –0.305 | 0.289 | 0.185 | 0.526 | 0.185 | 0.526 | ||
| NH3-N | 0.223 | 0.443 | 0.475 | 0.086 | 0.475 | 0.086 | ||
| TN | 0.315 | 0.273 | 0.524 | 0.054 | 0.524 | 0.054 | ||
| TP | 0.313 | 0.276 | 0.412 | 0.143 | 0.412 | 0.143 | ||
| 注:加粗字体表示有相关性, *代表相关, **代表极其相关 | ||||||||
在研究期间, 镜泊湖共鉴定浮游植物152个分类单位, 浮游动物38个分类单位。浮游动物种类多为广布种, 群落结构特征为小型浮游动物(原生动物、轮虫), 其种类数在浮游动物总种数中所占比例较高, 这与国内其他江河、湖泊和水库浮游动物各类群的组成比例情况相似(谢进金等, 2005; 吴利等, 2008)。从镜泊湖浮游动物群落组成来看, 与本世纪初期的报道相比, 虽然略有改变, 但轮虫仍然是主要类群之一。王杨(2009)报道, 2006年桡足类和轮虫为镜泊湖水域的主要类群, 近邻剑水蚤(Cyclops vicinus)、爪哇小剑水蚤(Microcyclops javanus)、虫宿温剑水蚤、前节晶囊轮虫为镜泊湖浮游动物全年优势种。汪星等(2015b)报道, 2013年镜泊湖浮游动物群落组成主要以桡足类为主要类群, 其中长额象鼻溞(Bosmina longirostris)和跨立小剑水蚤(Microcyclops varicans)等为2013年全年优势种。而本次研究中, 轮虫再次成为镜泊湖水域春、夏两季浮游动物的主要类群, 其主要优势种为前节晶囊轮虫、针簇多枝轮虫和螺形龟甲轮虫。本次研究与2006年和2013年的研究相比, 浮游动物优势类群从以桡足类和轮虫为主, 转变为以轮虫为绝对优势。从浮游植物群落组成分析看, 本研究中镜泊湖浮游植物的优势种主要以硅藻门的谷皮菱形藻、梅尼小环藻和绿藻门的镰形纤维藻为主。这与陈立群等(1994)、张新刚等(2007)和汪星等(2015a)对镜泊湖浮游植物群落结构的研究结果类似。水体营养状态的改变, 可能会导致某些耐污种类数量的大幅度增加, 浮游生物的种类多样性下降, 群落结构发生改变(杨宇峰等, 2006)。本研究中浮游生物的优势种(如镰形纤维藻、狭形纤维藻、椭圆卵囊藻、螺形龟甲轮虫和虫宿温剑水蚤)均为高度耐污种类(沈韫芬, 1990), 推测研究区域个别样点可能受到一定的污染, 这与本次TLI分析表水体处于中营养状态一致(表 2)。李共国等(2013)研究指出, 轮虫生物量的变化对水体营养状态改变敏感, 通常被认为是水体营养状态改变的有效指示生物。水产养殖(网/围栏养殖)过程中所带来的外源氮、磷污染, 被认为是湖泊水体富营养化的重要原因之一(孙辉等, 2014; 何勇凤等, 2015)。本研究中Spearman相关性分析也指出镜泊湖水体化学需氧量(CODCr)与浮游动物丰富度呈显著负相关(P < 0.05)(表 4), 说明镜泊湖人为活动所带来的部分水体有机质含量的变化, 可能是浮游动物群落改变的原因之一。此外, 镜泊湖是河道型湖泊, 受人为活动干扰较为明显, 其主要污染源来自景区周边农田及养殖过程中所投放的饵料产生的污染(赵光楠等, 2017)。在本研究中, TLI显示个别采样点如水产养殖区S2处于富营养状态(表 2)。另外, 湖泊上游旅游区S1样点较高的营养状态也与前期在镜泊湖相近研究点位的评价结果一致(庄道阔, 2015)。万莉(2014)在四明湖水库浮游生物的研究中也指出, 地表径流与浮游生物群落密切相关, 因此推测水产养殖及其他面源污染如地表径流等带来的外源营养输入可能是近年间浮游动物群落发生改变的原因之一。整体来看, 与过去10余年间的研究相比, 镜泊湖水域营养状态除个别样点外并无进一步恶化的趋势, 与前期研究相比较为稳定。作为初级生产者的浮游植物群落结构变化不大, 仍然以硅藻门为主要类群, 而浮游动物优势类群略改变, 耐污种浮游生物占据优势的现象应引起重视。
3.2 环境因子变化对浮游生物群落的影响湖泊生态系统中浮游生物物种多样性高、水体环境因子相对复杂, 浮游生物的生态分布往往受到多种环境因子共同限制(George et al, 1995)。以往的大量研究表明, 驱动浮游生物群落发生演替的主要环境变量为水体的营养盐以及水温等(杨亮杰等, 2014; Zhao et al, 2015; 李喆等, 2016)。本研究中, 镜泊湖浮游生物的群落结构季节间变化显著, 春、夏两季之间浮游生物的群落结构差异较大(图 2, 表 3)。RDA排序图中, 采样点的分布反映了包括浮游生物优势种类和环境因子在内的所有生态信息(Braak, 1998)。本研究RDA排序图中, 镜泊湖春、夏两季的采样点分布明显, 反映了春、夏两季之间环境条件变化对浮游生物群落结构演替的驱动作用。电导率体现了水体中离子的含量, 其浓度的变化反映了水体中营养盐的改变, 被广泛认为是驱动浮游生物群落演替的主要环境因子之一(Flores et al, 1998; Leland et al, 2000)。RDA分析显示, 电导率的升高对绿藻门的浮游植物如:镰形纤维藻和四刺顶棘藻丰度变化影响最为明显。Spearman相关分析也表明, 电导率与浮游生物丰度显著正相关(P < 0.05)(表 4)。一般认为, 在湖泊生态系统中, 硅藻类群占据优势指示水体为中营养水平, 而绿藻和蓝藻类群一般生活在富营养的水体中(Dagg, 1995)。因此本研究中, 喜好生存在较高营养水平水体的绿藻门类群, 随着电导率含量的改变而发生变化。RDA排序中, 春季采样点位于第一轴的负半轴, 并伴随较高的营养水平, 说明春季水体中较高电导率所反映的高营养水平促进了以绿藻门为主的浮游植物的生长。不同浮游植物类群有着不同的最适水温, 如水温在20℃左右时浮游植物的群落主要以硅藻为主, 30℃时以绿藻为主, 而40℃时以蓝藻为主(Elliott et al, 2006)。调查期间, 镜泊湖水温在13℃(春季)和24℃(夏季)之间变动, 适合喜低温的硅藻生长繁殖, 因此硅藻为研究期间优势类群。但本次RDA排序显示, 水温升高并未促进绿藻门等喜好较高水温的浮游植物生长; 相关性分析也表明, 浮游生物的丰度与水温显著负相关(P < 0.01), 这是因为水温较高的夏季为镜泊湖的丰水期(马成学等, 2010), 丰水期水位较高、外源水体输入带来水体扰动程度增加, 对浮游植物的生长代谢产生了一定的限制作用(王伟, 2013)。江成(2014)在青草沙水库水体扰动对微藻生长机制的研究中也表明, 水体扰动会限制蓝、绿藻类的生长。另外, 硅藻门种类具有很强的捕获光能力, 对外界光照强度的改变能迅速反应(Reynolds, 2006), 因此部分硅藻门种类如谷皮菱形藻和梅尼小环藻在水体扰动程度较高的夏季水环境中成为优势类群(图 3)。
水温是影响浮游动物新陈代谢的主要环境因子, 与有机体繁殖、生长和代谢都有密切的关系(Devreker et al, 2005; Lenz et al, 2005)。对浮游动物的室内实验表明30℃以下枝角类、桡足类、无节幼体丰度会随水温的升高而增加(金琼贝等, 1991)。对长湖浮游动物群落结构及其环境因子的研究也表明, 水温是影响长湖浮游动物群落机构变化的关键因子(郭坤等, 2017)。对衡山水库、五大连池以及上海滴水湖浮游动物群落结构的相关研究也得出水温是影响浮游动物分布的主要环境因子(林青等, 2014; 杨亮杰等, 2014; 李喆等, 2016), 这与本文RDA排序分析结果一致, 说明水温变化过程影响了镜泊湖浮游动物群落演替。综合多元统计分析及本底资料研究表明, 水温和电导率的变化是影响本研究期间镜泊湖浮游生物演替的主要水环境因子。考虑到不同水期中水体扰动及光层的变化对浮游生物群落的影响, 以及结合本研究中电导率变化对浮游生物群落演替的驱动作用, 未来研究中对于水文条件及水体中钠、钾和钙等水体中“八大离子”的分析不可忽视。
整体来看, 镜泊湖浮游植物和浮游动物对水环境因子变化的耐受能力不同(图 3b, 3c), 浮游植物和浮游动物通过食物网耦合在一起, 一旦环境条件改变必将通过上、下行效应引起浮游生物群落的改变(刘建康, 1999; Fermani et al, 2013)。相比于单一类群(仅浮游植物或浮游动物)的生态研究, 相信通过研究浮游生物群落对季节之间水环境因子变化的生态响应过程, 可更好地为温带地区湖泊环境变化做出有效生物指示。
4 结论位于黑龙江省东南部的镜泊湖是我国最大的高山堰塞湖, 地处温带季风性气候。本文对2015年镜泊湖丰水期和枯水期浮游生物群落结构及在不同水期驱动其演替的环境因子进行探究。综合浮游生物本底数据及水环境因子分析, 得到主要结论如下:
(1) 2015年镜泊湖共鉴定浮游植物152个分类单位, 浮游动物38个分类单位。浮游植物群落结构主要由硅藻门和绿藻门种类构成, 轮虫在浮游动物群落中占据绝对优势。
(2) 浮游生物的群落结构在春季(枯水期)和夏季(丰水期)之间变化显著, 浮游生物丰度在枯水期明显高于丰水期(P < 0.05)。
(3) 春季和夏季之间水温和电导率的变化是驱动浮游生物群落演替的主要环境因子。
(4) 镜泊湖水体营养状态基本处于中营养水平。与以往的10余年研究相比, 除个别样点外, 镜泊湖浮游生物群落结构及水体营养状态相对稳定。
| 万莉, 2014.四明湖水库浮游生物群落结构及其动态.宁波: 宁波大学硕士学位论文 |
| 马成学, 刘曼红, 黄璞祎, 等, 2010. 镜泊湖枯水期和丰水期浮游植物群落结构. 东北林业大学学报, 38(2): 35–37 DOI:10.3969/j.issn.1000-5382.2010.02.013 |
| 王伟, 2013.强降雨对胶州湾生源要素的补充作用及浮游植物丰度和种群结构的影响.青岛: 中国海洋大学硕士学位论文 |
| 王杨, 2009.镜泊湖后生浮游动物群落结构研究与水质评价.哈尔滨: 东北林业大学硕士学位论文 |
| 王明翠, 刘雪芹, 张建辉, 2002. 湖泊富营养化评价方法及分级标准. 中国环境监测, 18(5): 47–49 DOI:10.3969/j.issn.1002-6002.2002.05.018 |
| 巴秋爽, 李雪, 刘妍, 等, 2016. 扎龙湿地藻类植物群落结构特征及水质初步评价. 海洋与湖沼, 47(5): 924–934 |
| 庄道阔, 2015.镜泊湖流域浮游植物群落和功能类群特征及水质评价.保定: 河北大学硕士学位论文 |
| 刘建康, 1999. 高级水生生物学. 北京: 科学出版社 |
| 刘鸿雁, 徐云麟, 1996. 镜泊湖藻类生长和湖泊富营养化预测初探. 生态学报, 16(2): 195–201 |
| 江成, 2014.水体扰动对藻生长机制与QCS水库富营养化控制的影响研究.上海: 上海交通大学博士学位论文 |
| 孙辉, 汪岷, 汪俭, 等, 2014. 养殖活动对超微型浮游生物分布影响的研究. 海洋与湖沼, 45(6): 1272–1279 |
| 李喆, 王念民, 孙大江, 等, 2016. 五大连池浮游动物群落结构的时空分布特征. 生态学报, 36(4): 961–970 |
| 李共国, 屠霄霞, 王佩儿, 等, 2013. 杭州湾滩涂湿地浮游生物群落特征及与环境因子的关系. 生态学杂志, 32(10): 2764–2771 |
| 杨宇峰, 王庆, 陈菊芳, 等, 2006. 河口浮游动物生态学研究进展. 生态学报, 26(2): 576–585 DOI:10.3321/j.issn:1000-0933.2006.02.034 |
| 杨亮杰, 吕光汉, 竺俊全, 等, 2014. 横山水库浮游动物群落结构特征及水质评价. 水生生物学报, 38(4): 720–728 |
| 吴利, 冯伟松, 陈小娟, 等, 2008. 新疆伊犁地区夏季浮游动物群落结构特征. 应用生态学报, 19(1): 163–172 |
| 吴锋, 战金艳, 邓祥征, 等, 2012. 中国湖泊富营养化影响因素研究——基于中国22个湖泊实证分析. 生态环境学报, 21(1): 94–100 DOI:10.3969/j.issn.1674-5906.2012.01.018 |
| 何勇凤, 李昊成, 朱永久, 等, 2015. 湖北长湖富营养化状况及时空变化(2012-2013年). 湖泊科学, 27(5): 853–864 |
| 汪星, 刘录三, 李黎, 等, 2015a. 镜泊湖浮游藻类组成及其与环境因子的相关分析. 中国环境科学, 35(11): 3403–3413 |
| 汪星, 刘录三, 李黎, 等, 2015b. 镜泊湖浮游动物组成及其与环境因子的相关分析. 中国科技成果,(16): 22–27 |
| 沈韫芬, 顾曼如, 龚循矩, 等, 1990. 微型生物监测新技术. 北京: 建筑工业出版社 |
| 沈嘉瑞, 1979. 中国动物志-节肢动物门甲壳纲:淡水桡足类. 北京: 科学出版社 |
| 张达娟, 闫启仑, 王真良., 2008. 典型河口浮游动物种类数及生物量变化趋势的研究. 海洋与湖沼, 39(5): 536–540 DOI:10.3321/j.issn:0029-814X.2008.05.017 |
| 张新刚, 冷雪莲, 于洪贤, 2007. 镜泊湖水环境质量综合评价及保护对策探讨. 水利渔业, 27(4): 55–56, 74 DOI:10.3969/j.issn.1003-1278.2007.04.021 |
| 陈立群, 王友联, 王全喜, 等, 1994. 镜泊湖的浮游藻类及水质评价. 哈尔滨师范大学自然科学学报, 10(1): 80–84 |
| 林青, 由文辉, 徐凤洁, 等, 2014. 滴水湖浮游动物群落结构及其与环境因子的关系. 生态学报, 34(23): 6918–6929 |
| 金相灿, 屠清瑛, 1990. 湖泊富营养化调查规范. 2版. 北京: 中国环境科学出版社 |
| 金相灿, 屠清瑛, 1990. 湖泊富营养化调查规范. 北京: 中国环境科学出版社 |
| 金琼贝, 盛连喜, 张然, 1991. 温度对浮游动物群落的影响. 东北师大学报自然科学版,(4): 103–111 |
| 赵光楠, 吴德东, 潘宝源, 2017. 镜泊湖富营养化评价及防治对策研究. 环境科学与管理, 42(5): 106–109 DOI:10.3969/j.issn.1673-1212.2017.05.024 |
| 胡鸿钧, 魏印心, 2006. 中国淡水藻类——系统、分类及生态. 北京: 科学出版社 |
| 秦伯强, 高光, 胡维平, 等, 2005. 浅水湖泊生态系统恢复的理论与实践思考. 湖泊科学, 17(1): 9–16 DOI:10.3321/j.issn:1003-5427.2005.01.002 |
| 郭坤, 彭婷, 罗静波, 等, 2017. 长湖浮游动物群落结构及其与环境因子的关系. 海洋与湖沼, 48(1): 40–49 |
| 章宗涉, 黄祥飞, 1991. 淡水浮游生物研究方法. 北京: 科学出版社 |
| 蒋燮治, 堵南山, 1979. 中国动物志-节肢动物门甲壳纲:淡水枝角类. 北京: 科学出版社, 153-155 |
| 谢进金, 许友勤, 陈寅山, 等, 2005. 晋江流域水质污染与浮游动物四季群落结构的关系. 动物学杂志, 40(5): 8–13 DOI:10.3969/j.issn.0250-3263.2005.05.002 |
| 黎尚豪, 毕列爵, 1998. 中国淡水藻志-第五卷:绿藻门 丝藻目 石莼目 胶手藻目 橘色藻目 环藻目. 北京: 科学出版社 |
| Chang G, Dickey T, 2008. Interdisciplinary sampling strategies for detection and characterization of harmful algal blooms. In: Babin M, Roesler C S, Cullen J J eds. Real-Time Coastal Observing Systems for Marine Ecosystem Dynamics and Harmful Algal Blooms: Theory, Instrumentation and Modelling. Paris, France: UNESCO, 503-503 |
| Cloern J E, 2001. Our evolving conceptual model of the coastal eutrophication problem. Marine Ecology Progress Series, 210: 223–253 DOI:10.3354/meps210223 |
| Dagg M J, 1995. Ingestion of phytoplankton by the micro-and mesozooplankton communities in a productive subtropical estuary. Journal of Plankton Research, 17(4): 845–857 DOI:10.1093/plankt/17.4.845 |
| Devreker D, Souissi S, Seuront L, 2005. Effects of chlorophyll concentration and temperature variation on the reproduction and survival of Temora longicornis (Copepoda, Calanoida) in the Eastern English Channel. Journal of Experimental Marine Biology and Ecology, 318(2): 145–162 DOI:10.1016/j.jembe.2004.12.011 |
| Diovisalvi N, Echeverry G E S, Lagomarsino L, et al, 2015. Seasonal patterns and responses to an extreme climate event of rotifers community in a shallow eutrophic Pampean lake. Hydrobiologia, 752(1): 125–137 DOI:10.1007/s10750-014-1909-2 |
| Elliott J A, Irish A E, Reynolds C S., 2001. The effects of vertical mixing on a phytoplankton community:a modelling approach to the intermediate disturbance hypothesis. Freshwater Biology, 46(10): 1291–1297 DOI:10.1046/j.1365-2427.2001.00754.x |
| Elliott J A, Jones I D, Thackeray S J, 2006. Testing the sensitivity of phytoplankton communities to changes in water temperature and nutrient load, in a temperate lake. Hydrobiologia, 559(1): 401–411 DOI:10.1007/s10750-005-1233-y |
| Fermani P, Diovisalvi N, Torremorell A, et al, 2013. The microbial food web structure of a hypertrophic warm-temperate shallow lake, as affected by contrasting zooplankton assemblages. Hydrobiologia, 714(1): 115–130 DOI:10.1007/s10750-013-1528-3 |
| Flores L N, Barone R, 1998. Phytoplankton dynamics in two reservoirs with different trophic state (Lake Rosamarina and Lake Arancio, Sicily, Italy). Hydrobiologia, 369-370: 163–178 DOI:10.1023/A:1017063708180 |
| George D G, Taylor A H, 1995. UK lake plankton and the Gulf Stream. Nature, 378(6553): 139 DOI:10.1038/378139a0 |
| Lampitt R S, Wishner K F, Turley C M, et al, 1993. Marine snow studies in the Northeast Atlantic Ocean:distribution, composition and role as a food source for migrating plankton. Marine Biology, 116(4): 689–702 DOI:10.1007/BF00355486 |
| Landry M R, Hassett R P, 1982. Estimating the grazing impact of marine micro-zooplankton. Marine Biology, 67(3): 283–288 |
| Leland H V, Porter S D, 2000. Distribution of benthic algae in the upper Illinois River basin in relation to geology and land use. Freshwater Biology, 44(2): 279–301 DOI:10.1046/j.1365-2427.2000.00536.x |
| Lenz P H, Hower A E, Hartline D K, 2005. Temperature Compensation in the Escape Response of a Marine Copepod, Calanus finmarchicus (Crustacea). Biological Bulletin, 209(1): 75–85 DOI:10.2307/3593143 |
| Lizotte Jr R E, Shields Jr D F, Murdock J N, et al, 2012. Responses of Hyalella azteca and phytoplankton to a simulated agricultural runoff event in a managed backwater wetland. Chemosphere, 87(7): 684–691 DOI:10.1016/j.chemosphere.2011.12.058 |
| Paerl H W, 1988. Nuisance phytoplankton blooms in coastal, estuarine, and inland waters. Limnology and Oceanography, 33(4): 823–847 |
| Phlips J E, Badylak S, Bledsoe E, et al, 2006. Factors affecting the distribution of Pyrodinium bahamense var. bahamense in coastal waters of Florida. Marine Ecology Progress Series, 322: 99–115 DOI:10.3354/meps322099 |
| Reynolds C S, 2006. The Ecology of Phytoplankton. UK: Cambridge University Press, |
| Schütz J, Rydin E, Huser B J, 2017. A newly developed injection method for aluminum treatment in eutrophic lakes:Effects on water quality and phosphorus binding efficiency. Lake and Reservoir Management, 33(2): 152–162 DOI:10.1080/10402381.2017.1318418 |
| Ter Braak C J F, Smilauer P, 1998. CANOCO Reference Manual and User's Guide to Canoco for Windows: Software for Canonical Community Ordination (Version 4). Ithaca, Greece: Microcomputer Power |
| Zhao H J, Wang Y, Yang L L, et al, 2015. Relationship between phytoplankton and environmental factors in landscape water supplemented with reclaimed water. Ecological Indicators, 58: 113–121 DOI:10.1016/j.ecolind.2015.03.033 |
 2019, Vol. 50
2019, Vol. 50


