中国海洋湖沼学会主办。
文章信息
- 韩笑天, 赵婷, 苗辉, 孙斌, 赵卫红, 颜天, 于仁成. 2019.
- HAN Xiao-Tian, ZHAO Ting, MIAO Hui, SUN Bin, ZHAO Wei-Hong, YAN Tian, YU REN-Cheng. 2019.
- 苏北浅滩绿藻从定生到漂浮过程中的组成及其生长特性
- GROWTH CHARACTERISTICS OF GREEN ALGAE FROM ATTACHED TO FLOATED GROWTH PROCESS IN THE SUBEI SHOAL
- 海洋与湖沼, 50(2): 308-315
- Oceanologia et Limnologia Sinica, 50(2): 308-315.
- http://dx.doi.org/10.11693/hyhz20181000258
-
文章历史
- 收稿日期:2018-10-31
- 收修改稿日期:2018-12-10
2. 中国科学院海洋研究所 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
4. 中国科学院海洋大科学研究中心 青岛 266071;
5. 天津大学 青岛海洋工程研究院 青岛 266200
2. Institute of Oceanology, Chinese Academy of Science, Qingdao 266071, China;
3. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
5. Qingdao Institute for Ocean Engineering of Tianjin University, Qingdao 266200, China
20世纪70年代, 一些大型绿藻过度生长, 并在岸线上沉积, 对生态及环境造成不良影响, 被称为“绿潮” (Fletcher, 1996)。绿潮主要由石莼属(Ulva)、刚毛藻属(Cladophora)、硬毛藻属(Chaetomorpha)等大型定生绿藻脱离固着基后, 漂浮并不断增殖导致的藻类灾害(Blomster et al, 2002; Nelson et al, 2003)。绿潮目前已成为世界沿海各国普遍发生的生态异常现象, 在欧洲、亚洲、北美洲和澳大利亚均有记录, 主要发生在河口、内湾、瀉湖和城市密集的沿海(Morand et al, 2004)。绿潮藻通常无毒, 但会造成诸如破坏栖息地、消耗氧气以及改变生物地球化学循环等环境变化, 并最终影响生态系统的生物多样性(Burkholder et al, 2007; Van Alstyne et al, 2015)。
从2007年至今, 黄海近海海域已经连续11年暴发了大规模绿潮灾害, 不仅破坏了海洋生态系统及生态服务功能, 也造成巨大的经济损失。2008年青岛奥帆赛举办之前, 清理浒苔已花费了6亿元(Wang et al, 2009; Zhou et al, 2015)。通过形态和分子生物学分析, 浒苔Ulva prolifera (Enteromorpha prolifera)被确认为黄海绿潮藻中的优势种(Ye et al, 2011; Zhao et al, 2013)。使用遥感数据发现, 黄海和东海海域漂浮的绿潮来源于苏北近岸海域(Hu et al, 2010; Son et al, 2012), 特别是在北纬32.8°至33.8°之间(Liu et al, 2009)。早期绿藻漂浮斑块起始于4月下旬, 在海面上自南向北迁移和漂浮生长, 并在6个星期左右到达山东近海, 形成大规模绿潮(Li et al, 2014)。
苏北浅滩位于江苏省北岸, 从长江三角洲到射阳河, 宽200公里, 纵向90公里。这一地区的特点是沉积物松散, 潮汐活动强烈, 水动力复杂, 水体浑浊(Wang et al, 2011)。在苏北浅滩的大部分地区, 水深小于15米, 周边水深为20—30米; 浅滩淹没在高潮中, 在退潮时暴露(Zhou et al, 1981)。在这些径向沙丘上, 养殖了占中国生产总量65%的紫菜。2006年至2008年, 苏北浅滩紫菜养殖规模大幅度扩大, 养殖面积已达20000公顷左右。
由于苏北浅滩在低潮时, 潮间带海藻在空气中暴露呈干出状态, 且周围环境条件变化剧烈, 从而使其处于高光强、高温、脱水、营养限制以及渗透胁迫等胁迫环境因子条件下。同时通过苏北浅滩地区实地调查发现, 渔民从紫菜筏架上清除附着的绿藻, 许多绿藻藻体被释放到滩涂上使其处于干露状态(Liu et al, 2010, 2013; Zhang et al, 2011, 2014; Wang et al, 2015)。以往研究主要在实验室内针对绿藻群落演替及其不同绿藻种类的生长特性开展研究, 并未进行现场研究。本文通过在苏北浅滩紫菜筏架养殖现场设置滩涂围隔实验和船基围隔实验, 针对特殊的潮汐作用下筏架干出和水浸过程中定生和漂浮绿藻生长特性开展相关研究。本研究的目的在于了解: (1)绿潮暴发初期, 绿藻群落演替及生长率情况如何?(2)绿藻从定生到漂浮过程中, 浒苔及其他绿藻的生长竞争状况如何?(3)苏北浅滩潮水涨落对于脱落绿藻生长率有何影响?此项研究的结果将为进一步了解浒苔绿潮的形成原因提供科学依据。
1 材料与方法 1.1 藻体采集选择苏北浅滩作为实验地点, 调查船定点坐滩, 实验地点为32°47′N, 121°17′E(图 1), 季节选择绿藻附着和浒苔出现的关键期3月下旬(3月30日—4月4日)和5月初(5月7日—12日)。藻体样本选择该实验地点的紫菜养殖筏架, 采集2017年3月底和5月初筏架上附着的定生绿藻和海面采集的漂浮绿藻。取样时尤其要注意尽可能保持绿藻附着基的完整, 然后分别装入样品袋, 采样结束回到船上对样品进行初处理, 用海水冲洗掉夹带在样品中的泥沙, 自然阴干、冷藏带回陆地实验室分析。
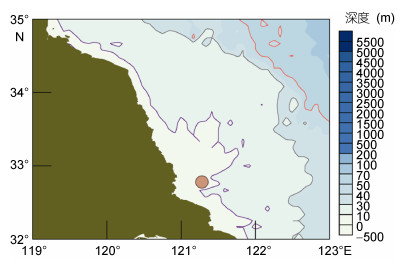 |
| 图 1 围隔实验地点(图中红色点为实验地点) Fig. 1 Location of the mesocosm experiment in the field (the red dot) |
2017年3月30日—4月4日, 5月7日—5月12日期间, 在苏北浅滩设置滩涂围隔实验。针对5月初在海面上开始出现漂浮浒苔的现象, 同时设置了船基围隔实验。滩涂围隔设置为通透型围隔, 底部悬空20cm, 围隔内水位随潮水涨落, 围隔网孔为1mm(防止浒苔从网孔中漏出)。船基围隔装置为宽1.5m、长2m、高1m的小型模块化围隔装置, 该装置主要由围隔体系、循环水装置及装载水装置组成, 绿藻分别用透明网筛分隔。
滩涂围隔和船基围隔中分别放入初始生物量为100g的绿藻样品, 初始样品为3月底和5月初紫菜养殖筏架上附着的定生绿藻藻体和5月份海面采集的漂浮绿藻藻体, 设置5个平行样。每两天称重一次:将藻样捞出, 用纱布包裹, 分别用吸水纸吸取水分至无水滴滴落, 再将样品放在电子秤上(精度为0.01g, 友声BS300+, 上海友声衡器有限公司)称重。
藻体相对生长率(relative growth rate, RGR)按照公式(1)计算,
RGR (%/d)=100(lnWt-lnW0)/t,
式中, W0为藻体初始湿重(g); Wt为培养第t天藻体湿重(g); t为培养时间(d)。
1.3 藻体形态鉴定每个样本随机挑取10根单独藻体, 进行形态鉴定。将绿藻样品放置于样品盘, 加入海水使其悬浮于其中, 根据其形态学特点包括:藻体颜色、形状、分枝情况、是否中空等特点, 参考相关文献(丁兰平等, 2008, 2009)对其进行形态学鉴定。
1.4 环境因子测定海水表层温度采用海水表层温度计测量(wqg-17表层温度计, 建兴仪表厂), 海水盐度采用手持式盐度计测量(master-s28α型手持式盐度计, 日本ATAGO)。
1.5 统计分析本研究所获得的数据, 均来自完全独立的藻体样品。绿藻及浒苔生物量在不同生长时期的变化以ANOVA进行验证。
2 结果 2.1 不同时期和不同生长状态绿藻的群落组成及其在围隔的生长 2.1.1 紫菜养殖筏架上绿藻定生及其脱落后漂浮状态的群落组成变化2017年3月底紫菜筏架附着定生绿藻主要由曲浒苔、盘苔、扁浒苔和缘管浒苔组成, 曲浒苔和盘苔为主要优势种, 湿重生物量在绿藻群落中所占比例分别为52.6%和25.6%;扁浒苔和缘管浒苔在绿藻群落中生物量所占比例相对较低, 分别为14.6%和7.2%;绿藻群落中没有出现浒苔, 海面只见到极少量绿藻漂浮在海面(图 2)。5月初紫菜养殖筏架上附着定生绿藻生物量明显高于3月底附着定生绿藻生物量(图 2a, 图 2d, 图 3), 主要优势种为盘苔和扁浒苔, 盘苔生物量在绿藻群落中所占比例最高, 为47%;其次为扁浒苔, 为38%;定生绿藻群落中开始出现浒苔, 但是在绿藻生物量中所占生物量比例不高, 为15%(图 3)。此次定生绿藻可见大量中空管状藻体(图 2e, 图 2f), 海面可见斑块状漂浮绿藻。海面漂浮绿藻的群落组成与定生绿藻的群落组成有较大差异, 其主要优势种为浒苔、扁浒苔和盘苔, 浒苔为主要优势种, 在漂浮绿藻群落中生物量所占比例为76%, 其次为扁浒苔为16%, 盘苔所占比例最少, 仅为8%, 与定生绿藻群落中优势种差异较大, 结果见图 3。
 |
| 图 2 2017年紫菜养殖筏架定生绿藻及海面漂浮绿藻 Fig. 2 Attached green algae on Porphyra agriculture rafts and free-floating green algae at sea surface in 2017 注: a. 3月底紫菜养殖筏架上附着的定生绿藻; b. 3月底定生绿藻形态; c. 3月底定生绿藻采集后置于桶中的漂浮状态; d. 5月初紫菜养殖筏架上定生绿藻; e. 5月初定生绿藻形态; f. 5月初漂浮在海面上的绿藻 |
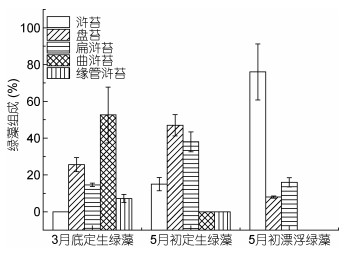 |
| 图 3 2017年3月底和5月初紫菜养殖筏架定生绿藻及漂浮绿藻群落组成变化 Fig. 3 Variation of the community composition of the attached green algae on Porphyra agriculture rafts and free-floating green algae at sea surface in early May and late March, 2017 |
3月底和5月初定生绿藻在滩涂设置的围隔(藻体随潮水涨落有干露和水浸状态)中进行生长实验。由图 4可知, 滩涂围隔中以3月底定生绿藻为初始绿藻时, 在实验5天后, 生物量从100g减少为40.4g, 绿藻群落以盘苔、扁浒苔、曲浒苔和缘管浒苔组成, 生物量均下降(图 4)。滩涂围隔中以5月初定生绿藻为初始绿藻时, 在实验5天后, 生物量从100g增加到146.9g, 绿藻群落由浒苔、盘苔和扁浒苔组成, 浒苔的生物量增加显著, 从第一天15g, 第三天增加到75.3g, 第五天即增加到105.8g;在绿藻中的组成比例同样增加显著, 实验过程中, 从第一天生物量组成比例为15%, 在第三天和第五天分别增加到62%和72%, 生物量增加呈显著性差异; 盘苔组成比例则呈下降趋势, 由初始的47%下降到10%, 扁浒苔呈同样趋势, 由初始的38%下降为18%, 均呈显著性差异(图 5)。
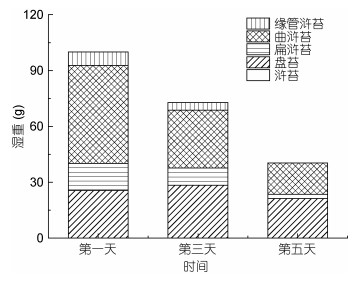 |
| 图 4 3月底滩涂围隔绿藻生物组成和生物量变化 Fig. 4 Variations in community composition and biomass of green algae in the shoal based mesocosm in late March, 2017 |
 |
| 图 5 5月初滩涂围隔绿藻生物组成和生物量变化 Fig. 5 Variations in community and biomass of green algae in the shoal based mesocosm in early May, 2017 |
5月初紫菜养殖筏架上附着生长的定生绿藻中开始出现浒苔, 且在海面出现斑块状漂浮绿藻, 在船基围隔实验中分别放置定生绿藻和海面漂浮绿藻进行生长实验。船基围隔中初始绿藻为5月初定生绿藻组, 在围隔生长三天后, 浒苔生物量从3.75g增长到26.06g;绿藻浒苔生物量所占比例从12.5%增加到72%;曲浒苔和盘苔生物量减少, 分别从15.8g和10.5g减少到3.6g和6.5g;浒苔生物量增加和曲浒苔、盘苔生物量减少均呈显著性差异(图 6)。船基围隔中初始绿藻为海面漂浮绿藻组, 在围隔中生长三天后, 浒苔生物量从22.8g增加到40.3g, 绿藻中组成比例从76%增加到83%, 差异显著; 曲浒苔和盘苔生物量基本与初始保持一致, 生物量没有显著性增加(图 6)。
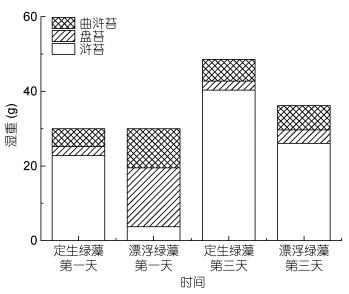 |
| 图 6 5月初定生绿藻和漂浮绿藻在船基围隔中的生物组成及生物量变化 Fig. 6 Variations in community composition and biomass of rooted and floating green algae in the ship-attached mesocosm in early May, 2017 |
以5月初定生绿藻作为初始培养对象放置在船基围隔中进行生长实验, 其中定生浒苔获得相对生长率较高为64.2%/d, 定生绿藻获得的相对生长率为7.1%/d; 而以5月初定生绿藻作为初始培养对象放置在滩涂围隔中进行生长实验时, 其中浒苔同样获得较高相对生长率, 在第3天时获得平均相对生长率为53.0%/d, 第5天时获得的平均相对生长率降低, 为39%/d (图 7), 而定生绿藻在滩涂围隔中平均相对生长率仅为6.2%/d。
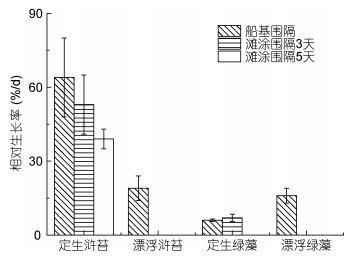 |
| 图 7 定生绿藻、漂浮绿藻、定生浒苔和漂浮浒苔相对生长率的比较 Fig. 7 Comparison in the relative growth rate of attached and free-floating green algae and U. prolifera |
以5月初漂浮绿藻作为初始培养对象放置在船基围隔中进行3天的生长实验, 其中漂浮浒苔获得的相对生长率为19.1%/d, 与漂浮绿藻获得的相对生长率相近(16.0%/d)。
2.3 不同时期苏北浅滩海洋环境因子的变化3月底测定海域温度变化范围为10.6—12.6℃, 平均温度为(11.4±0.8)℃; 5月初温度变化范围为17.5—20.8℃, 平均温度为(18.8±1.3)℃。3月底测定海域盐度变化范围为29.4—30.3, 平均盐度为30.0±0.5; 5月初盐度变化范围为27.2—29.2, 平均盐度为28.7±1.0。3月底和5月初温度及盐度变化见图 8。5月初海域温度比3月底海域温度高6—8℃, 5月初海域盐度比3月底海域盐度略低。
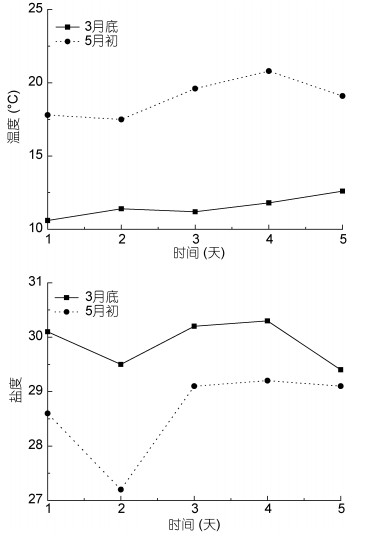 |
| 图 8 苏北浅滩3月底和5月初温度盐度变化曲线 Fig. 8 Variation of temperature and salinity in late March and early May, 2017 in the Subei Shoals |
筏架上定生绿藻群落演替现象明显, 3月份筏架上定生绿藻的种类组成和生物多样性明显高于5月份, 筏架上存在4种定生绿藻, 分别为扁浒苔、盘苔、曲浒苔及缘管浒苔; 其中曲浒苔和盘苔为主要优势种, 浒苔没有出现。5月份, 定生绿藻的种类多样性明显下降, 筏架上主要存在3种定生绿藻, 分别为盘苔、扁浒苔和浒苔; 其中盘苔藻为主要优势种, 其生物量比例显著高于浒苔和扁浒苔在绿藻中的生物量组成比例; 浒苔在5月份定生绿藻中出现, 但是所占比例不高。5月份海面上漂浮绿藻中开始出现浒苔, 且浒苔的比例显著高于定生浒苔所在绿藻中的比例, 达到76%。宋伟(2014)通过2012年3月初至5月中旬的六个航次中调查研究发现, 共计6种定生绿藻被发现存在于紫菜养殖筏架上, 它们分别为盘苔、浒苔、缘管浒苔、扁浒苔、肠浒苔Ulva intestinalis从及条浒苔Ulva clathrata, 浒苔、缘管浒苔及盘苔藻是筏架上的主要定生绿藻。自3月初至5月期间, 筏架上定生绿藻的生物多样性呈明显下降趋势。在3月上旬及中旬航次中, 此时筏架上定生绿藻共计发现5种绿藻, 其中浒苔的生物量较小。在4月份航次中, 盘苔藻及浒苔的出现频率较高, 而其他几种绿藻只是在某些时间段内出现。而到5月中旬, 紫菜养殖筏架上只发现三种定生绿藻, 其种类多样性达到最低, 此时在筏架上几乎已经无法发现缘管浒苔的存在(宋伟, 2014)。紫菜筏架早期附着的绿藻优势种为浒苔、肠浒苔, 绿潮初期海面漂浮绿藻有浒苔、肠浒苔和缘管浒苔, 然而在后期大规模绿潮暴发后, 漂浮绿藻主要为浒苔(Zhao et al, 2013; Zhou et al, 2015)。Fan等(2015)报道紫菜筏架上发现有6种绿藻, 而在紫菜养殖过程中, 筏架上的绿藻优势种由扁浒苔、肠浒苔、条浒苔转变为盘苔藻和浒苔。另有研究发现紫菜养殖筏架上收集到的大型绿藻样品主要有浒苔、缘管浒苔、扁浒苔、孔石蒓Ulva pertusa和盘苔藻(Shen et al, 2012; Han et al, 2013), 浒苔在紫菜筏架附着绿藻中的比例从3月至5月逐渐增加, 5月达到40%, 从4月中旬至五月底大约有6500吨的浒苔被释放到海水中, 并成为漂浮绿藻(Wang et al, 2015)。
紫菜养殖筏架附着定生绿藻在不同年度调查中, 表现出不同的生物多样性和生物群落组成。早期生物群落主要由5—6种绿藻组成(表 1), 而后期绿藻生物群落主要由2—3种绿藻组成, 主要为浒苔、盘苔和扁浒苔, 而漂浮绿藻中主要为浒苔。
| 定生绿藻 | 20121 | 20132 | 20153 | 2017 | |
| 浒苔 | Ulva prolifera | √ | √ | √ | √ |
| 盘苔 | Blidingia minima | √ | √ | √ | √ |
| 扁浒苔 | U. compressa | √ | √ | √ | √ |
| 曲浒苔 | U. flexuasa | √ | |||
| 缘管浒苔 | U. linza | √ | √ | √ | |
| 肠浒苔 | U. intestinalis | √ | √ | ||
| 条浒苔 | U. clathrata | √ | √ | ||
| 孔石蒓 | U. pertusa | √ | |||
| 注: 1: 宋伟, 2014; 2:引自Han et al, 2013; 3:引自Fan et al, 2015 | |||||
绿藻生长过程中温度和光照是其最重要的环境因子, 不同种类绿藻有不同的温度和光照适应性(Taylor et al, 2001)。温度是控制大型海藻生长及其各种营养吸收的重要因子, 对藻类的呼吸作用、光合作用及酶活性都有显著影响(Nelson et al, 2008)。曲浒苔具有广温广盐性, 因此在3—5月的紫菜养殖季节中都有曲浒苔的出现。扁浒苔和缘管浒苔在15℃下均具有最快生长率, 缘管浒苔在低温条件下仍然生长较好(Taylor et al, 2001); 由于扁浒苔和缘管浒苔都适应低温和低光照, 因此在3—4月低温季节时是主要优势种。缘管浒苔在10℃和15℃下均生长较快, 但是培养温度一旦超过20℃藻体就较易腐烂, 因此3—5月随着温度的升高, 缘管浒苔逐渐消失。不同培养温度下的研究发现, 浒苔微观繁殖体的最适宜萌发温度是15℃, 缘管浒苔为10℃, 盘苔藻为20℃, 曲浒苔为25℃, 这一结果表明紫菜养殖筏架定生绿藻的群落演替主要受温度影响(宋伟, 2014)。盘苔同样为广温广盐性绿藻, 但是在不同温度下生长速率都明显较低(宋伟, 2014)。吴洪喜等(2000)研究表明, 浒苔的生长温度为10—30℃, 最适生长温度为15—25℃。浒苔、缘管浒苔以及盘苔在不同培养温度下的生长率不同, 单种培养的浒苔在15℃时生长速率最快。浒苔表现出更广的温度适应性, 在低温5℃至高温25℃下其生长率均有增加。在富营养化海域, 浒苔具有形态多样、营养盐吸收和同化能力强的特点(Luo et al, 2012), 且具有广泛的温度和盐度适应性, 从而可以优于其他大型绿藻快速增加生物量(Li et al, 2009)。由此可知, 浒苔具有更广泛的生态适应性, 在不同温度下均表现出较高的生长率。
苏北浅滩上的浒苔由于其特殊的定生环境, 在高潮时于水中进行光合作用而在低潮时暴露在空气中, 因此在紫菜养殖筏架上绿藻的演替不仅与温度相关, 而且与光照和暴露时间等非生物影响因子密切相关。Keesing等(2016)研究表明, 筏架上浒苔的生物量积累与营养盐水平、温度和干出时间具有显著相关性, 而与pH、光照和盐度的变化及浒苔生物量积累不相关。绿藻最大生物量出现在最低氮浓度区, 这表明在氮限制条件下, 温度、光照和暴露时间很重要。黄显军等(2012)研究了浒苔、肠浒苔和扁浒苔在有光照和无光照的条件下的死亡率, 发现干燥时浒苔在耐受性上明显优于肠浒苔和扁浒苔。吴洪喜等(2000)发现浒苔生长的最适光照强度是5000—6000lx, 此时生长最快, 高于10000lx的强光照条件下, 生长又转为减慢, 但藻体生长仍呈正增长。浒苔适应生长季节为5月中旬至6月底, 当温度升到30.8℃, 仍然可以存活, 且可以暴露在极高光照条件下(Liu et al, 2009)。邹定辉等(2004)认为即使失水率达到70%时, 大型藻类仍可保持近59%的光合效率; 在低潮干出状态时, 筏架上的定生浒苔也能进行光合作用但其光合效率会明显下降, 然而在其脱离筏架成为漂浮状态时, 可保持更好的光合作用效率。在本研究中, 5月份海面开始出现斑块状漂浮绿藻, 其中漂浮浒苔所占比例显著高于紫菜养殖筏架上的定生浒苔, 且5月份定生绿藻中浒苔从定生转变为漂浮状态初期, 在船基围隔和滩涂围隔中的生长实验中都表现出极高的相对生长率, 表明浒苔更适应漂浮状态, 通过高生长率可以迅速成为漂浮绿藻中的绝对优势种, 为其暴发绿潮奠定生物量基础。
4 结语通过本研究发现, 紫菜筏架定生绿藻群落的演替变化为随温度升高, 其生物多样性降低。浒苔通常在4—5月份出现, 在定生绿藻中浒苔比例并不占主要优势, 但是由于紫菜养殖筏架附着绿藻特殊的消除方式, 使其从定生转变为漂浮状态, 在此转变过程中, 浒苔表现出极高的生长率和迅速适应的漂浮状态, 因此成为漂浮绿藻中的绝对优势种, 并最终暴发绿潮。因此紫菜筏架早期绿藻的及时处置对于绿潮早期防治具有重要的科学意义。
丁兰平, 栾日孝. 2009. 浒苔(Enteromorpha prolifera)的分类鉴定、生境习性及分布. 海洋与湖沼, 40(1): 68-71 DOI:10.3321/j.issn:0029-814X.2009.01.011 |
丁兰平, 栾日孝, 黄冰心, 等. 2008. 黄海西部、渤海海域盒管藻科Capsosiphonaceae(石莼目Ulvales)的分类研究. 海洋学报, 30(2): 169-174 DOI:10.3321/j.issn:0253-4193.2008.02.021 |
吴洪喜, 徐爱光, 吴美宁. 2000. 浒苔实验生态的初步研究. 浙江海洋学院学报(自然科学版), 19(3): 230-234 DOI:10.3969/j.issn.1008-830X.2000.03.007 |
邹定辉, 阮祚禧, 陈伟洲. 2004. 干出状态下羊栖菜的光合作用特性. 海洋通报. 2004, 23(5): 33-39 |
宋伟, 2014.苏北浅滩定生绿藻的鉴定、生理特征及群落演替研究.长沙: 湖南农业大学博士学位论文
|
黄显军, 骆其君. 2012. 光照与低温对3种浒苔存活的影响. 宁波大学学报(理工版), 25(1): 24-26 DOI:10.3969/j.issn.1001-5132.2012.01.005 |
Blomster J, B ck S, Fewer D P et al, 2002. Novel morphology in Enteromorpha (Ulvophyceae) forming green tides. American Journal of Botany, 89(11): 1756-1763 DOI:10.3732/ajb.89.11.1756 |
Burkholder J M, Tomasko D A, Touchette B W, 2007. Seagrasses and eutrophication. Journal of Experimental Marine Biology and Ecology, 350(1-2): 46-72 DOI:10.1016/j.jembe.2007.06.024 |
Fan S L, Fu M Z, Wang Z L et al, 2015. Temporal variation of green macroalgal assemblage on Porphyra aquaculture rafts in the Subei Shoal, China. Estuarine, Coastal and Shelf Science, 163: 23-28 DOI:10.1016/j.ecss.2015.03.016 |
Fletcher R L, 1996. The occurrence of "green tides"-a review. In:Schramm W, Nienhuis P H eds. Marine Benthic Vegetation. Berlin, Heidelberg:Springer: 7-43 |
Han W, Chen L P, Zhang J H et al, 2013. Seasonal variation of dominant free-floating and attached Ulva species in Rudong coastal area, China. Harmful Algae, 28: 46-54 DOI:10.1016/j.hal.2013.05.018 |
Hu C M, Li D Q, Chen C S et al, 2010. On the recurrent Ulva prolifera blooms in the Yellow Sea and East China Sea. Journal of Geophysical Research:Oceans, 115(C5): C05017 DOI:10.1029/2009JC005561 |
Keesing J K, Liu D Y, Shi Y J et al, 2016. Abiotic factors influencing biomass accumulation of green tide causing Ulva spp. on Pyropia culture rafts in the Yellow Sea, China. Marine Pollution Bulletin, 105(1): 88-97 |
Li R X, Wu X W, Wei Q S et al, 2009. Growth of Enteromorpha prolifera under different nutrient conditions. Advances in Marine Science, 27(2): 211-216 |
Li Y, Song W, Xiao J et al, 2014. Tempo-spatial distribution and species diversity of green algae micro-propagules in the Yellow Sea during the large-scale green tide development. Harmful Algae, 39: 40-47 DOI:10.1016/j.hal.2014.05.013 |
Liu D, Keesing J K, Dong Z et al, 2010. Recurrence of Yellow Sea green tide in June 2009 confirms coastal seaweed aquaculture provides nursery for generation of macroalgal blooms. Marine Pollution Bulletin, 60: 1423-1432 DOI:10.1016/j.marpolbul.2010.05.015 |
Liu D Y, Keesing J K, He P M et al, 2013. The world's largest macroalgal bloom in the Yellow Sea, China:formation and implications. Estuarine, Coastal and Shelf Science, 129: 2-10 DOI:10.1016/j.ecss.2013.05.021 |
Liu D Y, Keesing J K, Xing Q G et al, 2009. World's largest macroalgal bloom caused by expansion of seaweed aquaculture in China. Marine Pollution Bulletin, 58(6): 888-895 DOI:10.1016/j.marpolbul.2009.01.013 |
Luo M B, Liu F, Xu Z L, 2012, Growth and nutrient uptake capacity of two co-occurring species, Ulva prolifera and Ulva linza, Aquatic Botany, 100: 18-24
|
Morand P, Merceron M, 2004. Coastal eutrophication and excessive growth of macroalgae. In: Pandalai S G ed. Recent Research Developments in Environmental Biology, Vol 1(2). Trivandrum, Kerala, India: Research Signpost, 395-449
|
Nelson T A, Haberlin K, Nelson A V et al, 2008. Ecological and physiological controls of species composition in green macroalgal blooms. Ecology, 89(5): 1287-1298 DOI:10.1890/07-0494.1 |
Nelson T A, Lee D J, Smith B C, 2003. Are "green tides" harmful algal blooms? Toxic properties of water-soluble extracts from two bloom-forming macroalgae, Ulva fenestrata and Ulvaria obscura (Ulvophyceae). Journal of Phycology. 2003, 39(5): 874-879 |
Shen Q, Li H Y, Li Y et al, 2012. Molecular identification of green algae from the rafts based infrastructure of Porphyra yezoensis. Marine Pollution Bulletin, 64(10): 2077-2082 DOI:10.1016/j.marpolbul.2012.07.021 |
Son Y B, Min J E, Ryu J H, 2012. Detecting massive green algae (Ulva prolifera) blooms in the Yellow Sea and East China Sea using geostationary ocean color imager (GOCI) data. Ocean Science Journal, 47(3): 359-375 DOI:10.1007/s12601-012-0034-2 |
Taylor R, Fletcher R L, Raven J A, 2001. Preliminary studies on the growth of selected 'green tide' algae in laboratory culture:effects of irradiance, temperature, salinity and nutrients on growth rate. Botanica Marina, 44: 327-336 |
Van Alstyne K L, Nelson T A, Ridgway R L, 2015. Environmental chemistry and chemical ecology of "green tide" seaweed blooms. Integrative and Comparative Biology, 55(3): 518-532 DOI:10.1093/icb/icv035 |
Wang X H, Li L, Bao X et al, 2009. Economic cost of an algae bloom cleanup in China's 2008 Olympic sailing venue. Eos, Transactions American Geophysical Union, 90(28): 238-239 DOI:10.1029/2009EO280002 |
Wang X H, Qiao F L, Lu J et al, 2011. The turbidity maxima of the northern Jiangsu shoal-water in the Yellow Sea, China. Estuarine, Coastal and Shelf Science, 93(3): 202-211 DOI:10.1016/j.ecss.2010.10.020 |
Wang Z L, Xiao J, Fan S L et al, 2015. Who made the world's largest green tide in China?-An integrated study on the initiation and early development of the green tide in Yellow Sea. Limnology and Oceanography, 60(4): 1105-1117 DOI:10.1002/lno.10083 |
Ye N H, Zhang X W, Mao Y Z et al, 2011. 'Green tides' are overwhelming the coastline of our blue planet:taking the world's largest example. Ecological Research, 26(3): 477-485 DOI:10.1007/s11284-011-0821-8 |
Zhang J H, Huo Y Z, Wu H L et al, 2014. The origin of the Ulva macroalgal blooms in the Yellow Sea in 2013. Marine Pollution Bulletin, 89(1-2): 276-283 DOI:10.1016/j.marpolbul.2014.09.049 |
Zhang X W, Xu D, Mao Y Z et al, 2011. Settlement of vegetative fragments of Ulva prolifera confirmed as an important seed source for succession of a large-scale green tide bloom. Limnology and Oceanography, 56(1): 233-242 DOI:10.4319/lo.2011.56.1.0233 |
Zhao J, Jiang P, Liu Z Y et al, 2013. The Yellow Sea green tides were dominated by one species, Ulva (Enteromorpha) prolifera, from 2007 to 2011. Chinese Science Bulletin, 58(19): 2298-2302 DOI:10.1007/s11434-012-5441-3 |
Zhou M J, Liu D Y, Anderson D M et al, 2015. Introduction to the Special Issue on green tides in the Yellow Sea. Estuarine, Coastal and Shelf Science, 163: 3-8 DOI:10.1016/j.ecss.2015.06.023 |
Zhou C Z, Sun G S, 1981. On the genesis of the shoal off north Jiangsu. Marine Geological Research, 1(1): 83-91 |
 2019, Vol. 50
2019, Vol. 50


