中国海洋湖沼学会主办。
文章信息
- 唐启政, 孙志宾, 王新安, 马爱军, 杨双双, 黄智慧. 2019.
- TANG Qi-Zheng, SUN Zhi-Bin, WANG Xin-An, MA Ai-Jun, YANG Shuang-Shuang, HUANG Zhi-Hui. 2019.
- 大菱鲆(Scophthalmus maximus)蛋白质二硫键异构酶SmPDIA3的表达分析和功能验证
- EXPRESSION ANALYSIS AND FUNCTIONAL VERIFICATION OF PROTEIN DISULFIDE ISOMERASE SmPDIA3 IN TURBOT SCOPHTHALMUS MAXIMUS
- 海洋与湖沼, 50(2): 409-419
- Oceanologia et Limnologia Sinica, 50(2): 409-419.
- http://dx.doi.org/10.11693/hyhz20181000247
-
文章历史
- 收稿日期:2018-10-22
- 收修改稿日期:2018-12-06
2. 上海海洋大学水产与生命学院 上海 201306;
3. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室 青岛 266071
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China
蛋白质二硫键异构酶(protein disulfide isomerase, PDI)是一类能够催化蛋白质折叠的酶, 是生物体蛋白质合成过程所必须的(Freedman et al, 1994)。蛋白质二硫键异构酶A3 (protein disulfide isomerase A3, PDIA3), 是蛋白质二硫键异构酶(PDI)家族的一员, 具有催化内质网中蛋白质二硫键形成、氧化还原及异构化的作用(胡玥等, 2015)。PDIA3的二硫键氧化异构活性与其自身所具有的硫氧还原蛋白结构域有关, PDIA3包括4个这样的硫氧还原蛋白区域:两个具有硫氧还原蛋白的活性位点WCGHCK (命名为a-型区域), 另两个区域缺少活性位点(命名为b-型区域)(吕利霞等, 2010)。
PDIA3主要分布于细胞内质网腔, 但其在细胞表面、细胞核和线粒体等不同部位也广泛存在(Turano et al, 2002), 各自发挥不同的作用。例如, PDIA3在精子头部的表面表达, 似乎有助于精卵细胞融合(Ellerman et al, 2006);在血小板表面调控血小板生理功能、血栓形成和生理性止血(王璐, 2012);参与人类肝癌细胞的STAT3信号转导通路(Guo et al, 2002);在FFA诱导的肝细胞脂肪变性和细胞凋亡中起关键作用(Zhang et al, 2015);在用甲基苯丙胺处理原代纹状体神经元后显著上调, 揭示其神经保护作用(Pendyala et al, 2012);核ERp57在体内与黑色素瘤细胞中的DNA片段相互作用, 并可能参与其靶基因的转录调控(Aureli et al, 2013)。
PDIA3蛋白有如此重要的功能, 而迄今未见大菱鲆PDIA3的研究报道。大菱鲆(Scophthalmus maximus)是原产于欧洲的冷温性鱼类, 目前是我国北方沿海重要的海水养殖鱼类, 水体温度是其养殖过程中最重要的环境因子之一, 高温严重影响大菱鲆摄食、生长和体内的各种蛋白酶活性等(高淳仁等, 2006;李勇等, 2011)。针对养殖生产中的一些不利因素, 科研工作者们已经开始了一些基于SNP标记、微卫星标记等标记辅助的分子育种研究, 来提高大菱鲆的种质以应对这些生产实际问题(王婷等, 2014;郭建丽等, 2015)。本文拟克隆大菱鲆SmPDIA3基因cDNA全长, 分析该基因在健康鱼体各组织的表达情况及其在高温胁迫后的表达模式, 并进行了该基因的体外原核重组表达及功能分析, 为了解大菱鲆高温胁迫应答机制提供理论参考。
1 材料与方法 1.1 试验用鱼实验所需大菱鲆饲养于烟台开发区天源水产有限公司, 所选取大菱鲆健康有活力, 平均体重为(250±12.2)g, 均为人工繁育的健康幼鱼。试验前将大菱鲆幼鱼在实验用水池内暂养一周, 确保其能够正常摄食, 暂养期间控制水温为14±0.5℃。暂养与实验期间每天下午5点投喂一次饵料, 保证供氧充足, 每天换1次水。
1.2 主要试剂动物组织总RNA提取试剂盒(RNAprep pure Tissue Kit)、琼脂糖凝胶DNA回收试剂盒(TIANgel Midi Purification Kit)均购自天根生化科技(北京)有限公司; 原核表达载体pET28a (+)、限制性内切酶BamH Ⅰ和Hind Ⅲ、LA-taq酶和RACE试剂盒(SMARTerTM RACE cDNA Amplification Kit)购自宝日医生物技术(北京)有限公司; pEASY-T1载体以及Trans1-T1 Phage Resistant感受态细胞、E. coil transettea(DE3)大肠杆菌感受态细胞、亲和层析树脂填料、反转录试剂盒(TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix)和实时荧光定量试剂盒(TransStart Top Green qPCR SuperMix)购自北京全式金生物技术有限公司; E.Z.N.A.Plasmid Mini kit I小量质粒提取试剂盒购自OMEGA生物工程有限公司; 透析袋MD25 (8000—14000D)、聚乙二醇PEG 20000、BCA蛋白浓度测定试剂盒、DAB法显色试剂盒购自索莱宝生物科技有限公司; 溶菌酶(LZM)测试盒购自南京建成生物工程研究所; 一抗(Anti-6×His rabbit polyclonal antibody)、二抗(HRP- conjugated Goat Anti-Rabbit IgG)及PCR引物均由生工生物工程(上海)股份有限公司合成。
1.3 试验方法 1.3.1 温度胁迫实验随机挑取暂养7d的大菱鲆分为4组:对照组(14℃)、实验组1(20℃)、实验组2(25℃)、实验组3(28℃)。升温方法参考Ndong等(2007), 稍作改动:从正常水温14±0.5℃按每6h增加1℃的速度升至20℃作为实验组1, 然后按每12h增加1℃的速度升至25℃为实验组2, 接着按每24h增加1℃的速度升高至水温28℃为实验组3。对照组和实验组各设3个平行组, 每组投放15尾大菱鲆幼鱼。采用静水法充气培养, 恒温加热棒自动控温, 保证4个温度组同步进行。实验鱼在实验温度下6h后, 每个平行组随机取3尾鱼, 置于解剖盘内, 取肝、皮、鳃等组织于液氮中保存, 用于RNA的提取。
1.3.2 总RNA的提取及cDNA的合成各组织总RNA提取参照总RNA提取试剂盒说明书提取, 提取完成后通过核酸定量仪检测所提取的RNA浓度, 1%琼脂糖凝胶电泳检测所提RNA的完整性, 检测完成后, 将其放置于超低温冰箱中保存。另取肝脏总RNA, 按照RACE试剂盒说明书分别合成用于3′和5′末端PCR扩增的RACE模板, –20℃保存。
1.3.3 引物设计与中心片段序列克隆根据本实验室高温转录组测序所得的PDIA3基因原始序列, 利用Primer Premier5.0软件在保守区域设计引物PDIA3-F与PDIA3-R(表 1), 扩增大菱鲆PDIA3基因的中心片段序列。PCR反应条件如下: 94℃ 5min; 94℃ 30s, 52℃ 30s, 72℃ 30s, 35个循环; 72℃ 5min, 4℃保存。PCR产物经1%琼脂糖凝胶电泳检测后, 将单一的目的条带切胶, 使用琼脂糖凝胶DNA回收试剂盒回收目的片段, 取1μL回收产物与4μL pEASY- T1载体在25℃下连接10min, 然后转化50μL刚解冻的Trans1-T1 Phage Resistant感受态细胞, 加入250μL LB液体培养基37℃、200r/min震荡培养1h, 取200μL菌液涂布LB固体平板(Amp+), 37℃过夜培养进行蓝白斑筛选。第二天挑取白色单菌落接入1mL LB液体培养基中震荡培养6h, 利用菌液PCR验证挑取的菌样, 电泳检测后将条带大小合适的菌液样品送至生工生物工程(上海)有限公司测序。
| 引物名称 | 引物序列(5′—3′) | 用途 |
| PDIA3-F | AGTGGCTACCCAACCCT | 中心片段 |
| PDIA3-R | TCACTTCACGACCACCCTC | |
| PDIA3-F1 | GCTATCTCAAATCCGAGCCCAT | 3′ RACE-PCR |
| PDIA3-F2 | TTGCCAAGATGGACGCCACAGC | |
| PDIA3-R1 | TCTTCGCCACCTTCATCACC | 5′ RACE-PCR |
| PDIA3-R2 | AACCCAACAACACTTGCGTC | |
| UPM(long) | CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT | 通用引物 |
| UPM(short) | CTAATACGACTCACTATAGGGC | |
| PDIA3-RTF | GGAACATTCACCAGCATCAAGATCAAG | RT-PCR |
| PDIA3-RTR | GTCAACGTCATAATAAGCCACCAACAG | |
| β-actin F | GTAGGTGATGAAGCCCAGAGCA | |
| β-actin R | CTGGGTCATCTTCTCCCTGT | |
| ORF(F) | GGTGTGCGATGTTGAGAC | 原核表达 |
| ORF(R) | TGGCTTCAGAGCATTCGG | |
| MP(F) | AATGGGTCGCGGATCCAGTGATGTGCTGGAGTACACGG | |
| MP(R) | GTGCGGCCGCAAGCTTTTATAGCTCAATCCTCTTCTTTTTC |
根据获得的中心片段序列设计PDIA3全长cDNA的3′和5′ RACE特异性引物(表 1)。以1.3.2中cDNA为模板, 分别与引物UPM(long)配对进行3′与5′ RACE第1轮PCR扩增。第1轮PCR反应体系: 10×PCR Buffer 2.0μL, dNTP Mixture (10mmol/L) 3.2μL, PDIA3-F1/PDIA3- R1 (10μmol/L) 0.8μL, UPM (long) 0.8μL, LA Taq酶0.4μL, cDNA 0.4μL, 加ddH2O补至20μL。反应条件为:预变性94℃, 5min; 变性94℃, 30s; 72℃, 3min; 循环5次。变性延伸94℃, 30s;退火70℃, 30s;延伸72℃, 3min; 循环5次。变性延伸94℃, 30s;退火68℃, 30s;延伸72℃, 3min; 循环25次。4℃保存。将第1轮PCR产物稀释10倍用作第2轮PCR的模板, UPM(short)替代UPM(long), PDIA3-F2/PDIA3-R2 (10μmol/L)替代PDIA3-F1/PDIA3-R1 (10μmol/L), 其余组分均不变, 反应条件与第一轮相同, 余下步骤同1.3.3。
1.3.5 SmPDIA3基因的序列分析利用ORF Finder软件(http://www.ncbi.nlm.nih.gov/projects/gorf/orfig.cgi)预测其开放阅读框, 利用EditSeq软件预测其氨基酸序列, 利用ExPASy软件(http://web.expasy.org/compute_pi/)预测其分子量和等电点, 利用在线软件SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/)预测信号肽, 利用在线软件SOPMA (https://prabi.ibcp.fr/htm/site/web/home)预测二级结构, 利用在线软件SWISS-MODEL (https://www.swissmodel.expasy.org/)预测三级结构, 利用DNAMAN软件进行序列同源性比对, 从GenBank (https://blast.ncbi.nlm.nih.gov/Blast.cgi)中下载其他物种的PDIA3基因蛋白质序列, 利用MAGE 6.0软件构建该基因的NJ系统进化树。
1.3.6 实时荧光定量PCR选出上述提取的大菱鲆的肠、鳃、肝脏、皮肤、脾、脑、肾脏和心脏总RNA(每个组织选取3个个体)。使用反转录试剂盒合成cDNA, 放置于–20℃保存。根据PDIA3基因ORF设计引物PDIA3-RTF和PDIA3-RTR(表 1), 以β-actin为内参基因, 利用ABI7300实时荧光定量PCR仪分析大菱鲆PDIA3基因表达量。反应体系为20μL, 包括: 10μL TransStart® Top Green qPCR SuperMix(2×), 0.4μL PDIA3-RTF (10μmol/L), 0.4μL PDIA3-RTR (10μmol/L), 0.4μL ROX Reference DyeI(50×), 1.0μL cDNA, 7.8μL ddH2O。反应程序为: 94℃ 30s; 94℃ 5s, 60℃ 30s, 40个循环; 95℃ 15s, 60℃ 1min, 95℃ 15s。使用2–ΔΔCt法计算PDIA3基因相对表达量, 使用SPSS 11.0软件进行数据差异显著性分析。
1.3.7 SmPDIA3完整ORF质粒克隆载体的构建根据已得到的SmPDIA3序列全长, 利用ORF Finder在线软件找出其ORF区间, 设计引物扩增包含完整ORF在内的1609bp的PCR产物, 引物序列如表 1。PCR体系为20μL, 包括: 2× SeqAmp PCR Buffer 10μL, SeqAmp DNA Polymerase 0.4μL, 无菌水7μL, ORF(F/R) 0.8μL/0.8μL, cDNA 1μL。PCR反应条件如下: 94℃ 5min; 94℃ 30s, 50℃ 30s, 72℃ 30s, 35个循环; 72℃ 5min, 4℃保存。反应产物经1%琼脂糖凝胶电泳检测, 目的条带用琼脂糖凝胶DNA回收试剂盒回收, 回收产物与pEASY-T1载体25℃连接10min后转化Trans5α感受态细胞, 进行蓝白斑筛选。挑取阳性单克隆, 经菌液PCR验证后条带大小合适的菌液样品送至生工生物工程(上海)有限公司测序。将测序结果正确的菌落, 接种于5mL LB液体培养基中(含Amp)扩大培养, 使用OMEGA试剂盒提取质粒。
1.3.8 成熟肽基因的扩增和回收纯化综合分析pET-28a载体的多克隆位点以及SmPDIA3 ORF序列中的限制性内切酶位点, 设计带有酶切位点的表达引物MP(F/R)(表 1), 以1.3.7中提取的质粒作为模板进行PCR扩增, 反应产物经1%琼脂糖凝胶电泳检测, 目的条带用琼脂糖凝胶DNA回收试剂盒回收(PCR体系及反应条件同1.3.7)。
1.3.9 pET-28a载体双酶切构建酶切体系双酶切pET-28a载体, 体系共50μL, 包括: 10×QuickCut Green Buffer 5μL, pET-28a 20μL, BamH Ⅰ / Hind Ⅲ 1μL, ddH2O 23μL。根据BamH Ⅰ和Hind Ⅲ的不同反应温度, 实验时先在体系中加入1μL BamH Ⅰ, 轻轻混匀后瞬时离心, 30℃水浴15min; 再加入1μL Hind Ⅲ, 轻轻混匀后, 37℃水浴15min。反应结束后, 取5μL反应液与5μL未酶切载体, 琼脂糖凝胶电泳检测载体是否切开, 然后回收双酶切载体产物, 准备连接。
1.3.10 成熟肽基因片段与pET-28a载体的连接和转化构建连接体系, 连接成熟肽基因和pET-28a酶切载体, 体系10μL, 包括: 5X In-Fusion HD Enzyme Premix 2μL, DNA fragment 0.5μL, pET-28a载体2μL, ddH2O 5.5μL。轻轻混匀上述试剂, 放入PCR反应仪中, 50℃孵育15min, 然后置于冰上。取2.5μL反应液转入50μL刚解冻的Trans5α感受态细胞中, 冰浴25min; 然后42℃水浴热激30s, 取出放在冰上2min; 加入250μL LB液体培养基(无抗性), 恒温培养箱中37℃、200r/min震荡培养1h;取200μL菌液均匀涂布在LB固体培养基平板(Kan+)上, 37℃恒温过夜培养。第二天挑取单菌落, 接种于LB液体培养基(Kan+)中, 37℃、200r/min恒温培养6h;以菌液为模板, T7和T7ter为通用引物进行PCR, 电泳检测质粒中插入片段的长度大小, 将符合条件的菌液测序。测序结果正确的菌落, 扩大培养后提取质粒, 命名为pET-28a-PDIA3, 分装保存于–20℃备用。
1.3.11 重组质粒转化表达菌株取上述提取的重组质粒pET-28a-PDIA3 1μL转入100μL刚解冻的E. coil transettea(DE3)大肠杆菌感受态细胞中, 冰浴25min, 接着42℃水浴热激30s, 然后立即放在冰上; 取50μL菌液均匀涂布在LB固体培养基上(Kan+), 在37℃恒温培养箱中过夜培养, 第二天挑取阳性菌落接入2mL LB液体培养基(Kan+)中, 37℃、200r/min震荡培养8h, 用以下步实验诱导蛋白表达。同样操作转化pET-28a载体和DE3感受态细胞, 留做空白对照。
1.3.12 pET-28a-PDIA3在大肠杆菌中的诱导表达将目的菌液接种100μL于5mL LB液体培养基中(Kan+), 28℃、150r/min震荡培养至菌液的OD600nm约为0.6时, 吸取1mL作为空白对照, 在剩余的菌液中加入IPTG至终浓度为0.5mmol/L, 两组继续震荡培养6h。将两组菌液各取1mL, 室温5000r/min离心10min收集菌体, 加入320μL的PBS缓冲液充分重悬菌体, 然后在冰浴条件下进行超声波破碎; 超声完成后, 空白组得到细胞破碎液既可, 诱导处理过的菌体破碎液则4℃、12000r/min离心5min, 分别收集上清和沉淀(包涵体)。同样操作处理转化pET-28a空载体的菌液, 收集IPTG诱导前后的细胞破碎液。利用SDS-PAGE凝胶电泳检测pET-28a-PDIA3在大肠杆菌中的主要表达形式。
1.3.13 SDS-PAGE凝胶电泳检测方法将上述收集得到的上清、沉淀(用PBS重悬)及超声破碎的菌液各取40μL, 加入10μL 5×SDS Loading Buffer, 99℃加热10min, 3000r/min离心后放冰上冷却; 将20μL蛋白样品以及10μL蛋白Marker, 依次加入各个点样孔, 连接电泳仪; 电泳程序为120V、约20min, 180V、约40min; 电泳结束后, 小心取出凝胶用0.25%的考马斯亮蓝染液染色2—4h;然后弃去染色液, 用蒸馏水漂洗几次后脱色; 脱色期间可以更换几次脱色液, 待可以观察到清晰的蛋白质条带为止。
1.3.14 目的融合蛋白的分离纯化将目的菌液的培养体系扩增至200mL, 按照温度28℃、转速150r/min、IPTG终浓度0.5mmol/L的条件进行目的蛋白诱导。诱导表达6h后, 参照1.3.12操作收集上清, 用孔径为0.22μm的滤膜进一步去除菌和杂质。得到的上清小心加入装填有镍离子螯合亲和层析树脂填料的柱子中, 反复上样4次后, 将柱子在4℃堵口静置30min, 使目的蛋白和填料更好地结合。然后用30mL预冷的10mmol/L、20mmol/L的咪唑溶液清洗杂蛋白, 用30mL预冷的30mmol/L咪唑溶液, 洗脱目的蛋白, 收集流出液。
1.3.15 目的蛋白的透析、浓缩和浓度测定选择截留分子量为8000—14000Da的透析袋, 剪出3条10cm长的小段, 用含有10mm NaHCO3和1mm EDTA的溶液, 将其煮沸30min进行除杂, 随后用大量无菌水洗净, 将待透析的蛋白溶液加入透析袋中, 两端用透析夹加紧, 防止漏液。放入预冷的PBS缓冲液中, 辅以磁力搅拌器4℃透析, 每12h更换一次透析液, 更换6—7次。透析结束后, 将透析袋取出置于冰上, 正反面均匀铺上PEG 20000白色薄片进行浓缩, 每30min换一次PEG 20000, 直至透析袋内液体体积为3—4mL, 用0.22μm滤膜抽滤除菌, 分装保存。浓缩得到的蛋白溶液, 根据BCA蛋白浓度测定试剂盒说明书的操作方法, 测定其在562nm处的吸收值, 并与标准曲线对比, 即可计算待测蛋白的浓度。
1.3.16 目的蛋白的Western blot检测取20μL 1.3.14中纯化的目的蛋白, 按照1.3.13的步骤进行SDS-PAGE电泳, 电泳结束后, 切除多余凝胶(染料部分和浓缩胶部分)量好尺寸, 将裁切好的凝胶放入提前准备好的预冷的电转液中, 并裁取与凝胶大小相同的PVDF膜以及两块滤纸。PVDF膜需要在甲醇中浸泡十几秒使其带上正电, 随后将膜与滤纸一同放入电转液中, 浸泡十几分钟, 按照阳极、滤纸、PVDF膜、凝胶、滤纸、负极的顺序, 小心转入电转仪, 每放一层注意加入少量的电转液湿润, 并注意赶出气泡, 摆放好后接通电转仪, 15V恒压电转1h。电转完成后, 小心取出膜放入提前准备好的封闭液中, 室温摇床摇动封闭2h。回收封闭液, 将膜放入按照1:5000用抗体稀释液稀释的一抗中, 4℃过夜。回收一抗并洗膜, 用25mL PBST室温下在摇床上摇动洗涤, 每次5min, 重复4次。将洗过的膜, 放入按照1︰10000稀释的二抗中, 室温摇动孵育1h, 重复2次。最后按照DAB显色试剂盒说明书要求, 在暗室将显色工作液加入膜上, 将膜覆盖, 37℃震荡反应10min左右, 即有浅棕色条带出现。
1.3.17 目的蛋白的活性验证余秀娟等(2013)发现包括分子伴侣在内的许多小分子添加剂在变性蛋白体外复性过程中能够起到重要的作用。因而本实验将浓缩得到的SmPDIA3蛋白加入变性溶菌酶的复性体系中, 观察其是否促进变性溶菌酶的正确折叠, 发挥分子伴侣的功能, 从而验证其蛋白活性。实验设计参照贾长虹(2007)及刘慧萍等(1998)稍作改动:取20μL 20mg/mL的溶菌酶溶液加入30μL 1mol/L的DTT、130μL 8mol/L的盐酸胍和20μL 1mol/L的PBS混匀后在37℃、120r/min条件下变性4h, 然后取10μL变性液加水稀释至100μL, 混匀后37℃复性2h, 为实验组1;取10μL变性液加40μL 10mmol/L的GSSG、20μL 10mmol/L的GSH、10μL 1mol/L的PBS和20μL的H2O, 混匀后37℃复性2h, 为实验组2;将实验组2中20μL的H2O替换成20μL的SmPDIA3蛋白作为实验组3;另取10μL 20mg/mL的溶菌酶溶液稀释100倍, 37℃放置6h作为对照组。取四组溶液各20μL, 按照溶菌酶(LZM)测试盒说明书的要求测量它们在530nm处的透光度, 根据各组的透光度, 计算出不同实验组相较于对照组的复性程度。
2 结果 2.1 大菱鲆SmPDIA3基因的cDNA克隆及序列分析大菱鲆PDIA3基因cDNA序列全长为2083bp, 其中开放阅读框为1479bp, 5′非编码区(UTR)和3′非编码区分别为85bp和519bp。其中3′UTR区域含有典型的加尾信号AATAAA和polyA尾(图 1)。该基因ORF可编码一个由492个氨基酸残基组成的蛋白质, 相对分子质量为54.92kDa, 理论等电点为5.40, 包含一个由17个氨基酸组成的信号肽和两个活性位点WCGHCK。目前该基因序列已经提交至NCBI, GenBank登录号: MG765516。
 |
| 图 1 SmPDIA3 cDNA及其编码的氨基酸序列 Fig. 1 The cDNA and deduced amino acids sequence of SmPDIA3 注:起始密码子ATG和终止密码子TAA均用粗线方框标出, WCGHCK活性位点和加尾信号AATAAA分别用灰色阴影和下划线标出, 信号肽用青色阴影标出 |
使用SOPMA在线软件预测蛋白的二级结构, 结果发现SmPDIA3有四种二级结构, 包括36.79%的α螺旋(Alpha helix)、19.51%的β折叠(Extended strand)、38.62%的无规则卷曲(Random coil)和5.08%的β转角(beta turn)。如图 2所示, 蓝线、红线、绿线和紫线分别表示α螺旋、β折叠、β转角和无规则卷曲。
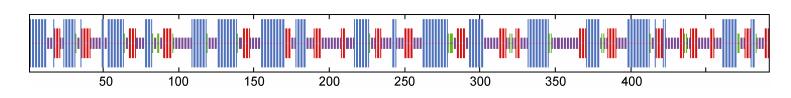 |
| 图 2 SmPDIA3蛋白质的二级结构预测 Fig. 2 The secondary structure of SmPDIA3 subunit protein |
使用SWISS蛋白序列分析软件, 推测出大菱鲆SmPDIA3蛋白的高级结构(图 3)。
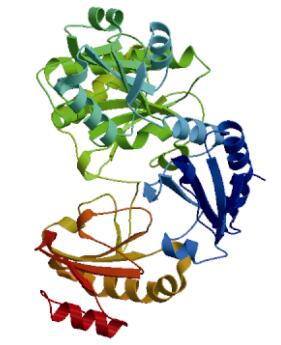 |
| 图 3 SmPDIA3蛋白质的三级结构预测 Fig. 3 The deduced tertiary structure of SmPDIA3 subunit protein |
利用DNAMAN软件对大菱鲆SmPDIA3氨基酸序列与其他物种该蛋白序列比对结果显示:大菱鲆与尖吻鲈和高体 
 |
| 图 4 大菱鲆SmPDIA3与其他物种的氨基酸序列比对 Fig. 4 Amino acid sequence alignment of turbot SmPDIA3 in comparison against those of other species |
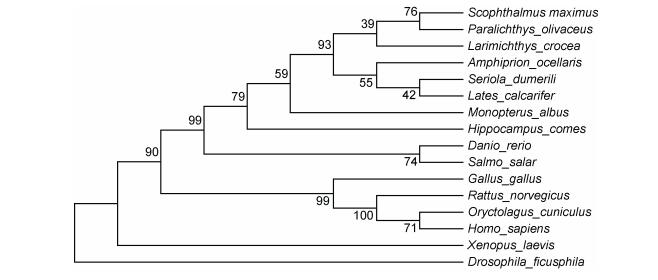 |
图 5 基于SmPDIA3基因氨基酸序列的NJ进化树 Fig. 5 The NJ tree based on SmPDIA3 gene amino acid sequences 注: Scophthalmus maximus:大菱鲆(MG765516); Paralichthys olivaceus:牙鲆(XM_020079362.1); Lates calcarifer:尖吻鲈(XM_018685667.1); Monopterus albus:黄鳝(XM_020625350.1); Amphiprion ocellaris:眼斑双锯鱼(XM_023272623.1); Hippocampus comes:虎尾海马(XM_019873978.1); Danio rerio:斑马鱼(BC044524); Salmo salar:大西洋鲑(FJ457023); Xenopus laevis:非洲爪蟾(NM_001086582.1); Gallus gallus:原鸡(NM_204110.3); Rattus norvegicus:褐家鼠(NM_017319.1); Oryctolagus cuniculus:家兔(NM_001171315.1); Homo sapiens:智人(NM_005313.4); Drosophila ficusphila:黑腹果蝇(XM_017194392.1); Seriola dumerili:高体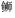 (XP_022612013.1)、Larimichthys crocea:大黄鱼(XP_010733510.1)
(XP_022612013.1)、Larimichthys crocea:大黄鱼(XP_010733510.1)
|
利用RT-PCR技术分析大菱鲆SmPDIA3基因在肝脏、鳃、皮肤、肠、肾脏、心脏、脾、脑8个组织中的相对表达量(图 6), 结果显示, PDIA3基因在各种组织中广泛表达, 但表达量存在显著差异。其中在肝脏中表达量最高(P < 0.05), 肠和鳃次之, 在脑中表达量最低。
 |
| 图 6 大菱鲆SmPDIA3基因在不同组织中的表达分布状况 Fig. 6 The expression of the SmPDIA3 gene in different tissues |
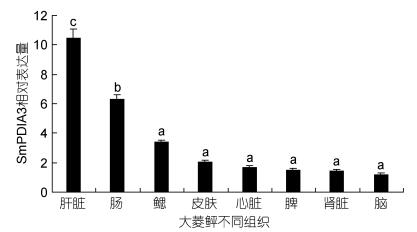
不同温度胁迫后, SmPDIA3在肠和肝脏组织中的相对表达量总体呈上调表达趋势, 在25℃时有所下降, 在28℃时达到最大值(图 7)。
 |
| 图 7 大菱鲆SmPDIA3基因在肝脏和肠组织中高温胁迫后的表达变化情况 Fig. 7 The expression of PDIA3 gene of turbot in the liver and intestine after thermal stress |
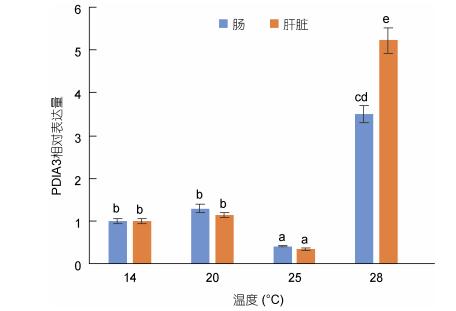
电泳结果如图 8所示, pET-28a-PDIA3转化的DE3大肠杆菌经IPTG诱导后, 总蛋白在44.3—66.4kDa之间有一条特异性条带, 符合我们对表达蛋白的预测结果(56kDa), 且目的蛋白主要在上清中表达; 对上清进行纯化后, 得到的目的蛋白条带单一, Western blot检测结果显示, 重组的pIgR-ED蛋白可以与anti His-tag的IgG发生特异性的免疫反应, 进一步说明重组蛋白得到了正确的表达及纯化。
 |
| 图 8 蛋白表达结果检测 Fig. 8 Detection of protein expression 注: M:蛋白Maker; 1:细胞破碎液(pET-28a, 未诱导); 2:细胞破碎液(pET-28a, 诱导); 3:细胞破碎液(pET-28a-PDIA3, 未诱导); 4:细胞破碎液(pET-28a-PDIA3, 诱导); 5:上清(pET-28a-PDIA3, 诱导); 6:沉淀(pET-28a-PDIA3, 诱导); 7:纯化后的目的蛋白; 8:纯化后的蛋白Western blot结果 |
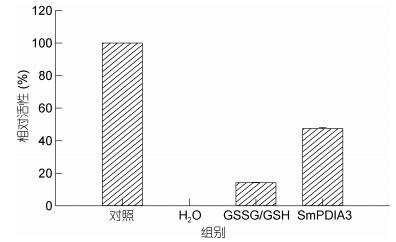
利用BCA蛋白浓度测定试剂盒测定浓缩蛋白的浓度为243.18μg/mL。由图 9结果可知, 溶菌酶变性4h后完全失活, 而在复性体系中添加CON一定量的氧化还原剂(GSSG/GSH)则能稍微促进溶菌酶的复性, 复性率为14.12%;当在氧化还原剂存在的条件下加入浓缩的SmPDIA3蛋白则能显著提高其复性率, 达到47.42%, 比只有氧化还原剂存在时提高了3.36倍。上述结果表明了SmPDIA3蛋白在溶菌酶的复性过程中起到了明显的分子伴侣功能。
 |
| 图 9 溶菌酶的复性结果 Fig. 9 The lysozyme renaturation results |
研究中, SmPDIA3基因在大菱鲆肝脏和肠中的表达量随着温度的升高先升高再降低再升高, 在28℃时达到最大值。目前PDIA3在鱼类肠道中的作用还没有研究, 但已有学者发现其可能在小鼠肠粘膜中通过介导树突状细胞激活T淋巴细胞, 导致肠黏膜的异常免疫应答, 从而促进肠易激综合征(IBS)的发生(马丽娟等, 2011; Zhuang et al, 2015)。另一方面, Chen等(2011)发现, 黄鳍鲷肝组织暴露于甲基对硫磷后, 其PDIA3表达水平增加; Huang等(2009)发现大西洋鲑鱼PDIA3 mRNA主要在肝脏中表达, 高锰酸钾氧化条件下, 其肝脏中PDIA3含量显著增加; Sever等(2013)发现虹鳟PDIA3在肝脏和卵子中具有最高表达, 在响应免疫刺激如双链RNA或植物血凝素时上调。因此可以推测, 大菱鲆受到高温胁迫时, PDIA3在肠和肝脏中的上调差异表达可能与其免疫功能及氧化还原功能相关, 对鱼体高温应激起到重要作用。
本研究利用原核表达技术, 将克隆得到的SmPDIA3基因成熟肽序列连接到pET-28a(+)载体上, 再转入DE3感受态细胞中进行诱导表达, 最后得到分子量约为56kDa的重组蛋白, 与刘群等(2015)对日本血吸虫PDIA3蛋白的原核表达研究结果相似。不同的是, 本研究中SmPDIA3蛋白主要在上清中表达, 而日本血吸虫PDIA3蛋白则主要以包涵体的形式存在于沉淀中。分析原因, 虽然两者使用同样的载体和表达菌, 但是诱导条件不同。本研究中诱导表达时温度为28℃、IPTG终浓度为0.5mmol/L, 而刘群等诱导时温度为37℃、IPTG终浓度为1mmol/L, 猜测是因为较高的温度和IPTG浓度使目的蛋白表达过快, 导致二硫键配对混乱, 造成大量的重组目的蛋白不能正确折叠, 从而以聚集的形式表达形成没有生物活性的包涵体沉淀。
本研究通过变性溶菌酶的复性实验对SmPDIA3蛋白进行了功能验证, 结果证明在变性蛋白的复性过程中, 该蛋白可作为分子伴侣辅助变性蛋白的正确折叠, 从而发挥着重要的作用。因其显著的分子伴侣功能, 推测其可作为包涵体透析复性的重要添加剂, 或作为有效的蛋白质促进剂用于生产中大规模的蛋白复性。目前关于体外原核表达PDIA3蛋白的研究很多, 但对其蛋白功能的报道较少, 本研究可为进一步探索PDIA3蛋白的功能提供一定的思路和研究基础。
4 结论本研究利用RACE技术首次克隆了大菱鲆SmPDIA3基因cDNA全长序列, 通过qPCR分析了其在大菱鲆不同组织中的分布情况及不同温度胁迫下在肠和肝脏中的表达变化, 然后构建原核表达载体在上清中表达了SmPDIA3目的蛋白, 并通过Western blot技术验证了目的蛋白的准确性, 利用BCA蛋白浓度测定方法得到浓缩蛋白的浓度, 最后通过溶菌酶的复性实验验证了SmPDIA3蛋白的分子伴侣功能。该研究为分析大菱鲆应答高温胁迫的分子机理奠定基础, 为大菱鲆耐高温遗传育种新标记的开发提供新的理论基础和研究方向, 并为PDIA3蛋白功能的研究拓宽了思路。
马丽娟, 吕宾, 孟立娜, 等. 2011. PDIA3在腹泻型肠易激综合征患者结肠黏膜中的蛋白表达及其意义. 胃肠病学, 16(4): 218-221 DOI:10.3969/j.issn.1008-7125.2011.04.007 |
王婷, 黄智慧, 马爱军, 等. 2014. 基于转录组数据的大菱鲆(Scophthalmus maximus)SNP标记开发及多态性分析. 海洋与湖沼, 45(6): 1300-1307 |
王璐, 2012.蛋白二硫键异构酶ERp57调控血小板活化和血栓形成的作用及其机制研究.苏州: 苏州大学硕士学位论文
|
吕利霞, 汤睿智, 邢万金. 2010. PDIA3的结构与功能及其在精卵融合过程中的作用. 生物技术通报, 49(3): 31-34, 49 |
刘群, 段明明, 苑纯秀, 等. 2015. 日本血吸虫PDIA3的原核表达和多抗血清制备. 中国动物传染病学报, 23(1): 33-38 DOI:10.3969/j.issn.1674-6422.2015.01.007 |
刘慧萍, 陈苏民, 1998.蛋白质二硫键异构酶结构域的克隆与活性研究.见: 材料科学与工程技术论文集.北京: 中国科学技术协会
|
李勇, 孙国祥, 柳阳, 等. 2011. 温度对高密度循环海水养殖大菱鲆摄食、生长及消化酶的影响. 渔业科学进展, 32(6): 17-24 DOI:10.3969/j.issn.1000-7075.2011.06.003 |
余秀娟, 赵丽艳, 张晓光. 2013. 体外蛋白质复性方法及小分子添加剂在复性过程中的作用. 河北北方学院学报(自然科学版), 29(2): 9-15 DOI:10.3969/j.issn.1673-1492.2013.02.004 |
胡玥, 陶丽媛, 吕宾. 2015. 蛋白质二硫键异构酶A3--疾病治疗的新靶点. 中国病理生理杂志, 31(6): 1145-1149 DOI:10.3969/j.issn.1000-4718.2015.06.032 |
贾长虹, 2007.人工伴侣与小分子添加剂协同辅助变性溶菌酶复性的研究.天津: 天津大学硕士学位论文
|
高淳仁, 王印庚, 马爱军, 等. 2006. 温度对大菱鲆幼鱼生长、成活率和体内蛋白酶活性的影响. 海洋水产研究, 27(6): 33-36 |
郭建丽, 田岳强, 马爱军, 等. 2015. 大菱鲆(Scophthalmus maximus)抗鳗弧菌(Vibrio anguillarum)性状的微卫星分子标记研究. 海洋与湖沼, 46(1): 157-164 |
Aureli C, Gaucci E, Arcangeli V et al, 2013. ERp57/PDIA3 binds specific DNA fragments in a melanoma cell line. Gene, 524(2): 390-395 DOI:10.1016/j.gene.2013.04.004 |
Chen H B, Huang H Q, 2011. Proteomic analysis of methyl parathion-responsive proteins in Sparus latus liver. Fish & Shellfish Immunology, 30(3): 800-806 |
Ellerman D A, Myles D G, Primakoff P, 2006. A role for sperm surface protein disulfide isomerase activity in gamete fusion: evidence for the participation of ERp57. Developmental Cell, 10(6): 831-837 DOI:10.1016/j.devcel.2006.03.011 |
Freedman R B, Hirst T R, Tuite M F, 1994. Protein disulphide isomerase: building bridges in protein folding. Trends in Biochemical Sciences, 19(8): 331-336 DOI:10.1016/0968-0004(94)90072-8 |
Guo G G, Patel K, Kumar V et al, 2002. Association of the chaperone glucose-regulated protein 58 (GRP58/ER-60/ERp57) with Stat3 in cytosol and plasma membrane complexes. Journal of Interferon & Cytokine Research, 22(5): 555-563 |
Huang T S, Olsvik P A, Krøvel A et al, 2009. Stress-induced expression of protein disulfide isomerase associated 3 (PDIA3) in Atlantic salmon (Salmo salar L.). Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 154(4): 435-442 DOI:10.1016/j.cbpb.2009.08.009 |
Ndong D, Chen Y Y, Lin Y H et al, 2007. The immune response of tilapia Oreochromis mossambicus and its susceptibility to Streptococcus iniae under stress in low and high temperatures. Fish & Shellfish Immunology, 22(6): 686-694 |
Pendyala G, Ninemire C, Fox H S, 2012. Protective role for the disulfide isomerase PDIA3 in methamphetamine neurotoxicity. PLoS One, 7(6): e38909 DOI:10.1371/journal.pone.0038909 |
Sever L, Bols N C, Dixon B, 2013. The cloning and inducible expression of the rainbow trout ERp57 gene. Fish & Shellfish Immunology, 34(2): 410-419 |
Turano C, Coppari S, Altieri F et al, 2002. Proteins of the PDI family: unpredicted non-ER locations and functions. Journal of Cellular Physiology, 193(2): 154-163 DOI:10.1002/(ISSN)1097-4652 |
Zhang X Q, Pan Y, Yu C H et al, 2015. PDIA3 knockdown exacerbates free fatty acid-induced hepatocyte steatosis and apoptosis. PLoS One, 10(7): e0133882 DOI:10.1371/journal.pone.0133882 |
Zhuang Z M, Wang X T, Zhang L et al, 2015. The effect of PDIA3 gene knockout on the mucosal immune function in IBS rats. International Journal of Clinical and Experimental Medicine, 8(5): 6866-6877 |
 2019, Vol. 50
2019, Vol. 50


