中国海洋湖沼学会主办。
文章信息
- 王朋鹏, 张芳, 孙松. 2019.
- WANG Peng-Peng, ZHANG Fang, SUN Song. 2019.
- 白色霞水母(Cyanea nozakii)摄食行为与消化时间研究
- FEEDING BEHAVIORS AND DIGESTION TIME OF CYANEA NOZAKⅡ
- 海洋与湖沼, 50(4): 864-875
- Oceanologia et Limnologia Sinica, 50(4): 864-875.
- http://dx.doi.org/10.11693/hyhz20181200300
文章历史
-
收稿日期:2018-12-20
收修改稿日期:2019-04-11
2. 青岛海洋科学与技术试点 国家实验室 海洋生态与环境科学功能实验室 青岛 266071;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋 大科学研究中心 青岛 266071;
5. 中国科学院海洋研究所 山东胶州湾海洋生态系统国家野外科学观测研究站 青岛 266071
2. Laboratory of Marine Ecology and Environmental Sciences, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
5. Jiaozhou Bay Marine Ecosystem Research Station, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China
自1990年以来, 全球很多海域中水母数量显著增多(Arai, 2001; Condon et al, 2013), 我国所处的东亚水域也是重灾区之一(孙松等, 2012)。我国近海暴发的大型水母种类主要有沙海蛰(Nemopilema nomurai)、霞水母(Cyanea spp.)、海月水母(Aurelia coerulea)、多管水母(Aequorea spp.)等(Zhang et al, 2012; Sun et al, 2015)。水母暴发已给所在海域的生态、经济、社会带来了严重影响, 如暴发水母对浮游动物、仔稚鱼的大量摄食, 造成海洋生态系统能量截留, 导致渔业资源衰退; 堵塞网孔、损害渔网, 危及渔业发展; 另外, 水母暴发堵塞冷却水设施, 蜇伤游客的报道屡见不鲜(Purcell et al, 2001a, b; Dong et al, 2006; 董婧等, 2013; 张芳等, 2017)。霞水母在我国渤海及长江口附近沿岸海域曾有过暴发的现象(Xian et al, 2005; Dong et al, 2006)。其中以白色霞水母(Cyanea nozakii)数量最多、分布最广、危害最大(董婧等, 2013), 针对此种水母我国学者从其形态分类与分布(周永东等, 2004; 董婧等, 2005, 2006; 王彬等, 2014; 左涛等, 2016)及其室内生态与生活史(Dong et al, 2006, 2008; 董婧等, 2012; 孙明等, 2012a; Sun et al, 2013; Feng et al, 2015)等方面做了较为详细的研究; 另外很多学者对于白色霞水母在生态系统中与鱼类及其他浮游动物所存在的复杂关系进行了研究(严利平等, 2004; 董婧等, 2013)。
由于白色霞水母食性广泛, 其大量出现给中国近海鱼类以及浮游动物带来巨大的摄食压力, 因此, 摄食关系自然引起学者的广泛关注。国内外学者较多关注于海月水母(Aurelia aurita), 从其自身摄食行为、饵料生物行为等方面全面揭示了海月水母摄食机制(Bailey et al, 1983; Purcell, 1983; Titelman et al, 2007; Hosia et al, 2011; 刘春胜等, 2016), 但对于白色霞水母的摄食机制我们缺乏深入了解。另外, 在野外环境中通过对水母胃含物分析的方法来确定其对于周围饵料生物的摄食率是精确估计水母对浮游动物摄食压力的重要手段, 但饵料生物在水母胃中会存在一定的转化时间, 定性与定量研究水母对饵料生物的消化时间就显得尤为重要(Uye et al, 2005; Purcell, 2009)。对于水母消化时间的研究, 在国外已有很多报道, 诸如海月水母(Aurelia aurita)、发形霞水母(Cyanea capillata)、五卷须金黄水母(Chrysaora quinquecirrha)、兜水母(Bolinopsis)、水螅水母等(Bailey et al, 1983; Heeger et al, 1987; Martinussen et al, 1999; Martin et al, 2001), 针对白色霞水母还未见有关消化时间的报道。
因此, 本文以不同密度的卤虫无节幼体为饵料, 观察在不同时间段白色霞水母触手丝伸缩、游动状态的变化; 以胶质类生物(水螅水母和海月水母)、桡足类、鱼类、卤虫无节幼体为饵料研究白色霞水母消化时间, 旨在揭示白色霞水母自身的摄食行为以及影响水母消化时间的因素, 以期为更全面了解该种水母的摄食机制提供帮助, 为在野外环境中定性与定量研究霞水母摄食率提供基础数据。
1 材料方法 1.1 实验动物霞水母(下文中无特指霞水母指白色霞水母)于2017年6月中下旬出海调查时在胶州湾外海采集, 伞径范围为1.7—23cm。霞水母采集完毕立即将其转移到实验室120—240L圆柱型玻璃培养箱中, 培养所用海水为过滤海水, 温度恒定在18—20℃, 盐度30—31, 每天定量投喂卤虫无节幼体, 实验室培养状态良好。霞水母摄食实验所用饵料生物为海月水母、卤虫无节幼体、桡足类、水螅水母、鱼类。桡足类、水螅水母于胶州湾海域使用浮游生物浅水Ⅱ型网(网孔径160μm, 网口面积0.08m2)从底到表采集, 采集完毕到实验室立即将浮游动物在解剖镜下分类挑选[桡足类(0.7±0.2)、(2.5±0.4)mm、水螅水母(2±0.5)mm], 并分别放入20L的培养箱中进行培养至实验; 海月水母碟状体以及水母体均为中科院海洋所水母实验室自行培育; 鱼类为牙鲆, 青岛养殖场获得, 将其放置在实验室1000L水体中培养, 培养过程中充氧气, 每天定量投喂轮虫, 第二天将死亡的鱼苗吸走, 并换三分之一的水体, 保证水体无污染, 所用海水温度恒定在19℃左右, 盐度为30—31。
1.2 实验过程 1.2.1 霞水母摄食状态为研究霞水母摄食状态, 将其触手丝长度、伞径收缩频率(游动状态)作为测量指标。容积为240L的6个玻璃培养箱中分别放置伞径(8±0.6)cm的霞水母各一只, 饥饿处理24h, 培养过程发现培养箱不会影响霞水母触手丝正常伸缩, 记录24h后霞水母触手丝初始状态并用卷尺测量长度。24h后将事先准备好的不同密度的卤虫无节幼体分别投喂到5个培养箱中(平行组), 另一个培养中不放置卤虫无节幼体作为对照组; 每隔一段时间分别记录霞水母触手丝的变化状态并测量触手丝的长度, 5个平行组取测量平均值, 时间持续24h。卤虫无节幼体密度设置为1、10、50和500ind./L (过量投喂)。于此同时, 对霞水母伞径收缩频率(/min)进行测量, 具体为每隔一段时间记录各个培养箱中霞水母伞径收缩次数, 每次计数持续10min。实验过程避免充气, 排除充气过程对水母摄食行为带来的影响, 但实验所用为水循环培养箱, 可以充分保证饵料的均匀分布, 实验温度恒定在18—20℃, 且整个实验过程处于正常灯光条件下, 无黑暗与特殊光照处理。
1.2.2 霞水母消化时间本实验分为三部分: (1)饵料种类对霞水母消化时间的影响; (2)饵料大小对霞水母消化时间的影响; (3)霞水母伞径大小对消化时间的影响。实验开始前, 所用霞水母24h内不进行任何投喂, 保证胃排空, 并提前放置到指定的实验所用培养箱中适应2h, 观察霞水母在其不受扰动的情况下能够自由正常游动为宜, 测量并记录实验所用霞水母、饵料生物的大小。每一类饵料生物采取人工喂养方式, 对于卤虫无节幼体、桡足类、水螅水母、海月水母碟状体采用剪掉末端的胶状滴管进行投喂, 对于海月水母体以及牙鲆采用镊子进行投喂, 投喂成功标准为定量的饵料生物(5ind.)进入到霞水母胃中。为追踪霞水母消化情况, 每隔3—5min进行一次观察, 直至完全消化。完全消化标准为卤虫无节幼体、桡足类、水螅水母、海月水母在霞水母胃中无斑块状存在, 牙鲆眼部消失并且鱼骨完全裸露。实验至少进行三个重复, 所有实验均在实验室过滤海水中进行, 温度恒定18.5℃, 盐度30—32, 具体实验条件见表 1-3。
| 摄食者 | 摄食者大小(cm) | 摄食者个数(ind.) | 饵料 | 饵料大小(mm) | 饵料个数(ind.) | 温度(℃) | 容器大小(L) |
| 霞水母 | |||||||
| 6.1±0.4 | 3 | 卤虫无节幼体 | 0.5±0.1 | 5 | 18.5 | 15 | |
| 6.1±0.4 | 3 | 桡足类 | 0.7±0.2 | 5 | 18.5 | 15 | |
| 6.1±0.4 | 3 | 海月碟状体 | 3.0±0.5 | 5 | 18.5 | 15 | |
| 6.1±0.4 | 3 | 水螅水母 | 2.5±0.3 | 5 | 18.5 | 15 | |
| 6.1±0.4 | 3 | 牙鲆幼体 | 3.3±0.4 | 5 | 18.5 | 15 | |
| 注:饵料个数指每一个霞水母所投喂的饵料个数 | |||||||
| 摄食者 | 摄食者大小(cm) | 摄食者个数(ind.) | 饵料 | 饵料大小(mm) | 饵料个数(ind.) | 温度(℃) | 容器大小(L) |
| 霞水母 | 海月水母 | ||||||
| 8.2±0.6 | 3 | 3.0±0.5 | 5 | 18.5 | 15 | ||
| 8.2±0.6 | 3 | 10.2±3.1 | 5 | 18.5 | 15 | ||
| 8.2±0.6 | 3 | 21.1±5.0 | 5 | 18.5 | 15 | ||
| 8.2±0.6 | 3 | 40.4±9.7 | 5 | 18.5 | 15 | ||
| 霞水母 | 桡足类 | ||||||
| 4.5±0.3 | 6 | 0.7±0.2 | 5 | 18.5 | 15 | ||
| 4.5±0.3 | 6 | 2.5±0.4 | 5 | 18.5 | 15 | ||
| 霞水母 | 牙鲆 | ||||||
| 6.1±0.4 | 3 | 3.3±0.4a | 5 | 18.5 | 15 | ||
| 6.1±0.4 | 3 | 5.4±0.4b | 5 | 18.5 | 15 | ||
| 6.1±0.4 | 3 | 11.2±0.5c | 5 | 18.5 | 15 | ||
| 注: a:开口期; b:开始摄食卤虫无节幼体阶段; c:变态发育前期 | |||||||
| 摄食者 | 摄食者大小(cm) | 摄食者个数(ind.) | 饵料 | 饵料大小(mm) | 饵料个数(ind.) | 温度(℃) | 容器大小(L) |
| 霞水母 | 卤虫无节幼体 | ||||||
| 2.2±0.1 | 5 | 0.5±0.1 | 5 | 18.5 | 15 | ||
| 4.5±0.3 | 6 | 0.5±0.1 | 5 | 18.5 | 15 | ||
| 6.1±0.4 | 3 | 0.5±0.1 | 5 | 18.5 | 15 | ||
| 8.2±0.6 | 3 | 0.5±0.1 | 5 | 18.5 | 15 | ||
| 14.5±1.1 | 4 | 0.5±0.1 | 5 | 18.5 | 15 | ||
| 霞水母 | 桡足类 | ||||||
| 2.2±0.1 | 5 | 0.7±0.2 | 5 | 18.5 | 15 | ||
| 4.5±0.3 | 6 | 0.7±0.2 | 5 | 18.5 | 15 | ||
| 6.1±0.4 | 3 | 0.7±0.2 | 5 | 18.5 | 15 | ||
| 8.2±0.6 | 3 | 0.7±0.2 | 5 | 18.5 | 15 | ||
| 14.5±1.1 | 4 | 0.7±0.2 | 5 | 18.5 | 15 |
利用Excel和SPSS15.0统计分析软件对各项数据进行整理和分析。对于霞水母在不同饵料环境下伞径收缩频率的差异性采取T-test, 显著性差异水平设为P < 0.05;对于霞水母对不同饵料消化时间的差异性分别用Kolmogorov-Smirnov检验和Levene检验分析各组数据内的组内正态分布检验和组间方差齐性检验, 利用One-Way ANOVA分析不同实验组的差异显著性; 统计学显著性差异水平设为P < 0.05。
2 结果 2.1 触手丝与伞径收缩频率变化霞水母触手丝在不同密度的卤虫无节幼体刺激下, 状态表现不一(图 1):密度较低时(1ind./L), 实验开始15—20min后长度由18cm陡增到65cm, 随即下降并保持稳定; 密度为10ind./L, 触手丝在6min时长度由15cm陡增到77cm, 4h后开始下降, 之后保持在20—27cm; 密度为50ind./L时触手丝变化与前者类似; 密度为500ind./L, 触手丝瞬间由18cm伸长到72cm, 随后下降到36cm, 4h时后又出现上升, 在4—10h间维持在60cm以上, 10h后开始下降。表明饵料密度较低时, 霞水母触手丝完全伸展; 密度过量时(500ind./L),周围饵料较充足, 触手丝处于收缩状态。图 2表示在不同饵料密度刺激下霞水母伞径在不同时间收缩频率(/min)变化, 饵料密度同样为1、10、50和500ind./L。T-test结果显示, 在本实验所设计饵料密度刺激下, 霞水母在不同时间段伞径收缩频率无明显差异(P=0.981 > 0.05)。
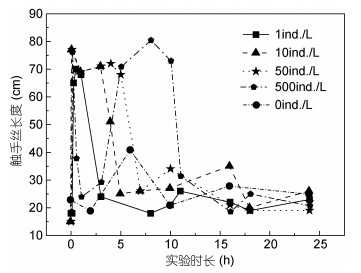 |
| 图 1 不同卤虫无节幼体密度刺激下霞水母触手丝平均长度(cm)随时间的变化 Fig. 1 Changes in the mean length of tentacles with time in different concentrations of Artemia nauplius 注:不同图标表示卤虫无节幼体密度的不同, 0ind./L表示不加卤虫无节幼体作为对照组 |
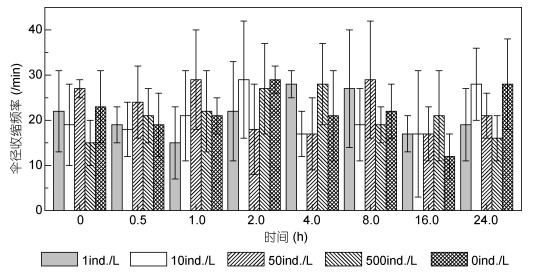 |
| 图 2 不同卤虫无节幼体密度刺激下霞水母[伞径(8±0.6)cm]伞径收缩频率(/min)随时间的变化 Fig. 2 of swim pulse frequency with time in different concentrations of Artemia nauplius 注:不同柱体表示投喂卤虫无节幼体密度的不同, 0ind./L表示不加卤虫无节幼体作为对照组 |
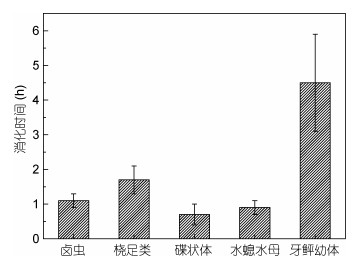
不同饵料生物对霞水母消化时间的影响, 伞径均值为6.1cm的霞水母对水螅水母、海月水母碟状体的消化时间分别为(0.9±0.2)、(0.7±0.3)h; 对卤虫无节幼体、桡足类的消化时间分别为(1.1±0.2)、(1.7±0.4)h; 对牙鲆幼体消化时间为(4.5±1.4)h (表 4)。大小无差异的饵料生物, 霞水母对于胶质类生物[海月碟状体(3.0±0.5)mm、水螅水母(2.5±0.3)mm]的消化时间要显著低于鱼类[(3.3±0.4)mm]; 即使胶质类生物体长大于桡足类[(0.7±0.2)mm], 对其消化时间同样显著小于桡足类, 且与对卤虫无节幼体的消化时间无明显差异(图 3, 表 5); 对于牙鲆的消化时间最长, 要显著高于其他饵料生物(表 5)。
| 饵料 | 饵料大小(mm) | 霞水母大小(cm) | 消化时间(mean±SD, h) |
| 卤虫无节幼体 | |||
| 0.5±0.1 | 2.2±0.1 | 1.3±0.5 | |
| 0.5±0.1 | 4.5±0.3 | 1.1±0.4 | |
| 0.5±0.1 | 6.1±0.4 | 1.1±0.2 | |
| 0.5±0.1 | 8.2±0.6 | 1.2±0.4 | |
| 0.5±0.1 | 14.5±1.1 | 0.9±0.1 | |
| 桡足类 | |||
| 0.7±0.2 | 2.2±0.1 | 2.1±0.5 | |
| 0.7±0.2 | 4.5±0.3 | 1.8±0.6 | |
| 0.7±0.2 | 6.1±0.4 | 1.7±0.4 | |
| 0.7±0.2 | 8.2±0.6 | 1.7±0.8 | |
| 0.7±0.2 | 14.5±1.1 | 1.9±0.7 | |
| 2.5±0.4 | 4.5±0.3 | 3.1±1.1 | |
| 海月水母 | |||
| 3.0±0.5 | 8.2±0.6 | 0.9±0.4 | |
| 10.2±3.1 | 8.2±0.6 | 2.4±0.6 | |
| 21.1±5.0 | 8.2±0.6 | 3.8±1.2 | |
| 40.4±9.7 | 8.2±0.6 | 6.7±1.8 | |
| 3.0±0.5 | 6.1±0.4 | 0.7±0.3 | |
| 水螅水母 | |||
| 2.5±0.3 | 6.1±0.4 | 0.9±0.2 | |
| 牙鲆 | |||
| 3.3±0.4 | 6.1±0.4 | 4.5±1.4 | |
| 5.4±0.4 | 6.1±0.4 | 5.8±1.5 | |
| 11.2±0.5 | 6.1±0.4 | 8.2±2.7 |
| P值 | |||||
| 卤虫无节幼体 | 桡足类 | 海月碟状体 | 水螅水母 | 牙鲆幼体 | |
| 卤虫无节幼体 | 0.001 | 0.117 | 0.328 | < 0.001 | |
| 桡足类 | < 0.001 | < 0.001 | < 0.001 | ||
| 海月碟状体 | 0.731 | < 0.001 | |||
| 水螅水母 | < 0.001 | ||||
| 注: df=44, F=131.13 | |||||
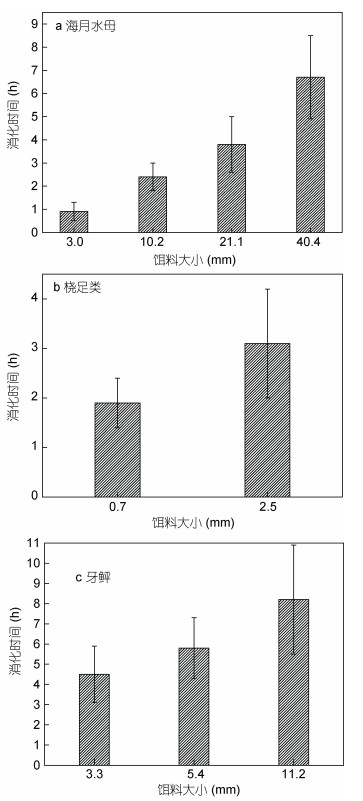
饵料大小对霞水母消化时间的影响, 实验发现, 当海月水母伞径由(3.0±0.5)mm增加到(40.4±9.7)mm时, 消化时间由(0.9±0.4)h增加到(6.7±1.8)h (图 4a); 当桡足类由(0.7±0.2)mm增加到(2.5±0.4)mm时, 消化时间由(1.8±0.6)h增加到(3.1±1.1)h (图 4b); 当牙鲆由(3.3±0.4)mm增加到(11.2±0.5)mm时, 消化时间由(4.5±1.4)h增加到(8.2±2.7)h (图 4c)。对于同一饵料生物, 饵料越大消化时间越长。
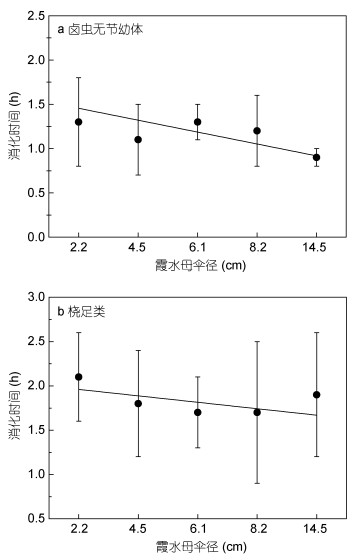
霞水母大小对消化时间的影响, 实验发现以卤虫无节幼体为饵料时, 霞水母伞径由2.2cm增加到14.5cm消化时间由(1.3±0.5)h下降到(0.9±0.1)h, 消化时间呈显著线性变化(df=4, F=10.1911, R2=0.6967, P=0.0496, 图 5a); 以桡足类为饵料时, 霞水母消化时间随伞径变化并不显著(df=4, F=1.4547, R2=0.1023, P=0.3143, 图 5b)。
水母作为海洋中重要的捕食者其摄食行为具有很强的选择性(Båmstedt, 1990), 这种选择性受到很多因素的影响, 诸如食物的粒径、游泳速度、逃逸能力, 摄食者的大小、游动能力、对水流的感知、刺细胞毒性等(Båmstedt, 1990; Purcell, 1992; Ford et al, 1997; Suchman et al, 2000; Titelman et al, 2006)。不同水母类群其摄食行为也会有很大差异, 霞水母密集而细长的触手丝遍布于口腕周围成为其摄食中的有利“武器”, 触手丝在水中自由伸缩进行觅食, 一旦触碰到猎物便会迅速出击(Suchman et al, 2000), Fraser(1969)将这种摄食方式定义为“伏击性摄食”。为研究这种摄食行为, 不同密度的卤虫无节幼体作为饵料观察霞水母触手丝的变化, 当水中饵料密度较低时(1ind./L), 霞水母[(8±0.6)cm]一旦触碰到周围猎物, 处于收缩状态的触手丝(18cm)便开始逐渐伸长, 最长可达70cm以上, 这使得霞水母与周围饵料的相遇几率大幅度提升, 增加了霞水母觅食空间, 即使在较低的饵料密度下也可以有效地进行摄食, 在1—3h后水中饵料密度几乎降低为0ind./L, 霞水母触手丝会慢慢恢复到原有的收缩状态(18—26cm, 图 1); 而不进行任何饵料的投喂霞水母触手丝会一直处于较稳定的收缩状态(图 1)。据此推测, 霞水母长时间处于无饵料状态下其触手丝会维持在收缩状态, 但其一旦发觉周围有食物出现触手丝会迅速向各个方向伸长, 通过此种方式来扩展其摄食空间, 据此推测, 这也许是霞水母为节省能量而进行的最有效摄食举措。当饵料密度升至10ind./L或50ind./L时同样证实了这种推测, 霞水母触手丝在伸长后分别在4h与6h开始收缩, 之后便维持在较稳定的收缩状态(图 1)。当饵料处于过量状态(500ind./L)时, 霞水母触手丝在短暂的伸长后开始收缩, 在4h时又出现上升, 在4—10h间维持在60cm以上, 10h后开始下降(图 1), 作者认为, 当霞水母周围饵料较丰富时, 此段时间根本无需通过触手丝的伸长来扩展摄食空间, 霞水母可以毫不费力便可摄食到较多的食物; 但在4h后水中饵料密度下降到较低状态, 此时霞水母不得不通过触手丝伸长来提高摄食效率。正是对周围食物密度的感知, 霞水母在水体中通过不断调整触手丝伸长与收缩来达到一种较为高效的摄食状态。实验中同样发现食物刺激对于霞水母的游动状态并无显著影响, 无论食物密度较低或过量, 其伞径收缩频率保持在较稳定状态(图 2)。在水体中, 食物会处于一种不定向的随机游动状态, 对水母这种被动摄食者而言, 增加与食物的相遇几率是提高其摄食成功率的关键(Bailey et al, 1983), 本研究发现即使周围饵料密度低至1ind./L, 霞水母并不是通过调整其自身的游动状态来增加与饵料的相遇几率, 而是通过触手丝的伸张来拓展摄食空间, 此种摄食行为正是“伏击性捕食者”的体现(Suchman et al, 2000; Titelman et al, 2007)。
霞水母与海月水母摄食行为大有不同, 海月水母主要通过伞径不停收缩、游动来增加与饵料生物的相遇几率, 通过其伞径边缘短而密集的触手丝在水中不断过滤海水从而达到摄食目的(Bailey et al, 1983; Stoecker et al, 1987), Fraser(1969)将这种摄食方式定义为“巡航式捕食”。Bailey等(1983)用鲱鱼幼体(鱼卵孵化后10—15天)作为饵料研究海月水母摄食行为时发现海月水母一旦触碰到第一个食物其伞径收缩频率明显加快, 使其游动速度增加, 并且在不同水层出现的频率明显增加, 当水母体摄食到较多食物时其游动速度又会下降, 这也充分证明海月水母主要是通过调整在水中的游动速度与状态来增加与饵料生物的相遇几率。在野外环境中海月水母与霞水母都会不停地游动(Costello et al, 1998), 水母体游动所产生的扰动信号会使得潜在饵料生物躲避摄食者所经过的区域(Suchman et al, 2000), 这样霞水母触手丝的作用就会有比较明显的体现。Suchman等(2000)曾指出水母触手丝的主要作用是用来伏击快速移动的食物像仔稚鱼、桡足类, 还有部分反应较慢的饵料生物也会被伸长的触手丝有效的拦截。
外界环境同样对水母的摄食行为具有重要影响, 诸如温度、水流、容器大小等(Purcell, 1983; Olesen, 1995; Purcell et al, 1995; Hansson, 2006), 因此, 实验室环境下应尽可能降低对水母摄食行为产生的影响。Olesen(1995)对海月水母研究时发现, 随温度升高伞径收缩频率逐渐增加, 但在15℃后趋于稳定, 本研究发现霞水母伞径收缩频率在16—17℃达到最大值, 之后稳定在25/min左右, 因此温度恒定在18—20℃, 可排除其对霞水母伞径收缩带来的影响; 此外, 实验中发现充气过程会直接影响霞水母的正常游动, 无论产生的气泡或气流都会导致霞水母产生形变, 这对霞水母伞径收缩及触手丝伸展会产生直接影响, 因此, 本研究采用循环水装置, 在保证饵料均匀分布基础上, 匀速循环的水流可降低对霞水母摄食行为的影响, 且120—240L圆柱型玻璃培养箱不会影响霞水母触手丝的正常伸展。光照作为影响水母生长发育的重要条件, 无论对底栖水螅体的横裂, 还是浮游水母体的垂直迁移都具有重要影响(Hamner et al, 1994; Ishii et al, 2003; 孙明等, 2012b), 但对于水母摄食行为方面的影响鲜有文献参考, 本研究对光照未进行特殊处理, 为排除光照对水母摄食行为的影响, 所有实验均在实验室正常灯光条件下进行。
3.2 饵料种类、大小及霞水母大小对消化时间的影响前人对于水母消化时间的研究多是采用先让水母体在水体中摄食一段时间后再进行消化时间的观测, 此种方法很难定量被摄食的饵料个数, 而且在摄食饵料这段时间内消化过程已经在进行(Martinussen et al, 1999), 这样可能造成结果上的偏差。本研究采取人工投喂饵料的方法, 在极短的时间内定量的饵料即可被霞水母所摄食, 当饵料生物成功进入到水母胃中时开始计时, 此种方法可以避免霞水母通过自身摄食定量的饵料所带来的消化时间上的不统一。另外, 饵料个数也是影响水母消化时间的重要因素, 随着水母胃中饵料个数的增加其消化时间也会延长, 预实验发现当饵料少于5ind.消化时间过快而不利于观测, 当饵料大于5ind.消化时间过长, 因此为正确对比霞水母对不同饵料生物的消化时间, 本研究将饵料生物个数定量为5ind.。
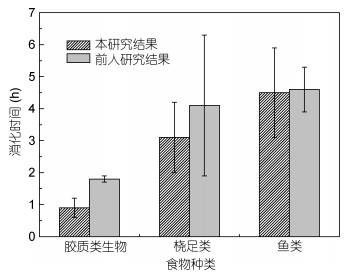
本研究发现饵料种类与大小都是影响霞水母消化时间的重要因素, 但霞水母作为捕食者自身的大小对消化时间的影响受饵料种类的不同而有差异。对于饵料种类来说, 霞水母对于胶质类生物的消化时间要明显低于桡足类、鱼类, 这与国外学者对发形霞水母(Cyanea capillata)研究结果类似(图 6)。作者推测当野外温度为18.5—22℃时, 诸如水螅水母等胶质类生物在霞水母胃中平均存留时间为(0.9±0.2)h, 小型桡足类[(0.73±0.25)mm]平均存留时间为(2.8±1.2)h, 大型桡足类[(2.25±0.33)mm]平均存留时间为(3.6±0.7)h, 仔稚鱼平均存留时间为(4.9±0.6)h。Fraser(1969)曾指出饵料生物的物质组成决定了水母对其的消化时间, 这同样被Martinussen等(1999)所证实, 胶质类生物很多组织是由中胶质组成, 因此更容易被消化(Purcell, 1991), 对于桡足类外被壳质, 其外壳的坚硬程度自然能够影响水母对其的消化时间(Uye et al, 2005), 胶质类生物易于消化的特性也成为霞水母喜食的一个重要因素。
对于饵料大小来说, 当海月水母伞径由3mm增加到40.4mm, 霞水母对其消化时间大约增加6h;桡足类由0.7mm增加到2.5mm, 消化时间增加1—1.4h;牙鲆由3.3mm增加到11.2mm, 消化时间增加3.7h (图 4, 表 4)。海月水母与发形霞水母同样存在此种规律, 以发形霞水母为例, 当飞马哲水蚤(Calanus finmarchicus)体长由0.5—1mm增加到2.04mm, 发形霞水母对其消化时间增加4h (Martinussen et al, 1999;Martin et al, 2001);当海月水母由40mm增加到110mm, 发形霞水母对其消化时间增加将近18h (Loginova et al, 1967)。Hansson(1997)研究发现, 11— 20cm发形霞水母也可将230mm海月水母完全消化, 虽然时间较长(32h), 本研究同样发现白色霞水母可以完全消化等同于自身甚至大于自身大小的海月水母, 对于比自身大的海月水母我们发现它会从伞径边缘、口腕等比较薄弱的部分开始慢慢蚕食, 而对于伞径较小的海月水母会将其完全包裹, 这也是霞水母对不同大小饵料生物的摄食策略。
对霞水母伞径大小对消化时间的影响来说, 以卤虫为饵料发现随伞径增大(2.2—14.5cm)消化时间呈线性下降(图 5a), 但以桡足类为饵料发现伞径大小对消化时间无显著影响(图 5b); Martinussen等(1999)以卤虫无节幼体为饵料研究海月水母伞径大小(4—15cm)对消化时间的影响时发现伞径大小对其消化时间无显著影响, 但以飞马哲水蚤为饵料发现二者之间存在y=16.953x–0.553(x:伞径大小; y:消化时间); Uye等(2005)分别以纺锤蚤(Acartia), 中华哲水蚤(Calanus sinicus)为饵料同样发现不同伞径的海月水母(2—30cm)消化时间无显著差异。这表明水母作为捕食者自身伞径大小对消化时间的影响会因饵料种类的不同而有差异。作者推测霞水母、海月水母消化系统在幼体阶段已发育成熟, 使得水母体在成长过程中对饵料生物的消化时间基本保持一致, 水母幼体阶段便对食物就有高效的消化效率也是其成为海洋中掠夺式摄食者的重要体现。
3.3 温度对于消化时间的影响水母消化时间同样会受到温度的影响, 当温度升高时消化时间会下降(Heeger et al, 1987; Martin et al, 2001), 我们并未研究白色霞水母消化时间与温度之间的关系, 但从前人研究结果来看, 海月水母与发形霞水母都具有如此规律(表 6)。例如:海月水母以大西洋鲱鱼(Clupea harengus)为饵料, 发形霞水母以飞马哲水蚤为饵料, 研究发现随温度升高水母消化时间均呈线性下降(Heeger et al, 1987; Martinussen et al, 1999; Martin et al, 2001)。另外大部分研究者将温度范围定在4—22℃之间(表 6), 但在野外环境中水母存在时温度要高于22℃, 水母消化时间是否会在一个温度节点维持不变还需要后续研究, 作者认为在做此研究时要根据水母存在海域的实际条件来进行实验设计。由于不同学者之间的研究在实验条件(温度、饵料种类、饵料个数等)设置上的不同, 要想准确对比不同水母之间消化时间较为不易。即使同一种类水母个体之间的消化时间也有较大差异, 我们在实验中发现不同白色霞水母个体对桡足类[(2.5±0.4)mm]的消化时间最大有1.1h的差异, 对牙鲆的消化时间最大有2.7h的差异, Martinussen等(1999)研究发形霞水母对海月水母消化时间时发现最短与最长消化时间更是有25.2h的差异, Purcell(1983)认为消化时间的差异可以反映酶功能以及代谢率的差异, 她在对管水母研究时发现消化率随呼吸率的提高而增加, 这说明不同水母体之间酶功能与代谢功能必然存在很大不同。
| 捕食者 | 捕食者大小 (cm) |
食物 | 食物大小 (mm) |
食物个数 (ind.) |
温度 (℃) |
容器大小 (L) |
消化时间 (h) |
文献 |
| 海月水母 (Aurelia aurita) |
||||||||
| 桡足类 | ||||||||
| 0.95±0.12 | Calanus finmarchicus | 2.04±0.19 | 3 | 5 | 0.3 | 23.10±2.73 | Martin et al, 2001 | |
| 1.28±0.19 | C. finmarchicus | 2.04±0.19 | 3 | 10 | 0.3 | 4.45±0.89 | Martin et al, 2001 | |
| 1.03±0.14 | C. finmarchicus | 2.04±0.19 | 3 | 15 | 0.3 | 2.63±0.80 | Martin et al, 2001 | |
| 1.25±0.22 | C. finmarchicus | 2.04±0.19 | 3 | 20 | 0.3 | 4.62±1.12 | Martin et al, 2001 | |
| 0.43—5.40 | C. finmarchicus | 2.34 | 1 | 9.5 | 0.3 | 3.74 | Martinussen et al, 1999 | |
| - | C. finmarchicus | - | - | 7 | - | 24 | Arai, 1997 | |
| 1.36±0.17 | Temora longicornis | 0.76±0.09 | 3 | 5 | 0.3 | 4.67±1.52 | Martin et al, 2001 | |
| 1.49±0.17 | T. longicornis | 0.76±0.09 | 3 | 10 | 0.3 | 6.26±0.94 | Martin et al, 2001 | |
| 1.37±0.98 | T. longicornis | 0.76±0.09 | 3 | 15 | 0.3 | 6.61±1.17 | Martin et al, 2001 | |
| 1.25±0.24 | T. longicornis | 0.76±0.09 | 3 | 20 | 0.3 | 2.33±0.58 | Martin et al, 2001 | |
| 0.87—1.30 | T. longicornis | 1.00 | 1 | 9.5 | 0.3 | 3.21 | Martinussen et al, 1999 | |
| 3.00 | Copepod | - | 1 | 7 | - | 3.50 | Sullivan et al, 1994 | |
| 0.45—1.35 | Pseudocalanus elongatus | 0.14 | 1 | 9.5 | 0.3 | 3.7 | Martinussen et al, 1999 | |
| 10.00 | Acartia omorii | 0.50 | - | 19 | - | 1 | Uye et al, 2005 | |
| 10.00 | Oithona davisae | 0.50 | - | 19 | - | 1 | Uye et al, 2005 | |
| 鱼类 | ||||||||
| < 5.00 | Clupea harengus | 幼体 | 1 | 12 | 6 | 2.5 | Fraser, 1969 | |
| 2.00—7.50 | C. harengus | 10.96 | 1—4 | 9.5 | 0.3 | 3.68 | Martinussen et al, 1999 | |
| 1.80—2.40 | C. harengus | 7—9 | 10 | 5 | 1 | 18.9 | Heeger et al, 1987 | |
| 1.80—2.40 | C. harengus | 7—9 | 10 | 10 | 1 | 12.2 | Heeger et al, 1987 | |
| 1.80—2.40 | C. harengus | 7—9 | 10 | 15 | 1 | 8.2 | Heeger et al, 1987 | |
| 1.80—2.40 | C. harengus | 7—9 | 10 | 22 | 1 | 3.8 | Heeger et al, 1987 | |
| < 5.00 | C. harengus | 5—7 | 1 | 11 | - | 5 | Möller, 1984 | |
| 1.20—1.40 | C. harengus | 11 | - | 11.5 | 5 | 4—6 | Bailey et al, 1983 | |
| 其他 | ||||||||
| < 5.00 | Mytilus sp. | 30 | 1 | 12 | 6 | 12 | Fraser, 1969 | |
| 0.35—1.45 | Artemia | 0.53 | 1—8 | 9.5 | 0.3 | 1.45 | Martinussen et al, 1999 | |
| 发形霞水母 (Cyanea capillata) |
||||||||
| 桡足类 | ||||||||
| 0.20—10.00 | Copepod | - | - | - | 22 | 1.7 | Fancett, 1988 | |
| 0.35—0.80 | C. finmarchicus | 2.04 | 1 | 5 | 0.3 | 23.26 | Martin et al, 2001 | |
| 0.56—1.14 | C. finmarchicus | 2.04 | 1 | 10 | 0.3 | 20.34 | Martin et al, 2001 | |
| 0.46—0.76 | C. finmarchicus | 2.04 | 1 | 15 | 0.3 | 8.07 | Martin et al, 2001 | |
| 0.64—1.28 | C. finmarchicus | 2.04 | 1 | 20 | 0.3 | 6.55 | Martin et al, 2001 | |
| 3.70—10.60 | C. finmarchicus | > 1.00 | 5 | 9.5 | 0.3 | 2.01 | Martinussen et al, 1999 | |
| 3.70—9.40 | C. finmarchicus | 0.50—1.00 | 5 | 9.5 | 0.3 | 1.52 | Martinussen et al, 1999 | |
| 0.46—1.10 | T. longicornis | 0.76±0.09 | 3 | 5 | 0.3 | 22.70 | Martin et al, 2001 | |
| 0.46—1.18 | T. longicornis | 0.76±0.09 | 3 | 10 | 0.3 | 21.88 | Martin et al, 2001 | |
| 0.64—1.28 | T. longicornis | 0.76±0.09 | 3 | 15 | 0.3 | 10.60 | Martin et al, 2001 | |
| 0.70—1.80 | T. longicornis | 0.76±0.09 | 3 | 20 | 0.3 | 5.62 | Martin et al, 2001 | |
| 鱼类 | ||||||||
| 0.20—10.00 | Fish eggs | - | - | - | 22 | 5.3 | Fancett, 1988 | |
| 胶质类 | ||||||||
| 3.40—29.00 | Aurelia aurita | 16—270 | 1 | 9.5 | 0.3—40 | 15.1 | Martinussen et al, 1999 | |
| 8.50 | A. aurita | 70 | - | 7—12 | - | 9.5 | Plotnikova, 1961 | |
| 10 | A. aurita | 40 | - | - | - | 6 | Loginova et al, 1967 | |
| 15 | A. aurita | 150 | - | - | - | 20—25 | Loginova et al, 1967 | |
| 11—20 | A. aurita | 230 | - | 15—17 | 300 | 32 | Hansson, 1997 | |
| 3.6—11.6 | Bolinopsis infundibulum | 13—80 | 1 | 9.5 | 0.3—2 | 1.85 | Martinussen et al, 1999 | |
| 3.6—11.6 | Phialella quadrata | 7—24 | 1 | 9.5 | 0.3—2 | 1.75 | Martinussen et al, 1999 | |
| 其他 | ||||||||
| 0.53—0.82 | Balanus nauplii | 0.78 | 1 | 5 | 4.66 | 4.66 | Martinussen et al, 1999 |
霞水母在水中主要通过调整触手丝的收缩与伸展来扩大其摄食范围, 增加与饵料生物的相遇几率, 而非调整其游动状态, 这是“伏击式”捕食者的主要摄食方式, 与海月水母“巡航式”的摄食方式截然不同。影响水母消化时间的因素有很多, 饵料种类与大小对霞水母的消化时间具有显著影响, 霞水母对胶质类生物的消化时间要显著低于桡足类、鱼类, 但与卤虫的消化时间无显著差异; 对于同一种饵料, 随饵料生物增大霞水母消化时间逐渐增加; 霞水母伞径大小对消化时间影响因饵料种类不同而有差异。
王彬, 李玉龙, 沈鸿, 等. 2014. 2005~2013年辽东湾北部近海白色霞水母的数量分布. 海洋渔业, 36(2): 146-154 DOI:10.3969/j.issn.1004-2490.2014.02.008 |
左涛, 王俊, 吴强, 等. 2016. 2015年5月黄海及东海北部大型水母分布及生物量估算. 海洋与湖沼, 47(1): 195-204 |
刘春胜, 庄志猛, 陈四清, 等. 2016. 三种大型钵水母幼体对牙鲆和许氏平鲉仔稚鱼的捕食选择性. 中国水产科学, 23(2): 436-446 |
孙松, 于志刚, 李超伦, 等. 2012. 黄、东海水母暴发机理及其生态环境效应研究进展. 海洋与湖沼, 43(3): 401-405 |
孙明, 董婧, 王爱勇. 2012a. 光照强度对白色霞水母(Cyanea nozakii Kishinouye)无性繁殖的影响. 海洋与湖沼, 43(3): 562-567 |
孙明, 董婧, 付志璐, 等. 2012b. 光照度对海月水母螅状体存活和生长的影响. 水产科学, 31(4): 211-215 |
严利平, 李圣法, 丁峰元. 2004. 东海、黄海大型水母类资源动态及其与渔业关系的初探. 海洋渔业, 26(1): 9-12 DOI:10.3969/j.issn.1004-2490.2004.01.002 |
张芳, 李超伦, 孙松, 等. 2017. 水母灾害的形成机理、监测预测及防控技术研究进展. 海洋与湖沼, 48(6): 1187-1195 |
周永东, 刘子藩, 薄治礼, 等. 2004. 东、黄海大型水母及其调查监测. 水产科技情报, 31(5): 224-227 DOI:10.3969/j.issn.1001-1994.2004.05.018 |
董婧, 姜连新, 孙明, 等. 2013. 渤海与黄海北部大型水母生物学研究. 北京: 海洋出版社, 175-205
|
董婧, 孙明, 王彬. 2012. 盐度对白色霞水母(Cyanea nozakii Kishinouye)生长和横裂生殖的影响. 海洋与湖沼, 43(3): 556-561 |
董婧, 王彬, 刘春洋. 2006. 白色霞水母各发育阶段的形态. 水产学报, 30(6): 761-766 |
董婧, 刘春洋, 李文泉, 等. 2005. 白色霞水母的形态与结构. 水产科学, 24(2): 22-23 |
Arai M N, 1997. A Functional Biology of Scyphozoa. London: Chapman and Hall, 92-112
|
Arai M N, 2001. Pelagic coelenterates and eutrophication:a review. Hydrobiologia, 451(1-3): 69-87 |
Bailey K M, Batty R S, 1983. A laboratory study of predation by Aurelia aurita on larval herring (Clupea harengus):experimental observations compared with model predictions. Marine Biology, 72(3): 295-301 DOI:10.1007/BF00396835 |
Båmstedt U, 1990. Trophodynamics of the scyphomedusae Aurelia aurita. Predation rate in relation to abundance, size and type of prey organism. Journal of Plankton Research, 12(1): 215-229 |
Condon R H, Duarte C M, Pitt K A et al, 2013. Recurrent jellyfish blooms are a consequence of global oscillations. Proceedings of the National Academy of Sciences of the United States of America, 110(3): 1000-1005 DOI:10.1073/pnas.1210920110 |
Costello J H, Klos E, Ford M D, 1998. In situ time budgets of the scyphomedusae Aurelia aurita, Cyanea sp. and Chrysaora quinquecirrha. Journal of Plankton Research, 20(2): 383-391 DOI:10.1093/plankt/20.2.383 |
Dong J, Liu C Y, Wang Y Q et al, 2006. Laboratory observations on the life cycle of Cyanea nozakii (Semeostomida, Scyphozoa). Acta Zoologica Sinica, 52(2): 389-395 |
Dong J, Sun M, Wang B et al, 2008. Comparison of life cycles and morphology of Cyanea nozakii and other scyphozoans. Plankton and Benthos Research, 3(S1): 118-124 |
Fancett M S, 1988. Diet and prey selectivity of scyphomedusae from Port Phillip Bay, Australia. Marine Biology, 98(4): 503-509 DOI:10.1007/BF00391541 |
Feng S, Zhang G T, Sun S et al, 2015. Effects of temperature regime and food supply on asexual reproduction in Cyanea nozakii and Nemopilema nomurai. Hydrobiologia, 754(1): 201-214 DOI:10.1007/s10750-015-2279-0 |
Ford M D, Costello J H, Heidelberg K B et al, 1997. Swimming and feeding by the scyphomedusa Chrysaora quinquecirrha. Marine Biology, 129(2): 355-362 |
Fraser J H, 1969. Experimental feeding of some medusae and chaetognatha. Journal of the Fisheries Research Board of Canada, 26(7): 1743-1762 DOI:10.1139/f69-161 |
Hamner W M, Hamner P P, Strand S W, 1994. Sun-compass migration by Aurelia aurita (Scyphozoa):population retention and reproduction in Saanich Inlet, British Columbia. Marine Biology, 119(3): 347-356 DOI:10.1007/BF00347531 |
Hansson L J, 1997. Capture and digestion of the scyphozoan jellyfish Aurelia aurita by Cyanea capillata and prey response to predator contact. Journal of Plankton Research, 19(2): 195-208 DOI:10.1093/plankt/19.2.195 |
Hansson L J, 2006. A method for in situ estimation of prey selectivity and predation rate in large plankton, exemplified with the jellyfish Aurelia aurita (L. ). Journal of Experimental Marine Biology and Ecology, 328(1): 113-126 DOI:10.1016/j.jembe.2005.07.002 |
Heeger T, Mller H, 1987. Ultrastructural observations on prey capture and digestion in the scyphomedusa Aurelia aurita. Marine Biology, 96(3): 391-400 DOI:10.1007/BF00412523 |
Hosia A, Titelman J, 2011. Intraguild predation between the native North Sea jellyfish Cyanea capillata and the invasive ctenophore Mnemiopsis leidyi. Journal of Plankton Research, 33(3): 535-540 DOI:10.1093/plankt/fbq106 |
Ishii H, Shioi H, 2003. The effects of environmental light condition on strobilation in Aurelia aurita polyps. Sessile Organisms, 20(2): 51-54 DOI:10.4282/sosj.20.51 |
Loginova N P, Perzova N M, 1967. Some data on ecology of feeding pelagic coelenterata in the White Sea. Issledovanie Fauny Morei, 7: 21-28 |
Martin M B, Bmstedt U, 2001. Digestion rate in relation to temperature of two gelatinous planktonic predators. Sarsia, 86(1): 21-35 DOI:10.1080/00364827.2001.10420458 |
Martinussen M B, B mstedt U, 1999. Nutritional ecology of gelatinous planktonic predators. Digestion rate in relation to type and amount of prey. Journal of Experimental Marine Biology and Ecology, 232(1): 61-84 |
Möller N, 1984. Reduction of a Larval Herring Population by Jellyfish Predator. Science, 224(4649): 621-622 DOI:10.1126/science.224.4649.621 |
Olesen N J, 1995. Clearance potential of jellyfish Aurelia aurita, and predation impact on zooplankton in a shallow cove. Marine Ecology Progress Series, 124: 63-72 DOI:10.3354/meps124063 |
Plotnikova E D, 1961. On the diet of medusae in the littoral of eastern Murman. In: Kamshilov M ed. Hydrological and Biological Features of the Shore Waters of Murman. Murmansk: Akademia Nauk SSSR, 153-166
|
Purcell J E, 1983. Digestion rates and assimilation efficiencies of siphonophores fed zooplankton prey. Marine Biology, 73(3): 257-261 DOI:10.1007/BF00392251 |
Purcell J E, 1991. A review of cnidarians and ctenophores feeding on competitors in the plankton. Hydrobiologia, 216(1): 335-342 |
Purcell J E, 1992. Effects of predation by the scyphomedusan Chrysaora quinquecirrha on zooplankton populations in Chesapeake bay, USA. Marine Ecology Progress Series, 87: 65-76 DOI:10.3354/meps087065 |
Purcell J E, 2009. Extension of methods for jellyfish and ctenophore trophic ecology to large-scale research. Hydrobiologia, 616(1): 23-50 DOI:10.1007/s10750-008-9585-8 |
Purcell J E, Arai M N, 2001a. Interactions of pelagic cnidarians and ctenophores with fish:a review. Hydrobiologia, 451(1-3): 27-44 |
Purcell J E, Cowan Jr J H, 1995. Predation by the scyphomedusan Chrysaora quinquecirrha on Mnemiopsis leidyi ctenophores. Marine Ecology Progress Series, 129: 63-70 DOI:10.3354/meps129063 |
Purcell J E, Sturdevant M V, 2001b. Prey selection and dietary overlap among zooplanktivorous jellyfish and juvenile fishes in Prince William Sound, Alaska. Marine Ecology Progress Series, 210: 67-83 DOI:10.3354/meps210067 |
Stoecker D K, Michaels A E, Davis L H, 1987. Grazing by the jellyfish, Aurelia aurita, on microzooplankton. Journal of Plankton Research, 9(5): 901-915 DOI:10.1093/plankt/9.5.901 |
Suchman C L, Sullivan B K, 2000. Effect of prey size on vulnerability of copepods to predation by the scyphomedusae Aurelia aurita and Cyanea sp. Journal of Plankton Research, 22(12): 2289-2306 DOI:10.1093/plankt/22.12.2289 |
Sullivan B K, Garcia J R, Klein-Macphee G, 1994. Prey selection by the scyphomedusan predator Aurelia aurita. Marine Biology, 121(2): 335-341 DOI:10.1007/BF00346742 |
Sun M, Dong J, Chai Y et al, 2013. Effect of temperature and feeding frequency on asexual reproduction and polyp growth of the scyphozoan Cyanea nozakii Kishinouye. Acta Ecologica Sinica, 33(10): 3222-3232 DOI:10.5846/stxb |
Sun S, Zhang F, Li C L et al, 2015. Breeding places, population dynamics, and distribution of the giant jellyfish Nemopilema nomurai (Scyphozoa:Rhizostomeae) in the Yellow Sea and the East China Sea. Hydrobiologia, 754(1): 59-74 DOI:10.1007/s10750-015-2266-5 |
Titelman J, Gandon L, Goarant A et al, 2007. Intraguild predatory interactions between the jellyfish Cyanea capillata and Aurelia aurita. Marine Biology, 152(4): 745-756 DOI:10.1007/s00227-007-0721-1 |
Titelman J, Hansson L J, 2006. Feeding rates of the jellyfish Aurelia aurita on fish larvae. Marine Biology, 149(2): 297-306 DOI:10.1007/s00227-005-0200-5 |
Uye S, Shimauchi H, 2005. Population biomass, feeding, respiration and growth rates, and carbon budget of the scyphomedusa Aurelia aurita in the Inland Sea of Japan. Journal of Plankton Research, 27(3): 237-248 DOI:10.1093/plankt/fbh172 |
Xian W W, Kang B, Liu R Y, 2005. Jellyfish blooms in the Yangtze Estuary. Science, 307(5706): 41 |
Zhang F, Sun S, Jin X S et al, 2012. Associations of large jellyfish distributions with temperature and salinity in the Yellow Sea and East China Sea. Hydrobiologia, 690(1): 81-96 DOI:10.1007/s10750-012-1057-5 |
 2019, Vol. 50
2019, Vol. 50