中国海洋湖沼学会主办。
文章信息
- 刘美剑, 赵子明, 刘明, 陈苏南, 郑翔隆, 林阿朋, 宫庆礼. 2020.
- LIU Mei-Jian, ZHAO Zi-Ming, LIU Ming, CHEN Su-Nan, ZHENG Xiang-Long, LIN A-Peng, GONG Qing-Li. 2020.
- 澳洲鳕鲈(Maccullochella peelii peelii)全人工繁殖技术研究
- ON PRACTICAL TECHNOLOGY FOR FULL ARTIFICIAL PROPAGATION OF MURRAY COD MACCULLOCHELLA PEELII PEELII
- 海洋与湖沼, 51(2): 371-377
- Oceanologia et Limnologia Sinica, 51(2): 371-377.
- http://dx.doi.org/10.11693/hyhz20191100214
文章历史
-
收稿日期:2019-11-13
收修改稿日期:2019-12-30
2. 中国海洋大学 青岛 266003
2. China Ocean University, Qingdao 266003, China
澳洲鳕鲈(Maccullochella peelii peelii)又称墨瑞鳕或澳洲虫纹斑, 属暖水性鱼类(Lake, 1971), 主要分布于澳大利亚墨瑞-达令河流域, 是澳大利亚土著鱼类, 素有澳大利亚国宝鱼之称。澳洲鳕鲈体型较大, 野生捕获最大个体体重可达113.6kg (Noble, 1955), 寿命可达48年(Lintermans, 2007; Koehn et al, 2012)。由于栖息环境恶化、迁徙受阻、水质恶化、非法捕捞等诸多因素(Koehn, 2004; Rowland, 2004; Koehn et al, 2012), 澳洲鳕鲈原产地野生资源量急剧减少, 现已被列为渐危种(Brazil et al, 1999; Ye et al, 2007)。澳大利亚政府采取了一系列措施, 如全国范围内禁止商业捕捞、开展增殖放流活动等(Lintermans et al, 2004)。澳洲鳕鲈人工繁殖研究始于1903年(Dannevig, 1903), Rowland于1985年初步实现了采用野生亲本以土池自产方式进行人工繁殖(Rowland, 1985)。
澳洲鳕鲈繁殖具有明显的周年周期特征, 雌鱼约6龄性成熟、雄鱼3—4龄性成熟(Gooley et al, 1995)。每年春季至初夏穆瑞河水温达到20℃时开始产卵(Rowland, 1998), 产卵前澳洲鳕鲈能够逆流而上120km (Koehn et al, 2009), 产卵时一般成对出现, 卵具黏性, 需附着于硬基质上。人工育苗土池中水温同样需达到20℃澳洲鳕鲈才能产卵, 需在水中放置管道或者空心原木等供卵子附着(Lake, 1967; Rowland, 1988; Lintermans, 2007)。据报道, 澳大利亚相关专家40年来通过此种方式获得的种苗量不超过1300万尾(Forbes et al, 2015)。因此, 这种人工繁殖方式, 亲本来源受限, 且效率低下。
澳洲鳕鲈已经成为澳大利亚国宴用鱼(廖静, 2019), 其含肉率高、无脊间刺、味道鲜美, 富含四种呈味氨基酸、EPA和DHA等营养物质(Gunasekera et al, 1999; 宋理平等, 2013)。此外, 澳洲鳕鲈形似鳜鱼, 口感和鲜度比鳜鱼更好, 其大型个体可替代三文鱼供应鱼片, 契合我国人民对鱼类消费升级的需求(Abery et al, 2005)。在2001年引入国内进行人工养殖后, 受到市场青睐, 但养殖产量较低, 年产只有约20t, 其原因主要是人工繁殖效率低下。刘怡(2014)曾报道在广东利用全人工繁育技术获得6万多尾4—10cm种苗, 但这对于人工养殖来说还远远不够。繁殖效率低、获得种苗数量少, 一方面是由于澳洲鳕鲈本身繁殖力不高(Rowland, 1985), 更重要的是人工繁殖过程中诸多问题如精卵同步、精子入卵时间的确定、授精时最佳精卵比例、受精成功与否的判别等, 还有待深入研究。
通过常规按压取精方法采集澳洲鳕鲈精液后, 多数精子即被激活, 且活性降低较快, 导致人工授精精卵难以同步, 极大地影响后期孵化率(Billard et al, 1992; Daly et al, 2008);精子质量直接影响能否成功入卵完成受精(Legendre et al, 1980; Stoss et al, 1981); 卵子受精成功与否还缺乏明确、具体的衡量指标。这一系列的问题都需要进一步研究、探索。本研究主要针对澳洲鳕鲈全人工繁殖过程中精卵同步、精子活力延长等关键环节进行了研究, 通过94对、188尾室内工厂化养殖亲鱼, 经过2个月的培育, 获得52.3万尾鱼苗, 证明了用室内工厂化养殖的个体作为亲本进行人工繁殖是可以满足工厂化养殖苗种需求的。
1 材料与方法 1.1 亲本与精液收集、精液动性分析澳洲鳕鲈亲本取自青岛七好饲料科技有限公司室内工厂化养殖基地。在3月下旬至4月初的繁殖季节, 选取体表无外伤、发育良好的6—8龄澳洲鳕鲈亲本, 其中雌、雄鱼各94尾(体重5.2—11.3kg, 体长42—75cm)。用丁香酚麻醉后, HCG催产, 雄鱼1000IU/kg, 雌鱼剂量减半(Rowland, 1988), 48h后, 将鱼腹部朝上倒放在产卵架上, 擦干鱼体表面, 将近生殖孔处水排除, 通过按压取精、卵。收集精液样本时, 为避免采集过程中尿液污染可能对后续实验数据带来的潜在影响(Billard et al, 1992), 取精时直接用预装有4mL人工精浆(ASP)的5mL不带针头注射器吸取1mL精液。将所取样品混匀后取0.1mL混合液用2mL蒸馏水激活(Rowland, 1988), 用CASA精子分析软件检测精子动性, 低于90%的样本丢弃, 收集三个以上动性超过90%的样品并将其混匀, 常温[(19.5±0.5)℃]放置备用。动性分析时取ASP-精液混合液0.1mL, 用2mL蒸馏水或实验设置所需激活液稀释激活, 读数、记录。操作时间15—20s、每组实验重复三次。
1.2 溶液配置据Ohta等(1998)配置ASP溶液1L (NaCl 55mmol/L, KCl 82.4mmol/L, CaCl2 2.0mmol/L, MgCl2 0.8mmol/L, NaHCO3 20mmol/L, TAPS 20mmol/L), 调节pH至8.0。为避免细菌影响实验结果, ASP溶液中额外加入青霉素1000IU/L、硫酸链霉素0.1g/L (Oplinger et al, 2015), 溶液放置4℃冰箱备用, 使用前先将溶液平衡至常温。所用试剂均为分析纯, 购自国药集团化学试剂有限公司。
1.3 方法评估常温下保存时间对精子初始动性的影响: 0h、6h、12h、24h、48h、96h六个不同时间点取样用蒸馏水激活, 记录精子初始(激活后20s时)动性。
分析其动性及存活时间变化规律, 设置了: 0h、6h、12h、24h四个不同时间点取样, 分别每隔20s记录其动性变化。
评估添加葡萄糖作为激活剂对精子动性的影响, 设置了蒸馏水、1.25%、2.50%、5.00%葡萄糖溶液(分别记为DW、G1、G2、G3)作为激活剂, 记录20s动性, 然后每隔1min记录一次; 不同浓度葡萄糖-氯化钠混合液作为激活剂激活精子, 葡萄糖注射液与生理盐水等体积混合, 再进行梯度稀释, 分别设置了蒸馏水、0.625%葡萄糖+1.125‰氯化钠、1.25%葡萄糖+2.25‰氯化钠、2.50%葡萄糖+4.50‰氯化钠四种激活剂(分别记为DW、G1-SC、G2-SC、G3-SC), 激活20s记录动性, 然后每隔1min记录一次。
1.4 数据分析实验数据用“平均值±标准误”表示(n=3), 数据采用SPSS 23.0软件进行样本检验分析, 并进行one-way ANOVA分析, 多重比较处理组与对照组之间的差异性, 采用Origin Pro 2018作图, 取P < 0.05为差异显著。
2 结果 2.1 保存时间对精子初始激活动性的影响如图 1所示, 保存不同时间激活后精子初始激活动性均超过90%, 未见显著差异。激活保存0h、6h、12h、24h、48h精子, 初始动性分别为94.00%±1.27%、96.15%±1.50%、92.00%±1.27%、93.00%±2.58%、92.00%, 保存96h后未见游动精子。
 |
| 图 1 精子在ASP中保存不同时间后精子动性 Fig. 1 Sperm motility after preserved at ASP for different time |
由图 2可知, 精子在ASP中保存6h即对精子活力有显著影响(P < 0.05), 保存6h、12h、24h后动性及存活时间均显著低于0h组(P < 0.05), 激活后1min动性降低20%以上, 6h、12h、24h三组间差异不显著。保存6h、12h、24h后40s、60s、80s、100s精子动性均显著低于保存0h组(P < 0.05);保存6h、12h、24h组激活后精子存活时间均小于100s, 显著低于0h组(120s, P < 0.05)。
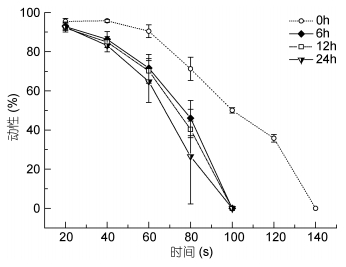 |
| 图 2 保存不同时间对精子动性及存活时间的影响 Fig. 2 Effect of different preservation time on sperm motility and survival time |
如图 3所示, 加入高浓度葡萄糖(G3组)后精子初始动性受到抑制, 可显著延长精子存活时间。G3激活精子20s时动性为48.89%±14.80%, 显著低于DW、G1、G2组(分别为87.61%±8.51%、93.60%±5.86%、92.10%±2.41%, P < 0.05), DW、G1、G2三组精子动性在20s未见显著差异; 激活后1min精子动性从高到低分别为G2(75.73%±11.92%)、G1(62.14%±16.80%)、G3(54.98%±12.16%)与DW组(54.28%±16.61%), 四组未见显著差异。
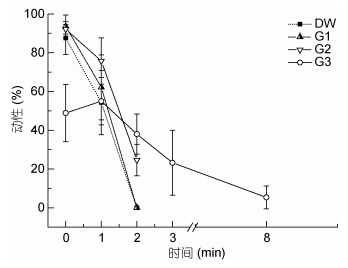 |
| 图 3 不同浓度葡萄糖(Glc)作为激活剂对精子动性及存活时间的影响 Fig. 3 Effect of different concentrations of glucose (Glc) for activation on sperm motility and survival time |
G3激活后精子存活时间达8min显著高于其余三组, G2组次之(超过2min, 未达3min), 最低为G1与DW组(超过1min, 未达2min)。可见, 较高浓度葡萄糖能延长精子存活时间。
2.4 添加葡萄糖(Glc)和氯化钠(NaCl)对精子活力的影响如图 4所示, G2-SC激活精子初始动性为92.55%±2.61%, 与G1-SC (88.09%±4.60%)和DW组(87.61%±8.51%)相比未见显著差异; G2-SC激活后1min精子动性为87.96%±4.52%, 显著高于G1-SC组(69.06%±13.42%)和DW组(54.28%±16.60%) (P < 0.05), 在1min时较DW组提升62%; G2-SC激活后2min精子动性降至50.39%±5.82%, 其余三组未见游动精子。G2-SC激活后精子存活时间达8min, 显著高于G1-SC组和DW组(< 2min)。
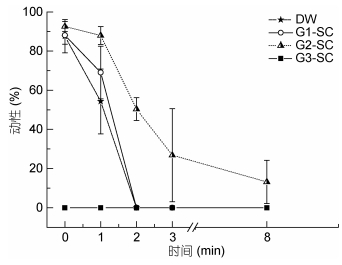 |
| 图 4 不同浓度氯化钠(NaCl)和葡萄糖(Glc)混合物作为激活剂对精子动性及存活时间的影响 Fig. 4 Effect of different concentrations of sodium chloride (NaCl) combined with glucose (Glc) for activation on sperm motility and survival time |
由此可见, 2.50%葡萄糖+4.50‰氯化钠不能激活精子, 而1.25%葡萄糖+2.25‰氯化钠能显著增强精子活力、延长存活时间。
2.5 澳洲鳕鲈卵子成熟度、胚胎发育选取的6—8龄雌性亲本, 注射催产针, 效应时间后泄殖孔处有卵自然流出, 即视为合格亲本, 解剖获取成熟卵子如图 5a所示。按压取卵进行人工授精后受精卵如图 5b, 剔除白色、不透明的死卵(Rowland, 1988), 结果表明, 成功受精卵数量超过80%, 能够满足人工繁殖要求。卵子受精后3—4d后即出现眼点(图 5c), 8—9d后发育成卵黄囊尚未被吸收初孵仔鱼(图 5d)。
 |
| 图 5 澳洲鳕鲈卵子及受精卵发育过程 Fig. 5 Oocytes and development of fertilized oocytes of M. peelii peelii 注: a.催产48h后卵子成熟情况, b.受精卵(箭头所指为死卵), c.眼点出现(3—4d, 箭头所指为眼点), d.初孵仔鱼(8—9d) |
澳洲鳕鲈非常适合高密度尤其是封闭系统养殖(Abery et al, 2005), 引入国内后主要进行室内工厂化养殖。已有研究表明澳洲鳕鲈在水温低于16℃时, 摄食减缓, 生长几乎停止, 水温高于30℃时开始死亡(Boreham et al, 2004; Ingram, 2004), 因此, 澳洲鳕鲈在我国无法过冬和度夏完成生活史, 完全不必担心造成生态入侵的可能性。一般2—3龄养至0.75—1.00kg即可达商品规格, 养殖产量低的主要原因是苗种受限。
 |
| 图 6 澳洲鳕鲈雌性亲本 Fig. 6 Female broodstock of M. peelii peelii |
对于澳洲鳕鲈人工繁殖已经有了一些研究, 但仅限于生殖力的评估(Rowland, 1985)以及人工促熟、催产技术(Rowland, 1983, 1988)。因当地动物保护政策、海关、运输成本较高等诸多原因, 从澳大利亚引进达到性成熟的野生亲本用于人工繁殖还不现实, 只能通过养殖企业自身培育获得。苗种数量少、性成熟年龄时间长、养殖周期长等诸多因素导致养殖企业成熟亲本量极少。因此, 目前国内工厂化养殖企业多数通过从澳大利亚进口受精卵或鱼苗, 成本极高。
Rowland等(1985)认为, 自然水体中5龄以上就能达到性成熟; Gooly等认为野外条件下雄性亲本3—4龄、雌性亲本6龄即可达性成熟(Gooley et al, 1995)。但繁殖期前三个月捕捞已达性成熟的多数雌性个体(体重3.1—34kg, 体长600—1075mm)多数生殖细胞出现卵泡退化或卵子被重吸收的现象, 需进一步在土池中养殖6年, 性腺发育才能达到繁殖需求(Rowland, 1988)。一般认为其性成熟需要经历季节变化(Gooley et al, 1995), 目前室内工厂化养殖水温一般控制在20—26℃之间(Ingram et al, 2005), 工厂化养殖培育亲鱼性腺发育能否满足繁殖要求还未明确。根据室内工厂化养殖的亲本性腺成熟度, 结合预实验结果以及生产成本等因素, 本实验选取了6—8龄的室内工厂化养殖亲本作为人工繁殖使用, 雌性亲本性腺成熟度如图 5a。
3.2 常温保存对于精子活力的影响澳洲鳕鲈孵化率偏低的重要原因是精子被提前激活。精子在由精巢至体外过程中遇到蒸馏水、池水、或者尿液(Ginzburg, 1972; Park et al, 2005), 因渗透压的突然改变致使精子被激活(Cosson, 2004; Alavi et al, 2005)。澳洲鳕鲈取精时, 精液必须经过较大的泄殖腔, 极易被污染, 精子被激活几乎无法避免, 而人工授精时精卵结合需要一定的时间。鲤科鱼类、虹鳟(Oncorhynchus mykiss)、鲟等种类在ASP中保存时间可达7—14d (Gallego et al, 2019), 因此我们尝试用ASP对收集到的精液进行短期保存。结果表明保存6h、12h、24h均会造成精子活力过低。常温条件下细菌繁殖较快, 鱼类精子质量短时间内迅速恶化, 因此在配制ASP中添加抗生素(Oplinger et al, 2015)。本实验中ASP中加入青霉素、硫酸链霉素能在一定时间内保持精子活力, 但较建鲤(Cyprinus carpio var. Jian) (Saad et al, 1988)、匙吻鲟(Polyodon spathula) (Brown et al, 1995; Park et al, 2005)等短期保存效果差。
3.3 葡萄糖延长精子存活时间高质量的精子是影响人工繁殖效率的关键因素。有学者研究指出淡水鱼类精子存活时间一般不超过2min (鲁大椿等, 1989; Rowland, 1998; Billard et al, 2004), 可能是因为细胞内线粒体DNA活动不足以补偿精子激活后ATP的利用(Perchec et al, 1995)。本实验中澳洲鳕鲈精子激活剂中添加葡萄糖后其存活时间延长, G2-SC组(1.25%葡萄糖+2.25‰氯化钠)精子动性在1min时相较于DW组(蒸馏水)提升62.0%, 存活时间达8min, 较DW组(2min)延长了3倍。表明适宜浓度的葡萄糖能够显著增强精子的活力, 延长存活时间。
鲤科鱼类和鲑鳟鱼类精子细胞中存在糖原物质(Lahnsteiner et al, 1992, 1993), 但这些糖原物质并不足以支持长时间消耗(Dadras et al, 2017)。Gardiner(1978)和Stoss(1983)的研究表明一定浓度的外源性葡萄糖可以延长鲤科鱼类精子存活时间, 这与本实验结果类似, 提示澳洲鳕鲈精子可能具有利用外源性葡萄糖的能力。然而, 一般认为葡萄糖分子较大不能直接通过精子细胞膜进入细胞内部, 葡萄糖是怎样充当精子能量来源还有待进一步探究。
此外, 本实验发现不同批次对照组精子激活后存活时间及精子动性存在差异, 可能是由于澳洲鳕鲈于室内工厂化养殖过程中, 温度、光照、饵料等人工因素对其造成胁迫, 影响精子质量(Bromage, 1995; Rowland, 1998; Izquierdo et al, 2001)。该现象同样在鲤鱼、罗非鱼中有发现(De W Kruger et al, 1984)。
4 结论澳大利亚众多政府组织和企业经过40年的努力, 共培育了1289万澳洲鳕鲈鱼苗(Forbes et al, 2015), 本研究中一次人工繁殖就获得了52.3万尾的鱼苗, 高于刘怡(2014)的结果(6万多尾, 4—10cm), 本研究使用延长精子活力的方法大大提高了育苗效率, 室内工厂化养殖所培育的亲本可以满足人工繁殖的要求。因此, 本研究解决了澳洲鳕鲈人工繁殖亲本来源问题, 有利于增加苗种供应规模, 可为澳洲鳕鲈工厂化养殖的大规模推广奠定基础; 与此同时, 通过该方法可以提高澳洲鳕鲈育苗效率, 降低生产成本, 使该品种的养殖更加经济可行; 此外, 添加糖类和氯化钠延长精子活力的方法为鳕鲈科鱼类人工繁殖提供了新思路。
刘怡. 2014. 墨瑞鳕在广东全人工繁育成功. 海洋与渔业, (5): 28-30 |
宋理平, 冒树泉, 胡斌, 等. 2013. 虫纹鳕鲈肌肉营养成分分析与品质评价. 饲料工业, 34(16): 42-45 |
鲁大椿, 傅朝君, 刘宪亭, 等. 1989. 我国主要淡水养殖鱼类精液的生物学特性. 淡水渔业, 19(2): 34-37 |
廖静. 2019. 澳洲华侨结缘"国宝鱼"归乡开启养殖之旅. 海洋与渔业, (7): 72-74 |
Abery N W, De Silva S S., 2005. Performance of murray cod, Maccullochella peelii peelii (Mitchell) in response to different feeding schedules. Aquaculture Research, 36(5): 472-478 |
Alavi S M H, Cosson J., 2005. Sperm motility in fishes. I. Effects of temperature and pH:a review. Cell Biology International, 29(2): 101-110 |
Brazil P, Boreham K, 1999. Environment Protection and Biodiversity Conservation Act 1999(Cth). Australian Mining & Petroleum Law Journal, 18(2): 183 |
Billard R, Cosson J, Noveiri S B et al, 2004. Cryopreservation and short-term storage of sturgeon sperm, a review. Aquaculture, 236(1-4): 1-9 |
Billard R, Cosson M P., 1992. Some problems related to the assessment of sperm motility in freshwater fish. Journal of Experimental Zoology, 261(2): 122-131 |
Boreham S, Ingram B A, Jones P L et al..2004. Water quality and intensive Murray cod aquaculture. In: Ingram B A, De Silva S S eds. Development of Intensive Commercial Aquaculture Production Technology for Murray cod. Final Report to the Fisheries Research and Development Corporation (Project No.1999/328). Alexandra, Victoria, Australia: Primary Industries Research Victoria, DPI, 113-128
|
Bromage N..1995. Broodstock management and seed quality-general considerations. In: Bromage N R, Roberts R J eds. Broodstock Management and Egg and Larval quality. Oxford: Blackwell Science Ltd., 1-24
|
Brown G G, Mims S D., 1995. Storage, transportation, and fertility of undiluted and diluted paddlefish milt. The Progressive Fish-Culturist, 57(1): 64-69 |
Cosson J., 2004. The ionic and osmotic factors controlling motility of fish spermatozoa. Aquaculture International, 12(1): 69-85 |
Dadras H, Sampels S, Golpour A et al, 2017. Analysis of common carp Cyprinus carpio sperm motility and lipid composition using different in vitro temperatures. Animal Reproduction Science, 180: 37-43 |
Daly J, Galloway D, Bravington W et al, 2008. Cryopreservation of sperm from Murray cod, Maccullochella peelii peelii. Aquaculture, 285(1-4): 117-122 |
Dannevig H C., 1903. Summary of Evidence Regarding the Murray Cod Fishes, with Notes. Sydney: Government Printer, 3-32
|
De W Kruger J C, Smit G L, Van Vuren J H J et al, 1984. Some chemical and physical characteristics of the semen of Cyprinus carpio L. and Oreochromis mossambicus (Peters). Journal of Fish Biology, 24(3): 263-272 |
Forbes J, Watts R J, Robinson W A et al, 2015. Assessment of stocking effectiveness for Murray cod (Maccullochella peelii) and golden perch (Macquaria ambigua) in rivers and impoundments of south-eastern Australia. Marine and Freshwater Research, 67(10): 1410-1419 |
Gallego V, Asturiano J F., 2019. Fish sperm motility assessment as a tool for aquaculture research:a historical approach. Reviews in Aquaculture, 11(3): 697-724 |
Gardiner D M., 1978. Utilization of extracellular glucose by spermatozoa of two viviparous fishes. Comparative Biochemistry and Physiology Part A:Physiology, 59(2): 165-168 |
Ginzburg A S., 1972. Fertilization in Fishes and the Problem of Polyspermy. Jerusalem: Keter Press, 71-50111
|
Gooley G J, Anderson T A, Appleford P., 1995. Aspects of the reproductive cycle and gonadal development of Murray cod, Maccullochella peelii peelii (Mitchell) (Percicthidae), in Lake Charlegrark and adjacent farm ponds, victoria, Australia. Marine and Freshwater Research, 46(4): 723-728 |
Gunasekera R M, De Silva S S, Ingram B A., 1999. The amino acid profiles in developing eggs and larvae of the freshwater Percichthyid fishes, trout cod, Maccullochella macquariensis and Murray cod, Maccullochella peelii peelii. Aquatic Living Resources, 12(4): 255-261 |
Ingram B A..2004. Murray cod fingerling production and growout. In: Ingram B A, De Silva S S eds. Development of Intensive Commercial Aquaculture Production Technology for Murray cod. Final Report to the Fisheries Research and Development Corporation (Project No. 1999/328). Alexandra, Victoria, Australia: Primary Industries Research Victoria, DPI, 25-65
|
Ingram B A, Gavine F, Lawson P., 2005. Fish Health Management Guidelines for Farmed Murray Cod. Snobs Creek: Fisheries Victoria
|
Izquierdo M S, Fernández-Palacios H, Tacon A G J., 2001. Effect of broodstock nutrition on reproductive performance of fish. Aquaculture, 197(1-4): 25-42 |
Koehn J D..2004. Threats to murray cod. In: Litermans M, Phillips B eds. Management of Murray Cod in the Murray-Darling Basin: Statement, Recommendations and Supporting Papers. Canberra: Murray-Darling Basin Commission, 30-37
|
Koehn J D, McKenzie J A, O'Mahony D J et al, 2009. Movements of Murray cod (Maccullochella peelii peelii) in a large Australian lowland river. Ecology of Freshwater Fish, 18(4): 594-602 |
Koehn J D, Todd C R., 2012. Balancing conservation and recreational fishery objectives for a threatened fish species, the Murray cod, Maccullochella peelii. Fisheries Management and Ecology, 19(5): 410-425 |
Lahnsteiner F, Patzner R A, Weismann T., 1992. Monosaccharides as energy resources during motility of spermatozoa in Leuciscus cephalus (Cyprinidae, Teleostei). Fish Physiology and Biochemistry, 10(4): 283-289 |
Lahnsteiner F, Patzner R A, Weismann T., 1993. Energy resources of spermatozoa of the rainbow trout Oncorhynchus mykiss (Pisces, Teleostei). Reproduction Nutrition Development, 33(4): 349-360 |
Lake J S., 1967. Rearing experiments with five species of Australian freshwater fishes. I. Inducement to spawning. Australian Journal of Marine and Freshwater Research, 18(2): 137-154 |
Lake J S., 1971. Freshwater Fishes and Rivers of Australia. Sydney: Thomas Nelson
|
Legendre M, Billard R., 1980. Cryopreservation of rainbow trout sperm by deep-freezing. Reproduction Nutrition Developpement, 20(6): 1859-1868 |
Lintermans M., 2007. Fishes of the Murray-darling Basin:An Introductory Guide. Canberra: Murray-Darling Basin Commission
|
Lintermans M, Rowland S, Koehn J et al..2004. The status, threats, and management of freshwater cod species Maccullochella spp. in Australia. In: Lintermans M, Phillips B eds. Management of Murray Cod in the Murray-Darling Basin: Statement Recommendations and Supporting Papers. Canberra: Murray-Darling Basin Commission, 15-29
|
Noble W G., 1955. Murray Cod. Sydney: Sydney Morning Herald
|
Ohta H, Tsuji M., 1998. Ionic environment necessary for maintenance of potential motility in the common carp spermatozoa during in vitro storage. Fisheries Science, 64(4): 547-552 |
Oplinger R M, Wagner E J., 2015. Use of penicillin and streptomycin to reduce spread of bacterial Coldwater disease I:antibiotics in sperm extenders. Journal of Aquatic Animal Health, 27(1): 25-31 |
Park C, Chapman F A., 2005. An extender solution for the short-term storage of sturgeon semen. North American Journal of Aquaculture, 67(1): 52-57 |
Perchec G, Jeulin C, Cosson J et al, 1995. Relationship between sperm ATP content and motility of carp spermatozoa. Journal of Cell Science, 108(2): 747-753 |
Rowland S J., 1983. Spawning of the Australian freshwater fish Murray cod, Maccullochella peeli (Mitchell), in earthen ponds. Journal of Fish Biology, 23(5): 525-534 |
Rowland S J..1985. Aspects of the Biology and Artificial Breeding of the Murray cod, Maccullochella peeli, and the Eastern Freshwater Cod, M. ikei sp. now. (Pisces: Percichthyidae). Sydney: Doctor Dissertation of Macquarie University, 253
|
Rowland S J., 1988. Hormone-induced spawning of the Australian freshwater fish Murray cod, Maccullochella peeli (Mitchell) (Percichthyidae). Aquaculture, 70(4): 371-389 |
Rowland S J., 1998. Aspects of the reproductive biology of Murray cod, Maccullochella peelii peelii. Proceedings of the Linnean Society of New South Wales, 120: 147-162 |
Rowland S J..2004. Overview of the history, fishery, biology and aquaculture of Murray cod (MaccuUochella peelii). In: Lintermans M, Phillips B eds. Management of Murray Cod in the Murray-Darling Basin: Statement, Recommendations and Supporting Papers. Proceedings of a Workshop Held in Canberra, ACT, 3-4 June 2004. Canberra: Murray-Darling Basin Commission and Cooperative Research Centre for Freshwater Ecology, 38-61
|
Saad A, Billard R, Theron M C et al, 1988. Short-term preservation of carp (Cyprinus carpio) semen. Aquaculture, 71(1-2): 133-150 |
Stoss J., 1983. Fish gamete preservation and spermatozoan physiology. Fish Physiology, 9: 305-350 |
Stoss J, Holtz W., 1981. Cryopreservation of rainbow trout (Salmo gairdneri) sperm:I. Effect of thawing solution, sperm density and interval between thawing and insemination. Aquaculture, 22: 97-104 |
Ye Q, Zampatti B..2007. Murray Cod Stock Status-the Lower River Murray, South Australia. Stock Status Report to PIRSA Fisheries. Adelaide: South Australian Research and Development Institute (Aquatic Sciences)
|
 2020, Vol. 51
2020, Vol. 51


