中国海洋湖沼学会主办。
文章信息
- 周毅, 徐少春, 许帅, 岳世栋, 顾瑞婷, 宋肖跃, 张玉, 乔永亮, 刘明杰, 张晓梅. 2020.
- ZHOU Yi, XU Shao-Chun, XU Shuai, YUE Shi-Dong, GU Rui-Ting, SONG Xiao-Yue, ZHANG Yu, QIAO Yong-Liang, LIU Ming-Jie, ZHANG Xiao-Mei. 2020.
- 中国温带海域新发现较大面积(大于50ha)海草床:Ⅲ渤海兴城-觉华岛海域大面积海草床鳗草种群动力学及补充机制
- NEW DISCOVERY OF LARGER SEAGRASS BEDS WITH AREAS > 50ha IN TEMPERATE WATERS OF CHINA: Ⅲ POPULATION DYNAMICS AND RECRUITMENT MECHANISM OF ZOSTERA MARINA IN THE XINGCHENG-JUEHUADAO COASTAL WATERS OF BOHAI SEA
- 海洋与湖沼, 51(4): 943-951
- Oceanologia et Limnologia Sinica, 51(4): 943-951.
- http://dx.doi.org/10.11693/hyhz20200100032
文章历史
-
收稿日期:2020-01-21
收修改稿日期:2020-03-06
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院海洋大科学研究中心 青岛 266071;
4. 中国科学院海洋牧场工程实验室 青岛 266071;
5. 中国科学院大学 北京 100049
2. Laboratory for Marine Ecology and Environmental Sciences, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. CAS Engineering Laboratory for Marine Ranching, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
5. University of Chinese Academy of Sciences, Beijing 100049, China
海草为一类高等显花种子植物, 具有完整的根、茎、叶营养器官。营沉水生活, 在海水中完成萌芽、开花、生长、结种等过程(林鹏, 2006)。其形成的海草床与红树林、珊瑚礁并称三大典型海洋生态系统(Green et al, 2004)。海草床具有重要的生态功能, 不仅可以为各种海洋生物提供栖息地和食物来源(Duffy, 2006), 还可以起到净化水质(Dennison et al, 1993)、护堤减灾(Fonseca et al, 1992)和气候调节等作用(韩秋影等, 2008; Fourqurean et al, 2012)。长期以来, 海草床在海洋中的重要作用始终未得到足够的重视, 全球海草床不断衰退和消失(Short et al, 1996; Orth et al, 2006)。海草主要通过有性繁殖和无性繁殖进行种群补充, 其中无性繁殖是海草床种群补充的主要方式(Duarte et al, 1990; Procaccini et al, 1998; Hemminga et al, 2000; Rasheed, 2004), 而有性繁殖对海草种群补充的贡献非常低(Hemminga et al, 2000; Orth et al, 2006; Cabaço et al, 2009)。但是, 有性繁殖是保持海草基因多样性的唯一繁殖方式(Ackerman, 2007; Reynolds et al, 2013), 海草基因多样性决定了海草床生态系统对外界干扰的抵抗力和恢复力(Coyer et al, 2004; Hughes et al, 2004, 2009; Ehlers et al, 2008; Cabaço et al, 2012)。因此, 有性繁殖在新海草床构建和受损海草床修复的过程中起到重要作用(Thayer et al, 1984; Harwell et al, 2002; Plus et al, 2003; Greve et al, 2005; Jarvis et al, 2010)。
鳗草(Zostera marina L.), 又名大叶藻(黄小平等, 2016), 属被子植物门(Angiospermae)、单子叶植物纲(Monocots)、泽泻目(Alismatales)、鳗草科(Zosteraceae)、鳗草属(Zostera), 其地下茎水平生长, 其上生有须根, 叶片细长而柔软, 靠近地下茎的叶片部分有白色叶鞘包裹。鳗草花期为4—7月, 果期6—7期, 肉穗花序(Xu et al, 2018)。长期的进化使得鳗草在对光照的利用、对营养元素的吸收、繁殖策略等方面都具有与沉水生活相适应的特征(高亚平等, 2010)。鳗草广泛分布在北半球温带海域, 主要分布在太平洋及北大西洋地区的欧亚、北非、北美沿海, 在我国鳗草分布于河北、山东、辽宁等省沿海。鳗草主要生长在地势平缓泥沙质浅水海底, 从潮间带到潮下带的浅水区域皆有分布(Setchell, 1920, 1929; den Hartog et al, 1990; Green et al, 2004; Moore et al, 2007), 鳗草可生长于温带地区的潮池(Keddy et al, 1978; Phillips et al, 1983; Robertson et al, 1984)、潮间带滩涂(Setchell, 1929; Harrison, 1993; van Katwijk et al, 2004)和潮下带(Moore et al, 2007; Lee et al, 2007)以及热带的加利福尼亚湾(Meling-López et al, 1999; Santamaría-Gallegos et al, 2000)。虽然鳗草的分布广泛、栖息地多样性, 但鳗草海草床受人类活动的影响极大, 近几十年来全球鳗草海草床分布面积一直在减少(Short et al, 1996)。在我国, 近几十年来, 受海岸建设等人类活动的影响, 很多鳗草海草床发生严重退化, 甚至已经消失。《中国海湾志》(中国海湾志编纂委员会, 1991)文献记载莱州湾荚蓉岛附近1982年时还存在1300ha的鳗草海草床, 但在2000年已基本消失(叶春江等, 2002); 2015年作者实地考察、估测莱州湾芙蓉岛鳗草床面积小于1ha, 鳗草呈斑块状分布。中国科学院海洋研究所标本馆资料显示, 20世纪50年代日照市石臼所(现日照港附近)、威海乳山等沿海海域均曾有鳗草分布, 但近些年作者实地考察并未发现鳗草, 推测以上海域鳗草已完全消失。此外, 青岛近海海域历史上曾分布较广的鳗草海草床, 现只在汇泉湾、青岛湾等几处海域有分布(杨宗岱等, 1984;郭栋等, 2010)。
为了更好地保护我国现有海草资源, 查明现阶段沿海地区海草资源分布情况及种群生态特征迫在眉睫。2018年5月作者在渤海兴城-觉华岛海域发现大面积海草床, 海草床以鳗草为优势种, 本文对该海草床分布情况、鳗草生物量、有性繁殖情况等进行了季度调查, 以期掌握该海草床鳗草种群生态特征, 并针对海草床生境主要威胁提出海草床的保护和管理建议。
1 材料与方法 1.1 研究区域和样品采集渤海兴城-觉华岛海域, 位于辽宁省兴城市东部海域, 处于兴城市与觉华岛之间, 属于中国渤海北部的辽东湾浅海水域。该海域底质以砂泥为主, 盛产菲律宾蛤仔(Ruditapes philippinarum)、毛蚶(Scapharca subcrenata)等贝类。潮汐属正规半日潮, 最大潮差2.7m左右。该海域设有兴城市红海滩(碱蓬)生态保护区。兴城觉华岛是辽东湾最大的岛屿, 是国家AAAA级风景名胜区(图 1)。
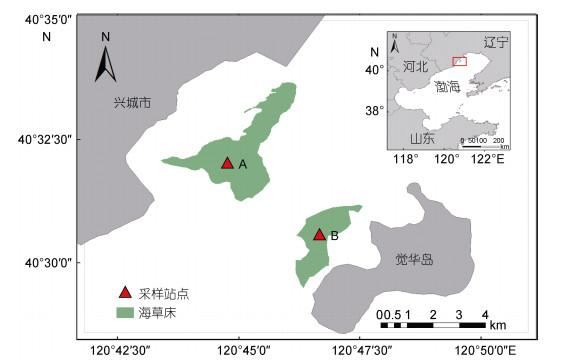 |
| 图 1 渤海兴城-觉华岛海域海草分布及采样站点示意 Fig. 1 Schematic map showing the distribution and sampling sites of Z. marina in the Xingcheng-Juehuadao coastal waters of Bohai Sea |
本研究于2018年5月、9月、11月和2019年3月对渤海兴城-葫芦岛海草床展开季度调查。首先利用船只和徒步调查相结合, 估测了海草床面积和分布情况; 再根据海草分布情况, 选取A和B两处作调查站点(图 1)。在每个站点, 通过随机取样法利用圆柱样方(直径19cm, 深度12cm)各采集8个样方, 将鳗草筛洗干净带回实验室作进一步处理。
1.2 样品处理及测定将鳗草样品冲洗干净并进行生物学参数测定, 测定生物学参数包括生物量(湿重, g/m2)、茎枝密度(茎枝/m2)、叶鞘高度(cm)、茎枝高度(cm), 其中茎枝高度为叶鞘高度和叶片高度之和。将A站点(图 1)鳗草植株分为叶、叶鞘和地下三部分, 并于60℃下烘干, 利用VARIO EL III元素分析仪(德国)测定其碳、氮元素含量, 采用灰化法测定其磷元素含量(Zhou et al, 2003)。
另外, 2018年5月(有性生殖关键时期)对生殖枝(Reproductive shoot)的数量进行统计并计算生殖枝比例; 对种苗茎枝(Seedling shoot)的数量进行统计并计算种群有性生殖补充贡献率, 公式如下:

其中, 总茎枝数=种苗茎枝数+营养枝数。
1.3 数据分析数据以平均值±标准差表示。对鳗草生物量、茎枝密度、叶鞘高度、茎枝高度等基本生物学参数进行单因素方差分析(one-way ANOVA); 对叶鞘高度与茎枝高度进行简单线性回归分析; 对叶、叶鞘氮元素含量进行简单线性回归分析。
采用Excel进行数据整理和作图; 利用ArcGIS软件进行海草面积计算; 利用SPSS 20.0软件进行单因素方差分析(ANOVA)和简单线性回归分析。
2 结果 2.1 海草床面积2018年5月现场调查发现, 渤海兴城-觉华岛海域存在大面积海草床(图 2), 海草床面积为791.61 ha, 为国内目前发现的较大面积海草床之一。海草种类为鳗草和日本鳗草, 以鳗草为优势种, 日本鳗草极少且呈斑块分布。因海沟阻隔, 海草床一分为二, 大陆沿岸一侧海草床面积为543.01ha, 觉华岛一侧海草床面积为248.60ha(图 1)。
 |
| 图 2 渤海兴城-觉华岛海草床实地照片 Fig. 2 Field photo of the seagrass bed in Xingcheng–Juehuadao coastal waters of Bohai Sea |
根据统计数据(表 1), 渤海兴城-觉华岛海草床鳗草生物量、茎枝密度、叶鞘高度、茎枝高度均呈现明显的季节变化(P < 0.05), 且均在2018年5月达到最高值; 鳗草生物量在2019年3月达到最低, 最低值为294.47—497.67g/m2; 2018年5月份茎枝密度相对较高, 达到(762.73±209.04)茎枝/m2(A站点), 9月份降到最低(A: 193.99±56.56茎枝/m2), 随后逐渐升高至564.33±184.72茎枝/m2(11月份, A站点); 叶鞘、茎枝高度范围分别为2.88—13.08cm、10.18—53.76cm; 2018年5月调查结果表明A站点和B站点鳗草生殖枝所占比例分别为12.53%±5.91%和12.05%±9.29 % (表 1)。
| 站点 | 采样日期 | 生物量(g/m2) | 茎枝密度(茎枝/m2) | 叶鞘高度(cm) | 茎枝高度(cm) | 生殖枝比例(%) |
| A | 2018/05/28 | 1632.64±684.57 | 762.73±209.04 | 13.08±3.21 | 53.76±15.08 | 12.53±5.91 |
| 2018/09/10 | 658.82±238.90 | 193.99±56.56 | 5.55±1.18 | 32.24±8.68 | — | |
| 2018/11/27 | 785.48±285.32 | 564.33±184.72 | 3.88±0.63 | 17.89±5.68 | — | |
| 2019/03/09 | 497.67±144.63 | 537.88±149.34 | 3.35±0.75 | 12.65±3.20 | — | |
| B | 2018/05/27 | 1241.22±184.09 | 502.61±163.00 | 7.56±2.37 | 30.12±9.20 | 12.05±9.29 |
| 2018/09/09 | 361.44±149.66 | 110.22±39.71 | 7.19±1.43 | 35.72±8.12 | — | |
| 2018/11/25 | 502.08±123.63 | 343.89±109.53 | 3.56±0.72 | 14.25±5.07 | — | |
| 2019/03/11 | 294.47±99.92 | 339.48±120.63 | 2.88±0.67 | 10.18±2.45 | — |
鳗草茎枝高度(Hshoot; cm)与叶鞘高度(Hsheath; cm)的回归分析结果显示, 两者存在显著的线性相关关系(Hshoot=4.2378Hsheath+0.7612, R2=0.9038, P < 0.01), 系数为4.2378。说明可用叶鞘高度预测茎枝高度。
2.3 营养元素含量特征2018—2019年鳗草不同部位碳含量基本维持稳定; 而2018年9月鳗草不同部位氮、磷元素含量明显低于其他月份; C/N、C/P、N/P范围分别为8.89—20.35、58.26—252.91、6.10—13.23;不同部位氮、磷含量排序为叶鞘 > 叶片 > 地下(表 2)。
| 日期 | 部位 | C (%) | N (%) | P | C/N | C/P | N/P |
| 2018年5月 | 叶片 | 36.57±0.21 | 2.80±0.06 | 0.31±0.04 | 13.06±0.27 | 118.64±13.26 | 9.07±0.85 |
| 叶鞘 | 29.70±0.33 | 2.90±0.13 | 0.48±0.04 | 10.26±0.35 | 62.44±5.68 | 6.10±0.75 | |
| 地下 | 28.76±0.55 | 1.47±0.04 | 0.21±0.05 | 19.57±0.49 | 139.16±32.93 | 7.11±1.68 | |
| 2018年9月 | 叶片 | 36.27±1.02 | 1.89±0.09 | 0.14±0.02 | 19.18±0.70 | 252.91±31.39 | 13.23±1.95 |
| 叶鞘 | 33.26±0.06 | 2.33±0.04 | 0.26±0.02 | 14.30±0.22 | 126.13±10.31 | 8.83±0.84 | |
| 地下 | 33.98±0.23 | 1.67±0.03 | 0.20±0.01 | 20.35±0.45 | 172.19±9.06 | 8.47±0.57 | |
| 2018年11月 | 叶片 | 35.35±0.72 | 3.35±0.09 | 0.41±0.04 | 10.55±0.12 | 86.86±7.51 | 8.23±0.77 |
| 叶鞘 | 35.12±1.58 | 3.95±0.21 | 0.63±0.18 | 8.89±0.10 | 58.26±13.51 | 6.55±1.46 | |
| 地下 | 32.45±1.21 | 2.18±0.12 | 0.17±0.03 | 14.90±0.29 | 195.56±24.05 | 13.12±1.55 | |
| 2019年3月 | 叶片 | 36.56±0.07 | 2.50±0.04 | 0.22±0.05 | 14.65±0.23 | 171.03±46.25 | 11.65±2.95 |
| 叶鞘 | 34.26±2.54 | 2.99±0.26 | 0.45±0.06 | 11.46±0.49 | 76.31±7.67 | 6.65±0.39 | |
| 地下 | 32.46±0.24 | 1.89±0.04 | 0.17±0.02 | 17.15±0.40 | 195.37±27.01 | 11.41±1.77 |
叶鞘与茎枝营养元素含量(碳、氮、磷)回归分析结果显示, 叶鞘与叶片氮含量及C/N值存在显著的线性相关关系(氮含量: r2=0.8098, P < 0.01; C/N值: r2=0.9407, P < 0.01, 图 3), 而叶鞘与叶片碳、磷元素含量无显著线性相关关系。
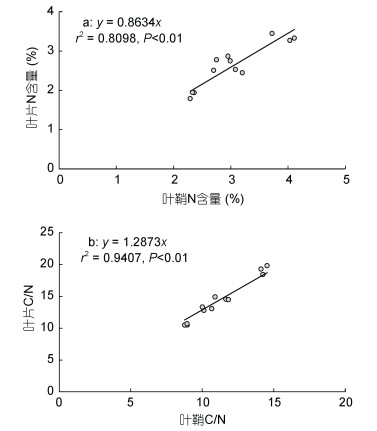 |
| 图 3 渤海兴城-觉华岛海域(A站点)鳗草叶鞘与叶片N含量(a)、叶鞘与叶片C/N (b)线性回归 Fig. 3 Regressions between N content (a) and C/N ratio (b) of sheath and leaf for Z. marina in the Xingcheng-Juehuadao coastal waters (Site A) of Bohai Sea |
通过计数2018年5月份样方内茎枝来源(表 3), 发现渤海兴城-觉华岛海域鳗草种群较多的来源于无性繁殖。统计的16个样方中, 仅有4个样方内发现鳗草种苗。计算有性繁殖茎枝/总茎枝比值为1.92%±3.48%, 说明该海域鳗草种群主要通过有性繁殖进行种群补充, 其种群补充贡献率仅约为2%。
| 站点 | 样品编号 | 克隆茎枝(个) | 有性繁殖个体(种苗/个) | 有性繁殖种苗茎枝 | 总茎枝 | 有性繁殖种苗茎枝/总茎枝(%) |
| A | #1 | 19 | 0 | 0 | 19 | 0.00 |
| #2 | 19 | 0 | 0 | 19 | 0.00 | |
| #3 | 11 | 1 | 1 | 12 | 8.33 | |
| #4 | 24 | 0 | 0 | 24 | 0.00 | |
| #5 | 23 | 0 | 0 | 23 | 0.00 | |
| #6 | 18 | 1 | 1 | 19 | 5.26 | |
| #7 | 22 | 0 | 0 | 22 | 0.00 | |
| #8 | 12 | 0 | 0 | 12 | 0.00 | |
| mean ± SD | 18.50±4.81 | 0.25±0.46 | 0.25±0.46 | 18.75±4.59 | 1.70±3.25 | |
| B | #1 | 10 | 0 | 0 | 10 | 0.00 |
| #2 | 18 | 1 | 1 | 19 | 5.26 | |
| #3 | 20 | 0 | 0 | 20 | 0.00 | |
| #4 | 12 | 0 | 0 | 12 | 0.00 | |
| #5 | 10 | 0 | 0 | 10 | 0.00 | |
| #6 | 15 | 0 | 0 | 15 | 0.00 | |
| #7 | 9 | 1 | 1 | 10 | 10.00 | |
| #8 | 6 | 0 | 0 | 6 | 0.00 | |
| mean ± SD | 12.50±4.78 | 0.25±0.46 | 0.25±0.46 | 12.75±4.86 | 1.91±3.75 | |
| 总平均mean ± SD | 15.87±5.57 | 0.27±0.46 | 0.27±0.46 | 16.13±5.49 | 1.92±3.48 | |
| 注: *站点A和B见图 1 | ||||||
本研究是我国渤海兴城-觉华岛海草分布情况及鳗草种群生态特征的首次调查和报道, 调查结果说明该海草床是目前中国面积第二大的鳗草海草床, 海草分布面积为791.61ha, 仅次于河北唐山乐亭-曹妃甸鳗草海草床(2917ha; 周毅等, 2019), 为国内目前发现的较大面积海草床之一。
3.2 生物学参数及营养元素(碳、氮、磷)变化特征兴城-觉华岛海草床鳗草茎枝密度在秋季(9—11月)增加约2倍, 说明该海草床鳗草克隆生殖高峰期为秋季, 这与乐亭-曹妃甸海草床克隆生殖高峰期一致(周毅等, 2019)。但这也明显不同于威海天鹅湖海草床, 后者克隆生殖高峰期为春夏季(Xu et al, 2018), 这可能与两个地理种群环境条件差异较大有关。天鹅湖为典型泻湖, 冬季低温(甚至出现全湖结冰现象)导致鳗草地上部分退化、消失; 春季气温回升, 海草进入克隆生殖高峰期(Xu et al, 2018)。
2018年5月兴城-觉华岛海草床鳗草茎枝密度((493.79±159.97)—(762.73±209.04)茎枝/m2)和生物量((1241.22±184.09)—(1632.64±684.57)g/m2)略低于乐亭-曹妃甸海草床(2018年5月, 茎枝密度(952.57± 289.48)茎枝/m2; 生物量(1817.10±528.68)g/m2; 周毅等, 2019);茎枝高度((30.12±9.20)—(53.76±15.08)cm)略高于乐亭-曹妃甸海草床(2015年5月; (23.99±7.90)cm; 周毅等, 2019);兴城-觉华岛海草床生殖比例(2018年5月; 12%—13%)与乐亭-曹妃甸海草床(2015年5月; 14.96%±6.27%;周毅等, 2019)大致相同。此外, A站点鳗草生物量、茎枝密度略高于B点, 这说明B站点海草分布相对稀疏, 这可能与当地渔民在B站点进行更加频繁的渔业活动有关。
国际上通常将海草叶片作海草碳、氮元素监测部位(Duarte, 1990), 但兴城-觉华岛鳗草叶片常附着大量藻类等且难以清除, 而叶鞘几乎无附着物(图 4), 鉴于此可通过构建线性回归模型以探讨叶鞘与叶片氮元素含量关系。研究结果显示, 叶鞘与叶片氮元素含量之间存在显著的线性相关关系(图 3), 因此可将叶鞘作为该海草床氮元素长期监测的指标部位, 以替代附着大量藻类的叶片。此外, 叶鞘高度与茎枝高度回归分析结果显示, 叶鞘高度与茎枝高度存在显著的线性相关关系, 说明可用叶鞘的高度预测茎枝高度, 因为叶片经常因风浪等作用而折断, 而叶鞘却相当稳定。
 |
| 图 4 渤海兴城-觉华岛海域鳗草叶片附着大量藻类等 Fig. 4 Epiphytes and other material attached to eelgrass leaves in the Xingcheng-Juehuadao coastal waters of Bohai Sea |
兴城-觉华岛海草床生殖枝比例平均为12.3%, 低于唐山乐亭-曹妃甸种群(21.72%; 2018年6月; 周毅等, 2019), 且明显低于威海天鹅湖种群(53.34%; Xu et al, 2018);调查期间发现兴城-觉华岛鳗草种子集中于春季萌发, 与天鹅湖种群时间一致, 而汇泉湾种群种子集中于秋季萌发(Xu et al, 2018);兴城-觉华岛海草床有性繁殖补充贡献仅为2%左右, 明显低于威海天鹅湖种群(41.36%—50.52%) (Xu et al, 2018)。以上对比分析发现兴城-觉华岛与唐山乐亭-曹妃甸、威海天鹅湖、青岛汇泉湾鳗草种群有性繁殖特征(生殖枝比例、种子萌发时间、种群补充情况)存在差异, 这可能与鳗草种群为适应当地环境而产生不同种群补充策略有关。
3.4 海草床生境主要威胁该海草床受捕蛤、围网捕鱼等人类活动影响, 破坏严重(图 5左), 致使海草床边缘区呈现严重斑块化趋势。尤其是当地高强度的捕蛤作业, 将海草连根翻起或耙断海草的根茎, 对海草的破坏性很大; 挖松滩涂的泥沙, 造成泥沙流动、埋没海草, 影响海草的生长。当地渔民通过马车、三轮车或拖拉机(图 5右)将蛤运送至岸, 交通工具的使用不仅会直接机械地损伤海草(碾压等), 而且增加了捕蛤强度, 从而加速了海草退化。据不完全统计, 2018年6月海草床及周边海域的菲律宾蛤仔、毛蚶等贝类每天的捕获量大于2000kg。此外, 渔船的航行活动会对海草叶片造成物理损伤, 对海草的生长与繁殖造成威胁。
 |
| 图 5 渤海兴城-觉华岛海草床中的捕蛤渔民(左)和运蛤拖拉机(右) Fig. 5 Fishermen digging for R. philippinarum (left) in a seagrass bed and a tractor (right) for carrying clams in Xingcheng-Juehuadao coastal waters of Bohai Sea |
1995—2019年期间, 渤海兴城-觉华岛海草床周边海域存在大规模围填海、围堰工程, 其面积高达1129.44ha, 造成海草床严重退化(图 6)。一方面, 围填海可直接导致周围水体浑浊、透明度降低, 致使海草光合效率降低, 甚至死亡, 引起海草床退化; 另一方面, 在该海草床北侧、西南侧的围堰工程可造成海水潮差的减小(图 6右), 使潮汐的冲刷能力降低, 致使渤海兴城-觉华岛海域水体自净能力降低, 从而使水质不断恶化, 引起海草床退化。
 |
| 图 6 渤海兴城-觉华岛海域历史围海面积(1995—2019) Fig. 6 Changes in reclamation area in Xingcheng-Juehuadao coastal waters of Bohai Sea from 1995 to 2019 |
针对兴城-觉华岛海草床生境所受主要威胁, 提出以下建议, 以实现海草床的有效保护和科学管理: (1)降低蛤等贝类的捕集力度:海草床区域应降低蛤等贝类的捕集力度, 严格限制贝类捕集频次和规范、合理使用捕集工具; (2)规划、设立海草特别保护区:在兴城-觉华岛海域设立海草特别保护区, 保护区内严禁渔业捕捞、捕集贝类等, 以助于海草床的自然恢复; (3)普及海洋生态教育, 提高海草保护意识:普及海草床生态意义, 增强公众海洋生态环境忧患意识, 引导当地企业和公众认识到保护海洋生态环境就是维护自己的切身经济利益。
4 结论本研究利用船只和徒步调查相结合, 初步估测葫芦岛兴城-觉华岛海草床面积近800ha, 为目前中国面积第二大的鳗草海草床, 并查明海草的时空分布特征。由于葫芦岛兴城-觉华岛海域地势较缓, 水深较浅, 为该处海草床提供了非常适宜的生存环境。该海草床鳗草生物量与其他文献报道的种群相比处于稍低水平(Xu et al, 2018)。该海草床鳗草种群补充方式以无性繁殖为主, 秋季为克隆生殖高峰期, 其有性繁殖补充比例仅为1.92%, 具有鲜明的独特性。该海草床受围填海、捕蛤、围网捕鱼等人类活动影响极大, 海草床退化趋势明显, 亟需建立海草保护区, 以对葫芦岛兴城-觉华岛海草床进行有效保护和科学管理, 坚决避免海草床退化殆尽的悲剧在此上演。
中国海湾志编纂委员会. 1991. 中国海湾志(第三分册). 北京: 海洋出版社, 71
|
叶春江, 赵可夫. 2002. 高等植物大叶藻研究进展及其对海洋沉水生活的适应. 植物学通报, 19(2): 184-193 DOI:10.3969/j.issn.1674-3466.2002.02.008 |
杨宗岱, 吴宝铃. 1984. 青岛近海的海草场及其附生生物. 黄渤海海洋, 2(2): 56-67 |
林鹏. 2006. 海洋高等植物生态学. 北京: 科学出版社
|
周毅, 许帅, 徐少春, 等. 2019. 中国温带海域新发现较大面积(大于0.5km2)海草床:Ⅱ声呐探测技术在渤海唐山沿海海域发现中国面积最大的鳗草海草床. 海洋科学, 43(8): 50-55 |
高亚平, 方建光, 张继红, 等. 2010. 桑沟湾大叶藻有性繁殖特性的观察研究. 渔业科学进展, 31(4): 53-58 DOI:10.3969/j.issn.1000-7075.2010.04.007 |
郭栋, 张沛东, 张秀梅, 等. 2010. 山东近岸海域海草种类的初步调查研究. 海洋湖沼通报, (2): 17-21 DOI:10.3969/j.issn.1003-6482.2010.02.004 |
黄小平, 江志坚, 范航清, 等. 2016. 中国海草的"藻"名更改. 海洋与湖沼, 47(1): 290-294 |
韩秋影, 施平. 2008. 海草生态学研究进展. 生态学报, 28(11): 5561-5570 DOI:10.3321/j.issn:1000-0933.2008.11.040 |
Ackerman J D, 2007. Sexual reproduction of seagrasses: pollination in the marine context. In: Larkum A W D, Orth R J, Duarte C M eds. Seagrasses: Biology, Ecology and Conservation. Dordrecht: Springer, 89-109
|
Cabaço S, Santos R, 2012. Seagrass reproductive effort as an ecological indicator of disturbance. Ecological Indicators, 23: 116-122 DOI:10.1016/j.ecolind.2012.03.022 |
Coyer J A, Diekmann O E, Serrão E A et al, 2004. Population genetics of dwarf eelgrass Zostera noltii throughout its biogeographic range. Marine Ecology Progress Series, 281: 51-62 DOI:10.3354/meps281051 |
den Hartog C, Yang Z D, 1990. A catalogue of the seagrasses of China. Chinese Journal of Oceanology and Limnology, 8(1): 74-91 DOI:10.1007/BF02846454 |
Dennison W C, Orth R J, Moore K A et al, 1993. Assessing water quality with submersed aquatic vegetation:Habitat requirements as barometers of Chesapeake Bay health. BioScience, 43(2): 86-94 |
Duarte C M, 1990. Seagrass nutrient content. Marine Ecology Progress Series, 67: 201-207 DOI:10.3354/meps067201 |
Duarte C M, Sand-Jensen K, 1990. Seagrass colonization:patch formation and patch growth in Cymodocea nodosa. Marine Ecology Progress Series, 65: 193-200 DOI:10.3354/meps065193 |
Duffy J E, 2006. Biodiversity and the functioning of seagrass ecosystems. Marine Ecology Progress Series, 311: 233-250 DOI:10.3354/meps311233 |
Ehlers A, Worm B, Reusch T B H, 2008. Importance of genetic diversity in eelgrass Zostera marina for its resilience to global warming. Marine Ecology Progress Series, 355: 1-7 DOI:10.3354/meps07369 |
Fonseca M S, Cahalan J A, 1992. A preliminary evaluation of wave attenuation by four species of seagrass. Estuarine, Coastal and Shelf Science, 35(6): 565-576 DOI:10.1016/S0272-7714(05)80039-3 |
Fourqurean J W, Duarte C M, Kennedy H et al, 2012. Seagrass ecosystems as a globally significant carbon stock. Nature Geoscience, 5(7): 505-509 DOI:10.1038/ngeo1477 |
Green E P, Short F T, 2004. World Atlas of seagrasses. Botanica Marina, 47(3): 259-260 |
Greve T M, Krause-Jensen D, Rasmussen M B et al, 2005. Means of rapid eelgrass (Zostera marina L.) recolonisation in former dieback areas. Aquatic Botany, 82(2): 143-156 DOI:10.1016/j.aquabot.2005.03.004 |
Harrison P G, 1993. Variations in demography of Zostera marina and Z.noltii on an intertidal gradient. Aquatic Botany, 45(1): 63-77 DOI:10.1016/0304-3770(93)90053-Y |
Harwell M C, Orth R J, 2002. Long-distance dispersal potential in a marine macrophyte. Ecology, 83(12): 3319-3330 DOI:10.1890/0012-9658(2002)083[3319:LDDPIA]2.0.CO;2 |
Hemminga M A, Duarte C M, 2000. Seagrass Ecology. Cambridge: Cambridge University Press
|
Hughes A R, Stachowicz J J, 2004. Genetic diversity enhances the resistance of a seagrass ecosystem to disturbance. Proceedings of the National Academy of Sciences of the United States of America, 101(24): 8998-9002 DOI:10.1073/pnas.0402642101 |
Hughes A R, Stachowicz J J, 2009. Ecological impacts of genotypic diversity in the clonal seagrass Zostera marina. Ecology, 90(5): 1412-1419 DOI:10.1890/07-2030.1 |
Jarvis J C, Moore K A, 2010. The role of seedlings and seed bank viability in the recovery of Chesapeake Bay, USA, Zostera marina populations following a large-scale decline. Hydrobiologia, 649(1): 55-68 DOI:10.1007/s10750-010-0258-z |
Keddy C J, Patriquin D G, 1978. An annual form of eelgrass in Nova Scotia. Aquatic Botany, 5: 163-170 DOI:10.1016/0304-3770(78)90059-1 |
Lee K S, Park S R, Kim Y K, 2007. Effects of irradiance, temperature, and nutrients on growth dynamics of seagrasses:A review. Journal of Experimental Marine Biology and Ecology, 350(1-2): 144-175 DOI:10.1016/j.jembe.2007.06.016 |
Meling-López A E, Ibarra-Obando S E, 1999. Annual life cycles of two Zostera marina L.populations in the Gulf of California:contrasts in seasonality and reproductive effort. Aquatic Botany, 65(1-4): 59-69 DOI:10.1016/S0304-3770(99)00031-5 |
Moore K A, Short F T, 2007. Zostera: biology, ecology, and management. In: Larkum A W D, Orth R J, Duarte C M eds. Seagrasses: Biology, Ecology and Conservation. Dordrecht: Springer, 361-386
|
Orth R J, Carruthers T J B, Dennison W C et al, 2006. A global crisis for seagrass ecosystems. BioScience, 56(12): 987-996 DOI:10.1641/0006-3568(2006)56[987:AGCFSE]2.0.CO;2 |
Phillips R C, Grant W S, McRoy C P, 1983. Reproductive strategies of eelgrass (Zostera marina L.). Aquatic Botany, 16(1): 1-20 DOI:10.1016/0304-3770(83)90047-5 |
Plus M, Deslous-Paoli J M, Dagault F, 2003. Seagrass (Zostera marina L.) bed recolonisation after anoxia-induced full mortality. Aquatic Botany, 77(2): 121-134 DOI:10.1016/S0304-3770(03)00089-5 |
Procaccini G, Mazzella L, 1998. Population genetic structure and gene flow in the seagrass Posidonia oceanica assessed using microsatellite analysis. Marine Ecology Progress Series, 169: 133-141 DOI:10.3354/meps169133 |
Rasheed M A, 2004. Recovery and succession in a multi-species tropical seagrass meadow following experimental disturbance:the role of sexual and asexual reproduction. Journal of Experimental Marine Biology and Ecology, 310(1): 13-45 DOI:10.1016/j.jembe.2004.03.022 |
Reynolds L K, Waycott M, McGlathery K J, 2013. Restoration recovers population structure and landscape genetic connectivity in a dispersal-limited ecosystem. Journal of Ecology, 101(5): 1288-1297 |
Robertson A I, Mann K H, 1984. Disturbance by ice and life-history adaptations of the seagrass Zostera marina. Marine Biology, 80(2): 131-141 |
Santamaría-Gallegos N A, Sánchez-Lizaso J L, Félix-Pico E F, 2000. Phenology and growth cycle of annual subtidal eelgrass in a subtropical locality. Aquatic Botany, 66(4): 329-339 DOI:10.1016/S0304-3770(99)00082-0 |
Setchell W A, 1920. Geographical distribution of the marine spermatophytes. Bulletin of the Torrey Botanical Club, 47(12): 563-579 DOI:10.2307/2480176 |
Setchell W A, 1929. Morphological and phenological notes on Zostera marina L. University of California Publications in Botany, 14: 389-452 |
Short F T, Wyllie-Echeverria S, 1996. Natural and human-induced disturbance of seagrasses. Environmental Conservation, 23(1): 17-27 |
Thayer G W, Kenworthy W J, Fonseca M S, 1984. Ecology of eelgrass meadows of the Atlantic Coast: A community profile. Report Number: FWS/OBS-84/02, Beaufort: National Marine Fisheries Service
|
van Katwijk M M, Wijgergangs L J M, 2004. Effects of locally varying exposure, sediment type and low-tide water cover on Zostera marina recruitment from seed. Aquatic Botany, 80(1): 1-12 DOI:10.1016/j.aquabot.2004.04.003 |
Xu S C, Wang P M, Zhou Y et al, 2018. New insights into different reproductive effort and sexual recruitment contribution between two geographic Zostera marina L. populations in temperate China. Frontiers in Plant Science, 9: 15
|
Zhou Y, Zhang F S, Yang H S et al, 2003. Comparison of effectiveness of different ashing auxiliaries for determination of phosphorus in natural waters, aquatic organism and sediments by ignition method. Water Research, 237: 3875-3882 |
 2020, Vol. 51
2020, Vol. 51


