中国海洋湖沼学会主办。
文章信息
- 田翠翠, 陆勤勤, 朱建一, 邓银银, 胡传明, 许广平, 周伟. 2020.
- TIAN Cui-Cui, LU Qin-Qin, ZHU Jian-Yi, DENG Yin-Yin, HU Chuan-Ming, XU Guang-Ping, ZHOU Wei. 2020.
- 温度对皱紫菜(Pyropia crispata)壳孢子萌发及叶状体形态建成的影响
- EFFECT OF TEMPERATURE ON CONCHOSPORE GERMINATION AND BLADES MORPHOGENESIS OF PYROPIA CRISPATA (BANGIALES, RHODOPHYTA)
- 海洋与湖沼, 51(5): 1144-1150
- Oceanologia et Limnologia Sinica, 51(5): 1144-1150.
- http://dx.doi.org/10.11693/hyhz20191200256
文章历史
-
收稿日期:2019-12-11
收修改稿日期:2020-02-06
2. 江苏省农业种质资源保护与利用平台 南京 210014;
3. 常熟理工学院生物与食品工程学院 常熟 215500
2. Protection and Utilization of Agricultural Germplasm Resources in Jiangsu Province, Nanjing 210014, China;
3. Department of Biology and Food Engineering, Changshu Institute of Technology, Changshu 215500, China
皱紫菜(Pyropia crispata Kjellman)(Sutherland et al, 2011)属暖温性海藻(黄淑芳, 2003), 主要分布在浙江以南的东海和南海海域(朱建一等, 2016)。叶状体圆形或肾脏形, 有裂片, 常呈花朵状, 生长在海浪冲击附近中潮带的岩石上(郑宝福等, 2009)。
紫菜作为我国重要的经济栽培海藻, 年净产值约2.58亿美元(Blouin et al, 2010)。藻类学者较多关注的是两大栽培物种条斑紫菜(P. yezoensis)和坛紫菜(P. haitanensis), 并在其形态学、细胞学、遗传育种及栽培等研究领域取得了令人瞩目的进展(许璞等, 2013)。近年来, 由温室效应引起的全球气候变暖已经给紫菜栽培业造成了影响(王华芝等, 2012)。因此, 紫菜耐高温品种的选育引起了研究者的重视。陈伟洲等(2015)研究了长紫菜(P. dentata)、坛紫菜、皱紫菜的叶状体对高温胁迫的响应能力, 发现皱紫菜耐高温能力最强。为进一步挖掘和开发紫菜种质资源, 有必要开展皱紫菜栽培技术研究工作。紫菜壳孢子作为“种子”是人工育苗的关键, 壳孢子的萌发率直接影响到育苗效果, 进而影响海上栽培的质量和产量。因此, 研究温度对壳孢子萌发的影响对紫菜的栽培具有重要意义。目前, 孔晓锐(2012)研究表明条斑紫菜壳孢子萌发最适温度为20℃。赵素芬等(2012)认为坛紫菜壳孢子附着和萌发的适宜温度是23—25℃。陈佩等(2015)研究表明适合长紫菜壳孢子萌发的温度为22—26℃。但关于温度对皱紫菜壳孢子萌发的影响未见报道。
紫菜叶状体早期呈现两种不同的发育模式:直线发育模式, 如条斑紫菜、坛紫菜; 两侧发育模式, 如半叶紫菜华北变种(P. katadai var. hemiphylla)(王金锋, 2007)。早期发育模式以及壳孢子细胞初始发生纵分裂位置对藻体的形态建成有很大的影响(朱建一等, 2016)。有研究发现圆紫菜(P. suborbiculata)壳孢子初始纵分裂发生时间较早是藻体为圆形或肾脏形的原因之一(杨秀文等, 2019)。皱紫菜的外形与圆紫菜相近, 叶状体形态建成未见报道。
本文采用皱紫菜自然种群制备成丝状体种质并接种贝壳, 通过贝壳丝状体的培育获取壳孢子。观察了不同培养温度对皱紫菜壳孢子萌发的影响, 并探讨了皱紫菜叶状体早期发育模式、形态建成过程、繁殖等生物学特性, 以期为皱紫菜的研究及人工栽培新物种开发提供基础资料。
1 材料与方法 1.1 种质制备及贝壳丝状体的培育皱紫菜采自广东南澳岛(23°20′N, 116°55′E)岩礁上分布的野生种群, 按照国家级紫菜种质库(江苏省海洋水产研究所, 南通)种质制备技术流程进行种质制备及保存(朱建一等, 2016)。将自由丝状体用食品粉碎机切割至200—300μm, 根据(200—300)ind./cm2的投放密度喷洒到附着基质文蛤壳上。培养条件为:温度23℃、光密度40μmol/(m2·s)、光周期12L︰12D。当丝状藻丝布满整个文蛤壳面时, 培养条件为:温度(29±1)℃, 光密度10—20μmol/(m2·s), 光周期8L︰16D, 期间每7d更换一次MES培养液(王素娟等, 1986), 以促进贝壳丝状体大量形成孢子囊枝。当壳面由暗红色转为红褐色时, 即标志着丝状体已经成熟。
1.2 壳孢子收集及萌发率比较试验将成熟的丝状体贝壳表面刷洗干净后, 放入高温灭菌海水中, 水温降至(25±1)℃, 充气培养以促进壳孢子放散。每天早上6点左右将洗刷干净后的贝壳放入装有100mL灭菌海水中, 早上9—10点将海水搅拌均匀收集放散的壳孢子。皱紫菜壳孢子萌发试验置光照培养箱(SANYO MLR-351, 日本)中进行。试验设4个温度组(15、20、25、28℃), 每个温度做4个平行样。培养条件均为光照40μmol/(m2·s), 光周期12L︰12D, 盐度26。将上述收集的壳孢子滴放在载玻片上, 显微镜下计数壳孢子总数。参考孔晓锐(2012)的方法, 静置培养24h后, 用显微镜(Nikon 90i, 日本)观察并记录壳孢子萌发情况, 连续统计4d。统计并计算其萌发率和萌发率的绝对增长速率, 公式如下:
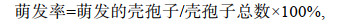 (1)
(1)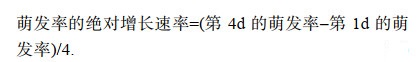 (2)
(2)在显微镜下观察壳孢子苗的生长发育情况。通过观察壳孢子第一、二次的细胞分裂形式, 了解皱紫菜叶状体早期发育模式。测定幼苗长度及长宽比, 探讨皱紫菜叶状体的形态建成。
1.4 繁殖特性观察通过对皱紫菜定期干出[即将附着藻体的玻片或藻体取出置于筛绢上, 15—20℃的空气中, 光照强度40μmol/(m2·s), 1h], 观察藻体是否放散单孢子及单孢子放散时间、放散量等, 判断其是否存在无性生殖。观察藻体是否形成雌雄生殖细胞, 以及是否放散果孢子形成丝状体, 以确定其是否具有有性生殖。
1.5 数据处理试验数据采用Graph Pad Prism 7.0和Origin 7.0软件进行数据处理及统计分析。用One-Way ANOVA检验差异的显著水平, 设显著水平为P < 0.05。
2 结果 2.1 不同温度下壳孢子萌发情况不同温度条件下壳孢子萌发率不同。第1天, 15℃温度组壳孢子萌发率与20、25和28℃温度组均无显著性差异(P > 0.05), 但第3天, 15℃温度组与20、25和28℃温度组有显著性差异(P < 0.05)(图 1), 且15℃温度组下壳孢子萌发率的绝对增长速率最小, 仅为4.43% (图 2), 说明低温会使壳孢子的萌发速度减缓。4天中20、25、28℃温度组之间无显著性差异(P > 0.05), 其中28℃温度组前3天的萌发率与20、25℃组相近; 第4天, 20°、25℃温度组萌发率显著提高, 但28℃温度组萌发率没有明显提高, 且观察显示萌发幼苗出现变绿死亡现象, 说明该温度不适合皱紫菜壳孢子的萌发。20和25℃温度组萌发率相近, 结合壳孢子萌发率绝对增长速率比较来看, 20—25℃是皱紫菜壳孢子萌发适宜温度, 20℃为最适温度。
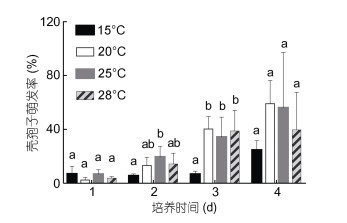 |
| 图 1 不同温度对皱紫菜壳孢子萌发的影响(n=4) Fig. 1 The effects of temperature on conchospore germination of P. crispata (n=4) 注:不同字母代表不同温度间差异显著(P < 0.05) |
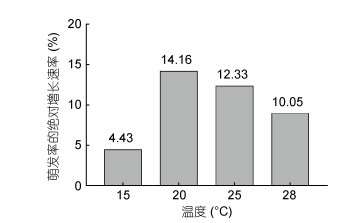 |
| 图 2 不同温度对壳孢子萌发率绝对增长速率的影响 Fig. 2 The effects of temperature on absolute growth rates of conchospore germination |
4个试验组的壳孢子苗早期发育模式均为直线发育模式。刚释放的壳孢子无细胞壁, 可做变形运动, 附着后即开始萌发, 孢子拉长, 色素体移向顶端(图 3a)。壳孢子第一次分裂为极性分裂, 经横分裂形成上下两个细胞, 一个为顶端细胞, 另一个靠附着基质的为基部细胞(图 3b)。基部细胞色素体偏位较小、液泡较大, 并逐渐伸长形成假根。第二次分裂仍为横分裂, 两个细胞的分裂不一定同步, 会形成3个或4个细胞的幼苗(图 3c, 3d)。随着更多次的细胞分裂, 壳孢子逐渐形成几个细胞呈直线排列的幼苗(图 3e)。当发育至7—10个细胞后, 幼苗细胞开始出现纵分裂, 纵分裂一般由幼苗中部细胞先开始, 逐渐向梢部及基部发展, 幼苗横向变宽呈“梭子形”(图 3f, 3g, 3h)。
 |
| 图 3 皱紫菜的早期发育过程 Fig. 3 The early development of P.crispata 注: a—h分别代表 1—8d的壳孢子萌发体 |
不同温度对皱紫菜形态建成过程略有影响。15、20℃温度组形态建成过程相似, 藻体多为不规则的半圆形裂片。25、28℃温度组形态建成过程相似, 藻体多为细长型叶片。
培养10d, 15、20℃温度组叶状体基部细胞不具生长势, 分裂缓慢, 逐渐向下伸出假根丝。中部细胞具生长优势, 分裂较梢部细胞快, 藻体逐渐变宽(图 4a), 长宽比为2.3—3.5 (图 5)。温度越高, 幼苗长宽比越大, 28℃温度组幼苗长宽比(4.6)是15℃温度组(2.3)的两倍。25、28℃温度组幼苗呈细长形(图 4e)。
 |
| 图 4 皱紫菜形态建成过程 Fig. 4 The blade morphogenesis of P.crispata 注: a—c: 15、20℃温度组分别在10、20、30d时叶状体的形态; d: 15℃温度组40d时叶状体的形态; e—g: 25、28℃温度组分别在10、20、30d时叶状体的形态; h: 25℃温度组40d时叶状体的形态 |
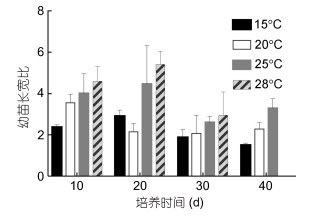 |
| 图 5 不同温度皱紫菜壳孢子幼苗长宽比 Fig. 5 The effects of temperature on the ratio length-to-width of P. crispate blades |
培养20d, 15、20℃温度组幼苗中部细胞纵分裂速度快于基部细胞, 使基部细胞逐渐向内旋转(图 4b)。25、28℃温度组幼苗长宽比由(4—4.6)增加到(4.4—5.4), 藻体进一步变细长(图 4f)。
培养30d, 由于藻体细胞分裂速度的差异, 纵分裂速度大于横分裂, 幼苗长宽比变小。15、20℃温度组幼苗基部细胞进一步向内旋转, 中部细胞形成的圆弧形组织逐渐占叶状体主导(图 4c)。25、28℃温度组幼苗已形成披针形小叶状体(图 4g)。
培养40d, 15℃温度组已形成半圆形不规则裂片(图 4d), 幼苗长宽比由原来的2.3减小至1.5。25℃温度组幼苗形成基部呈褶皱状、长形叶状体(图 4h)。28℃温度组幼苗细胞由于受高温刺激, 细胞分裂受阻, 藻体逐渐腐烂死亡。
2.4 不同温度下皱紫菜的繁殖对皱紫菜壳孢子幼苗干出后放散观察结果:培养50d, 15℃温度组部分藻体顶端、边缘等部位细胞间排列较疏松(图 6a), 干出后即可见放散出类似单孢子的细胞, 细胞呈椭圆形或圆形(图 6b), 每株藻体约统计到60个孢子。20℃温度组同样是藻体前端边缘细胞疏松部位有类单孢子放散出来, 放散量较少, 每株藻体约30个孢子。静置培养下, 有些孢子已原位萌发成几个细胞的小苗(图 6c, )。25和28℃温度组的壳孢子苗整个培养过程中均未发现有类单孢子放散的现象, 且分别培养至50、40d后藻体逐渐发白腐烂。
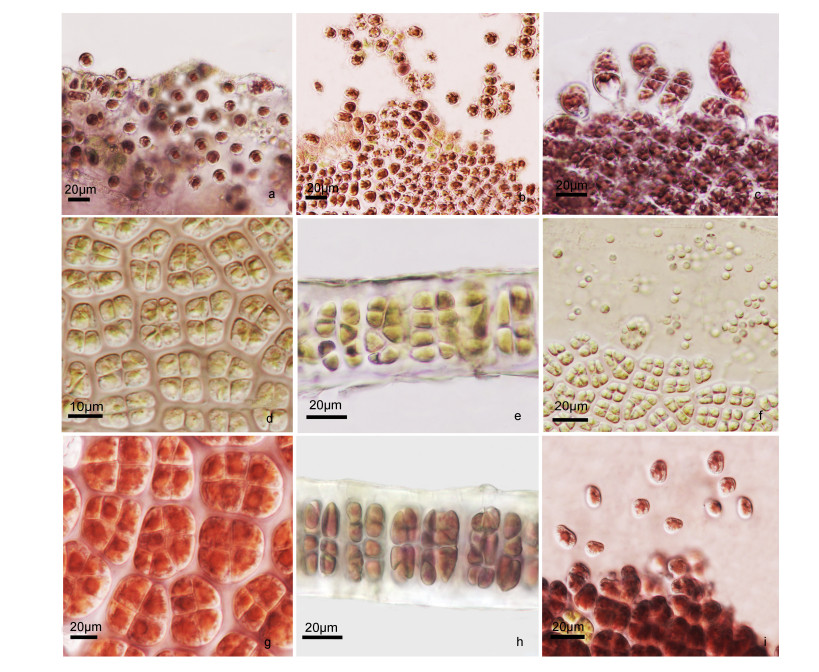 |
| 图 6 皱紫菜的繁殖 Fig. 6 The reproduction of P. crispata 注: a—b: 15℃温度组藻体边缘放散类单孢子; c: 20℃温度组藻体类单孢子原位萌发; d:雄性生殖细胞; e:精子囊器切面观; f:精子放散; g:雌性生殖细胞; h:果孢子囊切面观; i:果孢子释放 |
培养60d后, 15和20℃温度组藻体先后在藻体边缘出现有性生殖细胞。首先观察到的是沿藻体前端边缘形成雄性精子囊器细胞, 并逐渐延伸分布至藻体中、后部区域, 随着精子囊器细胞的分裂成熟, 细胞内色素逐渐减淡, 成熟时呈金黄色(图 6d)。成熟的单个精子囊器含64个精子囊, 分裂式为♂A4B4C4 (图 6e), 精子囊器细胞成熟后开始放散精子, 精子球形, 直径3—5μm, 无游动能力(图 6f)。雌性果孢子囊的区域呈现深紫红色(图 6g), 果孢子囊内含有32个果孢子, 分裂式为♀A4B2C4 (图 6h), 成熟后放散出的果孢子球形(图 6i), 直径10—15μm, 红褐色, 萌发形成丝状体。
3 讨论 3.1 温度对壳孢子萌发生长的影响萌发试验显示, 15℃温度组萌发率低, 表明该温度不适合皱紫菜壳孢子的萌发; 20、25、28℃温度组之间无显著性差异(P > 0.05), 但28℃组幼苗出现死亡现象, 显然该温度同样不适合皱紫菜壳孢子的萌发。结合萌发率绝对增长速率比较来看, 20—25℃是皱紫菜壳孢子萌发适宜温度。此研究结论与赵素芬等(2012)对坛紫菜壳孢子萌发适宜温度23—25℃、陈佩等(2015)对长紫菜壳孢子萌发适宜温度22—26℃相似。然而对壳孢子萌发后叶状体的生长跟踪来看, 尽管25℃温度对壳孢子萌发适宜, 持续时间长了并非完全有利, 说明壳孢子可以忍受短期25℃的水温, 随着培养时间的延长, 幼苗对高温的耐力逐渐降低, 叶状体生长受阻出现发白腐烂现象。因此, 本文认为20℃是皱紫菜壳孢子幼苗生长的适宜水温。这一结论与陈伟洲等(2013)的皱紫菜的适宜生长温度为17—23℃, 最适宜温度为20℃一致。而与汤晓荣等(1998)对条斑紫菜幼苗生长的适温18—20℃存在一定差异, 说明紫菜壳孢子生长的条件与紫菜的种类有关。
目前南方沿海已将皱紫菜作为新开发的紫菜人工栽培物种, 根据上述试验的结果, 从栽培生产安全的角度来看, 皱紫菜的壳孢子采苗时间应该安排在栽培海区水温降至20—25℃期间进行, 有利于皱紫菜壳孢子苗的生长与发育。
3.2 叶状体早期发育模式及形态建成本试验4种温度培养条件下, 皱紫菜壳孢子萌发过程均显示为直线发育模式, 与条斑紫菜、坛紫菜、少精紫菜(P. oligospermatangia)、圆紫菜和红毛菜的壳孢子发育模式相同(王金锋, 2007; Wang et al, 2010), 皱紫菜壳孢子萌发过程及分裂初期具有直线生长的特点。
紫菜壳孢子细胞纵分裂初始发生位置影响藻体形态建成(朱建一等, 2016)。杨秀文等(2019)发现圆紫菜壳孢子发育至7—9细胞时开始纵分裂, 认为初始纵分裂发生时间较早是藻体为圆形或肾脏形的原因之一。皱紫菜的外形与圆紫菜相近, 是什么原因引起皱紫菜叶状体形态的变化?根据本试验观察结果显示:当壳孢子发育至7—10细胞后, 藻体开始出现纵向分裂, 藻体长宽比逐渐变小是影响皱紫菜形态建成的因素之一, 这一细胞分裂形式为藻体形成弧形或扇形提供了基础; 另外中部与梢部细胞分裂速度不同步, 中部细胞分裂较快形成圆弧形裂片, 梢部细胞逐渐分裂变长, 从而使藻体形成不规则的半圆形裂片。同时, 不同温度对藻体形态略有影响, 15℃温度组圆形或半圆形藻体较其他组多, 25、28℃温度组更多是基部呈褶皱状、有一个较大、长形主裂片的叶状体。
3.3 繁殖特性紫菜属物种几乎都具有性生殖, 有的物种生活史中还可兼无性生殖(Blouin et al, 2010)。例如:条斑紫菜(梅俊学等, 2001)、甘紫菜(P. tenera)(曾呈奎等, 1954)、圆紫菜(Cao et al, 2019)、拟线性紫菜(P. pseudolinearis)(Yanagisawa et al, 2019)的叶状体可以释放单孢子。这一繁殖特性在栽培生产中对幼苗的补充起着很大的作用, 所以, 研究单孢子的形成及放散量并在栽培生产中加以利用具有重要意义。
本研究对皱紫菜繁殖特性观察显示, 在15—20℃范围内, 少部分皱紫菜藻体边缘可放散类单孢子, 且15℃温度组藻体的孢子放散量大于20℃温度组, 显示较低温度有利于皱紫菜边缘细胞形成类单孢子及其放散。然而与条斑紫菜放散单孢子为繁殖特性相比, 皱紫菜的类单孢子放散不具有普遍性和共性, 对于皱紫菜是否具无性生殖仍需进一步研究。本试验培养结果显示, 有性生殖是皱紫菜的主要繁殖方式。
4 结论通过观察、测定不同温度下对皱紫菜的壳孢子萌发率和藻体生长情况, 揭示皱紫菜壳孢子萌发生长适宜温度为20—25℃, 最适温度为20℃。基于本研究结果, 建议皱紫菜的壳孢子采苗时间安排在栽培海区水温降至20—25℃期间进行。试验显示, 温度对皱紫菜的形态建成有一定影响, 15、20℃温度组藻体多为不规则的半圆形裂片, 25、28℃温度组藻体多为细长型叶片, 温度越高, 藻体形态越细长。对皱紫菜繁殖方式的初步研究显示, 有性生殖是其主要的繁殖方式, 但低温组(15、20℃)部分藻体可以产生少量与单孢子类似的无性繁殖细胞。
王华芝, 严兴洪, 李琳. 2012. 条斑紫菜(Porphyra yezoensis)耐高温品系的筛选及特性分析. 海洋与湖沼, 43(2): 363-369 |
王金锋, 2007.红毛菜科海藻色素突变特征及其配子体初期发育模式的研究.南京: 南京师范大学硕士学位论文, 12-33
|
王素娟, 张小平, 徐志东, 等. 1986. 坛紫菜营养细胞和原生质体培养的研究Ⅰ. 海洋与湖沼, 17(3): 217-221 |
孔晓锐, 2012.环境因子对条斑紫菜壳孢子附着、萌发及幼苗生长的影响.青岛: 中国海洋大学硕士学位论文, 26-38
|
朱建一, 严兴洪, 丁兰平, 等. 2016. 中国紫菜原色图集. 北京: 中国农业出版社, 36-40
|
汤晓荣, 费修绠. 1998. 温度和光照对条斑紫菜壳孢子苗生长和单孢子形成放散的影响. 水产学报, 22(4): 378-381 |
许璞, 张学成, 王素娟, 等. 2013. 中国主要经济海藻的繁殖与发育. 北京: 中国农业出版社, 165-189
|
杨秀文, 丁洪昌, 严兴洪, 等. 2019. 圆紫菜(Pyropia suborbiculata)减数分裂时期的遗传分析与叶状体形态建成. 海洋与湖沼, 50(1): 173-180 |
陈佩, 黄中坚, 朱建一, 等. 2015. 环境条件对长紫菜壳孢子放散、附着和萌发的影响. 南方水产科学, 11(1): 55-61 |
陈伟洲, 许俊宾, 吴文婷, 等. 2015. 三种紫菜叶状体对高温胁迫的生理响应. 热带海洋学报, 34(1): 49-55 |
陈伟洲, 吴文婷, 许俊宾, 等. 2013. 不同生态因子对皱紫菜生长及生理组分的影响. 南方水产科学, 9(2): 14-19 |
郑宝福, 李钧, 2009.中国海藻志-第二卷, 第一册-红藻门, 紫球藻目红盾藻目角毛藻目红毛菜目.北京:科学出版社, 65-85
|
赵素芬, 罗世菊, 陈伟洲, 等. 2012. 海藻与海藻栽培学. 北京: 国防工业出版社, 297-299
|
黄淑芳, 2003.臺灣東北角海藻圖錄.台湾: 國立臺灣博物館, 117-118
|
梅俊学, 费修绠, 王斌. 2001. 条斑紫菜单孢子的研究. 海洋与湖沼, 32(4): 402-407 |
曾呈奎, 张德瑞. 1954. 紫菜的研究Ⅰ. 甘紫菜的生活史.植物学报, 3(3): 287-302 |
Blouin N A, Brodie J A, Grossman A C et al, 2010. Porphyra:a marine crop shaped by stress. Trends in Plant Science, 16(1): 29-37 |
Cao Y Z, Ding H C, Zhao S et al, 2019. Cytological studies on Pyropia Suborbiculata. Journal of Applied Phycology, 31(6): 4049-4060 DOI:10.1007/s10811-019-01835-4 |
Sutherland J E, Lindstrom S C, Nelson W A et al, 2011. A new look at an ancient order:generic revision of the Bangiales (Rhodophyta). Journal of Phycology, 47(5): 1131-1151 DOI:10.1111/j.1529-8817.2011.01052.x |
Wang J F, Zhu J Y, Zhou W et al, 2010. Early development patterns and morphogenesis of blades in four species of Porphyra (Bangiales, Rhodophyta). Journal of Applied Phycology, 22(3): 297-303 DOI:10.1007/s10811-009-9459-0 |
Yanagisawa R, Sekine N, Mizuta H et al, 2019. Transcriptomic analysis under ethylene precursor treatment uncovers the regulation of gene expression linked to sexual reproduction in the dioecious red alga Pyropia pseudolinearis. Journal of Applied Phycology, 31(5): 3317-3329 DOI:10.1007/s10811-019-01808-7 |
 2020, Vol. 51
2020, Vol. 51


