中国海洋湖沼学会主办。
文章信息
- 张文静, 董志军, 孙西艳, 张晨, 刘永亮, 侯朝伟, 赵建民. 2020.
- ZHANG Wen-Jing, DONG Zhi-Jun, SUN Xi-Yan, ZHANG Chen, LIU Yong-Liang, HOU Chao-Wei, ZHAO Jian-Min. 2020.
- 2018年烟台四十里湾及其邻近海域网采浮游植物群落结构的时空变化
- SPATIAL AND TEMPORAL DISTRIBUTION OF NET-SAMPLED PHYTOPLANKTON COMMUNITY IN SISHILI BAY AND ITS ADJACENT WATER, YANTAI IN 2018
- 海洋与湖沼, 51(5): 1151-1161
- Oceanologia et Limnologia Sinica, 51(5): 1151-1161.
- http://dx.doi.org/10.11693/hyhz20191200252
文章历史
-
收稿日期:2019-12-09
收修改稿日期:2020-01-30
2. 中国科学院海洋大科学研究中心 青岛 266071
2. Center for ocean mega-science, Chinese Academy of Sciences, Qingdao 266071, China
浮游植物作为海洋生态系统的初级生产者, 在整个生态系统的物质循环和能量流动方面起着重要作用。同时, 浮游植物的生长和分布受温度、营养盐、海流以及其他生物等自然条件和人类活动的影响, 能够对海洋环境的变化做出响应(Lalli et al, 1993;吴文广等, 2018;栾青杉等, 2018), 从而可对环境变化起到指示作用。通过研究海洋浮游植物的群落结构组成, 有助于了解海洋生态系统的健康状况, 同时对海洋生物资源的可持续利用具有重要意义。
烟台四十里湾位于山东半岛北部, 毗邻北黄海, 是一个半封闭海湾, 位于养马岛以西, 烟台港以东, 是山东重要的近海养殖基地, 海水养殖对浮游植物的群落结构组成和分布有重要影响(白美娜等, 2019;刘朋超等, 2019)。同时, 近岸人口密集, 有逛荡河、辛安河等4条自然河流和多个排污口, 海域生态环境受到人类活动的强烈干扰。该海域赤潮时有发生, 据统计从1998年至2018年20年间, 共发生18次赤潮, 其中2004年和2010年每年都发生3次赤潮, 2005年、2007年、2008年和2018年均发生2次(吴玉霖等, 2001;杨秀兰等, 2008;喻龙等, 2009a, 2009b;高昊东等, 2011;刘爱英等, 2013;喻龙等, 2014;王文君, 2017), 对烟台市滨海旅游业、养殖区和邻近港口的影响重大; 然而, 对该海域浮游植物群落的调查大多集中在2010年之前(蒋金杰等, 2011;王妍等, 2013;李斌等, 2013;杨俊丽, 2018), 近年来尚无对该海域网采浮游植物的调查研究。
本研究基于牟平海岸带环境综合试验站对四十里湾及其邻近海域的调查数据, 对比历史研究结果, 对该海域2018年浮游植物的群落结构变化进行分析, 探讨了影响浮游植物群落分布的主要环境因子, 了解了烟台近海浮游植物群落结构现状以及年度变迁, 为人类活动和全球气候变化影响下近海生态系统的演替和变化规律提供了科学依据。
1 材料与方法 1.1 调查站位与采样本研究在烟台四十里湾及其邻近海域共设置13个调查站位(图 1), 分别于2018年5月(春季)、8月(夏季)、11月(秋季)和2019年1月(冬季)采样调查。
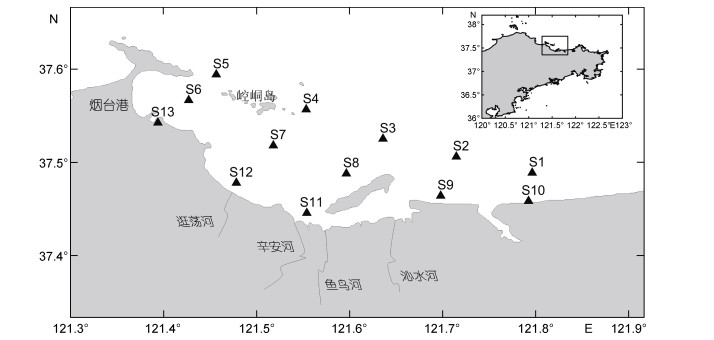 |
| 图 1 烟台四十里湾及其邻近海域调查站位图 Fig. 1 Sampling stations in Sishili Bay and its adjacent water, Yantai |
参照《海洋调查规范第6部分》(GBT 12763.1- 2007)进行浮游植物采样, 采用浅水III型浮游生物网(网口直径37cm, 网口面积0.1m2, 网径76μm)自水体底层至表层垂直拖网1次, 收集浮游植物样品后立即加5% (v/v)甲醛固定。带回实验室后, 将浮游植物样品充分混匀, 取1—5mL利用Olympus CKX41倒置显微镜计数和鉴定。在现场用RBR concerto3温盐深度测量仪(RBR公司, 加拿大)测定水体的温度(T)、盐度(S)和溶解氧浓度(DO); 用10L采水器分别采集各站位表层和底层水, 用于实验室测定硅酸盐(SiO32-)、磷酸盐(PO43-)和硝酸盐(NO3-)和亚硝酸盐(NO2-)浓度(QuAAtro营养盐自动分析仪, SEAL公司, 德国)。
1.2 数据处理与分析浮游植物优势种以优势度指数判断, 一般将浮游植物优势度≥0.02的种类定义为优势种, 优势度Y计算公式为:
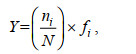 (1)
(1)式中, N为调查站位所有浮游植物出现的总个体数; ni为第i种浮游植物的个体数; fi为第i种浮游植物在各站位的出现频率。
浮游植物多样性指数用香农-威纳指数(H′)(Shannon et al, 1949)表示:
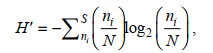 (2)
(2)式中, S为样品中的物种数。
浮游植物均匀度指数J用Pielou(1969)公式计算:
 (3)
(3)式中, Hmax表示最大物种多样性指数Hmax=log2S, S为群落中的总物种数。
浮游植物优势种更替率R计算公式为(张芳等, 2005;李轶平等, 2019):
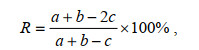 (4)
(4)式中, a、b分别为相邻季节浮游植物的优势种数; c为相邻季节相同优势种的种数。
为减少稀有种对浮游植物群落结构的干扰, 选取全年出现频率大于15%的种类进行分析, 并将其log(x+1)转化。采用Primer 6, 构建浮游植物Bray-Curtis相似性矩阵, 进行聚类分析。采用CANOCO4.5, 进行浮游植物群落分布与环境因子的冗余分析(RDA, Redundancy analysis)。为排除环境因子之间的高度自相关性, 多次运行RDA分析, 逐次去除膨胀因子(VIF)最大的环境因子, 最终保留VIF小于10的环境因子。同时, 利用forward selection(manual selection)筛选出通过蒙特卡罗置换检验(Monte Carlo Permutation test)(P < 0.05, n=999)的环境因子。采用surfer11绘制调查站位图、浮游植物群落分布图和丰度平面分布图, SAS 9.2进行数据统计分析(ANOVA和Wilcoxon test)。
2 结果 2.1 浮游植物种类组成、优势种和群落结构 2.1.1 种类组成2018年四十里湾及其邻近海域4个航次共鉴定浮游植物4门69属116种, 其中硅藻门和甲藻门浮游植物为主要类群。春季浮游植物种类最少, 共鉴定出浮游植物3门39属49种, 其中硅藻门31属39种, 占该季节浮游植物总种类数的79.59%;甲藻门7属9种, 占总种类数的18.37%;着色鞭毛藻门1属1种。夏季浮游植物种类最多, 共鉴定浮游植物4门53属88种, 硅藻门浮游植物38属61种, 占该季节浮游植物总种类的69.32%;甲藻12属23种, 占总种类数的26.14%;着色鞭毛藻门2属3种; 未定类(三深碎裂藻, Ebria tripartita)1种。秋季浮游植物包括硅藻门34属59种, 占该季节浮游植物总种类数的83.10%;甲藻门5属10种; 着色鞭毛藻门2属2种。冬季鉴定出浮游植物3门34属57种, 其中硅藻所占比例仍然最高, 为82.46%, 包括25属47种; 甲藻7属8种; 着色鞭毛藻2属2种。
2.1.2 优势种及其生态类型2018年四十里湾及其邻近海域浮游植物优势种主要有5种生态类型(表 1), 以广温近岸种、广布种和温带近岸种为主, 不同季节浮游植物优势种的种类和数量存在差异。冬季(1月)优势种多样性最高, 包括:卡氏角毛藻、旋链角毛藻、丹麦角毛藻、柔弱角毛藻、圆筛藻属、具槽帕拉藻、尖刺拟菱形藻和中肋骨条藻5属7种, 其中优势地位最明显的是尖刺拟菱形藻。夏季(8月)优势种多样性最低, 柔弱拟菱形藻具有非常高的优势地位, 其丰度占浮游植物总丰度的87.3%, 其次为尖刺拟菱形藻。秋季(11月)浮游植物优势种的多样性位居第二, 共6种, 包括:透明辐杆藻、卡氏角毛藻、旋链角毛藻、柔弱角毛藻、威利圆筛藻和柔弱拟菱形藻, 其中威利圆筛藻优势度最高。春季(5月)优势种的种类数仅高于夏季, 密连角毛藻的优势度最高, 其次是夜光藻、具槽帕拉藻, 圆筛藻属的优势度最低。根据各季节优势种的物种组成, 计算相邻季节的种群更替率, 春夏季浮游植物优势种的更替率为100%, 夏秋季为85.71%, 而秋冬季最低, 为72.73%。
| 优势种 | 优势度 | |||||
| 季节 | ||||||
| 序号 | 中文名 | 拉丁名 | 春季 | 夏季 | 秋季 | 冬季 |
| 1 | 透明辐杆藻a | Bacteriastrum hyalinum | 0.09 | |||
| 2 | 卡氏角毛藻b | Chaetoceros castracanei | 0.03 | 0.10 | ||
| 3 | 旋链角毛藻b | Chaetoceros curvisetus | 0.09 | 0.04 | ||
| 4 | 丹麦角毛藻c | Chaetoceros danicus | 0.03 | |||
| 5 | 柔弱角毛藻c | Chaetoceros debilis | 0.16 | 0.03 | ||
| 6 | 密连角毛藻d | Chaetoceros densus | 0.11 | |||
| 7 | 圆筛藻 | Coscinodiscus sp. | 0.02 | 0.09 | ||
| 8 | 威利圆筛藻e | Coscinodiscus wailesii | 0.28 | |||
| 9 | 具槽帕拉藻a | Paralia sulcata | 0.40 | 0.18 | ||
| 10 | 柔弱拟菱形藻c | Pseudo-nitzschia delicatissima | 0.84 | 0.07 | ||
| 11 | 尖刺拟菱形藻b | Pseudo-nitzschia pungens | 0.14 | 0.20 | ||
| 12 | 中肋骨条藻a | Skeletonema costatum | 0.12 | |||
| 13 | 夜光藻b | Noctiluca scintillans | 0.06 | |||
| 注: a.广布种; b.广温近岸种; c.温带近岸种; d.温带外洋种; e.北温带至亚热带种 | ||||||
筛选出全年出现频率大于15%的种类, 共30属58种, 将其log(x+1)转化后, 进行Bray-Curtis相似性聚类分析, 结果如图 2和图 3所示。
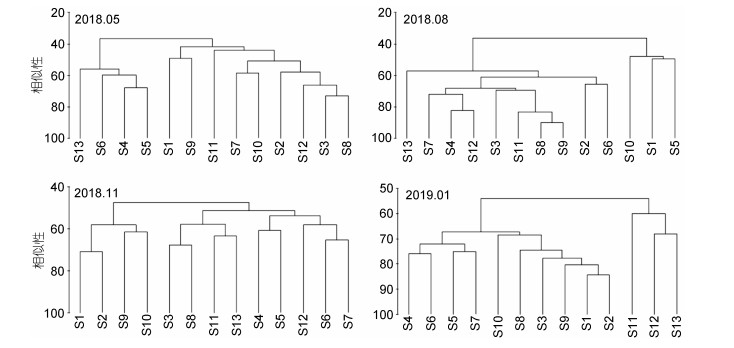 |
| 图 2 浮游植物Bray-Curtis相似性聚类结果 Fig. 2 Bray-Curtis similarity cluster analysis of phytoplankton from different stations |
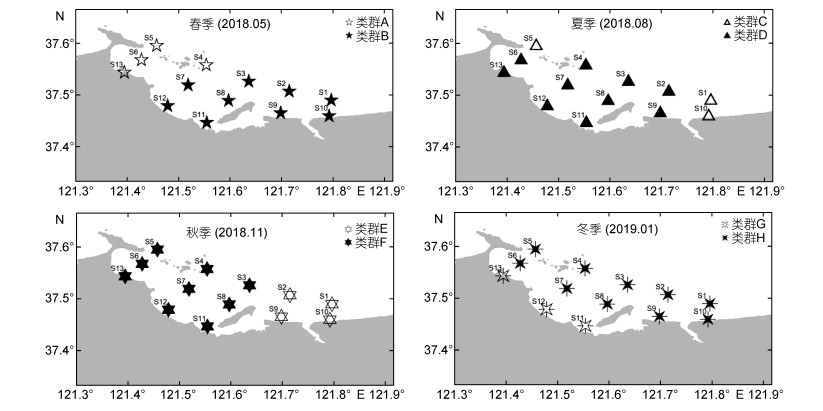 |
| 图 3 浮游植物类群及其分布 Fig. 3 Horizontal distribution of phytoplankton groups |
春季四十里湾及其邻近海域浮游植物可划分为两个生态类群, 靠近烟台港的类群A和中西部水域的类群B, 不同区域浮游植物生态类群存在明显差异。类群A中浮游植物的平均丰度为(3.62±1.94)×105cells/m3, 广布种-近岸底栖种具槽帕拉藻占绝对优势, 其丰度占类群A全部浮游植物丰度的81.45%, 温带外洋种密连角毛藻是位居第二位的优势种; 类群B中浮游植物的平均丰度为(5.60±2.66)×105cells/m3, 主要优势种为密连角毛藻, 广温近岸种夜光藻为第二位优势种, 另外圆筛藻、具槽帕拉藻也是该类群的优势种。
夏季浮游植物群落呈斑块化分布, 类群C包括四十里湾及其邻近海域东部的S1和S10站位, 还有调查区域最外缘的S5站位; 类群D(其余站位)分布比较集中, 受赤潮区域(S7、S11、S12、S13)影响明显:站位S7、S11和S12的柔弱拟菱形藻达到赤潮水平(丰度分别为2.42×109、2.83×108、2.30×108cells/m3), 站位S11和S13的尖刺拟菱形藻亦达到赤潮水平(丰度为3.12×108、1.17×108cells/m3)。类群C和类群D浮游植物的平均丰度分别为(5.22±4.11)×105和(3.75±7.62)×108cells/m3。类群C有4个优势物种, 除柔弱拟菱形藻和尖刺拟菱形藻之外, 广布种粗刺角藻和扁面角毛藻也是该类群的优势种, 粗刺角藻为第一优势种, 占该区域浮游植物总丰度的36.47%。在类群D中, 柔弱拟菱形藻占绝对优势, 占该区域浮游植物总丰度的83.74%, 是第二位优势种尖刺拟菱形藻的5.98倍。
秋季四十里湾及其邻近海域浮游植物以养马岛为界呈中西部(类群F)和东部(类群E)两个区域。类群E的平均丰度[(1.07±1.42)×106cells/m3]高于类群F[(1.92±2.24)×105cells/m3], 优势种类以广温近岸种和温带近岸种为主(威利圆筛藻、柔弱角毛藻、旋链角毛藻、透明辐杆藻、柔弱拟菱形藻、卡氏角毛藻、短角弯角藻和柔弱几内亚藻8种), 类群F的优势种以多种生态类型的浮游植物交叠出现(威利圆筛藻、格氏圆筛藻和柔弱拟菱形藻3种)。北温带至亚热带种威利圆筛藻在两个区域中均为第一优势种, 其在类群F中占该区域全部浮游植物的66.61%, 在类群E中占20.62%。
冬季浮游植物可划分为近岸区(类群G)和远岸区(类群H)两个类群。具槽帕拉藻在近岸区未被发现, 在远岸区是最主要的优势种, 占远岸区浮游植物总丰度的24.64%。类群G中广布种中肋骨条藻占绝对优势, 占近岸区浮游植物优势种的40.16%, 其他优势种以广温近岸种为主, 也有温带近岸种出现。类群G和类群H的平均丰度分别为(1.89±2.40)×105和(7.90±5.38)×105cells/m3。广温近岸种卡氏角毛藻、旋链角毛藻、尖刺拟菱形藻, 温带近岸种柔弱角毛藻和广布种中肋骨条藻以及圆筛藻是两个类群共同的优势种(属); 此外, 类群G中的优势种(属)还有海链藻, 类群H的优势种还包括温带近岸种丹麦细柱藻。
2.2 浮游植物丰度和群落多样性 2.2.1 浮游植物丰度的时空分布四十里湾及其邻近海域浮游植物2018年平均丰度为7.26×107cells/m3。由图 4可知, 2018年全年浮游植物分布呈单峰模式, 浮游植物丰度最高值均出现在夏季(8月), 达到2.89×108cells/m3, 其他季节浮游植物丰度均为~105cells/m3, 其中秋季(8.92×105cells/m3) > 冬季(6.52×105cells/m3) > 春季(1.50×105cells/m3)。从不同浮游植物类群来看, 不同季节硅藻的丰度均最高, 其次是甲藻、着色鞭毛藻和其他藻类。
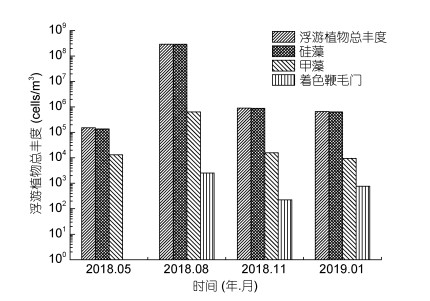 |
| 图 4 不同类群浮游植物丰度的季节变化 Fig. 4 Seasonal variations in phytoplankton abundance, Bacillariophyta, and Pyrrophyta Chromophyta densities |
从图 5可以看出, 2018年烟台近海浮游植物丰度的平面分布因季节而异。春季, 整个调查区域的平面分布特征差异不显著; 夏季分布的高值区出现在养马岛以西海域, 西部的浮游植物水平明显高于东部; 秋季高值区出现在养马岛近岸海域; 冬季与夏季相反, 调查区域东部的丰度水平明显高于西部。总体而言, 从春季到冬季, 浮游植物总丰度的高值区从调查区域的西部向东部逐渐移动。硅藻的水平分布趋势与浮游植物总丰度的分布趋势相同, 浮游植物的水平分布格局由硅藻主导。甲藻的分布趋势与硅藻不同, 整体来讲, 春、秋、冬季, 整个调查区域内差异不明显, 均呈现较低水平; 夏季在调查区域西部沿岸一带出现高值区。
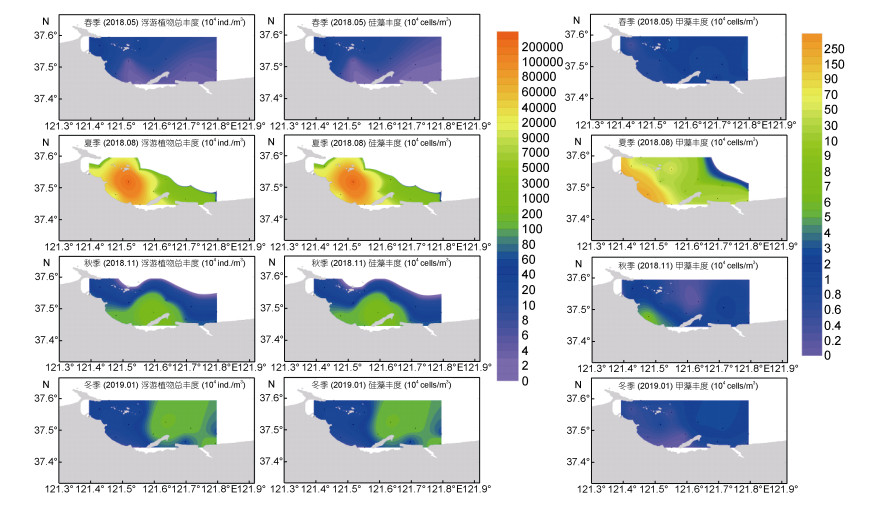 |
| 图 5 不同季节浮游植物总丰度、硅藻、甲藻细胞丰度平面分布图 Fig. 5 Seasonal variation in horizontal distribution of phytoplankton, Bacillariophyta, and Pyrrophyta abundance |
2018年四十里湾及其邻近海域浮游植物Shannon-Wiener多样性指数有明显的季节变化(图 6)。除秋季与冬季的差异无统计学意义外, 其余各季节之间的差异均有统计学意义(ANOVA, P < 0.05)。冬季Shannon-Wiener指数最高, 为3.21;秋季次之, 为3.09;夏季最低, 为1.58;春季为2.39;全年平均值为2.57。2018年4个季节的Pielou均匀度指数的变化趋势与Shannon-Wiener指数一致(图 6), 但是春季(0.64)、秋季(0.60)与冬季(0.70)间的Pielou指数无统计学差异, 与之相比, 夏季最低(0.31)(ANOVA, P < 0.05)。
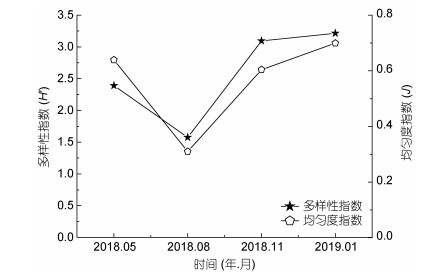 |
| 图 6 浮游植物多样性指数和均匀度指数的季节变化 Fig. 6 Seasonal variation in diversity index H′ and equitability J of phytoplankton |
对筛选出的2018年春季、夏季、秋季和冬季的浮游植物群落数据, 共包括30属58种, 分别进行去趋势对应分析(Detrended Correspondence Analysis, DCA), 结果显示其排序轴梯度长度(Length of gradient)均小于3, 故选用RDA(Redundancy analysis)线性模型进行排序。最终用forward selection(manual selection)筛选出的通过蒙特卡罗置换检验(Monte Carlo Permutation test)(P < 0.05, n=999)并且VIF小于10的环境因子为:春季:温度(T)、溶解氧浓度(DO)、硅酸盐(SiO32-)、磷酸盐(PO43-)和硝酸盐(NO3-); 夏季:盐度(S)、SiO32-和NO3-; 秋季: T、SiO32-、PO43-和亚硝酸盐(NO2-); 冬季: T、S和DO。
RDA排序较好地描述了春季、夏季、秋季和冬季浮游植物群落与环境因子的关系, 其中各约束轴(第一轴为水平轴, 第二轴为垂直轴)代表了解释变量对响应变量做出的解释, 环境因子在第一轴的分布表明不同季节影响浮游植物群落的主要环境因子不同(图 7, 表 2)。春季, 温度(相关性系数Correlated- Weight, CW=0.62)和SiO32-(CW=0.54)与浮游植物群落结构有显著相关性, 温度和SiO32-与第一轴显著正相关, NO3-浓度(CW=-0.44, P=0.05)与第一排序轴负相关。夏季, 与各样方浮游植物群落结构显著相关的环境因子是S(CW=-0.88)。秋季, SiO32-与第一轴显著负相关, 沿第一排序轴, 从左到右, SiO32-浓度逐渐减小。冬季, 溶解氧含量(CW=0.86)和温度(CW=-0.75)是影响各样方浮游植物群落结构的主要环境因子, 沿着第一排序轴从左到右, 温度升高, 溶解氧含量降低。
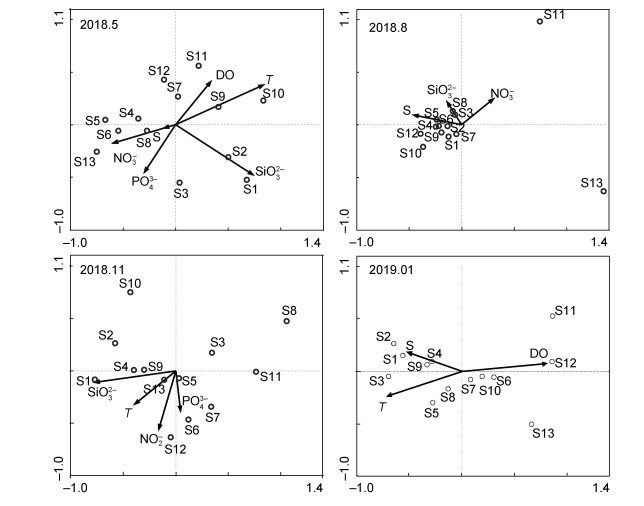 |
| 图 7 浮游植物群落结构分布与环境因子的RDA排序图 Fig. 7 RDA ordination of phytoplankton community distribution with environmental variables 注:图中箭头代表环境因子, 空心圆圈代表采样站位 |
| 因子 | 春季 | 夏季 | 秋季 | 冬季 | |||||||
| 第1排序轴 | 第2排序轴 | 第1排序轴 | 第2排序轴 | 第1排序轴 | 第2排序轴 | 第1排序轴 | 第2排序轴 | ||||
| T | 0.62 | –0.34 | –0.39 | –0.46 | –0.75 | –0.49 | |||||
| S | –0.08 | –0.03 | –0.88 | 0.25 | –0.51 | 0.35 | |||||
| DO | 0.86 | 0.12 | |||||||||
| SiO32- | 0.54 | 0.57 | –0.26 | 0.58 | –0.77 | –0.16 | |||||
| PO43- | –0.22 | 0.53 | 0.04 | –0.55 | |||||||
| NO3- | –0.44 | 0.23 | 0.59 | 0.67 | |||||||
| NO2- | –0.16 | –0.81 | |||||||||
| 特征值 | 0.24 | 0.11 | 0.23 | 0.11 | 0.26 | 0.13 | 0.27 | 0.06 | |||
| 浮游植物与环境因子相关性的累积百分数% | 41.30 | 59.80 | 58.00 | 87.30 | 46.70 | 69.60 | 74.40 | 90.60 | |||
| 典型特征值总和 | 0.59 | 0.39 | 0.55 | 0.37 | |||||||
春季(5月)SiO32-浓度为四个季节中最低水平[平均值为(60.32±23.97)μg/L, 27.85—104.60μg/L], N/Si和Si/P比值(原子比)分别为1.76和13.29, 说明对浮游植物的生长存在一定程度的硅限制, 这也是造成春季浮游植物的丰度为全年最低值的重要原因。王妍等(2013)对四十里湾及其邻近海域的研究表明, 春季(4月)浮游植物细胞丰度与海水表层温度、活性磷酸盐和活性硅酸盐的组合有显著相关性, 且早春(3月)有超过2/3的调查站位存在硅限制, 这与本研究中春季温度与SiO32-浓度均与浮游植物群落结构存在显著相关性相一致。蒋金杰等(2011)对2009年四十里湾及其邻近海域浮游植物群落的季节变化进行调查, 发现早春(3月)的浮游植物丰度仅次于夏季(8月), 调查中当年早春的温度(3.57℃)远低于本调查中的温度(平均值为14.14±0.88℃, 变化范围为12.86—16.25℃), 而SiO32-浓度(759.49μg/L)远高于本研究中的SiO32-浓度[(60.32±23.97)μg/L]。在本研究中, 春季水温开始回升, 但由于硅酸盐限制, 以硅藻为主的浮游植物群落丰度尚未能回升, 反而是2018年4个季节的最低值。RDA排序显示, NO3-浓度对类群A的影响较为显著(图 7, 图 3)。类群A分布的海域靠近烟台港, 且其北部与污水处理厂排污口相邻, 使得该水域的NO3-浓度(27.93μg/L)高于类群B所在的四十里湾及其邻近海域中西部海域(14.47μg/L), 因此常见于富营养水域的具槽帕拉藻(McQuoid et al, 2003)成为绝对优势种。
夏季(8月)水温升高[T=(21.96±1.33)℃], 达到大多数浮游植物生长的最适温度(Eppley, 1972)。此时SiO32-浓度也得到补充[(129.23±32.93)μg/L], N/P、Si/N和Si/P值分别为20.55、1.13和23.32, 解除了浮游植物生长的硅限制, 为以硅藻为主要类群的浮游植物的生长提供了有利的条件, 浮游植物的丰度也达到年度最高值, 在部分站位柔弱拟菱形藻(S7、S11和S12)和尖刺拟菱形藻丰度(S11和S13)达到赤潮水平。RDA排序分析显示, 浮游植物群落结构与盐度存在显著相关性, 这可能与夏季四十里湾及其邻近海域河流冲淡水的增加有关。夏季随着降雨的增多, 四十里湾及其邻近海域的入海河流:逛荡河、沁水河、辛安河和鱼鸟河的冲淡水量增多, 成为影响浮游植物生长的重要影响因素, 表征为盐度对该海域浮游植物影响的显著性(Carstensen et al, 2015)。夏季浮游植物类群呈斑块状分布, 类群C的多样性指数和均匀度指数均高于类群D, 这是由于类群D受赤潮区域影响明显, 柔弱拟菱形藻丰度显著高于类群C (Wilcoxon test, P < 0.05), 尖刺拟菱形藻也较高(类群C: 4.76×104cells/m3, 类群D: 5.25×107cells/m3, 虽然未有统计学意义)。Sakka等(2006)研究发现, 往柔弱拟菱形藻生长的水体中加入NO3-和PO43-, 会促进其生长; Burić等(2008)研究表明, 拟菱形藻水华与PO43-浓度有显著相关性; 吕颂辉等(2006)发现, 尖刺拟菱形藻对N、P的依赖性较强, 在N/P为10—32范围内, 对其生长有促进作用, 否则会抑制其生长; Sahraoui等(2009)研究表明, 柔弱拟菱形藻的丰度与夏季的温度、盐度和SiO32-浓度有密切关系。在本研究中, 类群D的SiO32-、NO3-和PO43-浓度(133.44、17.63、9.59μg/L)均比类群C (115.23、6.42、5.20μg/L)高, 且N/P值(22.15)明显高于类群C (13.98), 因此类群D的营养盐环境对尖刺拟菱形藻和柔弱拟菱形藻的生长有明显优势。
秋季(11月)SiO32-浓度持续升高[(158.56±41.15)μg/L], 硅藻优势种种类增多。RDA排序显示类群E所在海域的营养盐浓度高于类群F, 尤其是SiO32-浓度对类群E的影响更显著(图 7)。另外, 秋季该海域受西北风使流场向东南堆积影响, 使得类群E的丰度高于类群F。
冬季, 水温为全年最低值[T=(2.31±0.30)℃], DO浓度为(11.00±0.16)mg/L, 营养盐水平达到全年最高值, 营养盐供给充分, SiO32-、PO43-和DIN浓度分别为(178.31±65.49)、(17.15±8.94)和(212.92±116.79)μg/L, 因此全球近岸海域的赤潮种中肋骨条藻(黄长江等, 2001)在冬季成为优势种, 尤其是在类群G大量出现。RDA排序分析显示, 水温和DO浓度与该季节浮游植物群落有显著相关性, 随着排序轴从左到右, 温度逐渐降低, DO浓度逐渐升高(图 3, 图 7), 即近岸区(类群G所在海域)的温度低于远岸区(类群H所在海域), 溶解氧浓度是近岸区高于远岸区。冬季近岸温度低, 而且陆地盛行西北风, 近岸水域的混合更加充分, 低温加之水体的充分混合使得水体中溶解氧浓度更高, 但是温度是限制浮游植物生长的主要因素, 因此类群G的丰度低于类群H的丰度。
3.2 浮游植物群落结构特征的时空变化2018年浮游植物组成以硅藻为主, 甲藻次之, 其他门类占少数, 这与之前的研究结果一致(喻龙等, 2009b;高昊东等, 2011;蒋金杰等, 2011; Hao et al, 2011;王妍等, 2013;李斌等, 2013;李希磊等, 2018)。不同季节浮游植物的种类数依次是夏季 > 秋季 > 冬季 > 春季, 但是多样性指数却是冬季 > 秋季 > 春季 > 夏季, 均匀度指数也是夏季最低。钱罡等(2017)对桑沟湾海域的浮游植物群落调查发现优势种的出现会降低浮游植物的多样性; 刘述锡等(2013, 2015)对黄海北部浮游植物群落结构的研究表明, 绝对优势种的出现会导致浮游植物多样性极低。本研究也发现这一现象, 夏季多样性指数和均匀度指数最低是因为柔弱拟菱形藻的丰度在调查区域占绝对优势(优势度为0.84), 达到赤潮水平(夏季的平均丰度为2.42×108ind./m3)。
四十里湾及其邻近海域浮游植物优势种以广温近岸种、广布种和温带近岸种为主。本年度未发现四个季节共有的优势种类, 常见优势种为柔弱拟菱形藻、尖刺拟菱形藻、角毛藻、圆筛藻和具槽帕拉藻; 除春季存在甲藻(夜光藻)优势种外, 其余季节优势种均为硅藻。春季出现甲藻优势地位与调查海域的硅酸盐限制有关。春季SiO32-浓度为2018年四个季节中最低水平[平均值为(60.32±23.97)μg/L], 由于硅酸盐缺失, 导致春季硅藻在与甲藻的竞争中处于劣势, 形成了硅藻-甲藻联合优势地位。一般认为, PO43-和N/P对甲藻等鞭毛藻类的种群动态有重要影响(Hodgkiss et al, 1997)。与2009年和2010年四十里湾及其邻近海域的营养盐浓度相比(蒋金杰等, 2011; Wang et al, 2012;王妍等, 2013), 2018年PO43-和DIN的浓度有下降趋势, 并且夏季和秋季存在潜在的P限制(夏季DIN/P=20.55, Si/P=23.32;秋季DIN/P=23.09, Si/P=27.30)。另外, 冬季SiO32-、PO43-和DIN浓度均达到本年度最高值, 高浓度营养盐环境, 尤其是氮和磷的增加, 更有利于硅藻的生长(Kremp et al, 2008; Xiao et al, 2018), 这些可能是造成本年度夏季、秋季和冬季甲藻优势地位缺失的原因。
2018年四十里湾及其邻近海域浮游植物丰度在夏季(8月)达到最高值, 这与之前的研究结果一致。但是, 蒋金杰等(2011)与王妍等(2013)的研究均显示, 早春(3月)浮游植物丰度仅次于夏季, 冬季(12月)最低, 本研究中不同季节浮游植物丰度高低依次是:夏季(8月) > 秋季(11月) > 冬季(12月) > 春季(5月)。与其他两位作者的研究相比, 除夏季8月份外, 其余季节的调查月份均不同, 而不同月份的水温差异较大, 从而造成不同研究中浮游植物丰度的季节变化差异。另外, 这与不同研究当年由风海流形成的海湾流场和营养盐浓度也有极大的关系(管秉贤, 1962;张瑞安等, 1990;万修全等, 2004;王妍等, 2013)(见正文3.1)。春季各类营养盐浓度在整个调查区域的分布差异不明显, 这与春季浮游植物丰度的平面分布类似; 夏季和秋季浮游植物丰度的高值区与营养盐, 尤其是SiO32-浓度的低值区吻合(孙西艳, 未发表数据), 可能是由于浮游植物的生长对硅酸盐的消耗造成的; 冬季由于温度是浮游植物生长的重要限制因子, SiO32-浓度和其他营养盐浓度供给充分, 故其高值区与浮游植物丰度分布的高值区一致。此外, 四十里湾及其邻近海域浮游生物的分布还受到港运、海参和贝类养殖、污水排放等人类活动的影响。
4 结论(1) 2018年烟台四十里湾及其邻近海域共发现浮游植物4门69属116种, 硅藻门和甲藻门的浮游植物为主要类群; 硅藻门的优势地位明显。浮游植物生态类型以广温近岸种、广布种和温带近岸种为主。不同季节浮游植物优势种更替明显, 更替率均在70%以上。
(2) 浮游植物丰度夏季为全年最高峰, 达到2.89×108cells/m3, 其余季节均为~105cells/m3。其季节变化为夏季(8月) > 秋季(10月) > 冬季(1月) > 春季(5月)。浮游植物多样性指数冬季最高, 夏季最低; 均匀度指数夏季最低。
(3) 不同季节浮游植物群落结构的影响因子不同:春季, T、SiO32-浓度和NO3-浓度与浮游植物群落分布有显著相关性; 夏季, S与浮游植物群落结构呈负相关; 秋季, SiO32-与浮游植物丰度显著负相关; 冬季, T和DO是影响群落分布的主要因素。
万修全, 鲍献文, 吴德星, 等. 2004. 渤海夏季潮致-风生-热盐环流的数值诊断计算. 海洋与湖沼, 35(1): 41-47 |
王妍, 董志军, 刘东艳, 等. 2013. 烟台近海浮游植物的时空变化特征. 海洋通报, 32(4): 408-420 |
王文君. 2017. 2014年四十里湾一次海洋卡盾藻赤潮发展过程及其成因研究. 安徽农业科学, 45(15): 66-72 |
白美娜, 江涛, 陈飞羽, 等. 2019. 大亚湾大鹏澳牡蛎养殖临近海域自养微微型浮游生物种群分布特征. 海洋与湖沼, 50(1): 129-138 |
吕颂辉, 陈翰林, 何智强. 2006. 氮磷等营养盐对尖刺拟菱形藻生长的影响. 生态环境, 15(4): 697-701 |
刘述锡, 隋伟娜, 孙淑艳, 等. 2015. 北黄海北部近岸海域网采浮游植物群落结构. 海洋湖沼通报, (2): 128-138 |
刘述锡, 樊景凤, 王真良. 2013. 北黄海浮游植物群落季节变化. 生态环境学报, 22(7): 1173-1181 |
刘朋超, 王卫军, 骆启豪, 等. 2019. 山东半岛南北两侧海域真核浮游生物群落特征及与环境因子的相关性分析. 海洋与湖沼, 50(4): 876-885 |
刘爱英, 宋秀凯, 秦华伟, 等. 2013. 2011年烟台四十里湾微微型金藻褐潮分析. 海洋湖沼通报, (3): 73-79 |
李斌, 白艳艳, 邢红艳, 等. 2013. 四十里湾营养状况与浮游植物生态特征. 生态学报, 33(1): 260-266 |
李希磊, 杨俊丽, 于潇, 等. 2018. 烟台四十里湾扇贝养殖区浮游植物群落调查. 海洋科学, 42(8): 30-37 |
李轶平, 李玉龙, 付杰, 等. 2019. 辽东湾西海岸潮间带大型底栖动物群落生态位特征. 海洋科学, 43(3): 32-39 |
杨秀兰, 王育红, 刘义豪, 等. 2008. 关于烟台四十里湾水域出现海洋卡盾藻的分析. 齐鲁渔业, 25(2): 47-49 |
杨俊丽, 2018.烟台扇贝养殖区环境因子的变化特征及其对浮游植物的影响.烟台: 烟台大学硕士学位论文, 33-41
|
吴文广, 张继红, 刘毅, 等. 2018. 獐子岛及邻近海域秋季浮游植物的粒级结构及其影响因素. 生态学报, 38(4): 1418-1426 |
吴玉霖, 周成旭, 张永山, 等. 2001. 烟台四十里湾海域红色裸甲藻赤潮发展过程及其成因. 海洋与湖沼, 32(2): 159-167 |
张芳, 孙松, 杨波. 2005. 胶州湾水母类生态研究I.种类组成与群落特征. 海洋与湖沼, 36(6): 507-517 |
张瑞安, 董以芝. 1990. 烟台排污海域的自然环境条件分析和污染物输运路径研究. 海岸工程, 9(2): 35-44 |
钱罡, 魏玉秋, 孙军. 2017. 2015年春季桑沟湾浮游植物群落研究. 海洋科学, 41(2): 44-52 |
栾青杉, 康元德, 王俊. 2018. 渤海浮游植物群落的长期变化(1959~2015). 渔业科学进展, 39(4): 9-18 |
高昊东, 邓忠伟, 孙万龙, 等. 2011. 烟台四十里湾赤潮发生与生态环境污染研究. 中国环境监测, 27(2): 50-55, 101 |
黄长江, 董巧香. 2001. 1998年春季珠江口海域大规模赤潮原因生物的形态分类和生物学特征Ⅲ. 海洋与湖沼, 32(1): 1-6 |
蒋金杰, 刘东艳, 邸宝平, 等. 2011. 烟台四十里湾浮游植物群落的季节变化及其对环境的指示意义. 海洋学报, 33(6): 151-164 |
喻龙, 马兆虎, 郝彦菊, 等. 2014. 四十里湾2012年一次血红哈卡藻赤潮的调查分析. 海洋科学进展, 32(1): 84-91 |
喻龙, 郝彦菊. 2009a. 烟台四十里湾一次血红哈卡藻赤潮过程的分析. 海洋科学进展, 27(4): 516-522 |
喻龙, 郝彦菊, 蔡悦荫. 2009b. 四十里湾赤潮高发期营养盐与叶绿素a的年际变化. 海洋环境科学, 28(5): 558-561 |
管秉贤. 1962. 有关我国近海海流研究的若干问题. 海洋与湖沼, 4(3-4): 121-141 |
Burić Z, Viliĉié D, Mihalić K C et al, 2008. Pseudo-nitzschia blooms in the Zrmanja River estuary (Eastern Adriatic Sea). Diatom Research, 23(1): 51-63 DOI:10.1080/0269249X.2008.9705736 |
Carstensen J, Klais R, Cloern J E, 2015. Phytoplankton blooms in estuarine and coastal waters:Seasonal patterns and key species. Estuarine, Coastal and Shelf Science, 162: 98-109 DOI:10.1016/j.ecss.2015.05.005 |
Eppley R, 1972. Temperature and phytoplankton growth in the sea. Fishery Bulletin, 70(4): 1063-1085 |
Hao Y J, Tang D L, Yu L et al, 2011. Nutrient and chlorophyll a anomaly in red-tide periods of 2003-2008 in Sishili Bay, China. Chinese Journal of Oceanology and Limnology, 29(3): 664-673 DOI:10.1007/s00343-011-0179-3 |
Hodgkiss I J, Ho K C, 1997. Are changes in N:P ratios in coastal waters the key to increased red tide blooms?. Hydrobiologia, 352(1-3): 141-147 |
Kremp A, Tamminen T, Spilling K, 2008. Dinoflagellate bloom formation in natural assemblages with diatoms:nutrient competition and growth strategies in Baltic spring phytoplankton. Aquatic Microbial Ecology, 50(2): 181-196 |
Lalli C M, Parsons T R, 1993. Biological Oceanography. An Introduction. New York: Pergamon Press, 45-79
|
McQuoid M R, Nordberg K, 2003. The diatom Paralia sulcata as an environmental indicator species in coastal sediments. Estuarine, Coastal and Shelf Science, 56(2): 339-354 DOI:10.1016/S0272-7714(02)00187-7 |
Pielou E C, 1969. An Introduction to Mathematical Ecology. New York: Wiley-Inter science, 1-286
|
Sahraoui I, Sakka H A, Hadj M H et al, 2009. Blooms of the diatom genus Pseudo-nitzschia H. Peragallo in Bizerte lagoon (Tunisia, SW Mediterranean). Diatom Research, 24(1): 175-190 |
Sakka H A, Chikhaoui M A, El Grami B et al, 2006. Effects of N and P supply on phytoplankton in Bizerte Lagoon (western Mediterranean). Journal of Experimental Marine Biology and Ecology, 333(1): 79-96 DOI:10.1016/j.jembe.2005.12.049 |
Shannon C E, Weaver W, 1949. The Mathematical Theory of Communication. Urbana, Ill: University of Illinois Press, 1-125
|
Wang Y J, Liu D Y, Dong Z J et al, 2012. Temporal and spatial distributions of nutrients under the influence of human activities in Sishili Bay, northern Yellow Sea of China. Marine Pollution Bulletin, 64(12): 2708-2719 DOI:10.1016/j.marpolbul.2012.09.024 |
Xiao W P, Liu X, Irwin A J et al, 2018. Warming and eutrophication combine to restructure diatoms and dinoflagellates. Water Research, 128: 206-216 DOI:10.1016/j.watres.2017.10.051 |
 2020, Vol. 51
2020, Vol. 51


