中国海洋湖沼学会主办。
文章信息
- 郝雅, 管晨, 侯承宗, 唐学玺, 王影. 2021.
- HAO Ya, GUAN Chen, HOU Cheng-Zong, TANG Xue-Xi, WANG Ying. 2021.
- 苏北浅滩筏架附生绿藻群落结构变化及与环境因子的相关性探究
- STRUCTURAL CHANGE OF GREEN MACROALGAL COMMUNITY ATTACHED ON RAFTS IN SUBEI SHOAL AND ITS CORRELATION WITH ENVIRONMENTAL FACTORS
- 海洋与湖沼, 52(1): 123-131
- Oceanologia et Limnologia Sinica, 52(1): 123-131.
- http://dx.doi.org/10.11693/hyhz20200400111
文章历史
-
收稿日期:2020-04-06
收修改稿日期:2020-04-12
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China
自2007年以来, 大规模绿潮频发于黄海海域, 严重破坏了海洋生态环境, 造成了巨大的经济损失(于仁成等, 2018; 王宗灵等, 2018)。通过DNA分子鉴定, 黄海绿潮的致灾种为石莼属(Ulva)的浒苔(U. prolifera)(Xiao et al, 2013; Zhao et al, 2015)。通过对浒苔绿潮的溯源调查, 研究人员在浒苔绿潮起源的问题上达成广泛共识:黄海绿潮起源于江苏省苏北浅滩紫菜养殖筏架上附生的绿藻群落(Liu et al, 2009; Keesing et al, 2011; Zhou et al, 2015; 王广策等, 2020)。
苏北浅滩筏架养殖区的绿藻群落作为浒苔绿潮的源头, 在绿潮发生前的绿藻群落组成分析是浒苔绿潮早期防控的主要内容之一。研究人员对紫菜养殖筏架上附着的绿藻群落进行了种类鉴定(Tian et al, 2011; Shen et al, 2012), 并且进一步估算了每种绿藻的生物量, 但是由于样本数量、取样时间和调查方法的不同, 结果之间存在很大差异。Pang等(2010)和Shen等(2012)发现紫菜养殖筏架上没有或只有少量绿藻附着; Liu等(2010)的现场调查中则发现有大量的浒苔附着在紫菜养殖筏架上; Han等(2013)和Fan等(2015)通过多次现场调查发现, 筏架附生的绿藻群落存在明显的演替现象, 在不同的时期筏架上绿藻群落的优势种也不同; 各调查结果不一致的原因可能是由于样本量较少, 或者是绿藻群落结构的时空变化导致的随机效应(Xiao et al, 2013)。在早期绿潮斑块出现之前, 浒苔(U. prolifera)不是筏架附生绿藻群落的主要优势种, 但是在绿潮暴发后, 浒苔在漂浮藻垫中的比例接近100% (Liu et al, 2015; Zhang et al, 2015)。这些研究表明, 群落结构变化是绿潮暴发前苏北浅滩绿藻群落的鲜明特征, 并且对绿潮的发生具有重要影响, 解析其变化的原因对浒苔绿潮的早期预警具有重要意义。
绿藻群落结构的改变是生物与环境相互作用的结果, 已有研究尚缺乏与环境因素的相关性分析。温度、盐度、营养盐含量和光照强度等环境因素对大型绿藻群落结构组成和演替具有显著影响(Fong et al, 1996; 方松等, 2012)。为了找出导致绿藻群落结构变化的关键环境因素, 作者在苏北浅滩主要的筏架养殖区进行连续采样, 对绿藻样品进行了分类鉴定和生物量统计, 并结合环境因子进行了相关性分析, 探明苏北浅滩绿藻群落结构变化特征的同时, 找出导致筏架附生绿藻群落结构变化的关键环境因素, 为浒苔绿潮的早期预警和防控提供生态学资料支持。
1 材料与方法 1.1 调查海域与站位本次调查区域位于江苏省南通市如东县东北部的苏北浅滩, 该区域是全国最大的条斑紫菜筏架养殖区, 一共设置了6个样品采集站位(图 1)。绿藻样品采集时间为2019年3月10日、4月15日和5月15日, 每个采样站点随机选择5个紫菜养殖筏架, 在筏架上每次刮取50 cm长度的绿藻样品, 每个筏架重复取样3次。采集后的绿藻样品在现场用过滤海水清洗掉表面附着的泥沙等杂质, 用吸水纸吸干表面水分, 用样品袋封装并编号, 然后置于4℃的便携式冰箱(米其林, 中国)中送回实验室进行形态学分类和分子生物学鉴定。采样地点的海水温度、盐度和pH值使用手持式野外多参数水质检测仪(YSI Orion, 美国)测定; 光照强度使用双辐照仪(卓川, 中国)在晴朗天气下进行测量, 测量时间为正午11—13点, 视天气情况筛除极端测量值, 用光合有效辐射(photosynthetically active radiation, PAR)来表示光照强度的测量结果, 单位为μmol photons/(m2·s)。
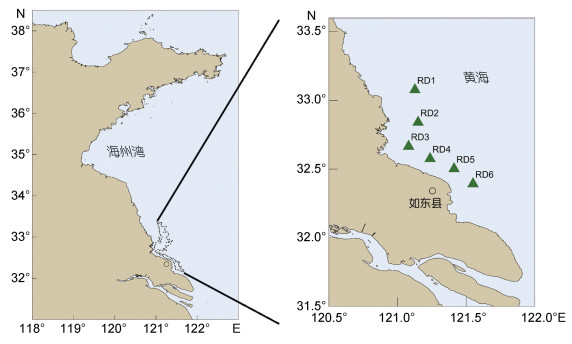 |
| 图 1 苏北浅滩绿藻采集站位 Fig. 1 The sampling site of green macroalgae in the Subei Shoal 注:左图虚线框内为苏北浅滩主要的紫菜筏架养殖区域 |
送回实验室的绿藻样品再次用无菌海水冲洗, 并用毛刷仔细清洁。清洁后的绿藻以株为单位分开, 置于添加有无菌海水的玻璃培养皿中, 用镊子轻轻展开藻体, 在体式显微镜(Olympus SZ51, 日本)下进行绿藻的形态学鉴定(图 2)。绿藻样品的形态学鉴定主要依据藻体颜色、基部情况(固着器等)、藻体外形轮廓、主轴和分支特征等(Tseng, 1983; 丁兰平等, 2009; 余秋瑢等, 2017)。鉴定完毕后的绿藻样品用吸水纸充分吸干表面水分, 并使用高精度电子天平(BSA124S, 中国)称重, 藻体重量精确到1 mg, 通过汇总所有物种的生物量来计算绿藻群落的总生物量(湿重)。
 |
| 图 2 筏架附生绿藻群落中的各种绿藻 Fig. 2 Various green macroalgae attached onto the rafts 注: a.盘苔; b.浒苔; c.缘管浒苔; d—g.未分类绿藻 |
为了对绿藻形态学鉴定结果进行补充和验证, 本文在3月和5月的绿藻样品中随机选择了60株绿藻样品进行了ITS序列(internal transcribed spacer, ITS)和5S rDNA间隔区序列(5S rDNA spacer)分析。绿藻样品用去离子水多次清洗后用吸水纸吸干水分, 将藻体置于研钵中加入液氮充分研磨成组织粉末, 选用植物基因组DNA试剂盒(北京天根生化科技有限公司)进行后续的全基因组DNA提取。用于序列分析的样品的命名方式为“采集月份-站位-样品编号”的方式。提取后的绿藻DNA样品被转移到2mL冻存管中并置于液氮中保存, 随后交付上海生工公司(生工, 上海)进行PCR (polymerase chain reaction)、引物合成和ITS与5S rDNA间隔区序列的双向测序, PCR引物序列如表 1所示(Xiao et al, 2013)。
| ITS | FW: 5′-TCGTAACAAGGTTTCCGTAGG-3′ |
| RV: 5′-TTCCTTCCGCTTATTGATATGC-3′ | |
| 5S rDNA | FW: 5′-GGTTGGGCAGGATTAGTA-3′ |
| RV: 5′-AGGCTTAAGTTGCGAGTT-3′ |
将1.3的测序结果录入NCBI(美国国家生物技术信息中心) (http://www.ncbi.nlm.nih.gov)进行Blast同源性比对。使用MEGA 5进行了最大似然法(maximum-likelihood, ML)和邻接法(neighbor-joining, NJ)分析(Tamura et al, 2011), 以Umbraulva amamiensis作为外类群。通过Bootstrap方法计算支持率(1000次重复, 省略支持率小于50%的数值), 采用环式(Circle)进化树模型构建文本序列分析的进化树。
1.5 数据处理及分析所有数据分析均为三个重复, 并以平均标准差(standard deviation, SD)表示。实验数据采用单因素方差分析(One-way ANOVA)进行检验, 如果方差分析显示有显著差异, 则采用Student-Newman-Keuls检验进行事后多重比较。本文使用的统计分析软件为IBM SPSS 22.0 (SPSS Inc, 美国), P < 0.05认为有统计学意义。冗余分析(redundancy analysis, RDA)采用软件Canoco 5.0进行。
2 结果与讨论 2.1 绿藻样品的形态学鉴定通过形态学特征比对, 在采集的绿藻样品中共鉴定出浒苔(U. prolifera), 盘苔(Blidingia sp.), 缘管浒苔(U. linza) 3种大型绿藻和无法通过形态学特征进一步区分的绿藻混合种(图 2), 根据之前的调查结果, 本文中的绿藻混合种可能包含有曲浒苔(U. flexuosa)和扁浒苔(U. compressa)等形态结构较为相似的筏架附生绿藻(Huo et al, 2013; Fan et al, 2015)。
2.2 绿藻样品的序列分析ITS序列分析结果显示, 绿藻样品主要由石莼属绿藻构成的复合类种群LPP (Ulva linza-procera- prolifera)、盘苔(Blidingia sp.)和曲浒苔(U. flexuosa)组成(图 3)。由于ITS序列无法明确区分LPP内的绿藻种类, 对分布在LPP区域内的27个绿藻DNA样品进行了基于5S rDNA的序列分析。5S序列分析结果表明, 27个LPP样品中有20个属于浒苔(U. prolifera), 7个属于缘管浒苔(U. linza) (图 4)。
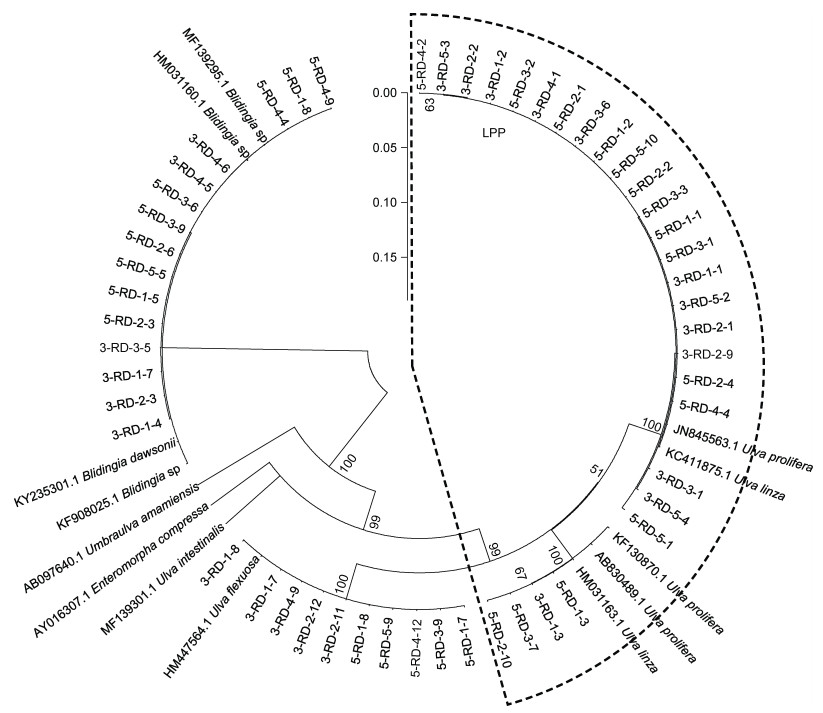 |
| 图 3 筏架附生绿藻样品基于ITS序列分析的邻接树[Neighbor-joining (NJ) tree] Fig. 3 Neighbor-joining (NJ) tree of green macroalgae samples on the rafts in Subei Shoal based on ITS sequence analysis 注:虚线框内为石莼属绿藻构成的复合类种群(LPP) |
 |
| 图 4 筏架附生绿藻样品基于5S序列分析的邻接树 Fig. 4 Neighbor-joining (NJ) tree of green macroalgae samples on the rafts in Subei Shoal based on 5S sequence analysis |
在生物量统计过程中, 无法通过形态学进行分类的绿藻样品被合并为石莼属绿藻(Ulva spp.)。筏架附生绿藻的总生物量从3月的29.95 g/m增加到了5月的108.41 g/m (图 5b)。研究人员对苏北浅滩海域绿藻微观繁殖体的研究表明, 绿藻微观繁殖体的数量在4月下旬达到最大值, 筏架附生绿藻生物量在五月达到峰值(Li et al, 2014; Wang et al, 2018), 这与本文的生物量统计结果一致。调查期间绿藻生物量统计结果表明, 苏北浅滩的筏架附生绿藻群落具有明显的演替现象(图 6)。3月在各站点的绿藻群落中没有发现或者零星出现少量浒苔(U. prolifera), 4月浒苔在绿藻群落的比例上升到了20%, 5月浒苔在绿藻群落中的比例达到了接近40% (图 6), 浒苔的生物量从3月的1.65 g/m增加到了5月的31.78 g/m (图 5a); 石莼属绿藻(Ulva spp.)在绿藻群落中的比例则表现出与浒苔(U. prolifera)相反的变化趋势(图 7); 缘管浒苔的生物量在调查期间的变化不显著(One way ANOVA, P > 0.05, 图 5a); 盘苔在调查期间一直是筏架附生绿藻群落中的优势种(图 5a, 6), Song等(2015)对苏北浅滩水体和沉积物的调查中未检测出盘苔的微观繁殖体, 并推断营养生殖是盘苔在筏架区增加种群数量的主要方式, 对于此推论我们还需要进一步的研究求证。
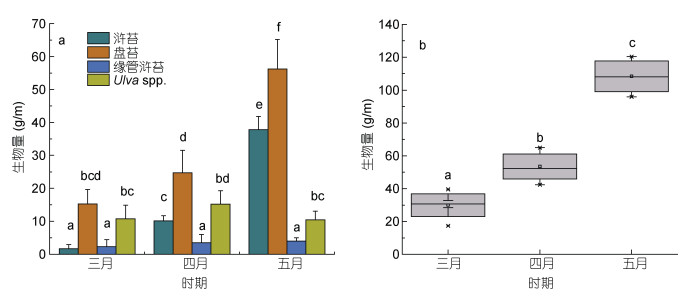 |
| 图 5 3—5月紫菜筏架附生绿藻生物量变化情况 Fig. 5 Biomass changes of green macroalgae on the rafts in Subei Shoal from March to May 注: a.每种绿藻的生物量; b.绿藻群落的总生物量。不同的字母表示显著性差异, P < 0.05 |
 |
| 图 6 苏北浅滩筏架附生绿藻群落的组成比例变化 Fig. 6 Change in composition proportion of the green macroalgae community on the rafts in Subei Shoal |
 |
| 图 7 针对环境变量与绿藻生物量变化相关性的冗余分析(RDA)结果 Fig. 7 Redundancy analysis (RDA) results of the correlation between environmental variables and biomass changes of green macroalgae 注:空心箭头表示环境变量的分数, 实心箭头表示绿藻样品的生物量, 并且与该方向上矢量最长的空心箭头代表的环境因子的相关性最强 |
苏北浅滩紫菜养殖筏架区3—5月的环境因子变化情况如表 2所示, 从3月到5月, 苏北浅滩的环境温度呈显著上升的趋势(One-way ANOVA, P < 0.05), 平均温度从8.32℃上升到了18.38℃。海水盐度、光照强度和海水pH在调查期间没有显著变化(One-way ANOVA, P > 0.05)。
| 时期 | 温度(℃) | 盐度 | PAR [μmol photons/(m2·s)] | pH |
| 3.10 | 8.32±0.3a | 30.7±0.31a | 496±83.8a | 7.87±0.06a |
| 4.15 | 12.4±0.36b | 30.25±0.14a | 551±17.4a | 7.89±0.01a |
| 5.15 | 18.38±0.28c | 30.22±0.23a | 576±56.8a | 7.88±0.07a |
| 注:不同的字母表示显著性差异, P < 0.05 | ||||
研究证明不同的大型藻类对环境因子变化的响应存在明显差异(Dawes et al, 1978), 温度、盐度和光照强度可以决定藻类的分布特征(Wiencke et al, 1980)。在本研究中, 四种环境因子对生物量变化的总解释度为59.9% (表 3)。温度对绿藻生物量变化的解释度最高(47.8%), 因此温度是导致筏架附生绿藻群落结构改变的主要环境因子(表 3)。在本次调查期间, 环境温度与浒苔(U. prolifera)种群生物量呈正相关(图 7)。Song等(2015)的研究证明, 环境温度低于10℃时浒苔的微观繁殖体不会生长, Pang等(2010)的研究也证实在3—4月苏北浅滩没有或只有很少的浒苔。15—20℃是浒苔生长较适宜的温度(王建伟等, 2007), 苏北浅滩在3—5月的温度变化范围是8.3—18.4℃ (表 2), 因此, 从3月到5月, 苏北浅滩的环境温度逐渐接近浒苔(U. prolifera)生长的适宜温度, 该区域浒苔种群的生物量也随之迅速增加。在筏架绿藻群落中, 扁浒苔(U. compressa)的最适生长温度是10℃ (王阳阳等, 2010), 肠浒苔(Ulva intestinalis)和条浒苔(Ulva clathrata)也已被证明是适低温性的绿藻(Wiencke et al, 1990), 因此5月上升的环境温度不利于筏架上适低温性的绿藻的生存, 逐渐被浒苔等能够适应较高环境温度的绿藻取代。
| 环境变量 | 解释度(%) | pseudo-F | P |
| 温度 | 47.8 | 14.7 | 0.002 |
| 光强 | 9.4 | 3.3 | 0.028 |
| 盐度 | 1.6 | 0.6 | 0.596 |
| pH | 1 | 0.3 | 0.756 |
除温度以外, RDA分析结果显示光照强度也对绿藻群落结构产生了较大影响(表 3, 图 7), 浒苔和缘管浒苔的生物量对光照强度表现出较强的正相关性(图 7)。Xiao等(2016)通过培养实验发现筏架附生的浒苔对光照强度的耐受性较高, 而Kim等(2011)也发现发现缘管浒苔对高光强也具有很强的适应性, 这与本次RDA分析结果相符。盘苔和浒苔的生物量与海水盐度呈负相关(图 7), 这可能与调查期间地表径流和降水量的变化有关。南黄海沿岸河流众多, 除了长江以外, 还有射阳河和关河等地方河流以及众多人工运河(赵全基, 1992), 大量的地表径流的汇入在降低海水盐度的同时, 提高了苏北浅滩海域的营养盐负荷, 为大型藻类的生长提供了外源营养物质补充(Mieszkin et al, 2013), 筏架绿藻群落的生物量变化与海水盐度的关系还需要进一步的研究求证。
3 结论(1) 苏北浅滩紫菜养殖筏架上附生的绿藻群落主要由浒苔、盘苔、缘管浒苔、曲浒苔和其他绿藻5个类群构成。
(2) 绿潮暴发前期(3—5月), 筏架附生绿藻群落具有明显的演替现象, 温度是导致绿藻群落结构改变的关键环境因素, 适低温性的绿藻逐渐被浒苔等能够适应较高环境温度的绿藻取代。
(3) 浒苔的生物量从3月份的1.65 g/m增加到了5月的31.78 g/m, 所占比例从低于5%达到接近40%, 浒苔生物量的积累为苏北浅滩早期绿潮漂浮斑块的出现提供了物质基础。
丁兰平, 栾日孝. 2009. 浒苔(Enteromorpha prolifera)的分类鉴定、生境习性及分布. 海洋与湖沼, 40(1): 68-71 DOI:10.3321/j.issn:0029-814X.2009.01.011 |
方松, 王宗灵, 李艳, 等. 2012. 南黄海及长江口附近海域绿潮暴发前期微观繁殖体的动态变化. 海洋学报(中文版), 34(4): 147-154 |
于仁成, 孙松, 颜天, 等. 2018. 黄海绿潮研究:回顾与展望. 海洋与湖沼, 49(5): 942-949 |
王广策, 王辉, 高山, 等. 2020. 绿潮生物学机制研究. 海洋与湖沼, 51(4): 789-808 |
王建伟, 阎斌伦, 林阿朋, 等. 2007. 浒苔(Enteromorpha prolifera)生长及孢子释放的生态因子研究. 海洋通报, (2): 60-65 DOI:10.3969/j.issn.1001-6392.2007.02.009 |
王阳阳, 霍元子, 曹佳春, 等. 2010. 低温、低光照强度对扁浒苔生长的影响. 中国水产科学, 17(3): 593-599 |
王宗灵, 傅明珠, 肖洁, 等. 2018. 黄海浒苔绿潮研究进展. 海洋学报, 40(2): 1-13 |
余秋瑢, 杨革, 刘正一. 2017. 黄渤海典型海岛的石莼属绿藻形态学观察及分子系统发育分析. 生态科学, 36(1): 102-110 |
赵全基. 1992. 河流对江苏海岸发育的影响. 海洋科学, 16(3): 53-55 |
Dawes C J, Moon R E, Davis M A, 1978. Science CM. The photosynthetic and respiratory rates and tolerances of benthic algae from a mangrove and salt marsh estuary:a comparative study. Estuarine and Coastal Marine Science, 6(2): 175-185 |
Fan S L, Fu M Z, Wang Z L et al, 2015. Temporal variation of green macroalgal assemblage on Porphyra aquaculture rafts in the Subei Shoal, China. Estuarine, Coastal and Shelf Science, 163: 23-28 DOI:10.1016/j.ecss.2015.03.016 |
Fong P, Boyer K E, Desmond J S et al, 1996. Salinity stress, nitrogen competition, and facilitation:what controls seasonal succession of two opportunistic green macroalgae?. Journal of Experimental Marine Biology and Ecology, 206(1-2): 203-221 DOI:10.1016/S0022-0981(96)02630-5 |
Han W, Chen L P, Zhang J H et al, 2013. Seasonal variation of dominant free-floating and attached Ulva species in Rudong coastal area, China. Harmful Algae, 28: 46-54 DOI:10.1016/j.hal.2013.05.018 |
Huo Y Z, Zhang J H, Chen L P et al, 2013. Green algae blooms caused by Ulva prolifera in the southern Yellow Sea:identification of the original bloom location and evaluation of biological processes occurring during the early northward floating period. Limnology and Oceanography, 58(6): 2206-2218 DOI:10.4319/lo.2013.58.6.2206 |
Keesing J K, Liu D Y, Fearns P et al, 2011. Inter- and intra-annual patterns of Ulva prolifera green tides in the Yellow Sea during 2007-2009, their origin and relationship to the expansion of coastal seaweed aquaculture in China. Marine Pollution Bulletin, 62(6): 1169-1182 DOI:10.1016/j.marpolbul.2011.03.040 |
Kim J H, Kang E J, Park M G et al, 2011. Effects of temperature and irradiance on photosynthesis and growth of a green-tide-forming species (Ulva linza) in the Yellow Sea. Journal of Applied Phycology, 23(3): 421-432 DOI:10.1007/s10811-010-9590-y |
Li Y, Song W, Xiao J et al, 2014. Tempo-spatial distribution and species diversity of green algae micro-propagules in the Yellow Sea during the large-scale green tide development. Harmful Algae, 39: 40-47 DOI:10.1016/j.hal.2014.05.013 |
Liu D Y, Keesing J K, Xing Q G et al, 2009. World's largest macroalgal bloom caused by expansion of seaweed aquaculture in China. Marine Pollution Bulletin, 58(6): 888-895 DOI:10.1016/j.marpolbul.2009.01.013 |
Liu X Q, Li Y, Wang Z L et al, 2015. Cruise observation of Ulva prolifera bloom in the southern Yellow Sea, China. Estuarine, Coastal and Shelf Science, 163: 17-22 DOI:10.1016/j.ecss.2014.09.014 |
Liu F, Pang S J, Chopin T et al, 2010. The dominant Ulva strain of the 2008 green algal bloom in the Yellow Sea was not detected in the coastal waters of Qingdao in the following winter. Journal of Applied Phycology, 22(5): 531-540 DOI:10.1007/s10811-009-9489-7 |
Mieszkin S, Callow M E, Callow J A, 2013. Interactions between microbial biofilms and marine fouling algae:a mini review. Biofouling, 29(9): 1097-1113 DOI:10.1080/08927014.2013.828712 |
Pang S J, Liu F, Shan T F et al, 2010. Tracking the algal origin of the Ulva bloom in the Yellow Sea by a combination of molecular, morphological and physiological analyses. Marine Environmental Research, 69(4): 207-215 DOI:10.1016/j.marenvres.2009.10.007 |
Shen Q, Li H Y, Li Y et al, 2012. Molecular identification of green algae from the rafts based infrastructure of Porphyra yezoensis. Marine Pollution Bulletin, 64(10): 2077-2082 DOI:10.1016/j.marpolbul.2012.07.021 |
Song W, Peng K Q, Xiao J et al, 2015. Effects of temperature on the germination of green algae micro-propagules in coastal waters of the Subei Shoal, China. Estuarine, Coastal and Shelf Science, 163: 63-68 DOI:10.1016/j.ecss.2014.08.007 |
Tamura K, Peterson D, Peterson N et al, 2011. MEGA5:molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution, 28(10): 2731-2739 DOI:10.1093/molbev/msr121 |
Tian X L, Huo Y Z, Chen L P et al, 2011. Molecular detection and analysis of green seaweeds from Rudong coasts in Jiangsu province. Chinese Science Bulletin, 56(4-5): 309-317 DOI:10.1360/972010-2124 |
Tseng C K, 1983. Common Seaweeds of China. Beijing, China: Science Press
|
Wang S Y, Huo Y Z, Zhang J H et al, 2018. Variations of dominant free-floating Ulva species in the source area for the world's largest macroalgal blooms, China:differences of ecological tolerance. Harmful Algae, 74: 58-66 DOI:10.1016/j.hal.2018.03.007 |
Wiencke C, ton Dieck I, 1990. Temperature requirements for growth and survival of macroalgae from Antarctica and southern Chile. Marine Ecology Progress Series, 59: 157-170 DOI:10.3354/meps059157 |
Wiencke C, Lauchli A, 1980. Growth, cell volume, and fine structure of Porphyra umbilicalis in relation to osmotic tolerance. Planta, 150(4): 303-311 DOI:10.1007/BF00384660 |
Xiao J, Li Y, Song W et al, 2013. Discrimination of the common macroalgae (Ulva and Blidingia) in coastal waters of Yellow Sea, northern China, based on restriction fragment-length polymorphism (RFLP) analysis. Harmful Algae, 27: 130-137 DOI:10.1016/j.hal.2013.05.003 |
Xiao J, Zhang X, Gao C et al, 2016. Effect of temperature, salinity and irradiance on growth and photosynthesis of Ulva prolifera. Acta Oceanologica Sinica, 35(10): 114-121 DOI:10.1007/s13131-016-0891-0 |
Zhang Q C, Liu Q, Yu R C et al, 2015. Application of a fluorescence in situ hybridization (FISH) method to study green tides in the Yellow Sea. Estuarine, Coastal and Shelf Science, 163: 112-119 DOI:10.1016/j.ecss.2014.09.005 |
Zhao J, Jiang P, Qin S et al, 2015. Genetic analyses of floating Ulva prolifera in the Yellow Sea suggest a unique ecotype. Estuarine, Coastal and Shelf Science, 163: 96-102 DOI:10.1016/j.ecss.2015.05.027 |
Zhou M J, Liu D Y, Anderson D M et al, 2015. Introduction to the Special Issue on green tides in the Yellow Sea. Estuarine, Coastal and Shelf Science, 163: 3-8 DOI:10.1016/j.ecss.2015.06.023 |
 2021, Vol. 52
2021, Vol. 52


