中国海洋湖沼学会主办。
文章信息
- 徐轶肖, 韦光领, 王玉, 贾樱, 高寒, 张腾, 佟蒙蒙. 2021.
- XU Yi-Xiao, WEI Guang-Ling, WANG Yu, JIA Ying, GAO Han, ZHANG Teng, TONG Meng-Meng. 2021.
- 钦州湾海水和香港牡蛎体内脂溶性贝类毒素污染特征
- POLLUTION OF LIPOPHILIC SHELLFISH TOXINS IN QINZHOU BAY: SEAWATER AND CRASSOSTREA HONGKONGENSIS
- 海洋与湖沼, 52(1): 144-152
- Oceanologia et Limnologia Sinica, 52(1): 144-152.
- http://dx.doi.org/10.11693/hyhz20200400126
文章历史
-
收稿日期:2020-04-22
收修改稿日期:2020-06-15
2. 南宁师范大学 广西地表过程与智能模拟重点实验室 南宁 530001;
3. 浙江大学海洋学院 舟山 316000
2. Guangxi Key Laboratory of Earth Surface Processes and Intelligent Simulation, Nanning Normal University, Nanning 530001, China;
3. Ocean College, Zhejiang University, Zhoushan 316000, China
脂溶性贝类毒素(lipophilic shellfish toxins, LSTs)指在贝类脂肪组织富集而不易排出体外、具有热稳定性、易溶解于有机溶剂的一大类毒素。根据化学结构特征, 脂溶性贝类毒素主要包括6类:原多甲藻酸(azaspiracids, AZAs, 也叫氮杂螺环酸)、短裸甲藻毒素(brevetoxins, BTXs或PbTx)、环亚胺(cyclic imines, CIs)、大田软海绵酸(okadaic acids, OAs)、蛤毒素(pectenotoxins, PTXs, 也叫扇贝毒素)和虾夷扇贝毒素(yessotoxins, YTXs)。这些贝类毒素由海洋藻类产生, 经贝类滤食摄入累积代谢而成。贝类沾染LSTs毒素是沿海国家常见的水产品安全问题(纪莹等, 2018; Farabegoli et al, 2018)。目前我国贝类主要沾染AZAs、CIs、OAs、PTXs、YTXs五大类组分, 除YTXs主要发生在北方海域, 其他组分从南到北均有发生(李美慧等, 2016; 梁玉波等, 2019)。
广西北部湾位于我国南海西北部, 与饱受海洋环境问题困扰的我国东部海域相比, 长期被誉为“洁海、净海” (钟春云, 2015)。事实上, 2010年以来, 广西北部湾海域环境日益恶化, 藻华频发(Xu et al, 2019), 但对该海域的有毒藻及有毒贝类研究仍远远不够。北部湾脂溶性贝类毒素研究早期见吴施卫等(2005)、杨美兰等(2009)、黄玉柳等(2010)和黄翔等(2013), 他们通过小白鼠生物法对腹泻性贝毒(可能包含脂溶性贝类毒素中的OAs、DTXs、PTXs组分)进行了研究, 近年学者们为了明确毒素组成和含量大小, 应用液相色谱串联质谱法(LC-MS/MS)开展脂溶性贝类毒素研究(刘仁沿等, 2008, 2014; 纪莹等, 2018; 戴梓茹等, 2018)。在这些为数不多的北部湾LSTs毒素工作中, 环亚胺毒素中的GYM (gymnodimine)在我国首次被报道恰恰来自广西北海的缘齿牡蛎(Dendostrea crenulifrea) (刘仁沿等, 2008), 2016年春季中国沿海31种养殖贝类中, 广西北海贝类的GYM均值最高, 其中对角蛤(Antigono lamellaris) GYM含量高达211.47 µg/kg (纪莹等, 2018)。国际上至今未规定GYM限量标准, 如此高含量的GYM对人类的健康影响仍无法评估。
北部湾脂溶性贝类毒素研究多集中在广西北海(刘仁沿等, 2008, 2014; 纪莹等, 2018), 其他海域研究很少。钦州湾位于广西北部湾北部, 过去三十年溶解态无机氮(DIN)、磷酸盐(PO4)均经历了显著增长(Xu et al, 2019), 部分区域出现富营养化, 海域环境利于海洋生物生长(杨斌等, 2014), 是国内外闻名的牡蛎养殖基地(伍晋宏等, 2016)。香港牡蛎(Crassostrea hongkongensis), 又称香港巨牡蛎, 俗称“大蚝”、“白蚝”, 是钦州湾主要养殖品种、钦州四大名贵海产之一(贾真等, 2019)。目前仍不了解该海域香港牡蛎沾染LSTs毒素情况与食用安全性。此外, 北部湾包括钦州湾至今未有海水脂溶性贝类毒素污染研究, 而这是了解本地区LSTs毒素来源与食物链富集的关键因素。
固相吸附毒素跟踪技术(solid phase adsorption toxin tracking, SPATT)通过大孔树脂对特定贝类毒素快速高效的吸附性, 吸附浓缩海水中的贝类毒素(MacKenzie et al, 2004; Roué et al, 2018)。该项技术已被广泛应用到国内外不同海域进行LSTs毒素预警预测研究(Rundberget et al, 2009; 渠佩佩等, 2016)。因此, 本文选择钦州湾为样品采集地点, 以香港牡蛎为研究对象, 通过SPATT和LC-MS/MS方法, 对钦州湾海域养殖区水体和香港牡蛎体内的贝类毒素进行连续一年的污染分析, 结果可为钦州湾和北部湾脂溶性贝类毒素研究、牡蛎食用安全和出口贸易管理提供理论依据。
1 材料与方法 1.1 试剂本文研究的脂溶性贝类毒素氮杂螺环酸类AZA1、AZA2、AZA3, 鳍藻毒素DTX1、DTX2, 环亚胺毒素GYM、大田软海绵酸OA、扇贝毒素PTX1、PTX2, 螺环内酯毒素SPX1, 虾夷扇贝毒素YTX标准品购自加拿大海洋生物科学研究所(The National Research Council Canada, Marine Analytical Chemistry Standards Program, Halifax NS, Canada)。毒素提取所需的分析纯级甲醇购自中国国药集团化学试剂有限公司, HPLC-MS/MS分析所需的色谱纯级甲醇和乙腈购自美国的Fisher公司。
1.2 SPATT吸附装置制作SPATT盘具体制作参考渠佩佩等(2016), 即将干重9.00 g±0.05 g的DiaionⓇ HP-20树脂(H & E Co., Ltd, China)放在23 cm×12 cm的120 µm孔径筛绢(SEFAR NITEX 03-120/49)中, 绣花绷子(直径9 cm)固定。使用前活化: 100%甲醇中浸泡48 h, 取出, 用大量MilliQ超纯水反复冲洗, 然后MilliQ水中超声10 min, 取出后用MilliQ水冲洗三遍后, 浸泡其中4—6℃冷藏待用。
1.3 样品采集2015年10月至2016年9月在钦州湾养殖区海水交换口设置采样点S1、S2和S3 (图 1)。在距水面2m处将已经活化的SPATT盘用渔线系在香港牡蛎养殖链上, 同一位置两个重复(n=2), 采样时取出SPATT树脂盘放入密封袋内, 同一位置放入新的SPATT吸附装置, 并采集该采样点的香港牡蛎样品, 三个重复(n=3), -20℃冷冻保存待后续分析。研究中每月采样一次, 若海况欠佳不利作业, 采样时间相应提前或滞后 < 5天, 共采集51份SPATT; 2015年11月损失一个贝类样品, 共采集35份香港牡蛎样品。
 |
| 图 1 采样点 Fig. 1 Sampling sites |
将SPATT盘置于烧杯中, 用500 mL MilliQ水浸泡5 min, 轻甩去水分并除去多余的盐分, 重复一次。将树脂转移至30 mL玻璃注射针筒中, 加入30 mL甲醇, 用玻璃棒轻轻搅动树脂, 使之充分浸泡于甲醇中。1 min后打开塞阀, 调节流速, 以1 mL/min过0.22 μm滤膜收集在血清瓶中。氮吹浓缩, 用100%甲醇定容到5 mL, 涡旋1 min。取1 mL过0.22 μm有机相滤膜装进色谱进样小瓶中, -80℃冷冻保存, 待LC-MS/MS分析。
1.4.2 香港牡蛎毒素提取牡蛎样品解冻去壳搅成匀浆, 准确称取2.00 g±0.02 g并加入9 mL 100%甲醇, 涡旋混匀1 min, 离心(4000×g, 10 min), 取上清液转移至30 mL玻璃针筒中。残渣再用9mL甲醇重复提取1次, 合并上清液过0.22 μm针式过滤器, 收集样品至血清瓶中, 氮吹浓缩, 用甲醇定容到5 mL, -80℃冷冻保存, 待LC-MS/MS分析。由于OA/DTXs类毒素易发生转化, 为了评估OA类毒素食用安全, 需对贝肉水解后测定毒素总量(OA、DTX1、DTX2):取1 mL上述提取液于进样小瓶中, 加入125 μL 2.5 mol/L NaOH, 涡旋0.5 min后76℃加热40 min, 待流水冷却至室温后用125 μL 2.5 mol/L HCl中和, 过0.22 μm滤膜后, 于-80℃保存, 待LC-MS/MS分析。
1.4.3 LC-MS/MS分析采用四级杆-线性阱复合型液相色谱质谱联用仪(5500 QTRAP LC-MS/MS system, AB Sciex Instruments, Foster City, CA, USA)对贝类毒素进行定性和定量检测。HPLC条件: Phenomenex Kinetex XB-C18色谱柱(100 mm×2.1 mm, 2.6 μm), 柱温40℃, 流速0.350 mL/min, 进样体积5 μL。流动相A为含50 mmol/L甲酸、2 mmol/L甲酸铵的水, 流动相B为含50 mmol/L甲酸、2 mmol/L甲酸铵的95%乙腈水溶液。梯度洗脱: 0—0.01 min, 80% A; 0.01—7.0 min, 由80% A线性梯度至10% A; 7.0—10.0 min, 10% A; 10.0—10.10 min, 回到80% A; 10.10—12.0 min, 80% A。质谱条件见王玉(2018)。
1.5 数据分析采用外标法进行毒素定量, 用对应标准回归方程进行含量计算。对于没有标准品的毒素, 参照王玉(王玉, 2018)进行去簇电压和碰撞能量设定, 通过对比定性离子对的质荷比确定。OA、DTX-1、DTX-2毒素含量根据毒素当量因子1.0、1.0、0.6 (Alexander et al, 2009)换算成μg/kg OA当量, 以评估OA类毒素食用安全。计算结果扣除空白值, 保留二位有效数字。
2 结果 2.1 毒素种类及含量在监测的14种脂溶性贝类毒素AZA1、AZA2、AZA3、DTX1、DTX2、GYM、OA、PTX1、PTX2、SPX1、YTX、Homo-YTX、45-OH-YTX、45-OH-homo YTX中, GYM在SPATT吸附装置和香港牡蛎中都有检出, OA和PTX2仅在SPATT检出, DTX2、SPX1和Homo-YTX仅在香港牡蛎检出(表 1)。SPATT分析的毒素最高值为OA: 143.94 µg/(kg resin·30d), 香港牡蛎分析的最高值为GYM: 52.14 µg/kg (表 1)。海水和香港牡蛎中检出率最高的成分分别为OA (98.0%)和GYM (100%)。
| 毒素种类 | SPATT | 香港牡蛎 | |||
| 含量[µg/(kg resin·30d)] | 检出率(%) | 含量(µg/kg) | 检出率(%) | ||
| 原多甲藻酸贝类毒素1(AZA1) | - | - | |||
| 原多甲藻酸贝类毒素2(AZA2) | - | - | |||
| 原多甲藻酸贝类毒素3(AZA3) | - | - | |||
| 鳍藻毒素-1(DTX1) | - | - | |||
| 鳍藻毒素-2(DTX2) | - | 0.95(ND—12.08) | 34.3 | ||
| 环亚胺毒素(GYM) | 0.44(ND—1.95) | 58.8 | 18.86(0.18—52.14) | 100 | |
| 大田软海绵酸(OA) | 14.20(ND—143.94) | 98.0 | - | ||
| 扇贝毒素-1(PTX1) | - | - | |||
| 扇贝毒素-2(PTX2) | 1.67(ND—13.23) | 82.4 | - | ||
| 螺环内酯毒素-1(SPX1) | - | 0.95(ND—1.98) | 85.7 | ||
| 虾夷扇贝毒素(YTX) | - | - | |||
| 虾夷扇贝毒素衍生物(Homo-YTX) | - | 未定量 | |||
| 虾夷扇贝毒素衍生物(45-OH-YTX) | - | - | |||
| 虾夷扇贝毒素衍生物(45-OH-homoYTX) | - | - | |||
| 注:数据以均值(范围)表示; “ND”和“-”表示未检出。 | |||||
以SPATT树脂盘吸附的脂溶性贝类毒素表征海水中相应的毒素, 三个监控点毒素GYM、OA、PTX2标准差分别为0—0.44、1.54—39.63、0.14—4.36 µg/(kg resin·30d), 变化幅度较大, 故用毒素含量平均值进行比较分析, 发现在整个监控期内, 海水中共检出GYM、OA、PTX2三种毒素, 其中OA的含量最高, PTX2其次, GYM的含量最低(图 2)。以3—5月为春季、6—8月为夏季、9—11月为秋季、12月至次年2月为冬季, 发现海水中OA和PTX2的均值夏季高, 其他季节低。其中OA在7月最高, 为53.09 µg/(kg resin·30d), 次均值31.04 µg/(kg resin·30d)在6月; PTX2均值在6月最高, 为6.68 µg/(kg resin·30d), 次均值4.17 µg/(kg resin·30d)在8月(图 2)。海水GYM在冬季的2月最高, 但全年含量变化不明显, 为ND—1.26 µg/(kg resin·30d) (图 2)。
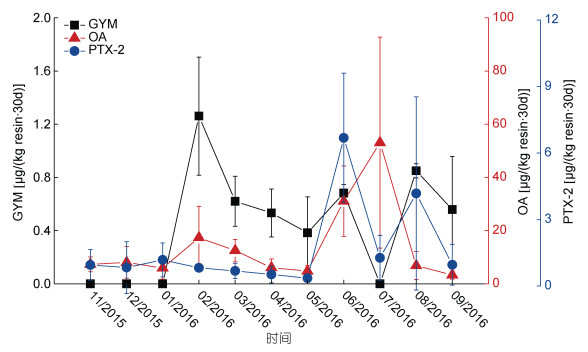 |
| 图 2 SPATT/海水中脂溶性贝类毒素季节变化特征 Fig. 2 Temporal variation of lipophilic shellfish toxins in SPATT resins/seawaters |
香港牡蛎体内共检出GYM、DTX2、SPX1、Homo-YTX四种毒素, Homo-YTX被检出但未能定量。GYM、DTX2、SPX1标准差分别为1.95—14.33、0.06—0.95、0—1.20 µg/kg, 变化幅度较大, 仍用毒素含量平均值进行比较分析, 具体见图 3, 发现GYM的含量最高, DTX2和SPX1次之。季节变化上, GYM冬季和夏季较高, 均值最高值和次高值分别为2月和8月的43.19和38.22 µg/kg; DTX2在春季和夏季较高, 均值最高值和次高值分别为3月和7月的7.55和2.31 µg/kg。SPX1冬季较高, 但含量全年变化小, 为ND—1.98 µg/kg。
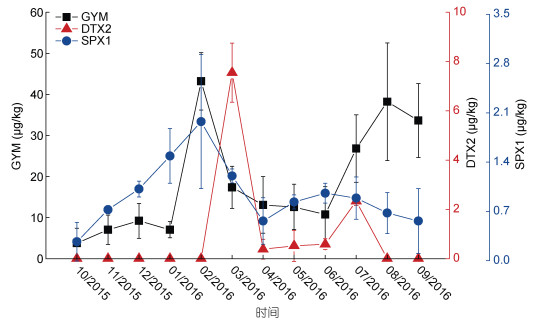 |
| 图 3 香港牡蛎体内毒素变化特征 Fig. 3 Temporal variation of lipophilic shellfish toxins in Crassostrea hongkongensis |
因海水(SPATT)与香港牡蛎体内均检出GYM, 且检出率分别为58.8%和100%, 故选择GYM分析海水与香港牡蛎体内毒素的相关性。发现海水和香港牡蛎体内GYM毒素均值变化趋势基本一致, 呈正相关(图 4), Pearson相关系数为0.70 (P=0.017, P < 0.05)。两者的GYM含量10月至次年1月趋势有所不同, 但从1月份开始两者均急剧增长, 在2月份达到峰值, 随后缓慢减少, 在夏季再次增加, 并在8月份达到第二个峰值(图 4)。总的来说, 除了2月出现短暂峰值, 海水和香港牡蛎的GYM含量春夏季高、秋冬季低。
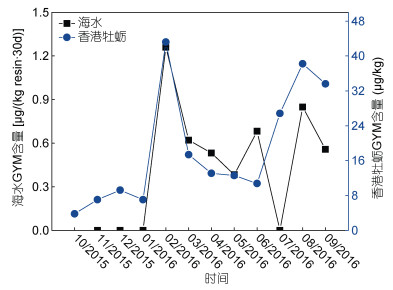 |
| 图 4 GYM毒素在海水和香港牡蛎中的分布特征 Fig. 4 GYM relationships between SPATT discs and Crassostrea hongkongensis tissues |
将检测到的OA和DTXs毒素换算成OA当量, 对海水(SPATT)和香港牡蛎中的OAs毒素含量进行比较, 发现两者亦呈现相近的变化趋势(图 5), 但相关性较弱, Pearson相关系数为0.35, 分析与牡蛎体内很长时间OA类毒素含量低/未检出有关。海水毒素含量峰值出现时间比香港牡蛎中提前:前者2月出现短暂的峰值后缓慢减少, 5月开始急剧增长, 并在7月达到峰值, 但后者直至3月才出现短暂的峰值, 随后维持在较低水平, 并从6月开始增长, 7月达到次峰值(图 5)。
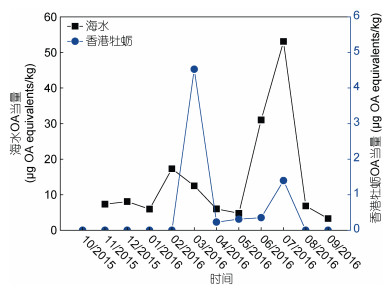 |
| 图 5 OA当量在海水和香港牡蛎中的分布特征 Fig. 5 OA equivalents relationships between SPATT discs and Crassostrea hongkongensis tissues |
SPATT技术通过聚合树脂被动吸附海水中由产毒藻释放的生物毒素, 以期实现生物毒素实时监控和提前预警(张亚亚等, 2020)。该技术最早见于新西兰脂溶性贝类毒素监测中(MacKenzie et al, 2004), 后在实验室及野外的脂溶性和水溶性贝类毒素研究中得到广泛应用, 它与传统的有毒藻细胞、贝毒和鱼毒检测相比, 具有可靠、灵敏及同时监测多类毒素的优点(Roué et al, 2018)。至今研究者们使用了二十来种树脂开展SPATT研究, 其中, DIAIONⓇHP20树脂被证实为最常用有效的类型, 在海水脂溶性贝类毒素中得到了大量成功应用(宿志伟等, 2016; 渠佩佩等, 2016; Roué et al, 2018)。
本文系首次对中国北部湾海水LSTs含量进行研究, 本研究应用SPATT技术发现钦州湾海水中存在GYM、OA、PTX2三种毒素, 未发现黄、东海海域常见的DTX1和YTX(李兆新等, 2016; 宿志伟等, 2016; 渠佩佩等, 2016; Li et al, 2017)。其中, OA和PTX2在我国海域分布广泛(渠佩佩等, 2016; 宿志伟等, 2017; Li et al, 2017; Chen et al, 2018), 而GYM目前仅在局部海域检出(渠佩佩等, 2016; 宋新成等, 2017; 宿志伟等, 2017)。钦州湾海水脂溶性贝类毒素含量较国内其他海域低, 如黄海桑沟湾GYM、OA、PTX2三种毒素最高值达37.44、25.48、65.44 μg/(20g resin·7d)(宿志伟等, 2017), 单位换算成μg/(kg resin·30d)后约为钦州湾海水对应毒素最高值的224.0、2.1、57.7倍, 钦州湾海水与浙江南麂相对比较接近, 前者GYM、OA、PTX2最大值分别是后者最大值的1.8、6.2和0.16倍(渠佩佩等, 2016; 表 1)。可见, 我国各个海域海水LSTs毒素组成和含量大小存在差别, 这与各自海域海水的产毒藻组成和丰度、理化特征、沉积环境等密切相关(Wang et al, 2015; 梁玉波等, 2019)。
3.2 牡蛎毒素含量与安全评估本文系首次对钦州湾养殖的香港牡蛎LSTs含量进行研究。早在2002年, 广西沿岸已发现贝类沾染腹泻性贝毒(可能OAs、PTXs)(吴施卫等, 2005), 但当时检测采用的是生物小白鼠法, 故无法得知结果是否可靠(假阳性)、及确切的染毒成分和毒性大小。在最近采用的液-质联用法研究中, 钦州湾栉江珧(Atrina pectinata)未检测到LSTs毒素(戴梓茹等, 2018), 但本文在该海域香港牡蛎体内检测到了四种常见的LSTs成分(DTX2、GYM、SPX1、Homo-YTX), 结果很可能与两者分析的贝类品种不同有关。本文的香港牡蛎GYM和SPX1平均含量与2008年国内首次报道的广西北海缘齿牡蛎体内的GYM含量12.00µg/kg (刘仁沿等, 2008)接近, 但比2016年春季广西北海对角蛤(A. lamellaris)、栉江珧(A. pectinata)、牡蛎(Crassostrea sp.)、厚壳贻贝(Mytilus coruscus)、短文蛤(Meretrix petechialis)、文蛤(Meretrix linnaeus)贝类体内的GYM含量49.75 µg/kg (2.47—211.47 µg/kg)和SPX1含量1.11 µg/kg (ND—2.35 µg/kg)(纪莹等, 2018)低。毒素检出率则与纪莹等(2018)接近, GYM均为100%, SPX1分别为85.7%和83.3%, 上述差异很可能与贝类种类和采样时间不同有关。至于本文频繁检出的DTX2未被检测(纪莹等, 2018), 所以无法进行比较。
与国内其他海域贝类LSTs含量相比, 总的来说广西沿岸贝类LSTs毒素成分较少, 如常检测不到OA、PTX2、YTXs等, 毒素含量亦偏低, 但GYM例外, 其含量和检出率明显大于国内其他海域来源的贝类(陈建华等, 2014; 纪莹等, 2018; 陈雨等, 2018; Liu et al, 2019)。目前我国尚未对贝类LSTs毒素制订相应的国家标准, 食用安全评估往往参考欧盟标准, AZA、OA、PTX为160 µg/kg, YTX为1.0 mg/kg [EFSA Panel on Contaminants in the Food Chain (CONTAM), 2010], 环亚胺类毒素GYM和SPX1等成分国际上仍未设定标准, 有时参考腹泻性贝类毒素的标准160 µg/kg进行评价(纪莹等, 2018), 参照上述标准, 本文采集的钦州湾香港牡蛎尽管受到多个LSTs毒素组分污染, 但未超过食用安全标准, 可放心食用。
3.3 毒素季节变化特征海水和贝类中的脂溶性贝类毒素普遍存在季节变化特征。本文钦州湾海水和香港牡蛎体内的LSTs毒素通常夏季和冬季含量高, 尤其是夏季, 多个毒素成分达到峰值, 且海水和贝类相比, 达到峰值的时间同步或提前。我国黄海海区研究发现胶州湾(李兆新等, 2011)、灵山湾(张婷婷, 2015)、桑沟湾(宿志伟等, 2016)海水中, LSTs毒素成分如PTX2、OA、DTX1、GYM、PTX2也在夏季7—8月达到峰值, 东海南麂的LSTs毒素夏季含量最高, 其次是春秋季(渠佩佩等, 2016)。本文毒素峰值变化趋势与这些研究类似, 分析可能因为夏季水温高, 利于水体中LSTs产毒藻生长从而释放更多毒素至水体中, 高产毒藻密度也利于贝类摄食有毒藻并积累毒素。但其他研究则发现海水中OA浓度5月最高(宋新成等, 2017), 贝类OA和PTX2倾向于春季和冬季, GYM则于冬季达到峰值(Wu et al, 2015), 贝类OA秋季、PTXs春季最高, AZAs、GYM和YTXs则无季节性差异, 具体随品种而异(陈雨等, 2018), 最近更有学者提出贝类毒素季节变化呈地点特异性(site-specific seasonal variation pattern)(Liu et al, 2019)。因此, 关于钦州湾/北部湾贝类脂溶性毒素季节变化特征, 有必要进一步扩大采样范围, 并将更多的贝类品种纳入研究。
3.4 LSTs潜在产毒藻海水和贝类体内的LSTs毒素来源于海洋微藻, 我国北部湾之外海域已记录多种LSTs潜在产毒藻(Gu et al, 2013; Jiang et al, 2014; Liu et al, 2017; 勾玉晓等, 2018), 但广西北部湾LSTs产毒藻研究极为匮乏, 本文亦未能就海水样品中的LSTs肇事藻开展识别工作。目前, 仅刘仁沿等(2016)指出广西北海分布有网状原角藻和具刺膝沟藻孢囊, Gu等(2013)在防城港海域分离到部分腹孔环胺藻株能产生AZA2毒素(Gu et al, 2013; Li et al, 2016)。而对广西沿岸反复检测到、浓度多次达到全国最高, 潜在危害突出的GYM产毒藻尚未分离发现。GYM是一种螺旋形环亚胺结构, 最先从新西兰牡蛎(Tiostrea chilensis)中分离到, 产毒藻为甲藻门(Dinophyta)、凯伦藻属(Karenia)下的鞍状凯伦藻(K. selliformis)和亚历山大藻属(Alexandrium)下的奥氏亚历山大藻(A. ostenfeldii)(与A. peruvianum同种异名) (Farabegoli et al, 2018)。目前, 中国其他沿海包括北部湾仍未分离明确能产GYM毒素的微藻, 只在我国渤海湾发现了不产毒的奥氏亚历山大藻(Gu, 2011)、香港海域发现对轮虫具有急性毒性的鞍状凯伦藻(李思等, 2018)。由于自然水体中LSTs肇事藻浓度往往不高, 通过传统实验手段不易分离发现目标藻, 接下来有必要借助在浮游植物检测研究中得到广泛应用的实时荧光定量PCR(qPCR)技术(Medlin et al, 2017), 完成北部湾LSTs目标藻定量定性分析。
4 结论(1) 海水共检出GYM、OA和PTX2三种组分, 平均浓度分别为0.44、14.20和1.67 µg/(kg resin·30d)。香港牡蛎共检出DTX2、GYM、SPX1、Homo-YTX四种组分, 其中Homo-YTX为定性结果, DTX2、GYM、SPX1三者平均浓度分别为0.95、18.86和0.95 µg/kg。
(2) GYM毒素均值在海水和香港牡蛎之间变化趋势呈正相关, Pearson相关系数为0.70; OAs毒素则变化趋势类似, 但Pearson相关系数0.35。
(3) 毒素含量存在一定季节变化。海水OA和PTX2夏季高, 其他季节低, 均值最高值分别发生在7月和6月; 香港牡蛎体内GYM冬季和夏季较高, DTX2春季和夏季较高; 海水中的GYM和香港牡蛎体内的SPX1全年季节变化均不明显。
因此, 钦州湾海水和香港牡蛎已受到多个LSTs毒素组分污染, 海水LSTs毒素含量较国内其它海域低, 参考欧盟LSTs毒素标准, 钦州湾香港牡蛎脂溶性贝类毒素未超标, 可放心食用。
王玉, 2018.扇贝毒素的检测与标准化制备方法研究.杭州: 浙江大学硕士学位论文
|
勾玉晓, 刘磊, 李冬梅, 等. 2018. 北黄海慢原甲藻形态结构与腹泻性贝类毒素组成. 中国渔业质量与标准, 8(3): 11-18 DOI:10.3969/j.issn.2095-1833.2018.03.002 |
伍晋宏, 鲁洋, 李晋文, 等. 2016. 钦州牡蛎产业现状及发展对策分析. 北方经贸, (9): 58-59 DOI:10.3969/j.issn.1005-913X.2016.09.022 |
纪莹, 胡杨, 宋甲亮, 等. 2018. 春季中国沿海主要养殖贝类中脂溶性贝毒的组分分析和地域特征. 中国渔业质量与标准, 8(4): 15-24 DOI:10.3969/j.issn.2095-1833.2018.04.003 |
刘仁沿, 高春蕾, 梁玉波, 等. 2008. Gymnodimine, 首次在我国北海缘齿牡蛎中发现的一种腹泻性贝毒组分. 海洋学报, 30(6): 171-176 DOI:10.3321/j.issn:0253-4193.2008.06.021 |
刘仁沿, 梁玉波, 刘磊, 等. 2014. 液相色谱结合串联质谱方法研究中国沿海贝类中脂溶性藻毒素的种类结构和分布规律. 生态环境学报, 23(8): 1320-1326 DOI:10.3969/j.issn.1674-5906.2014.08.011 |
刘仁沿, 刘磊, 梁玉波, 等. 2016. 我国近海有毒微藻及其毒素的分布危害和风险评估. 海洋环境科学, 35(5): 787-800 |
李思, 岑竞仪, 王建艳, 等. 2018. 两株凯伦藻对轮虫急性毒性的研究. 海洋环境科学, 37(1): 28-32, 69 |
李兆新, 郭萌萌, 杨守国, 等. 2011. 黄海胶州湾海水中蛤毒素特征及变化规律. 渔业科学进展, 32(6): 69-75 DOI:10.3969/j.issn.1000-7075.2011.06.011 |
李兆新, 宋才湖, 张婷婷, 等. 2016. 黄海海州湾海域腹泻性贝类毒素特征研究. 中国渔业质量与标准, 6(6): 47-52 |
李美慧, 李爱峰, 曹际娟, 等. 2016. 我国常见的几种脂溶性贝毒的研究进展. 生命科学, 28(1): 33-43 |
吴施卫, 张纯超, 卢楚谦, 等. 2005. 南海近岸海域腹泻性贝类毒素分析. 海洋环境科学, 24(4): 48-51 DOI:10.3969/j.issn.1007-6336.2005.04.013 |
宋新成, 周德山, 尹华斌, 等. 2017. 海州湾脂溶性藻毒素分布特征及变化规律. 淮海工学院学报(自然科学版), 26(4): 84-88 DOI:10.3969/j.issn.1672-6685.2017.04.018 |
张亚亚, 闫国旺, 吴海燕, 等. 2020. 基于SPE与SPATT的水体中麻痹性贝类毒素检测方法构建与应用. 海洋与湖沼, 51(2): 298-306 |
张婷婷, 2015.黄海灵山湾和海州湾海域腹泻性贝毒季节变化规律研究.上海: 上海海洋大学硕士学位论文
|
陈雨, 张菁, 江天久. 2018. 广东省沿海脂溶性贝类毒素的分布特征. 海洋环境科学, 37(2): 161-167 |
陈建华, 于仁成, 孔凡洲, 等. 2014. 北黄海海域虾夷扇贝体内脂溶性藻毒素分析. 海洋与湖沼, 45(4): 855-863 |
杨斌, 鲁栋梁, 钟秋平, 等. 2014. 钦州湾近岸海域水质状况及富营养化分析. 中国环境监测, 30(3): 60-64 DOI:10.3969/j.issn.1002-6002.2014.03.013 |
杨美兰, 贾晓平, 林钦, 等. 2009. 南海海域重要养殖水域牡蛎体中的腹泻性贝类毒素. 海洋环境科学, 28(4): 410-413 DOI:10.3969/j.issn.1007-6336.2009.04.014 |
钟春云. 2015. 守护北部湾这片净海. 当代广西, (14): 40-41 |
贾真, 佘智彩, 彭业韶, 等. 2019. 香港牡蛎不同育肥方式的育肥效果. 水产科学, 38(4): 514-520 |
黄翔, 雷芳, 江天久. 2013. 我国东海和南海近岸海域腹泻性贝类毒素污染状况. 暨南大学学报(自然科学版), 34(1): 101-105 |
黄玉柳, 黎小正, 吴祥庆, 等. 2010. 广西海水养殖贝类腹泻性贝类毒素(DSP)检测及评价. 江苏农业科学, (6): 485-486 DOI:10.3969/j.issn.1002-1302.2010.06.193 |
宿志伟, 赵峰, 刘远平, 等. 2016. 固相吸附毒素跟踪技术监测牡蛎养殖区中腹泻性贝毒. 渔业科学进展, 37(6): 144-150 |
宿志伟, 赵峰, 姜雪, 等. 2017. 桑沟湾养殖牡蛎中贝类毒素监测及预警. 食品科学, 38(6): 303-309 |
渠佩佩, 杨晶晶, 徐轶肖, 等. 2016. 固相吸附毒素跟踪技术(SPATT)在浙江南麂海域的应用. 海洋与湖沼, 47(4): 795-803 |
梁玉波, 李冬梅, 姚敬元, 等. 2019. 中国近海藻毒素及有毒微藻产毒原因种调查研究进展. 海洋与湖沼, 50(3): 511-524 |
戴梓茹, 王培, 张晨晓, 等. 2018. 钦州湾栉江珧营养成分及腹泻性贝毒分析与评价. 食品科技, 43(8): 137-143 |
Alexander J, Benford D, Boobis A et al, 2009. Scientific opinion of the panel on contaminants in the food chain on a request from the European Commission on marine biotoxins in shellfish-summary on regulated marine biotoxins. The EFSA Journal, 1306: 1-23 |
Chen J H, Han T Z, Li X T et al, 2018. Occurrence and distribution of marine natural organic pollutants:Lipophilic marine algal toxins in the Yellow Sea and the Bohai Sea, China. Science of the Total Environment, 612: 931-939 DOI:10.1016/j.scitotenv.2017.08.304 |
EFSA Panel on Contaminants in the Food Chain (CONTAM), 2010. Statement on further elaboration of the consumption figure of 400 g shellfish meat on the basis of new consumption data. EFSA Journal, 8(8): 1706 DOI:10.2903/j.efsa.2010.1706 |
Farabegoli F, Blanco L, Rodríguez L P et al, 2018. Phycotoxins in marine shellfish:Origin, occurrence and effects on humans. Marine Drugs, 16(6): 188 DOI:10.3390/md16060188 |
Gu H F, 2011. Morphology, phylogenetic position, and ecophysiology of Alexandrium ostenfeldii (Dinophyceae) from the Bohai Sea, China. Journal of Systematics and Evolution, 49(6): 606-616 DOI:10.1111/j.1759-6831.2011.00160.x |
Gu H F, Luo Z H, Krock B et al, 2013. Morphology, phylogeny and azaspiracid profile of Azadinium poporum (Dinophyceae) from the China Sea. Harmful Algae, 21-22: 64-75 DOI:10.1016/j.hal.2012.11.009 |
Jiang T, Xu Y X, Li Y et al, 2014. Dinophysis caudata generated lipophilic shellfish toxins in bivalves from the Nanji Islands, East China Sea. Chinese Journal of Oceanology and Limnology, 32(1): 130-139 DOI:10.1007/s00343-014-2290-8 |
Li A F, Jiang B Z, Chen H D et al, 2016. Growth and toxin production of Azadinium poporum strains in batch cultures under different nutrient conditions. Ecotoxicology and Environmental Safety, 127: 117-126 DOI:10.1016/j.ecoenv.2016.01.017 |
Li M H, Sun G, Qiu J B et al, 2017. Occurrence and variation of lipophilic shellfish toxins in phytoplankton, shellfish and seawater samples from the aquaculture zone in the Yellow Sea, China. Toxicon, 127: 1-10 DOI:10.1016/j.toxicon.2016.12.009 |
Liu L, Wei N, Gou Y X et al, 2017. Seasonal variability of Protoceratium reticulatum and yessotoxins in Japanese scallop Patinopecten yessoensis in northern Yellow Sea of China. Toxicon, 139: 31-40 DOI:10.1016/j.toxicon.2017.09.015 |
Liu Y, Yu R C, Kong F Z et al, 2019. Contamination status of lipophilic marine toxins in shellfish samples from the Bohai Sea, China. Environmental Pollution, 249: 171-180 |
MacKenzie L, Beuzenberg V, Holland P et al, 2004. Solid phase adsorption toxin tracking (SPATT):a new monitoring tool that simulates the biotoxin contamination of filter feeding bivalves. Toxicon, 44(8): 901-918 |
Medlin L K, Orozco J, 2017. Molecular techniques for the detection of organisms in aquatic environments, with emphasis on harmful algal bloom species. Sensors, 17(5): 1184 |
Roué M, Darius H T, Chinain M, 2018. Solid phase adsorption toxin tracking (SPATT) technology for the monitoring of aquatic toxins:a review. Toxins, 10(4): 167 |
Rundberget T, Gustad E, Samdal I A et al, 2009. A convenient and cost-effective method for monitoring marine algal toxins with passive samplers. Toxicon, 53(5): 543-550 |
Wang Y L, Chen J H, Li Z Y et al, 2015. Determination of typical lipophilic marine toxins in marine sediments from three coastal bays of China using liquid chromatography-tandem mass spectrometry after accelerated solvent extraction. Marine Pollution Bulletin, 101(2): 954-960 |
Wu H Y, Yao J H, Guo M M et al, 2015. Distribution of marine lipophilic toxins in shellfish products collected from the Chinese market. Marine Drugs, 13(7): 4281-4295 |
Xu Y X, Zhang T, Zhou J, 2019. Historical occurrence of algal blooms in the northern Beibu Gulf of China and implications for future trends. Frontiers in Microbiology, 10: 451 |
 2021, Vol. 52
2021, Vol. 52


