中国海洋湖沼学会主办。
文章信息
- 杨进宇, 汤锦铭, 郭香会, 高树基. 2021.
- YANG Jin-Yu, TANG Jin-Ming, GUO Xiang-Hui, KAO Shuh-Ji. 2021.
- 中国边缘海氮循环过程和源汇格局——以南海为例
- NITROGEN CYCLING PROCESSES AND ITS BUDGET IN CHINA MARGINAL SEA: CASE STUDIES IN THE SOUTH CHINA SEA
- 海洋与湖沼, 52(2): 314-322
- Oceanologia et Limnologia Sinica, 52(2): 314-322.
- http://dx.doi.org/10.11693/hyhz20200800234
文章历史
-
收稿日期:2020-08-20
收修改稿日期:2020-12-02
氮元素是合成生命有机体所必需的重要组分, 是决定生物生长发育的主要营养物质。在自然环境中, 氮元素存在多种价态, 能够通过不同的氧化还原反应发生形态间的转化(图 1)。对于绝大多数海洋环境, 氮元素的供给是限制海洋初级生产力和有机物输出的主要因素, 是海洋生物赖以生存的物质基础, 因而是控制生态系统运转的重要因素之一(Moore et al, 2013); 另一方面, 氮元素在不同储库间的转运需要以不同微生物为媒介, 且与海洋中生物食物链的传递密切相关, 是维系海洋生物相互作用的重要纽带。因此, 理解海洋氮循环过程及其源汇格局对于探究海洋生物地球化学以及生物多样性形成具有重要意义。
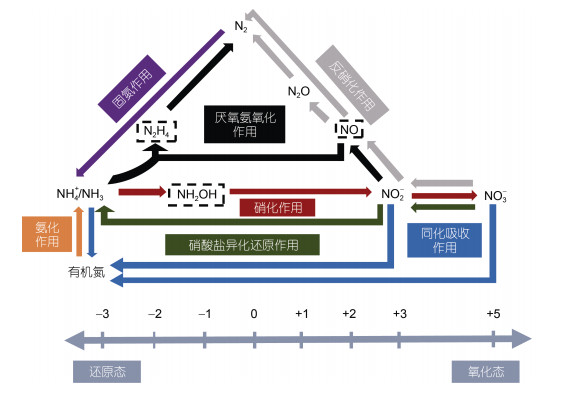 |
| 图 1 海洋氮循环过程示意图 Fig. 1 Schematic diagram of marine nitrogen cycle 注: 虚线框中的氮组分为不稳定的中间产物 |
现代海洋中氮循环过程与微生物代谢和自然环境条件形成紧密的耦合关系, 决定海洋中氮的储量和形态(Canfield et al, 2010)。固氮作用和大气氮沉降是海洋中最重要的氮输入途径, 而通过径流输入的氮通量对于近岸环境的氮储库具有显著影响。区别于主要通过沉积物埋藏从海洋中移除的磷、硅等生源要素, 发生在缺氧环境中的反硝化作用和厌氧氨氧化作用是海洋中氮移除的主要途径。此外, 海洋中氮元素的内部循环过程, 如同化作用、矿化作用、硝化作用、异养硝酸盐还原作用等, 不改变海洋氮储库的数量, 但是能够使得海洋中生物可利用氮(bioavailable nitrogen)的形态发生转变。随着分子生物学技术和同位素手段的应用, 更多种类的微生物被发现能够参与氮循环过程。同时, 多种新的氮循环过程的发现, 极大地丰富了海洋氮循环的研究, 但也因此挑战了海洋氮储库处于稳态的传统观点。另一方面, 大量人为活动产生的氮(anthropogenic nitrogen)进入海洋, 可能进一步造成海洋中氮源汇格局的不确定性, 并由此影响海洋调控大气二氧化碳的能力以及释放温室气体氧化亚氮的潜力, 对全球气候变化产生重要反馈(Voss et al, 2013)。厘清海洋中氮储库和形态的潜在变化及其敏感性有助于审视未来全球生态环境和气候变化的响应趋势。
边缘海具有高生产力、高生物多样性的特点, 是全球重要的碳汇区(carbon sink), 其中的生物地球化学过程存在较高的时空变异性(Cao et al, 2020)。边缘海承接陆地和开阔大洋的物质和能量, 是受人为活动和环境变化影响最直接和显著的区域。人为来源氮的输入引起近岸水体富营养化、缺氧和赤潮等事件频发(俞志明等, 2019), 全球变暖和海洋酸化等环境问题在边缘海也尤为突出, 这些环境问题又可能进一步扰动海洋中不同氮组分之间的迁移转化途径及其速率(Rabouille et al, 2001; Wannicke et al, 2018; Pajares et al, 2019; Zhang et al, 2020)。另一方面, 与开阔大洋的水体交换会影响边缘海内部的底物浓度和物理场结构, 能够改变其中氮生物地球化学动力学过程(Voss et al, 2013)。准确量化边缘海氮生物地球化学过程的速率是解析海洋生物地球化学动力学机理的关键要素。
中国南海地处西北太平洋热带-亚热带地区, 是全球最大的边缘海之一, 被人口稠密的亚洲大陆包围。南海的陆架区和海盆区的水文环境和生物地球化学过程分别受到河流和西北太平洋的影响(图 2), 可视为河流主控型海区和大洋主控型海区(Dai et al, 2013), 因此是研究不同类型边缘海中氮循环过程的理想示范场。近年来, 随着同位素示踪手段的广泛应用, 针对南海氮循环过程的定量研究得到广泛开展, 不仅加深了对区域性氮循环的认识, 还具有全球性指示意义。本文将重点回顾和总结在南海河口陆架区和海盆区两种典型的河流主控型和大洋主控型海区关于氮循环过程及其源汇格局的最新进展, 以及全球变化对边缘海氮循环过程的影响, 最后对未来边缘海氮循环研究的重点方向提出展望。
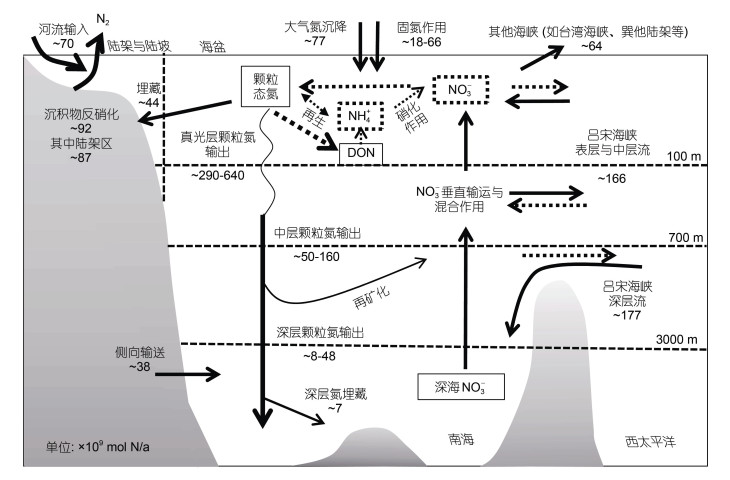 |
| 图 2 南海氮循环过程及相关通量(改自Liu et al, 2007, 2010; Chen et al, 2008; Yang et al, 2014, 2017) Fig. 2 The nitrogen cycling and budget in the South China Sea (modified form Liu et al, 2007, 2010; Chen et al, 2008; Yang et al, 2014, 2017) |
边缘海的氮输入过程主要包括河流输入、大气氮沉降和生物固氮作用。然而, 上述三种途径对于边缘海氮输入的贡献量及其影响范围不尽相同。
1.1 河流输入从全球范围上看, 自工业革命以来河流输入至边缘海陆架区的氮通量增加了近两倍, 达到约17×1012 g N/a, 其中热带河流是氮输入海洋的主要通道(Jickells et al, 2017)。以珠江、湄公河为代表的热带大河每年向南海河口和陆架区输入的无机氮总量达到0.55×1012 g N/a, 占所有河流向南海输入氮总量的60%以上。南海周边区域由于快速工业化进程和农业氮肥加速利用等人为活动产生了大量氮并进入河流, 正在快速改变河流的氮输入通量。以珠江流域为例, 人为来源的氮输入从1986年的3362 kg N/(km2·a) 增加至2015年的8071 kg N/(km2·a) (Cui et al, 2020), 远高于同期世界河流氮输入通量的平均增长率。与大多数河流主控型边缘海类似, 南海河口陆架区的营养盐浓度和初级生产力限制状态受河流的影响显著。观测数据显示在1989—2004年间南海北部陆架区水体溶解无机氮含量呈上升趋势, 增幅为0.38—0.81 μmol/(L·a), 明显高于同期溶解无机磷的增量。因此, 南海陆架水体中氮磷比从~10增加至~16, 总体上近岸水体初级生产力的氮限制状态得到缓解(Ning et al, 2009)。
1.2 大气氮沉降大气氮沉降是人为来源氮组分进入海洋的另一重要途径。区别于河流输入的影响仅局限于河流主控型海区(河口和近岸海域), 大气氮沉降不仅能够作用于近岸海域, 更能广泛影响开阔海洋, 尤其对寡营养开阔海区的氮循环过程和生态系统的运转产生重要改变(Duce et al, 2008; Yang et al, 2016; Yang et al, 2020)。模型估算结果显示在2005年由大气沉降进入全球海洋的氮通量为38×1012—96×1012 g N/a, 相比1850年(工业革命以前)增长了4—10倍, 其中大部分进入边缘海(Duce et al, 2008; Jickells et al, 2017)。
随着改革开放以来我国经济发展进入快速增长期, 氮排放的峰值和增速已经赶超欧美(Liu et al, 2013), 中国边缘海也因此成为世界上受大气氮沉降影响最显著的区域之一。近三十年间, 东海表层水体中溶解无机氮浓度明显增高[0.1—0.2 µmol/(L·a)] (Kim et al, 2011; Kim et al, 2014a)。Ren等(2017)发现东沙岛珊瑚礁骨骼中记录的稳定氮同位素组成在过去45年间降低了1.3‰, 表明人为来源大气氮沉降(提供氮同位素较轻的氮源)的影响呈上升趋势, 并估算大气氮沉降约占南海表层氮输入总量的20%。Yang等(2014)和Xiao等(2015)通过分析南海大气沉降中硝酸盐和颗粒物的稳定氮同位素组成证实在冷季主要来源于中国大陆的煤炭使用, 而在暖季则以天然来源的氮组分(如闪电合成大气中的氮气和氧气)和源自东南亚的生物质燃烧为主。此外, 有限的现场观测数据显示在南海大气氮沉降通量约为1.08×1012 g N/a, 超过河流氮输入和固氮作用的通量(Kim et al, 2014b; Yang et al, 2014), 因此大气氮沉降是南海最重要的外源氮输入(external nitrogen input)渠道。模型估算显示未来中国边缘海大气氮沉降通量仍将持续增加, 该结果需要更多的现场观测加以验证, 其对边缘海生物地球化学过程和生态系统的潜在影响也亟需厘清(Yang et al, 2016; Jickells et al, 2017)。
1.3 生物固氮作用从全球尺度上看, 生物固氮作用通常被认为主要活跃在寡营养的开阔大洋中, 是海洋外源氮输入最重要的途径。然而, 最近研究表明开阔海区的生物固氮作用可能受到磷和铁输入的限制, 而在岛弧附近却存在较高的固氮生物丰度和固氮速率(Shiozaki et al, 2010)。该发现暗示边缘海可能是固氮生物活跃生存的潜在热点区域。Mulholland等(2019)和Tang等(2019)证实在西北大西洋近岸水体存在比马尾藻海(开阔海盆)更高的固氮速率, 且以单细胞蓝细菌(UCYN-A)为主要固氮藻功能类; 基于高空间分辨率观测的估算结果显示全球近岸水体的固氮作用通量可以达到16.7×1012 g N/a (Tang et al, 2019), 表明近岸水体的固氮作用是全球海洋氮储库收支中不可忽视的重要组成部分。
总体上, 整个南海的固氮作用通量为0.25—0.93×1012 g N/a (Chen et al, 2008; Liu et al, 2010), 其在河口陆架区和海盆区受到不同因素的影响。南海近岸水体的固氮速率受河流输入的外源限制性营养盐的影响。Voss等(2006)发现湄公河冲淡水携带丰富的微量元素可能对固氮生物生长起到促进作用。另一方面, 沿岸水体的动力过程也是影响该区域固氮速率的重要因素。Zhang等(2015)发现琼东上升流使得富含营养盐的次表层水涌入表层会抑制固氮藻生长; 而Wen等(2017)在台湾海峡发现受上升流影响的表层水存在较高的固氮速率以及低氮磷比的次表层水信号, 说明沿岸水体的固氮作用可能受水团中氮与磷相对丰度的影响更显著。相较于临近的黑潮流域, 南海海盆区的固氮速率相对较低, 且以单细胞蓝藻为主要的优势种(Wu et al, 2018)。较强的大气氮沉降通量和由于海盆整体尺度抬升造成的营养盐跃层变浅可能是限制南海海盆中固氮藻生长的主要因素。然而, 海盆内部时常存在的中尺度涡旋(mesoscale eddy)能够通过改变上层水体营养盐的供给影响固氮速率。例如, Liu等(2020)在南海东北部发现反气旋涡旋内部的固氮速率明显高于气旋涡旋内部和不受涡旋影响区域。此外, 海盆区与开阔大洋的水体交换也能够改变其内部固氮速率。黑潮入侵夹带大量束毛藻在南海北部海盆发生藻华, 提升南海北部上层水体的固氮速率并显著贡献于初级生产力(Lu et al, 2019)。这些发现极大拓展了对固氮作用的传统认识, 并显著提升边缘海固氮作用对全球海洋氮循环和碳循环的重要性。
2 南海的氮移除过程海洋中氮移除过程包括水体和沉积物反硝化作用和厌氧氨氧化作用, 以及沉积物的氮埋藏。水体中的氮移除过程通常发生在缺氧水体中, 而南海河口陆架区和海盆区水体中溶解氧含量相对充足(Li et al, 2006), 因而发生水体反硝化作用和厌氧氨氧化作用等氮移除过程的可能性较小。目前, 尚没有研究显示南海水体中存在明显的氮移除速率。输入南海的外源氮绝大多数会最终进入沉积物中, 其中仅有不足30%的生物可利用氮(有机和无机组分)最终会在沉积物中埋藏(Zheng et al, 2008), 大部分生物可利用氮会在沉积物中通过反硝化作用和厌氧氨氧化作用被移除, 以气体形态回到水体和大气中。
河口沉积物常扮演高效的“过滤器”, 能够截留大部分河流携带的人为来源氮, 一定程度上缓解近岸富营养化程度。Cai等(2015)根据224Ra/228Th不平衡法估算出珠江口中由水体进入沉积物的硝酸盐通量为0.18×1012 g N/a, 说明约80%由珠江水体携带的生物可利用氮进入到河口沉积物中。Hong等(2019)发现珠江河口区沉积物间隙水中无机氮和有机氮的含量显著低于底层河水的浓度, 暗示上覆水中生物可利用氮进入表层沉积物后被微生物快速移除。Tan等(2019)通过人工标记15N同位素的手段证实珠江口沉积物中有机物的降解与硝化-反硝化的耦合作用共同决定沉积物中氮移除过程, 结果显示沉积物中反硝化作用能够贡献90%以上的氮移除速率[282— 6200 mmol N/(m2·a)], 远高于厌氧氨氧化作用的贡献。
边缘海被普遍认为是沉积物反硝化作用发生的热点区域。由于观测手段的限制, 海盆沉积物的反硝化速率主要基于模型估算, 现场实测数据相对缺乏(Devol, 2015)。南海底层水源自西北太平洋深层水, 但是世界海洋地图集(WOA13)数据显示南海底层水的氮磷比明显低于南海次表层水和西北太平洋深层水的氮磷比。南海底层水的溶解氧浓度较高(> 100 mol/kg, Li et al, 2006)会抑制水体反硝化作用的发生。同时, 南海底层水与西北太平洋深层水中硝酸盐稳定氮同位素组成的一致性也表明水体反硝化作用的影响可以忽略(Yang et al, 2017)。因此, 我们推测南海内部沉积物反硝化作用对氮移除的显著效应是造成南海深层水氮磷比减小的主要因素。Liu等(2007)通过物理-生物地球化学耦合三维数值模型得出南海沉积物反硝化速率(FBD)的空间分布, 结果显示大部分南海陆架区FBD为20—80 mmol N/(m2·a), 陆坡和海盆区FBD减小至不足1 mmol N/(m2·a)。据此可知, 南海沉积物反硝化作用的氮移除总量为1.3×1012 g N/a, 其中85%的氮移除量发生在陆架区, 这与河流输入南海的氮通量相似(Liu et al, 2007)。
值得关注的是边缘海是释放强效温室气体氧化亚氮(N2O)的重要区域, 对全球气候变化的影响具有重要意义(Murray et al, 2015; 洪义国等, 2020)。作为反硝化作用的中间产物和硝化作用的副产物, 少部分沉积物和水体中的生物可利用氮能够被转化成N2O。南海河口和陆架区水体中N2O常处于过饱和状态, 总体上是大气N2O的源(Han et al, 2013; Lin et al, 2016)。通过分析N2O的位点特异性(site preference), Zhang等(2019)发现南海陆架和陆坡开阔海区水体真光层和中层水中N2O产生的主要途径分别为硝化微生物的反硝化作用(nitrifier denitrification)和自养硝化作用, 两种过程对N2O的平均产率为0.035%。在河口区水体中氨氧化细菌(AOB)是N2O的主要生产者(Ma et al, 2019); 然而, 沉积物反硝化作用具有更高的N2O产率(0.03%—3%), 能够贡献约35%的N2O海气通量, 这可能与河口区沉积物中较高的有机氮含量以及有机物中较高的碳氮比有关(Tan et al, 2019)。
3 南海的氮内循环过程 3.1 河口区的硝化作用硝化作用能够将氨最终氧化为硝酸盐, 是近岸水体中耗氧的重要途径, 增加了生态系统的环境压力。河口区硝化生物的分布和活性受底物浓度、溶解氧和温度等环境因子的影响。以珠江口为例, 水体硝化速率在夏季明显高于冬季(Dai et al, 2008)。就氨氧化生物而言, 尽管在珠江口上游缺氧区的颗粒物上发现了较高丰度的AOB基因, 但是对于整个珠江河口, 氨氧化古菌(AOA)主导了氨氧化生物的群落结构; 对于亚硝氧化菌(NOB), Nitrospira和Nitrospina分别是珠江口中上游和近海端的优势种群(Hou et al, 2018)。尽管AOB的丰度相对较低, 但在珠江河口中AOB的丰度和水体中硝化速率呈现很好的相关性, 表明其在河口区的活跃性。通过生物抑制剂结合同位素示踪的手段, Zheng等(2020)在九龙江口发现在AOB基因拷贝数仅占AOA的1/10, 但AOB仍然能够贡献超过30%的氨氧化速率, 进一步表明了AOB在贡献河口水体氨氧化速率的重要作用。
3.2 海盆区的氮吸收与硝化作用南海海盆区表层水通常呈现寡营养状态, 但是其硝酸盐跃层(50—75 m)位于真光层内部, 浅于开阔寡营养大洋的硝酸盐跃层(> 100 m)。这一现象使得南海真光层内部形成有关营养盐的双层结构, 即营养盐匮乏层(NDL)和营养盐充足层(NRL)(Du et al, 2017), 为不同功能类群的生物提供了生态位。在NDL内, 营养盐的补充较少, 基本处于耗尽状态。原核浮游植物由于具有较高铵盐亲和力, 能够高效地利用有机物再矿化产生的铵盐, 因而处于优势地位。真核生物和氨氧化生物的生存会受到抑制。在NRL内, 来自次表层的硝酸盐供应相对充足, 这使得偏好吸收同化硝酸盐的真核浮游植物占主导地位, 从而为氨氧化生物利用氨提供了生态位。这一发现说明真光层内部硝酸盐浓度可能是影响不同生物利用氨的主要因素, 挑战了以往硝化作用主要受控于光强改变的传统观点(Wan et al, 2018)。然而, Xu等(2019)认为在硝酸盐缺乏的真光层内光照强度增加会促进浮游植物吸收再生氮(铵盐和尿素), 同时抑制硝化微生物氧化氨。因此, 底物浓度和光强可能共同决定了再生营养盐的转化途径。
侧向水平传输是影响南海上层水体中营养盐和有机物分布的重要因素(Du et al, 2013; Wu et al, 2015), 同时也会影响氮内循环过程。例如, 富含有机物的黑潮入侵南海, 会刺激原位微生物矿化这些外源有机物, 从而为硝化作用提供丰富的底物。Xu等(2018)发现虽然在光和营养盐的调控下, 表层水的氨氧化速率受到抑制[仅0.001—0.6 nmol/(L·d)], 而在黑潮影响区域上层水体中氨氧化作用得到显著增强, 速率最高可达133.5 nmol/(L·d)。该发现暗示黑潮入侵导致增强的硝化作用可能也是刺激上层水体N2O释放的潜在因素。此外, 南海深部水层同样观测到存在明显的由陆架向深海侧向传输的有机物(Yang et al, 2017), 这一过程如何影响南海深部氮内循环值得关注。
4 全球变化对边缘海氮循环的影响河口及近岸陆架海域中氮循环过程受到复杂的环境梯度和逐渐加剧的人类活动的双重影响, 同时也显著受气候变化的调控。Zheng等(2020)发现由于氨氧化生物群落以及营养盐浓度的差异, 氨氧化速率在近海和海盆对全球暖化的响应呈现出截然不同的反馈: 在氨浓度相对较高的近岸环境中, 平均氨氧化速率增加了13%; 而在寡营养的开阔海域, 氨氧化速率则下降了约27%。在未来暖化条件下, 近岸环境中增强的氨氧化作用可能进一步刺激反硝化作用的加强。Tan等(2020)发现暖化会造成低纬度近海河口沉积物中反硝化作用的增强, 同时伴随着厌氧氨氧化作用的减弱。此外, 基于现场观测的数据显示南海河口和陆架区溶解氧含量持续下降(Qian et al, 2018), 未来水体缺氧面积和程度继续增大的情况下, 水体和沉积物的氮移除速率以及N2O产量可能进一步增强。上述因素均会加剧近岸环境向大气释放N2O, 从而可能进一步加速全球气候变暖。
不同的氮循环过程对于海洋酸化的响应存在差异(Wannicke et al, 2018)。大部分研究显示海洋酸化对固氮作用起促进作用; 然而Hong等(2017)在南海北部的研究显示尽管CO2升高有利于束毛藻的生长, 但是pH下降会更为显著地抑制束毛藻的生长和固氮速率。海洋酸化对环境中AOB和AOA的丰度影响较小, 却会显著降低硝化作用速率, 这可能会造成海洋酸化条件下氮组分趋向于还原态, 并因此造成反硝化作用的底物含量下降和浮游植物群落结构的转变。目前关于海洋酸化如何影响其他氮循环过程的研究还明显不足。基于现有认识表明南海的氮收支处于平衡状态(图 2), 在全球变化背景下该平衡状态是否会被打破值得注意。
5 研究展望越来越多的证据表明海洋氮循环过程对于全球变化的响应存在复杂性。多数研究还仅是针对单一因素的影响, 关于多气候胁迫因子对氮循环的协同影响及相应的微生物生理响应机制的研究仍然鲜有报道, 这对准确厘清边缘海氮循环过程的变化趋势至关重要。此外, 现场调查和实验室研究得出的结论仍存在不一致性, 这些都亟待进一步的研究探明。
需要加强应用新技术对氮循环相关过程分类群的探究。传统上对海洋氮循环的微生物代谢过程通常局限于量化群落总速率的研究。在复杂且动态的氮循环中, 同一个过程可能由多种不同的生物同时介导。近年来, 如流式细胞仪(FCM)分选、纳米二次离子质谱(NanoSIMS)结合同位素示踪等技术的出现让针对种群和细胞尺度代谢的细节研究成为可能(Lomas et al, 2011; Mayali, 2020)。目前这些技术已经开始被应用在探究不同硝化微生物的代谢机制与偏好(Kitzinger et al, 2020)、氧匮乏层(oxygen depleted layer)不同功能类群浮游植物的氮利用策略(Aldunate et al, 2020)、固氮生物引入氮(DDN)的归宿(Caffin et al, 2018)、以及单细胞氨氮代谢(Klawonn et al, 2019)等前沿课题中, 具有广阔的研究前景。
需要进一步加强氮生物地球化学过程速率观测的原位化、自动化和实时化。传统上, 针对营养盐的分析、相关氮循环过程速率通量的测定, 以及相关基因表达的获取, 这些参数的采样通常存在强烈的离线式、非原位性、耗时长等不足。以氮循环过程速率研究为例, 目前已发表的研究通常在时间和空间上都具有相当的离散性, 已经不能满足海洋学研究的需要, 尤其在时空变化较大的边缘海。Tang等(2019)成功实现现场连续化测定固氮速率, 高分辨率的观测成功解析了边缘海固氮速率变化的精细结构。因此, 实现高分辨率和原位实时的数据获取将有助于更加深入地解析氮循环过程及其源汇格局。
俞志明, 陈楠生. 2019. 国内外赤潮的发展趋势与研究热点. 海洋与湖沼, 50(3): 474-486 |
洪义国, 胡耀豪, 刘晓晗, 等. 2020. 海洋N2O的排放及其关键微生物过程作用机制研究进展. 微生物学报, 60(9): 1852-1864 |
Aldunate M, Henríquez-Castillo C, Ji Q X et al, 2020. Nitrogen assimilation in picocyanobacteria inhabiting the oxygen-deficient waters of the eastern tropical North and South Pacific. Limnology and Oceanography, 65(2): 437-453 DOI:10.1002/lno.11315 |
Caffin M, Berthelot H, Cornet-Barthaux V et al, 2018. Transfer of diazotroph-derived nitrogen to the planktonic food web across gradients of N2 fixation activity and diversity in the western tropical South Pacific Ocean. Biogeosciences, 15(12): 3795-3810 DOI:10.5194/bg-15-3795-2018 |
Cai P H, Shi X M, Hong Q Q et al, 2015. Using 224Ra/228Th disequilibrium to quantify benthic fluxes of dissolved inorganic carbon and nutrients into the Pearl River Estuary. Geochimica et Cosmochimica Acta, 170: 188-203 DOI:10.1016/j.gca.2015.08.015 |
Canfield D E, Glazer A N, Falkowski P G, 2010. The evolution and future of Earth's nitrogen cycle. Science, 330(6001): 192-196 DOI:10.1126/science.1186120 |
Cao Z M, Yang W, Zhao Y Y et al, 2020. Diagnosis of CO2 dynamics and fluxes in global coastal oceans. National Science Review, 7(4): 786-797 DOI:10.1093/nsr/nwz105 |
Chen Y L L, Chen H Y, Tuo S H et al, 2008. Seasonal dynamics of new production from Trichodesmium N2 fixation and nitrate uptake in the upstream Kuroshio and South China Sea basin. Limnology and Oceanography, 53(5): 1705-1721 DOI:10.4319/lo.2008.53.5.1705 |
Cui X, Huang C Z, Wu J P et al, 2020. Temporal and spatial variations of net anthropogenic nitrogen inputs (NANI) in the Pearl River Basin of China from 1986 to 2015. PLoS One, 15(2): e0228683 DOI:10.1371/journal.pone.0228683 |
Dai M H, Cao Z M, Guo X H et al, 2013. Why are some marginal seas sources of atmospheric CO2?. Geophysical Research Letters, 40(10): 2154-2158 DOI:10.1002/grl.50390 |
Dai M H, Wang L F, Guo X H et al, 2008. Nitrification and inorganic nitrogen distribution in a large perturbed river/estuarine system: The Pearl River Estuary, China. Biogeosciences, 5: 1227-1244 DOI:10.5194/bg-5-1227-2008 |
Devol A H, 2015. Denitrification, anammox, and N2 production in marine sediments. Annual Review of Marine Science, 7(1): 403-423 DOI:10.1146/annurev-marine-010213-135040 |
Du C, Liu Z, Dai M et al, 2013. Impact of the Kuroshio intrusion on the nutrient inventory in the upper northern South China Sea: insights from an isopycnal mixing model. Biogeosciences, 10: 6419-6432 DOI:10.5194/bg-10-6419-2013 |
Du C J, Liu Z Y, Kao S J et al, 2017. Diapycnal fluxes of nutrients in an oligotrophic oceanic regime: The South China Sea. Geophysical Research Letters, 44: 11510-11518 DOI:10.1002/2017GL074921 |
Duce R A, LaRoche J, Altieri K et al, 2008. Impacts of atmospheric anthropogenic nitrogen on the open ocean. Science, 320(5878): 893-897 DOI:10.1126/science.1150369 |
Han Y, Zhang G L, Zhao Y C et al, 2013. Distributions and sea-to-air fluxes of nitrous oxide in the coastal and shelf waters of the northwestern South China Sea. Estuarine, Coastal and Shelf Science, 133: 32-44 DOI:10.1016/j.ecss.2013.08.001 |
Hong H Z, Shen R, Zhang F T et al, 2017. The complex effects of ocean acidification on the prominent N2-fixing cyanobacterium Trichodesmium. Science, 356(6337): 527-531 DOI:10.1126/science.aal2981 |
Hong Y G, Wu J P, Guan F J et al, 2019. Nitrogen removal in the sediments of the Pearl River Estuary, China: Evidence from the distribution and forms of nitrogen in the sediment cores. Marine Pollution Bulletin, 138: 115-124 DOI:10.1016/j.marpolbul.2018.11.040 |
Hou L, Xie X B, Wan X H et al, 2018. Niche differentiation of ammonia and nitrite oxidizers along a salinity gradient from the Pearl River estuary to the South China Sea. Biogeosciences, 15(16): 5169-5187 DOI:10.5194/bg-15-5169-2018 |
Jickells T D, Buitenhuis E, Altieri K et al, 2017. A reevaluation of the magnitude and impacts of anthropogenic atmospheric nitrogen inputs on the ocean. Global Biogeochemical Cycles, 31(2): 289-305 |
Kim T W, Lee K, Duce R et al, 2014b. Impact of atmospheric nitrogen deposition on phytoplankton productivity in the South China Sea. Geophysical Research Letters, 41(9): 3156-3162 DOI:10.1002/2014GL059665 |
Kim I N, Lee K, Gruber N et al, 2014a. Increasing anthropogenic nitrogen in the North Pacific Ocean. Science, 346(6213): 1102-1106 DOI:10.1126/science.1258396 |
Kim T W, Lee K, Najjar R G et al, 2011. Increasing N abundance in the northwestern Pacific Ocean due to atmospheric nitrogen deposition. Science, 334(6055): 505-509 DOI:10.1126/science.1206583 |
Kitzinger K, Marchant H K, Bristow L A et al, 2020. Single cell analyses reveal contrasting life strategies of the two main nitrifiers in the ocean. Nature Communications, 11(1): 767 DOI:10.1038/s41467-020-14542-3 |
Klawonn I, Bonaglia S, Whitehouse M J et al, 2019. Untangling hidden nutrient dynamics: rapid ammonium cycling and single-cell ammonium assimilation in marine plankton communities. ISME Journal, 13(8): 1960-1974 DOI:10.1038/s41396-019-0386-z |
Li L, Qu T D, 2006. Thermohaline circulation in the deep South China Sea basin inferred from oxygen distributions. Journal of Geophysical Research, 111: C05017 |
Lin H, Dai M H, Kao S J et al, 2016. Spatiotemporal variability of nitrous oxide in a large eutrophic estuarine system: The Pearl River Estuary, China. Marine Chemistry, 182: 14-24 DOI:10.1016/j.marchem.2016.03.005 |
Liu J X, Zhou L B, Li J J et al, 2020. Effect of mesoscale eddies on diazotroph community structure and nitrogen fixation rates in the South China Sea. Regional Studies in Marine Science, 35: 101106 DOI:10.1016/j.rsma.2020.101106 |
Liu K K, Chen Y J, Tseng C M et al, 2007. The significance of phytoplankton photo-adaptation and benthic-pelagic coupling to primary production in the South China Sea: Observations and numerical investigations. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 54(14-15): 1546-1574 DOI:10.1016/j.dsr2.2007.05.009 |
Liu K K, Atkinson L, Quiñones R et al, 2010. Carbon and Nutrient Fluxes in Continental Margins: A Global Synthesis. Berlin Heidelberg: Springer, 124-146
|
Liu X J, Zhang Y, Han W X et al, 2013. Enhanced nitrogen deposition over China. Nature, 494(7438): 459-462 DOI:10.1038/nature11917 |
Lomas M W, Bronk D A, van den Engh G, 2011. Use of flow cytometry to measure biogeochemical rates and Processes in the ocean. Annual Review of Marine Science, 3(1): 537-566 DOI:10.1146/annurev-marine-120709-142834 |
Lu Y Y, Wen Z Z, Shi D L et al, 2019. Biogeography of N2 fixation influenced by the western boundary current intrusion in the South China Sea. Journal of Geophysical Research: Oceans, 124(10): 6983-6996 DOI:10.1029/2018JC014781 |
Ma L, Lin H, Xie X B et al, 2019. Major role of ammonia-oxidizing bacteria in N2O production in the Pearl River estuary. Biogeosciences, 16(24): 4765-4781 DOI:10.5194/bg-16-4765-2019 |
Mayali X, 2020. NanoSIMS: Microscale quantification of biogeochemical activity with large-scale impacts. Annual Review of Marine Science, 12(1): 449-467 DOI:10.1146/annurev-marine-010419-010714 |
Moore C M, Mills M M, Arrigo K R et al, 2013. Processes and patterns of oceanic nutrient limitation. Nature Geoscience, 6: 701-710 DOI:10.1038/ngeo1765 |
Mulholland M R, Bernhardt P W, Widner B N et al, 2019. High rates of N2 fixation in temperate, western North Atlantic coastal waters expand the realm of marine diazotrophy. Global Biogeochemical Cycles, 33(7): 826-840 DOI:10.1029/2018GB006130 |
Murray R H, Erler D V, Eyre B D, 2015. Nitrous oxide fluxes in estuarine environments: response to global change. Global Change Biology, 21(9): 3219-3245 DOI:10.1111/gcb.12923 |
Ning X, Lin C, Hao Q et al, 2009. Long term changes in the ecosystem in the northern South China Sea during 1976-2004. Biogeosciences, 6(10): 2227-2243 DOI:10.5194/bg-6-2227-2009 |
Pajares S, Ramos R, 2019. Processes and microorganisms involved in the marine nitrogen cycle: knowledge and gaps. Frontiers in Marine Science, 6: 739 DOI:10.3389/fmars.2019.00739 |
Qian W, Gan J P, Liu J W et al, 2018. Current status of emerging hypoxia in a eutrophic estuary: The lower reach of the Pearl River Estuary, China. Estuarine, Coastal and Shelf Science, 205: 58-67 DOI:10.1016/j.ecss.2018.03.004 |
Rabouille C, Mackenzie F T, Ver L M, 2001. Influence of the human perturbation on carbon, nitrogen, and oxygen biogeochemical cycles in the global coastal ocean. Geochimica et Cosmochimica Acta, 65(21): 3615-3641 DOI:10.1016/S0016-7037(01)00760-8 |
Ren H J, Chen Y C, Wang X T et al, 2017. 21st-century rise in anthropogenic nitrogen deposition on a remote coral reef. Science, 356(6339): 749-752 DOI:10.1126/science.aal3869 |
Shiozaki T, Furuya K, Kodama T et al, 2010. New estimation of N2 fixation in the western and central Pacific Ocean and its marginal seas. Global Biogeochemical Cycles, 24(1): GB1015 |
Tan E H, Zou W B, Jiang X L et al, 2019. Organic matter decomposition sustains sedimentary nitrogen loss in the Pearl River Estuary, China. Science of the Total Environment, 648: 508-517 DOI:10.1016/j.scitotenv.2018.08.109 |
Tan E H, Zou W B, Zheng Z Z et al, 2020. Warming stimulates sediment denitrification at the expense of anaerobic ammonium oxidation. Nature Climate Change, 10: 349-355 DOI:10.1038/s41558-020-0723-2 |
Tang W Y, Wang S, Fonseca-Batista D et al, 2019. Revisiting the distribution of oceanic N2 fixation and estimating diazotrophic contribution to marine production. Nature Communications, 10(1): 831 DOI:10.1038/s41467-019-08640-0 |
Voss M, Bange H W, Dippner J W et al, 2013. The marine nitrogen cycle: recent discoveries, uncertainties and the potential relevance of climate change. Philosophical Transactions of the Royal Society B: Biological Sciences, 368(1621): 20130121 DOI:10.1098/rstb.2013.0121 |
Voss M, Bombar D, Loick N et al, 2006. Riverine influence on nitrogen fixation in the upwelling region off Vietnam, South China Sea. Geophysical Research Letters, 33(7): L07604 |
Wan X S, Sheng H X, Dai M H et al, 2018. Ambient nitrate switches the ammonium consumption pathway in the euphotic ocean. Nature Communications, 9(1): 915 DOI:10.1038/s41467-018-03363-0 |
Wannicke N, Frey C, Law C S et al, 2018. The response of the marine nitrogen cycle to ocean acidification. Global Change Biology, 24(11): 5031-5043 DOI:10.1111/gcb.14424 |
Wen Z Z, Lin W F, Shen R et al, 2017. Nitrogen fixation in two coastal upwelling regions of the Taiwan Strait. Scientific Reports, 7(1): 17601 DOI:10.1038/s41598-017-18006-5 |
Wu C, Fu F X, Sun J et al, 2018. Nitrogen Fixation by Trichodesmium and unicellular diazotrophs in the northern South China Sea and the Kuroshio in summer. Scientific Reports, 8(1): 2415 DOI:10.1038/s41598-018-20743-0 |
Wu K, Dai M H, Chen J H et al, 2015. Dissolved organic carbon in the South China Sea and its exchange with the Western Pacific Ocean. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 122: 41-51 DOI:10.1016/j.dsr2.2015.06.013 |
Xiao H W, Xie L H, Long A M et al, 2015. Use of isotopic compositions of nitrate in TSP to identify sources and chemistry in South China Sea. Atmospheric Environment, 109: 70-78 DOI:10.1016/j.atmosenv.2015.03.006 |
Xu M N, Li X L, Shi D L et al, 2019. Coupled effect of substrate and light on assimilation and oxidation of regenerated nitrogen in the euphotic ocean. Limnology and Oceanography, 64(3): 1270-1283 DOI:10.1002/lno.11114 |
Xu M N, Zhang W J, Zhu Y F et al, 2018. Enhanced ammonia oxidation caused by lateral Kuroshio intrusion in the boundary zone of the northern South China Sea. Geophysical Research Letters, 45(13): 6585-6593 DOI:10.1029/2018GL077896 |
Yang J Y T, Hsu S C, Dai M H et al, 2014. Isotopic composition of water-soluble nitrate in bulk atmospheric deposition at Dongsha Island: sources and implications of external N supply to the northern South China Sea. Biogeosciences, 11: 1833-1846 DOI:10.5194/bg-11-1833-2014 |
Yang J Y T, Kao S J, Dai M H et al, 2017. Examining N cycling in the northern South China Sea from N isotopic signals in nitrate and particulate phases. Journal of Geophysical Research: Biogeosciences, 122(8): 2118-2136 DOI:10.1002/2016JG003618 |
Yang J Y T, Lee K, Zhang J Z et al, 2020. Contrasting decadal trends of subsurface excess nitrate in the western and eastern North Atlantic Ocean. Biogeosciences, 17(13): 3631-3642 DOI:10.5194/bg-17-3631-2020 |
Yang S, Gruber N, 2016. The anthropogenic perturbation of the marine nitrogen cycle by atmospheric deposition: nitrogen cycle feedbacks and the 15N Haber-Bosch effect. Global Biogochemical Cycles, 30(10): 1418-1440 DOI:10.1002/2016GB005421 |
Zhang G L, Liu S M, Casciotti K L et al, 2019. Distribution of concentration and stable isotopic composition of N2O in the shelf and slope of the northern South China Sea: implications for production and emission. Journal of Geophysical Research: Oceans, 124(8): 6218-6234 DOI:10.1029/2019JC014947 |
Zhang R, Chen M, Yang Q et al, 2015. Physical-biological coupling of N2 fixation in the northwestern South China Sea coastal upwelling during summer. Limnology and Oceanography, 60(4): 1411-1425 DOI:10.1002/lno.10111 |
Zhang X N, Ward B B, Sigman D M, 2020. Global nitrogen cycle: critical enzymes, organisms, and processes for nitrogen budgets and dynamics. Chemical Reviews, 120(12): 5308-5351 DOI:10.1021/acs.chemrev.9b00613 |
Zheng G X, Song J M, Sun Y M et al, 2008. Characteristics of nitrogen forms in the surface sediments of southwestern Nansha Trough, South China Sea. Chinese Journal of Oceanology and Limnology, 26: 280-288 DOI:10.1007/s00343-008-0280-4 |
Zheng Z Z, Zheng L W, Xu M N et al, 2020. Substrate regulation leads to differential responses of microbial ammonia-oxidizing communities to ocean warming. Nature Communications, 11(1): 3511 DOI:10.1038/s41467-020-17366-3 |
 2021, Vol. 52
2021, Vol. 52

