中国海洋湖沼学会主办。
文章信息
- 骆启豪, 王卫军, 倪乐海, 景福涛, 许贺, 李赞, 李彬, 杨建敏. 2021.
- LUO Qi-Hao, WANG Wei-Jun, NI Le-Hai, JING Fu-Tao, XU He, LI Zan, LI Bin, YANG Jian-Min. 2021.
- 四种不同饵料对真蛸(Octopus vulgaris)生长与肠道微生物影响的研究
- EFFECTS OF FOUR DIFFERENT DIETS ON GROWTH AND INTESTINAL MICROORGANISMS OF COMMON OCTOPUS (OCTOPUS VULGARIS)
- 海洋与湖沼, 52(3): 729-737
- Oceanologia et Limnologia Sinica, 52(3): 729-737.
- http://dx.doi.org/10.11693/hyhz20200900259
文章历史
-
收稿日期:2020-09-26
收修改稿日期:2020-11-26
2. 鲁东大学农学院 烟台 264025;
3. 江苏宝源生物科技有限公司 连云港 222100;
4. 山东省渔业技术推广站 济南 250013;
5. 烟台海育海洋科技有限公司 烟台 264000;
6. 山东省海洋资源与环境研究院 烟台 264006
2. School of Agriculture, Ludong University, Yantai 264025, China;
3. Jiangsu Baoyuan Biotechnology Co., Ltd., Lianyungang 222100, China;
4. Shandong Fishery Technology Extension Station, Jinan 250013, China;
5. Yantai Haiyu Ocean Technology Co., Ltd., Yantai 264000, China;
6. Shandong Marine Resource and Environment Research Institute, Yantai 264006, China
真蛸(Octopus vulgaris)别称普通八爪鱼、母猪章、章鱼, 为软体动物门(Mollusca)、头足纲(Cephalopoda)、八腕目(Octopoda)、蛸科(Octopodidae)、蛸属(Octopus) (董正之, 1978), 是我国沿海地区的重要经济头足类。真蛸为世界广布种, 在中国主要分布于东南沿海地带, 在北部地区如山东沿海也有少量分布(徐实怀等, 2014)。真蛸对环境适应性强, 饵料来源广且转化率高(王怀忠等, 2018), 而且肉质鲜美, 富含优质蛋白质和不饱和脂肪酸, 营养丰富, 具有养血通乳、解毒、生肌的功效(Vaz-Pires et al, 2004), 深受消费者欢迎, 因而具有很大养殖发展前景。
水产养殖过程中, 饵料选择直接影响养殖物种健康与生长的好坏, 这使饵料对水产动物生长性能的影响成为了国内外研究的热点。Abu-Elala等(2020)发现在日粮中添加一定量的啤酒酵母(Sacharomyces cerevisiae)可以促进尼罗罗非鱼(Oreochromis niloticus)生长性能和免疫力, 并增加其对疾病的抵抗力。叶建生等(2017)研究不同饵料对胭脂鱼(Myxocyprinus asiaficus)生长的影响, 结果表明不同饵料对其生长的效果具有明显差异。张丽等(2011)对投喂冰鲜小杂鱼和配合饲料的加州鲈(Micropterus salmoides)生长性能、形体指标等进行比较分析后, 发现饲喂冰鲜小杂鱼可显著提高加州鲈的生长性能并改良其肌肉品质。
水产动物摄食饵料种类的不同可导致其体内的肠道微生物群落结构的不同, 而动物肠道微生物在宿主的生长、营养和健康等方面可作为一个重要的角色, 对宿主的免疫防御、消化吸收和营养代谢等生理功能产生十分重要的影响(陈泓宇等, 2018)。Wang等(2020)研究发现日粮中添加一定量的发酵麦麸多糖可以提高鲤鱼(Cyprinus carpio)的消化酶活性和双歧杆菌(Bifidobacterium)的数量, 改变其肌肉组成并提高鲤鱼的生长性能。Amoah等(2020)研究发现一定水平的多粘芽孢杆菌(Paenibacillus polymyxa)可以调节凡纳滨对虾(Litopenaeus vannamei)的肠道微生物组成, 对其肠道健康具有积极作用, 并促进营养的消化吸收, 增强虾的免疫力。
目前, 对于真蛸的饲养限于从野外捕获的苗种进行海上网箱或室内水泥池的养成(王怀忠等, 2018), 国内外现已研究了多种类型的人工饲料用于喂养真蛸, 但比较生长及存活率结果后发现人工配合饲料的效果不如自然饵料(Biandolino et al, 2010)。目前, 饵料对于真蛸的生长性能与肠道微生物多样性影响的研究鲜有报道。本研究作者选用4种真蛸养成过程中常用的自然饵料: 蓝点马鲛(Scomberomorus niphonius)、天津厚蟹(Helice tridens tientsinensis)、四角蛤蜊(Mactra veneriformis)和日本枪乌贼(Loligo japonica)进行投喂, 比较其日均摄食量、特定生长率、饵料转化率及经济效益比、肠道微生物菌群结构和多样性的影响, 并分析其生长与肠道微生物的关系, 旨在为真蛸养成过程中的饵料选择提供科学的理论依据。
1 材料与方法 1.1 材料2019年5月本实验用真蛸(Octopus vulgaris)采捕于中国福建海域, 挑选个体健康且体表无外伤的真蛸运至山东华春渔业有限公司养殖基地。实验水池长×宽×高为6.85 m × 3.37 m × 1.40 m, 在水池底部两侧用瓷砖与红砖搭建巢穴, 巢穴数量多于真蛸数量。养殖车间白天亮度小于300 lx, 模拟真蛸在自然状态下所适宜的暗环境。
1.2 方法真蛸在暂养池中适应48 h后, 从中挑选120只体重相近、活力强且无外伤的真蛸随机分成四组进行实验: 分别投喂冰鲜蓝点马鲛(鱼组)、鲜活天津厚蟹(蟹组)、鲜活四角蛤蜊(贝组)和冰鲜日本枪乌贼(鱿鱼组)。每组真蛸30只, 实验前称其初始体重量, 饵料投喂量为真蛸体重的10%—20%。每日16:00进行全量换水并清除残饵, 水温控制在21—23 ℃, 盐度为28—31。每日17:00投喂饵料, 每次投饵前称饵料重量, 第二天清池时收集残饵沥干后称残饵重量。饲养周期为36 d, 每18 d对各实验组称重。
1.3 样本采集第36天投喂饵料8 h后对各实验组雄性真蛸进行取样。对真蛸的体表进行消毒处理, 在无菌环境条件下, 用无菌手术剪刀对胴部进行解剖, 收集肠道内容物于冻存管中, 并迅速放入液氮罐中保存。每组取五个平行样本, 共计20个样本。
1.4 肠道微生物16S rDNA测序与分析 1.4.1 基因组DNA的提取和PCR扩增将样本交由诺禾致源生物信息科技有限公司进行处理。采用CTAB法对样本的基因组DNA进行提取, 之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度, 取适量的样本DNA于离心管中, 使用无菌水稀释样本至1 ng/μL。以稀释后的基因组DNA为模板, 根据测序区域的选择, 使用带Barcode的特异引物, New England Biolabs公司的PhusionⓇ High-Fidelity PCR Master Mix with GC Buffer, 和高效高保真酶进行PCR扩增, 并对PCR产物进行混样和纯化。16S rRNA V4区引物对应区域为:
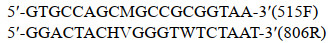
使用TruSeqⓇ DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建, 构建好的文库经过Qubit和Q-PCR定量, 文库合格后, 使用NovaSeq6000进行上机测序。
1.4.3 序列信息分析通过对测序所得的原始数据进行Reads拼接、Tags过滤去杂和去除嵌合体等重量控制处理后获得最终所需的有效数据(Caporaso et al, 2010; Bokulich et al, 2013; Rognes et al, 2016)。利用Uparse软件(Haas et al, 2011)对各个样本的有效数据以97%的一致性进行聚类, 获得可操作分类单元(OTUs), 随后筛选OTUs中出现频数最高的序列作为OTUs的代表序列, 并用Mothur方法与SILVA132 (Edgar, 2013)的SSU rRNA数据库(Wang et al, 2007)进行序列信息比对获得物种注释分析(设定阈值为0.8—1.0)。最后利用Qiime软件(Caporaso et al, 2010)、R软件和SPSS 22.0软件等分析途径对各样品OTU进行丰度、α-多样性、β-多样性以及各分类水平(界、门、纲、目、科、属、种)上的细菌群落结构比较分析。
1.5 数据处理日均摄食量、特定生长率、饵料转化率、经济效益比计算公式如下:
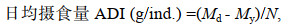 (1)
(1)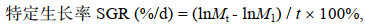 (2)
(2)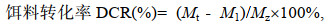 (3)
(3)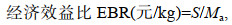 (4)
(4)式中, Md表示每只真蛸每天饵料投喂量(g), My表示饵料剩余量(g), N表示每天真蛸个数(ind.), Mt表示第36 d时测量真蛸体重(g), M1为真蛸初始重量(g), Mz为36 d内总摄入量, Ma表示36 d内真蛸平均增加体重(kg/ind.), S表示36 d真蛸所需饵料成本(元/ind.)。
2 结果 2.1 饵料对于真蛸摄食及生长的影响各实验组的真蛸每只日均摄食量与特定生长率的变化见图 1。贝组的饵料日均摄食量最高(47.94 g/ind.), 蟹组的摄食量稍高于鱼组, 分别为19.60 g/ind.和19.10 g/ind., 鱿鱼组的摄食量最低(12.50 g/ind.)。在36 d的饲养期间, 蟹组的特定生长率高于其他三组, 平均每只可达到2.15 %/d, 贝组与鱼组的特定生长率分别为1.85 %/d和1.67 %/d, 鱿鱼组最低, 其特定生长率为0.26 %/d。
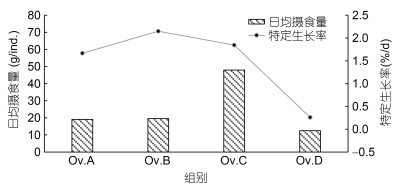 |
| 图 1 真蛸日均摄食量与特定生长率 Fig. 1 The average daily food intake and specific growth rate in each group 注: Ov.A, Ov.B, Ov.C, Ov.D分别表示鱼组、蟹组、贝组、鱿鱼组。下同 |
不同实验组的成本、饵料转化率与经济效益比如表 1所示。贝类饵料投喂组成本远高于其他组, 而其饵料转化率低于鱼组和蟹组, 且经济效益与鱼组和蟹组相比较差; 蟹组的饵料转化率最高, 且经济效益比最佳; 鱿鱼组的饵料转化率最低, 仅为0.46%, 其成本也高于鱼组和蟹组, 且经济效益比最差。
| 组别 | 饵料价格(元/kg) | 日均摄食量(kg/ind.) | 成本(元/ind.) | 饵料转化率(%) | 经济效益比(元/kg) |
| Ov.A | 8.00 | 0.02 | 5.35 | 2.29 | 15.24 |
| Ov.B | 10.00 | 0.02 | 6.86 | 2.79 | 12.50 |
| Ov.C | 4.00 | 0.16 | 22.37 | 1.18 | 48.01 |
| Ov.D | 20.00 | 0.01 | 8.75 | 0.46 | 186.17 |
由测序数据量与对应的物种数来构建的物种数目饱和度稀释曲线, 可见各样本的曲线均趋向平坦(图 2), 说明目前的OTU数量可以代表各组的微生物信息。对测序数据进行OTU聚类分析, 获得鱼组、蟹组、贝组和鱿鱼组的OTU个数分别为862、658、695和519。
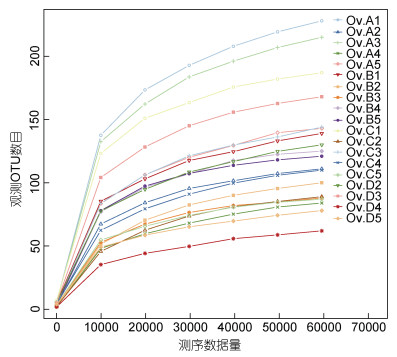 |
| 图 2 物种数目饱和度稀释曲线 Fig. 2 The species-number saturation dilution curve of samples 注: Ov.A1、Ov.A2、Ov.A3、Ov.A4、Ov.A5为鱼组的真蛸肠道内容物样本; Ov.B1、Ov.B2、Ov.B3、Ov.B4、Ov.B5为蟹组的真蛸肠道内容物样本; Ov.C1、Ov.C2、Ov.C3、Ov.C4、Ov.C5为贝组的真蛸肠道内容物样本; Ov.D2、Ov.D3、Ov.D4、Ov.D5鱿鱼组的真蛸肠道内容物样本 |
各实验组的覆盖率均为1, 表明本次实验的测序深度均已经基本覆盖各个样品的所有物种。各实验组的Chao1指数和可观测物种数从大到小依次为鱼组、贝组、蟹组和鱿鱼组, 表明鱼组肠道微生物群落的丰富度最高, 鱿鱼组丰富度最低。由香农指数和辛普森指数可以看出, 微生物群落的多样性大小依次为鱼组、贝组、鱿鱼组、蟹组(表 2)。
| 组别 | 覆盖率 | Chao1指数 | 可观测物种数 | 香农指数 | 辛普森指数 |
| Ov.A | 1.00 | 177.70 | 156 | 2.57 | 0.63 |
| Ov.B | 1.00 | 123.20 | 114 | 1.94 | 0.55 |
| Ov.C | 1.00 | 134.46 | 123 | 2.31 | 0.61 |
| Ov.D | 1.00 | 122.63 | 109 | 2.25 | 0.60 |
多重响应排列程序(Multi Response Permutation Procedure, MRPP)分析显示, 各实验组间(除鱼组与其他三组无显著性差异外)微生物群落结构的差异显著, 可看出, 其他各组之间在微生物群落结构上存在显著性差异, 而贝组与鱿鱼组存在极显著差异(表 3)。
| 组别 | A值 | 观测delta值 | 期望delta值 | P值 |
| Ov.A vs. Ov.B | 0.08 | 0.56 | 0.61 | 0.07 |
| Ov.A vs. Ov.C | 0.07 | 0.64 | 0.68 | 0.08 |
| Ov.A vs. Ov.D | 0.00 | 0.56 | 0.56 | 0.38 |
| Ov.B vs. Ov.C | 0.17 | 0.60 | 0.71 | 0.02 |
| Ov.B vs. Ov.D | 0.18 | 0.51 | 0.63 | 0.02 |
| Ov.C vs. Ov.D | 0.16 | 0.60 | 0.71 | 0.01 |
| 注: 观测delta值越小表示组内差异小, 期望delta值越大表示组间差异大。A值表示分组解释的距离比例, A值大于0表示组间差异大于组内差异; A值小于0表示组内差异大于组间差异。P值小于0.05表示差异显著; P值小于0.01表示差异极显著 | ||||
测序注释结果显示, 所有样本在不同分类水平上可划分入16个门, 26个纲, 56个目, 93个科, 159个属, 65个种; 其中, 在门的水平上, 丰度排名前十的物种分别为软壁菌门(Tenericutes)、螺旋体门(Spirochaetes)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、蓝细菌(Cyanobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)、芽单胞菌门(Gemmatimonadetes)、疣微菌门(Verrucomicrobia)。选取各组丰度前10的物种构建物种相对丰度图(见图 3), 显示软壁菌门为四个实验组的优势菌群, 蟹组中螺旋体门的丰度最高, 贝组中变形菌门和厚壁菌门丰度均高于其他三组。
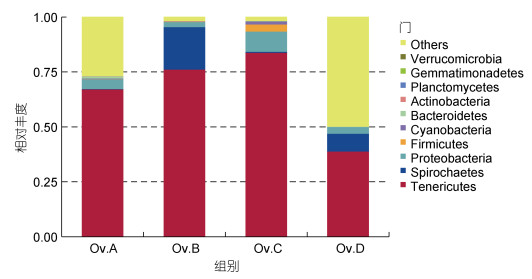 |
| 图 3 真蛸肠道微生物门水平上的物种相对丰度柱形图 Fig. 3 The histogram of relative abundance of species at phylum level of intestinal microorganisms in each group |
在属水平上, 选取丰度前35的物种绘制丰度聚类热图(见图 4), 实验结果显示: 鱼组盐单胞菌(Halomonas)、下水道球菌(Amaricoccus)、大肠杆菌(Enterobacteriaceae)、摩根氏菌(Morganella)、嗜冷杆菌(Psychrobacter)、黄杆菌(Flavobacterium)、假交替单胞菌(Pseudoalteromonas)、假船蛆科杆菌(Pseudofulvibacter)、Xanthomarina、Marivita的丰度均高于其他实验组。蟹组弧菌(Vibrio)、小纺锤状菌(Fusibacter)、微酸菌属(Ilumatobacter)、Nitratireductor、Aliivibrio的丰度均高于其他实验组。贝组在支原体(Mycoplasma)、藻际细菌(Labrenzia)、小纺锤状菌(Fusibacter)、螺旋体(unidentified Spirochaetaceae)、发光杆菌(Photobacterium)、蓝细菌(unidentified Cyanobacteria)、乳球菌(Lactococcus)、鼠海豚杆菌(Phocoenobacter)、慢杆菌(Lentibacter)、Planktotalea、Shimia的丰度均高于其他实验组。鱿鱼组的滨海边疆杆菌(Primorskyibacter)的丰度均高于其他实验组。
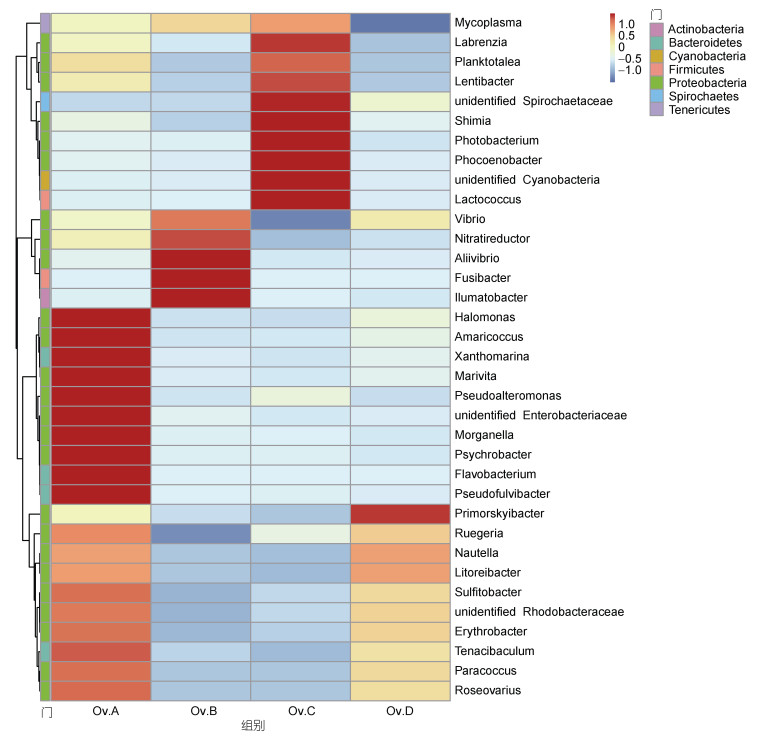 |
| 图 4 真蛸肠道微生物属水平的物种丰度聚类图 Fig. 4 The cluster map of species abundance of intestinal microorganisms in each group |
在蛸类养殖中, 通常用鲜活的杂蟹、杂虾、杂鱼、低廉贝类等作为饵料进行投喂(朱文博等, 2016), 而不同的饵料种类会影响生长(陈泓宇等, 2018)。本实验使用蓝点马鲛、天津厚蟹、四角蛤蜊和日本枪乌贼四种饵料分别投喂真蛸, 各组在生长性能指标上均表现出明显差异。前人研究发现, 蟹类是蛸类的优选饵料, 如吕国敏等(2007)研究发现头足类主要食物为甲壳类, 其中游泳能力弱的蛸类以捕食蟹类等底栖甲壳动物为主, 而人工养殖下的嘉庚蛸(Octopus tankahkeei)喜捕食天津厚蟹(焦海峰等, 2005), 长蛸(Octopus variabilis Sasaki)较菲律宾蛤仔(Ruditapes philippinarum)和南美白对虾(Penaeus vannamei Boone)等更喜食招潮蟹(郝振林等, 2013), 这与本研究发现蟹组中真蛸日均摄食量高于鱼组和鱿鱼组的结果一致。
朱文博等(2016)比较了菲律宾蛤仔、缢蛏(Sinonovacula constrzcta)和肉球近方蟹(Hemigrapsus sanguineus) 3种饵料对短蛸(Octopus ocellatus)生长的影响, 结果发现蟹类是短蛸养成阶段较为理想的饵料, 邵楚等(2011)用缢蛏、凡纳滨对虾、弧边招潮蟹(Ocypoda ortmann)投喂暂养长蛸, 通过分析长蛸的摄食率、重量增加率、特定生长率、饵料转化率的结果后表明蟹类饵料最佳, 本实验结果发现蟹组的特定生长率和饵料转化率均高于其他三组, 表明蟹类相对其他饵料更有利于蛸类的生长。
有研究发现通过对真蛸分别投喂杂鱼、紫贻贝(Mytilus galloprovinicialis)和由蟹肉、贝肉及鱼肉组成的混合饵料, 分析其生长性能后发现, 使用冰鲜杂鱼投喂真蛸能够更快地促进生长(Biandolino et al, 2010)。本实验使用蓝点马鲛、天津厚蟹、四角蛤蜊和日本枪乌贼投喂真蛸后发现鱼组的特定生长率低于蟹组, 与前人研究结果不一致, 本研究结果显示鱼组饵料转化率和经济效益比也低于蟹组, 表明蟹类比鱼类更能促进真蛸的生长且更适合作为真蛸养成期间的饵料。
在养殖过程中, 特定生长率越高则所饲养动物的日均增重量越大, 而饵料中蛋白质含量的高低可以影响动物的特定生长率(徐云等, 2009)。真蛸具有高蛋白、低脂肪的特点(马之明等, 2011), 且可以较快地将饵料中的蛋白质转化为氨基酸为自身所利用(戴宏杰等, 2014), 因而真蛸的生长速度的快慢与饵料的蛋白水平有关, 研究发现四指马鲅鱼(Eleutheronema tetradctylus)、三疣梭子蟹(Portunus trituberculatus)、四角蛤蜊和日本枪乌贼肌肉中的粗蛋白含量分别为19.51%、74.02%、11.10%和9.29% (徐善良等, 2009; 刘玉锋等, 2011; 滕瑜等, 2014; 郭海波等, 2017), 本实验结果表明蟹组的特定生长率最高, 平均每只可达到2.15 %/d, 其原因可能为蟹类所含蛋白质高于其他饵料, 使得蟹组的真蛸能较其他组更快地生长。
3.2 饵料对肠道微生物的影响盛鹏程等(2020)以乌鳢(Ophiocephalus argus)为研究对象, 发现用畜禽内脏为饵料投喂的乌鳢肠道细菌群落多样性和物种总数均高于用冰鲜鱼投喂; 钟蕾等(2016)通过PCR-DGGE指纹分析发现投喂人工配合饲料和冰鲜鱼会对鳡(Elopichthys bambusa)肠道菌落组成产生差异。本实验通过对真蛸肠道微生物的α-多样性和群落结构差异分析, 发现各实验组间真蛸肠道微生物组成具有差异, 鱼组的真蛸肠道微生物群落的丰富度与多样性均高于其他各组, 且蟹组、贝组与鱿鱼组的真蛸肠道微生物群落结构之间可产生显著性的差异, 说明水产动物的摄食方式和种类可以影响肠道内微生物的组成种类、菌群多样性和分布比例(钟蕾等, 2016)。Iehata等(2015)研究发现智利章鱼(Octopus mimus)的肠道菌群主要为变形菌门和厚壁菌门, 与本研究测得的真蛸肠道微生物的优势菌群一致。
弧菌是一种广泛分布于淡水和海水中的条件致病菌, 易存在于杂食性动物体表和体内, 尤其是甲壳类和贝类(陈梅等, 2002), 本研究通过16S rDNA扩增技术测序后发现蟹组的弧菌属丰度高于其他三组, 蟹组高丰度的弧菌可能来源于所食的天津厚蟹, 但在养殖过程中并未暴发疾病, 这可能与鱼类自身的肠道微生物中的弧菌可以作为一种正常菌群而存在有关(Bano et al, 2007)。支原体为水生动物易感染的致病菌(Li et al, 2016), 能够破坏宿主免疫的系统并参与其他致病病变的发展和诱导疾病的加重(Razin et al, 1998), 本实验结果显示贝组的支原体属的丰度高于其他三组, 有研究发现缢蛏内脏团的优势菌属为支原体(王鑫毅等, 2019), 推测本实验中贝组的支原体属有可能来源于真蛸所食的四角蛤蜊。
不同食性的鱼类肠道菌群内, 存在满足不同营养物质消化吸收的标志性微生物(Navarrete et al, 2008)。在肉食性鱼类的肠道菌群中会存在与消化吸收紧密相关的产生蛋白酶和脂肪酶的微生物, 如盐单胞杆菌属、鲸杆菌属(Cetobacterium) (孟晓林等, 2019)。本研究发现真蛸肠道内存在盐单胞杆菌属, 与前人研究结果一致。藻际细菌存在于微藻周围, 与藻细胞及其胞外分泌物共同形成“藻际环境” (Bell et al, 1972)。本研究发现贝组真蛸肠道中藻际细菌的丰度高于其他实验组, 其原因可能与所用饵料为以浮游植物为主的滤食性贝类有关(董波等, 2000)。
3.3 生长与肠道微生物的关系乳球菌等益生菌可以长期定植在宿主的肠道体内, 可以有效地帮助宿主进行食物消化与营养吸收(Balcázar et al, 2007)。本实验中贝组真蛸的日均摄食量远高于其他三组, 可能与贝组肠道微生物中的乳球菌丰度高于其他三组有关。Lin等(2019)研究发现螺旋体属在延缓花鳗鲡(Anguilla marmorata)生长方面起着关键作用, 从本研究得出的生长性能指标可以发现, 贝组真蛸摄食量远高于蟹组, 但其特定生长率却低于蟹组, 其原因可能与贝组的真蛸肠道中优势菌群为螺旋体属有关。
肠道菌群的生物多样性和群落结构的组成对水生宿主, 尤其是海洋生物的生长具有密切的联系, 通常认为在一个稳定的肠道菌群环境下, 其微生物多样性越高, 肠道对于营养吸收的功能越好(de Schryver et al, 2014)。本实验中鱿鱼组的肠道微生物的多样性最低, 且优势菌属单一, 尤其是益生菌较少, 这可能为鱿鱼组的摄食率和饵料转化率明显低于其他实验组的原因, 进而造成该组的特定生长率也低于其他实验组。
Shi等(2020)研究发现快速生长的花鳗鲡肠道的优势菌群为梭菌属, 其生长与肠道内的梭菌属丰度有关。通过本实验结果发现蟹组的特定生长率最高, 肠道内弧菌、小纺锤状菌、微酸菌属、Nitratireductor、Aliivibrio的丰度高于其他实验组, 推测真蛸的快速生长可能与上述菌属有关。
4 结论本研究分别投喂真蛸蓝点马鲛(鱼组)、天津厚蟹(蟹组)、四角蛤蜊(贝组)和日本枪乌贼(鱿鱼组)4种自然饵料, 各实验组间的真蛸生长性能指标与肠道微生物产生了明显差异。贝组中真蛸日均摄食量最高, 而饵料转化率低于鱼组与蟹组。鱼组与蟹组的日均摄食量差异不大, 其中蟹组的特定生长率和饵料转化率高于其他三组且经济效益最佳。鱿鱼组的日均摄食量、特定生长率、饵料转化率和经济效益比均低于其他三组。鱼组的真蛸肠道微生物群落的丰富度与多样性均高于其他各组, 而鱿鱼组的真蛸肠道微生物群落的丰富度最低。
马之明, 徐实怀, 陈怡飚, 等. 2011. 真蛸肌肉营养成分及氨基酸含量分析. 安徽农业科学, 39(2): 1059-1061 DOI:10.3969/j.issn.0517-6611.2011.02.162 |
王怀忠, 钱耀森, 郑小东, 等. 2018. 苏北沿海真蛸室内养殖试验. 水产养殖, 39(3): 11-12 DOI:10.3969/j.issn.1004-2091.2018.03.005 |
王鑫毅, 谢骁, 金珊, 等. 2019. 基于高通量测序的缢蛏及其养殖池塘菌群结构的季节变化. 应用生态学报, 30(12): 4267-4276 |
叶建生, 赵素珍, 陈小江, 等. 2017. 不同饵料对胭脂鱼生长和肠道消化酶活性的影响. 水产科学, 36(1): 109-112 |
吕国敏, 吴进锋, 陈利雄. 2007. 我国头足类增养殖研究现状及开发前景. 南方水产, 3(3): 61-66 DOI:10.3969/j.issn.2095-0780.2007.03.012 |
朱文博, 孙玉忠, 赵宏远, 等. 2016. 不同饵料对短蛸生长的影响. 水产科学, 35(5): 573-577 |
刘玉锋, 毛阳, 王远红, 等. 2011. 日本枪乌贼的营养成分分析. 中国海洋大学学报, 41(S1): 341-343 |
张丽, 许国焕, 郭慧青, 等. 2011. 摄食不同饵料对加州鲈生长性能及体成分的影响. 淡水渔业, 41(6): 60-63 DOI:10.3969/j.issn.1000-6907.2011.06.011 |
陈梅, 李筠, 徐怀恕. 2002. 梭子蟹及牡蛎中致病性弧菌的研究. 广西预防医学, 8(4): 193-196 DOI:10.3969/j.issn.1673-758X.2002.04.001 |
陈泓宇, 闫海亚, 赵胤丞, 等. 2018. 宏基因组学及其在鱼类肠道微生物中的研究进展. 水产科学, 37(5): 699-706 |
邵楚, 王亚, 王春琳. 2011. 3种饵料对暂养长蛸生长的影响. 水产科学, 30(3): 140-143 DOI:10.3969/j.issn.1003-1111.2011.03.004 |
孟晓林, 李文均, 聂国兴. 2019. 鱼类肠道菌群影响因子研究进展. 水产学报, 43(1): 143-155 |
郝振林, 于洋洋, 宋坚, 等. 2013. 长蛸摄食行为的初步研究. 河北渔业, (9): 11, 45 |
钟蕾, 向建国, 曾丹, 等. 2016. 饵料对鳡肠道微生物多样性的影响. 水生生物学报, 40(4): 830-835 |
徐云, 马甡. 2009. 不同饵料对三疣梭子蟹生长和能量收支的影响. 中国海洋大学学报, 39(S1): 353-358 |
徐实怀, 马之明, 陈怡飚, 等. 2014. 真蛸亲体培育与受精卵孵化研究. 海洋与渔业, (4): 72-75 |
徐善良, 张薇, 严小军, 等. 2009. 野生与养殖三疣梭子蟹营养品质分析及比较. 动物营养学报, 21(5): 695-702 DOI:10.3969/j.issn.1006-267x.2009.05.014 |
郭海波, 吴益春, 罗海军, 等. 2017. 四指马鲅鱼的营养成分分析. 食品安全质量检测学报, 8(1): 88-92 |
盛鹏程, 周冬仁, 韩新荣, 等. 2020. 不同饲养方式对乌鳢(Ophiocephalus argus)肠道微生物群落结构差异及种类多样性的影响. 海洋与湖沼, 51(1): 148-155 |
董波, 薛钦昭, 李军. 2000. 滤食性贝类摄食生理的研究进展. 海洋科学, 24(7): 31-34 DOI:10.3969/j.issn.1000-3096.2000.07.012 |
董正之. 1978. 中国近海头足类的地理分布. 海洋与湖沼, 9(1): 108-118 |
焦海峰, 尤仲杰, 包永波. 2005. 人工养殖条件下嘉庚蛸的生物学特性及繁育技术初探. 动物学杂志, 40(3): 67-71 |
滕瑜, 李辉, 王志勇, 等. 2014. 四角蛤蜊的营养性和安全性评价. 农产品加工(学刊), (3): 48-50 |
戴宏杰, 陈道海. 2014. 头足类营养研究进展. 动物营养学报, 26(3): 597-604 DOI:10.3969/j.issn.1006-267x.2014.03.007 |
Abu-Elala N M, Younis N A, AbuBakr H O et al, 2020. Influence of dietary fermented Saccharomyces cerevisiae on growth performance, oxidative stress parameters, and immune response of cultured Oreochromis niloticus. Fish Physiology and Biochemistry, 46(2): 533-545 DOI:10.1007/s10695-019-00711-9 |
Amoah K, Huang Q C, Dong X H et al, 2020. Paenibacillus polymyxa improves the growth, immune and antioxidant activity, intestinal health, and disease resistance in Litopenaeus vannamei challenged with Vibrio parahaemolyticus. Aquaculture, 518: 734563 DOI:10.1016/j.aquaculture.2019.734563 |
Balcázar J L, Vendrell D, de Blas I et al, 2007. In vitro competitive adhesion and production of antagonistic compounds by lactic acid bacteria against fish pathogens. Veterinary Microbiology, 122(3-4): 373-380 DOI:10.1016/j.vetmic.2007.01.023 |
Bano N, DeRae Smith A, Bennett W et al, 2007. Dominance of Mycoplasma in the guts of the Long-Jawed Mudsucker, Gillichthys mirabilis, from five California salt marshes. Environmental Microbiology, 9(10): 2636-2641 DOI:10.1111/j.1462-2920.2007.01381.x |
Bell W, Mitchell R, 1972. Chemotactic and growth responses of marine bacteria to algal extracellular products. The Biological Bulletin, 143(2): 265-277 |
Biandolino F, Portacci G, Prato E, 2010. Influence of natural diet on growth and biochemical composition of Octopus vulgaris Cuvier, 1797. Aquaculture International, 18(6): 1163-1175 DOI:10.1007/s10499-010-9331-x |
Bokulich N A, Subramanian S, Faith J J et al, 2013. Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing. Nature Methods, 10(1): 57-59 |
Caporaso J G, Kuczynski J, Stombaugh J et al, 2010. QIIME allows analysis of high-throughput community sequencing data. Nature Methods, 7(5): 335-336 |
de Schryver P, Vadstein O, 2014. Ecological theory as a foundation to control pathogenic invasion in aquaculture. The ISME Journal, 8(12): 2360-2368 |
Edgar R C, 2013. UPARSE: highly accurate OTU sequences from microbial amplicon reads. Nature Methods, 10(10): 996-998 |
Haas B J, Gevers D, Earl A M et al, 2011. Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons. Genome Research, 21(3): 494-504 |
Iehata S, Valenzuela F, Riquelme C, 2015. Analysis of bacterial community and bacterial nutritional enzyme activity associated with the digestive tract of wild Chilean octopus (Octopus mimus Gould, 1852). Aquaculture Research, 46(4): 861-873 |
Li X M, Yan Q Y, Ringø E et al, 2016. The influence of weight and gender on intestinal bacterial community of wild largemouth bronze gudgeon (Coreius guichenoti, 1874). BMC Microbiology, 16(1): 191 DOI:10.1186/s12866-016-0809-1 |
Lin M, Zeng C X, Jia X Q et al, 2019. The composition and structure of the intestinal microflora of Anguilla marmorata at different growth rates: a deep sequencing study. Journal of Applied Microbiology, 126(5): 1340-1352 |
Navarrete P, Mardones P, Opazo R et al, 2008. Oxytetracycline treatment reduces bacterial diversity of intestinal microbiota of Atlantic salmon. Journal of Aquatic Animal Health, 20(3): 177-183 |
Razin S, Yogev D, Naot Y, 1998. Molecular biology and pathogenicity of mycoplasmas. Microbiology and Molecular Biology Reviews, 62(4): 1094-1156 |
Rognes T, Flouri T, Nichols B et al, 2016. Vsearch: a versatile open source tool for metagenomics. PeerJ, 4: e2584 |
Shi Y, Ma D Y, Zhai S W, 2020. Revealing the difference of intestinal microbiota composition of cultured European eels (Anguilla anguilla) with different growth rates. The Israeli Journal of Aquaculture-Bamidgeh: 72 |
Vaz-Pires P, Seixas P, Barbosa A, 2004. Aquaculture potential of the common octopus (Octopus vulgaris Cuvier, 1797): a review. Aquaculture, 238(1-4): 221-238 |
Wang Q, Garrity G M, Tiedje J M et al, 2007. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Applied and Environmental Microbiology, 73(16): 5261-5267 |
Wang R F, An X P, Wang Y et al, 2020. Effects of polysaccharide from fermented wheat bran on growth performance, muscle composition, digestive enzyme activities and intestinal microbiota in juvenile common carp. Aquaculture Nutrition, 26(4): 1096-1107 |
 2021, Vol. 52
2021, Vol. 52


