中国海洋湖沼学会主办。
文章信息
- 宋维佳, 宋秀贤, 李靖, 张悦, 申慧慧, 张培培, 俞志明. 2021.
- SONG Wei-Jia, SONG Xiu-Xian, LI Jing, ZHANG Yue, SHEN Hui-Hui, ZHANG Pei-Pei, YU Zhi-Ming. 2021.
- 改性粘土絮凝后残留的太平洋亚历山大藻(Alexandrium pacificum)毒素变化研究
- TOXIN REMAINED IN RESIDUAL ALEXANDRIUM PACIFICUM AFTER FLOCCULATION WITH MODIFIED CLAY
- 海洋与湖沼, 52(4): 917-924
- Oceanologia et Limnologia Sinica, 52(4): 917-924.
- http://dx.doi.org/10.11693/hyhz20210100020
文章历史
-
收稿日期:2021-01-22
收修改稿日期:2021-04-30
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院海洋大科学研究中心 青岛 266071;
4. 中国科学院大学 北京 100049
2. Laboratory of Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
有害藻华是一种近海常见的海洋生态异常现象, 对海洋生态系统的平衡、人类的健康与安全构成严重威胁, 已经成为一种全球性的生态安全问题。尤其是近年来, 有害藻华的原因种呈现出向甲藻类、有毒藻类演变的趋势, 有毒甲藻藻华频繁暴发。其中, 亚历山大藻(Alexandrium)是我国近海常见的、能够产生麻痹性贝类毒素(paralytic shellfish toxins, PSTs)的甲藻类群。海域中暴发有毒亚历山大藻藻华后, 由藻细胞合成的PSTs毒素可通过食物链进入人类体内引发中毒。全球范围内每年发生约2 000起PSTs中毒事件, 人员死亡率高达15% (Anderson et al, 2012)。2002—2017年间, 该藻在我国近海形成了24次藻华(梁玉波等, 2019), 欧洲、北美等全球范围内也曾多次暴发该藻藻华, 不仅破坏了海洋生态环境, 还给海水养殖业和滨海旅游业造成巨大的经济损失。探究水体中亚历山大藻的去除方法及其对水体中PSTs毒素含量的影响, 降低亚历山大藻藻华的危害效应尤为重要。
改性粘土技术通过粘土颗粒与藻华生物发生絮凝, 可使藻华生物快速沉降到底层, 达到有效治理有害藻华的效果。该方法具有安全、高效、可操作性强等优点, 成为少数能被应用于有害藻华现场治理的技术方法(Anderson, 1997; Yu et al, 2017)。改性粘土不仅可以有效去除水体中的藻华生物(Liu et al, 2016; 邱丽霞等, 2017; Li et al, 2017), 还能吸附水体中的营养物质, 在一定程度上起到改善水质、有效降低水体富营养化程度的作用(Pierce et al, 2004; Lu et al, 2015)。另外, 大量研究表明, 粘土或改性粘土在絮凝去除有毒微藻的同时, 对水体中的藻毒素也能产生良好的去除效果, 如短凯伦藻及其产生的短裸甲藻毒素(brevetoxin, BTX)(Pierce et al, 2004)、小定鞭金藻及其产生的毒素(Sengco et al, 2005)、微囊藻等蓝藻及其产生的微囊藻毒素(Morris et al, 2000)等。
针对PSTs毒素, Lu等(2015)跟踪了改性粘土絮凝沉降太平洋亚历山大藻细胞后沉积絮体中PSTs的含量与组成, 结果表明沉积絮体中出现了高毒性组分漆沟藻毒素1 & 4 (gonyautoxin-1 & 4, GTX1 & 4)向低毒性组分GTX2 & 3和脱氨甲酰基膝沟藻毒素2 & 3(decarbamoylgonyautoxin-2 & 3, dcGTX2 & 3), 以及无毒性衍生物转化降解的现象。另外, Li等(2019)的研究也发现, 改性粘土絮凝沉降亚历山大藻后, 沉积絮体中出现PSTs毒素的积累, 但在6 h后逐渐降低, 96 h即已低于高效液相色谱法的检出限。目前, 缺乏改性粘土絮凝亚历山大藻细胞后水体中胞内外PSTs含量与组成变化情况的研究。
本文研究了改性粘土在絮凝亚历山大藻的同时, 对水体中胞内和胞外PSTs毒素的去除效果, 考察了水体pH、磷酸盐、溶解无机氮(DIN)等影响藻细胞产毒的水质参数的变化情况, 为改性粘土治理亚历山大藻等产毒藻藻华提供理论依据。
1 材料与方法 1.1 实验材料本研究所用藻种为太平洋亚历山大藻(Alexandrium pacificum), 来自中科院海洋研究所海洋生态与环境科学重点实验室。实验用海水取自青岛汇泉湾近海, 经0.45 μm滤膜过滤后121 ℃高温灭菌30 min。在温度为(20±1) ℃, 光照强度为65 μmol photon/(m2·s), 光暗比为L︰D=12 h︰12 h的环境条件下, 采用L1培养液对该藻进行培养。选择密度约为6.11×103 cells/mL的指数生长期藻细胞进行实验。
本研究所用改性粘土为Ⅰ型改性粘土(MC I), 为取自广西北海的高岭土和无机改性剂聚合氯化铝(poly aluminum chloride, PAC), 参照Yu等(1994)的改性方法制备而成。实验开始前采用灭菌海水将其配制成浓度为50 g/L的改性粘土悬浮液。
1.2 实验方法改性粘土对亚历山大藻的去除实验在体积为10 L的玻璃缸中进行, 分为对照组和实验组, 每组设置三个平行。将太平洋亚历山大藻(A. pacificum)藻液混匀后倒入玻璃缸中, 实验组加入一定量的改性粘土悬浮液, 使终浓度为0.2 g/L, 于培养条件下静置3 h, 然后将上层5 L水体通过虹吸的方法小心转移至5 L锥形瓶中培养24 h, 并分别在3、12、24 h取样, 进行藻细胞密度, 胞内毒素, 胞外毒素以及pH、磷酸盐、DIN等水质参数的测定。
1.3 实验参数的分析测定方法 1.3.1 藻细胞密度的测定将藻液混合摇匀后移取至离心管中加入鲁哥试剂固定, 通过显微镜计数法得到取样时刻藻细胞密度。
1.3.2 胞内毒素的提取将藻液通过GF/D滤膜过滤收集藻细胞, 用于藻细胞内PSTs的提取。样品加入0.1 mol/L乙酸溶液, 用核酸提取仪使藻细胞破碎完全。破碎完成后在6 000 r/min转速下离心5 min, 收集上清液, 过0.22 μm滤膜于进样小瓶中, -20 ℃条件下避光保存待测。
1.3.3 胞外毒素的提取胞外毒素的提取方法参照张亚亚等(2020), 该藻主要产生漆沟藻毒素(GTX1-5)和N-磺酰胺甲酰膝沟藻毒素(N-Sulfocarbamoylgonyautoxin-2 & 3, C1 & 2), 回收率如表 1所示。将ENVI-Carb 500 mg/6 mL固相萃取柱预先用3 mL乙腈、1 mL超纯水活化, 移取上述经过GF/D滤膜过滤的藻液滤液, 通过固相萃取柱, 自然流干后正压挤干, 然后用75%乙腈水溶液(含0.25%甲酸)洗脱混匀, 过0.22 μm滤膜于进样小瓶中, -20 ℃条件下避光保存待测。
| PSTs组分 | GTX1 | GTX2 | GTX3 | GTX4 | GTX5 | C1 | C2 |
| 回收率(%) | 90.9 | 87.7 | 84.8 | 73.7 | 75.3 | 92.9 | 77.2 |
本研究中PSTs毒素通过高效液相色谱串联质谱法测定。所用仪器为API4000液相色谱-三重四级杆串联质谱(ABSCIEX公司, 美国), 配有电喷雾离子源(ESI)。该方法的检出限(LOD)和定量限(LOQ)如表 2所示。
| GTX1 | GTX2 | GTX3 | GTX4 | GTX5 | C1 | C2 | |
| LOD (ng/mL) |
7.4 | 1.4 | 6.8 | 4.2 | 4.6 | 2.7 | 2.0 |
| LOQ (ng/mL) |
24.6 | 4.8 | 22.5 | 13.9 | 15.5 | 9.0 | 6.8 |
液相色谱条件如下: 色谱柱: HILIC Amphion II色谱柱(5 μm, 4.6×250 mm); 柱温: 30 ℃; 流速: 1 mL/min; 进样量: 10 μL; 流动相A: 乙腈(含0.1%甲酸), B: 水(含2 mmol/L乙酸铵, 0.1%甲酸); 洗脱梯度: 0—1.0 min, 60% A, 40% B; 1.0—10.0 min, 60%—10% A, 40%—90% B; 10—15 min, 10% A, 90% B; 15—18.0 min, 10%—60% A, 90%—40% B; 18.0—25.0 min, 60% A, 40% B。
质谱条件如下: 电喷雾离子源(ESI), 多反应监测(MRM), 正离子模式; 喷雾电压: 5.5 kV; 离子源温度650 ℃; 碰撞气压力: 7 psi; 气帘气压力: 30 psi; 雾化气压力GS1: 50 psi; 辅助加热气压力GS2: 60 psi。
1.3.5 总PSTs毒素含量和单细胞毒素含量的计算总毒素含量=胞内毒素含量+胞外毒素含量; 单细胞毒素含量=胞内毒素含量/藻细胞密度。毒素含量采用相对石房蛤毒素(saxitoxin, STX)的物质的量表示(STX-equ.nmol)。
1.3.6 水质参数的测定利用pH计测定水体的pH。借助营养盐自动分析仪(Skalar-1000, SA 3000/5000 chemistry unit, 荷兰)测定样品中各项营养盐浓度。
2 结果 2.1 水体中藻细胞密度变化本文选用指数生长中后期的太平洋亚历山大藻, 利用MC I对其进行去除实验。向藻液中添加0.2 g/L MC I后, 水体中的藻细胞被迅速絮凝沉降, 3 h后, 絮凝过程基本完成, 此时上层水体藻细胞密度已由起始的6.11×103 cells/mL降低至2.07×103 cells/mL, 与相同时刻对照组水体中藻细胞密度相比, 改性粘土对实验组藻细胞的去除效率约为62% (图 1)。将上层5 L水体通过虹吸的方法小心移出至锥形瓶中继续观察残留藻细胞的增殖情况, 在24 h内水体中残留藻细胞密度未发生明显变化。
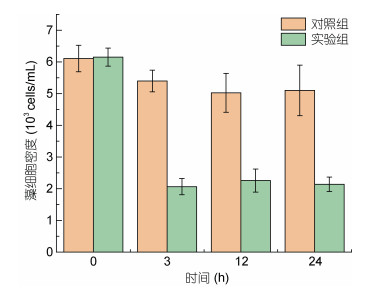 |
| 图 1 经MC I处理后藻细胞密度变化情况 Fig. 1 Change in algal density after MC I treatment |
在添加MC I絮凝沉降太平洋亚历山大藻后, 我们对水体中PSTs毒素含量的变化情况进行了测定和分析。如表 3所示, 添加0.2g/L MC I处理3 h后, 与藻细胞密度变化相对应, 上层水体总PSTs含量也发生了显著的改变。与相同时刻对照组相比, 实验组水体中的总PSTs含量下降45.93%。将上层水体移出后继续跟踪了水体中总PSTs含量在24 h内的变化情况, 结果表明3—24 h内实验组总PSTs含量持续低于对照组。
| 总PSTs | 胞内PSTs | 胞外PSTs | |||||||||
| 时间(h) | 对照组 | 实验组 | 下降率(%) | 对照组 | 实验组 | 下降率(%) | 对照组 | 实验组 | 下降率(%) | ||
| 0 | 163.58 | 163.54 | – | 122.16 | 118.28 | – | 43.70 | 45.26 | – | ||
| 3 | 143.32 | 77.49 | 45.93 | 99.23 | 37.05 | 62.66 | 44.09 | 40.44 | 8.29 | ||
| 12 | 139.94 | 81.20 | 41.98 | 95.95 | 42.52 | 55.68 | 43.99 | 38.67 | 12.09 | ||
| 24 | 145.20 | 92.20 | 36.50 | 99.49 | 47.95 | 51.80 | 45.71 | 44.25 | 3.20 | ||
| 注: 0时间点尚未对实验组进行处理, 该时间点下降率用–表示。 | |||||||||||
MC I絮凝完成后, 水体中胞内PSTs毒素含量的下降幅度与藻细胞密度的下降幅度相接近(表 3), 添加0.2 g/L MC I 3 h后, 水体中的胞内PSTs含量由原来的118.28 STX-equ. nmol/L降低为37.05 STX-equ. nmol/L, 与此时对照组水体中的胞内PSTs含量相比, 实验组下降了62.66%, 与改性粘土对藻细胞的去除率相接近。3—24 h期间, 实验组胞内PSTs含量持续远低于对照组。针对胞外水体中的PSTs毒素, 本研究参照张亚亚等(2020)的处理方法, 对其进行了富集, 实验过程中胞外PSTs含量的变化表明, 添加0.2 g/L MC I上层水体胞外PSTs含量与对照组相比未发生明显改变(表 3)。
在探究MC I絮凝后藻液中毒素变化情况的同时, 本研究还采用A. pacificum藻液滤液, 实验考察了较高用量MC I (0.5g/L)对藻液滤液中溶解态PSTs毒素的吸附效果, 以便于进一步阐明MC I絮凝对胞外PSTs毒素含量变化的影响机制。结果表明, 添加0.5 g/L MC I处理3 h后亚历山大藻液滤液中PSTs毒素含量与组成均无明显变化(图 2), 即0.5 g/L MC I对水体中胞外PSTs无明显吸附效果。
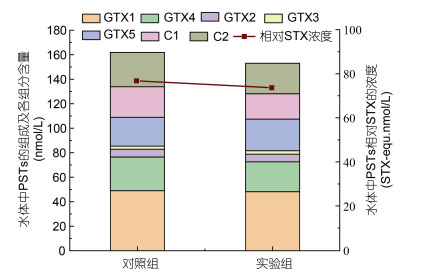 |
| 图 2 添加MC I后亚历山大藻液滤液中PSTs毒素含量与组成变化 Fig. 2 Change of PSTs concentration and composition in the filtrate of Alexandrium culture after MC I treatment |
为考察0.2 g/L MC I的添加是否刺激了残留藻细胞使其产毒增加, 本研究对0.2 g/L MC I处理后水体中残留藻细胞的单细胞毒素含量(图 3)和胞内外毒素组成(图 4)变化进行了跟踪与测定, 结果表明, 在该实验条件下0.2 g/L MC I的添加未导致实验组残留藻细胞单细胞毒素含量与组成在24 h内出现明显差异。
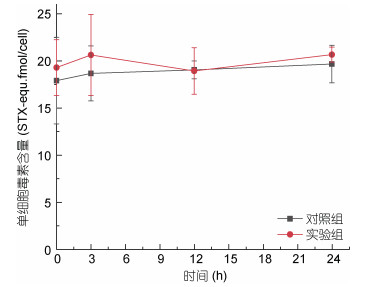 |
| 图 3 添加MC I后残留藻细胞单细胞毒素含量变化 Fig. 3 Changes in the cellular toxin content in the residual algae after MC I treatment |
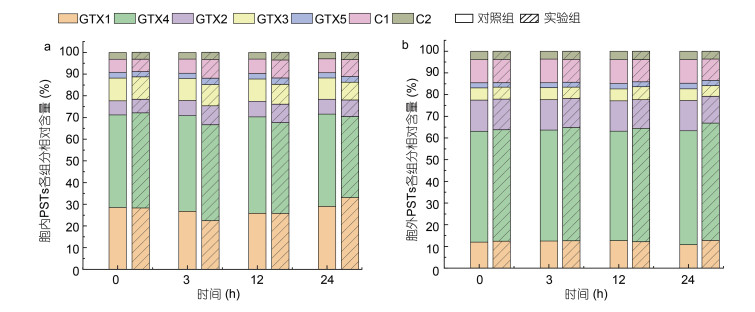 |
| 图 4 添加MC I后水体中胞内外PSTs组成变化 Fig. 4 Changes in the composition of intracellular and extracellular PSTs after MC I treatment |
本研究还分析测定了添加改性粘土后多种水质参数的变化情况(图 5)。实验用亚历山大藻藻液的初始pH约为8.89, 加入MC I 3 h后实验组水体pH为8.63, 与对照组相比下降0.22; 24 h时实验组pH为8.52, 与此时的对照组相比也仅下降0.28。总体来看, 添加MC I后水体pH略有下降, 但变化幅度较小, 整个实验过程对照组与实验组水体pH均维持在8.52—8.91之间。
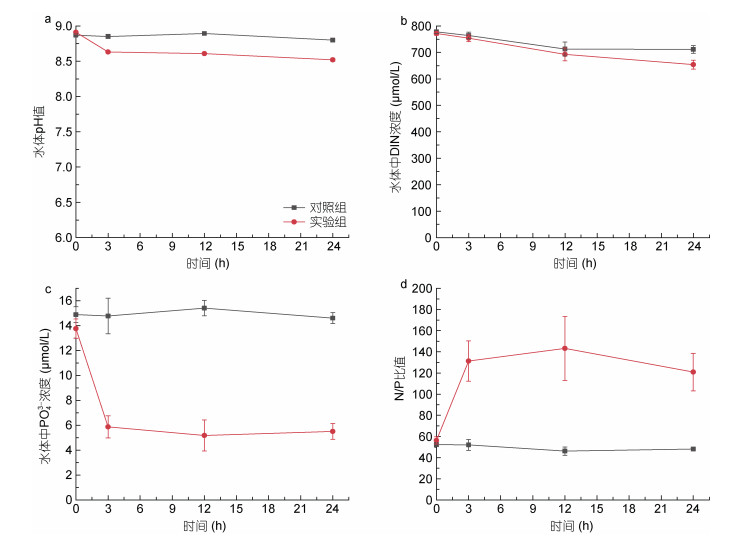 |
| 图 5 MC I处理后水质参数的变化情况 Fig. 5 Changes of water quality parameters after MC I treatment |
通过跟踪测定实验过程中对照组与实验组水体硝酸盐、亚硝酸盐、铵盐含量变化情况发现, 添加MC I后水体中的溶解态无机氮含量变化不明显(图 5b), 而水体中磷酸盐含量在MC I处理后显著降低, 添加改性粘土3 h后实验组水体中的磷酸盐含量由13.78 µmol/L下降至5.87 µmol/L, 与对照组相比下降60.28%, 3—24 h期间实验组磷酸盐含量均远低于对照组的水平(图 5c)。与之相对应, 实验组的氮磷比值(N/P)也由于磷酸盐含量的大幅度降低出现了明显高于对照组的现象(图 5d)。
3 讨论 3.1 胞内、胞外PSTs对总毒素下降的贡献MC I在絮凝去除藻细胞的同时, 也大大降低了水体中总PSTs含量水平, 这与以往的研究结果相一致, 即粘土或改性粘土在絮凝产毒藻的同时对水体中藻毒素也具有良好的去除作用。Pierce等(2004)研究了磷酸盐土对于短凯伦藻(Karenia brevis)及其产生的BTX毒素的去除效果, 结果表明0.25 g/L的粘土在絮凝去除藻细胞的同时, 可以去除水体中97%的胞内BTX毒素, 对于水体中胞外毒素的吸附效果可以达到70%左右。Sengco等(2005)研究了PAC改性粘土对于小定鞭金藻Prymnesium parvum的去除过程及毒素的响应, 发现改性粘土处理后, 上层水体的毒素含量由24.2 μg/mL降低至9.2 μg/mL, 且改性粘土对于上层水体毒素的去除效果与藻细胞去除率具有很好的相关性, 其对毒素的去除效果主要是通过去除藻细胞来实现的。
本研究结果表明, 水体中总PSTs的降低主要体现在胞内PSTs的降低(图 6), 胞内PSTs的降低占总下降量的90%以上, 也就是说改性粘土在产毒亚历山大藻藻华治理过程中, 主要是通过去除水体中的产毒藻细胞以达到降低水体中毒素含量的效果。同时水体中总PSTs含量与藻细胞密度、总PSTs下降量与藻细胞密度下降量均呈现出较强的正相关关系(图 7), 这同样反映出水体中总PSTs含量的变化主要源自改性粘土通过絮凝藻细胞去除胞内PSTs。
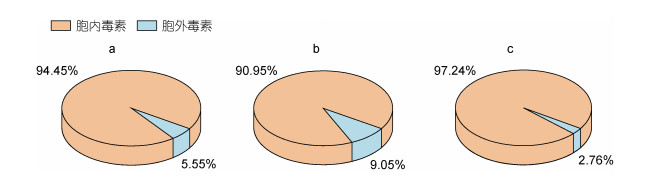 |
| 图 6 胞内外PSTs毒素对总PSTs毒素下降的贡献 Fig. 6 Contribution of intracellular and extracellular PSTs to the decrease of total PSTs 注: a: 添加改性粘土3 h; b: 添加改性粘土12 h; c: 添加改性粘土24 h |
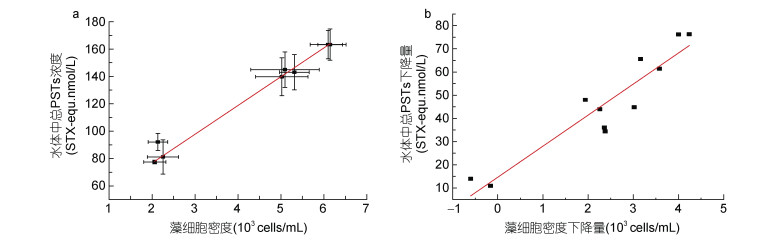 |
| 图 7 水体总PSTs浓度与藻细胞密度的关系 Fig. 7 Relationship between total PSTs concentration and algal density in the water 注: a: 水体中总PSTs浓度与藻细胞密度的相关性; b: 水体中总PSTs下降量与藻细胞密度下降量的相关性 |
在本研究中, 添加改性粘土后水体中胞外PSTs对总PSTs下降的贡献较小。研究结果表明, 与对照组相比, 添加0.2 g/L MC I未使实验组上层水体胞外PSTs含量发生显著改变。MC I作为一种有吸附作用的外源添加物, 可能从两个方面对水体中的溶解态PSTs含量产生影响: 一方面, 改性粘土的添加可能会直接碰撞藻细胞或改变藻细胞培养液的水质参数, 从而对藻细胞产生胁迫刺激作用, 使其向水体中分泌PSTs毒素, 同时若改性粘土的添加导致部分藻细胞破裂, 这些藻细胞破碎释放的毒素也会直接导致水体中溶解态毒素含量的大幅升高。另一方面, 改性粘土在絮凝藻细胞的同时, 可能对水体中的溶解态PSTs毒素也具有一定的吸附作用, 从而导致其含量的降低。而本研究中“胞外PSTs含量无明显变化”这一现象出现的原因存在两种可能性: (1) 添加MC I后, 藻细胞受到外界刺激向水体中分泌了一定量的藻毒素, 而改性粘土对溶解于水体中的毒素存在一定的吸附或降解作用, 分泌量和吸附量大致平衡; (2) MC I的添加既未刺激藻细胞向水体中分泌毒素, 也未对水体中的胞外毒素产生吸附作用。针对上述可能的原因, 本文采用A. pacificum滤液, 实验考察了MC I对水体中PSTs毒素的吸附效果。由实验结果可知, 添加0.5 g/L MC I后, 水体中PSTs含量和组分均无明显变化, 且沉积絮体中未检测到毒素存在。由此可见, 低于0.5 g/L的MC I对水体中的溶解态PSTs毒素无显著吸附效果。结合MC I絮凝去除A. pacificum藻细胞后水体中PSTs含量无明显变化这一实验结果, 可以判断在此过程中改性粘土的添加可能没有刺激藻细胞大量破裂释放毒素或刺激藻细胞毒素分泌量升高。即上述第二种猜想更符合添加MC I后藻液中胞外PSTs变化的实际情况。
3.2 单细胞毒素含量与PSTs组成变化在本研究中, 0.2 g/L的MC I对实验组藻细胞的去除效率约为62%, 对于水体中残留的藻细胞, 我们分析了其产毒能力是否受到影响。一般来讲, 藻细胞在受到外来环境胁迫时, 其生理生化状态会发生一定的改变。甲藻PSTs毒素的生物合成过程也受到温度、营养盐、光照等多种外界环境因素的影响, 环境条件的改变会引起藻细胞毒素的组成和含量发生不同程度的变化。因此, 添加改性粘土后, 由于外来胁迫的干扰, 残留亚历山大藻细胞的单细胞毒素含量极有可能会发生一定的改变。一方面, 粘土颗粒可能撞击藻细胞直接影响藻细胞生理生化状态, 致使其产毒特征发生改变; 另一方面, 改性粘土的添加势必会引起pH、营养盐等水质参数发生一定的改变, 这些环境因素的变化一定程度上可对藻细胞产生胁迫, 引起其产毒量的变化。然而在本研究中0.2 g/L MC I的添加并未引起单细胞毒素含量与毒素组成的明显改变。
首先, 这一结果的出现可能是因为残留藻细胞未明显受到来自粘土颗粒严重碰撞的影响。改性粘土对于藻细胞的絮凝作用主要来自于经过表面改性的粘土颗粒在海水中与藻细胞间的静电作用、桥连作用、网捕作用, 同时对比前人关于未改性粘土和改性粘土对藻细胞絮凝效果的研究可知, 粘土颗粒自身与藻细胞虽然可能发生直接碰撞, 但由于改性粘土在海水中容易形成絮体, 加之实验所用微藻不易破碎, 因此本研究中絮凝完成后水体中剩余的这部分藻细胞有较大的概率未严重遭受来自粘土颗粒直接碰撞的影响, 或粘土颗粒对其的碰撞强度未达到刺激其产毒增加的程度。
其次, 本研究还从间接影响藻细胞产毒的水质参数的角度, 对添加改性粘土后残留藻细胞单细胞毒素含量无明显升高这一实验结果进行了分析。已有研究表明, 硝酸盐、磷酸盐等水质参数的改变会影响藻细胞的产毒情况(Macintyre et al, 1997; Wang et al, 2002; Leong et al, 2004; Frangópulos et al, 2004; Lee et al, 2006; Xu et al, 2012)。环境中的磷浓度可影响PSTs毒素的合成, 胞内毒素含量随着环境中磷含量的升高而降低, 磷限制可以导致亚历山大藻胞内毒素含量显著增加(Frangópulos et al, 2004; Lee et al, 2006; Xu et al, 2012)。而当N/P比过高时, 藻细胞中的氮除分配给含磷化合物的合成外, 还可剩余大量的氮用于毒素合成, N/P比过高也可能导致单细胞毒素含量的升高。在本研究中, 添加0.2 g/L MC I后, 水体中硝酸盐、亚硝酸盐、铵盐浓度无明显变化, 磷酸盐含量由初始的13.78 µmol/L下降至5.87 µmol/L, N/P比值也相应出现了明显高于对照组的现象, 但水体中残留藻细胞的单细胞毒素含量却未因环境参数的改变呈现出明显的变化, 推测在本研究中环境参数的改变尚未达到胁迫残留藻细胞增加产毒的程度, 其中的机制、原理尚待深入研究。
在利用改性粘土治理开阔海域有害藻华的实际应用中, 改性粘土的有效用量约为4—10 t/km2 (相当于4—10 g/m2), 在该用量下对水质等生态环境的影响基本可以忽略; 另外, 在现场治理过程中, 由于水体交换和海水强大的缓冲能力, 总体而言, 磷酸盐等水质参数在治理前后不会出现明显的变化。因此, 本文可以推断在改性粘土治理亚历山大藻藻华的现场应用中, 残留藻细胞单细胞毒素含量不会因水质而产生变化。
4 结论(1) 0.2 g/L MC I在去除水体中A. pacificum藻细胞的同时, 对水体中总PSTs具有良好的去除效果。水体中降低的总PSTs毒素主要源于藻细胞的絮凝去除, 胞内PSTs的去除占被去除总量的90%以上。
(2) 本研究中, 改性粘土的添加未刺激藻细胞大量分泌毒素, 水体中残留藻细胞单细胞毒素含量和PSTs组分与对照组无显著差异。
(3) 0.5 g/L的MC I对胞外PSTs无明显吸附效果, 因此推测低于0.5 g/L的MC I对胞外PSTs亦无明显吸附效果。结合改性粘土处理亚历山大藻藻液后胞外PSTs含量无明显变化, 推测0.2 g/L MC I未造成大量藻细胞破裂。
邱丽霞, 俞志明, 曹西华, 等. 2017. 改性粘土对球形棕囊藻(Phaeocystis globosa)和东海原甲藻(Prorocentrum donghaiense)的去除作用. 海洋与湖沼, 48(5): 982-989 |
张亚亚, 闫国旺, 吴海燕, 等. 2020. 基于SPE与SPATT的水体中麻痹性贝类毒素检测方法构建与应用. 海洋与湖沼, 51(2): 298-306 |
梁玉波, 李冬梅, 姚敬元, 等. 2019. 中国近海藻毒素及有毒微藻产毒原因种调查研究进展. 海洋与湖沼, 50(3): 511-524 |
Anderson D M, 1997. Turning back the harmful red tide. Nature, 388(6642): 513-514 DOI:10.1038/41415 |
Anderson D M, Cembella A D, Hallegraeff G M, 2012. Progress in understanding harmful algal blooms: paradigm shifts and new technologies for research, monitoring, and management. Annual Review of Marine Science, 4(1): 143-176 DOI:10.1146/annurev-marine-120308-081121 |
Frangópulos M, Guisande C, De Blas E et al, 2004. Toxin production and competitive abilities under phosphorus limitation of Alexandrium species. Harmful Algae, 3(2): 131-139 DOI:10.1016/S1568-9883(03)00061-1 |
Lee H O, Ishimaru T, Toshiya K et al, 2006. Growth of the Dinoflagellate Alexandrium tamarense isolated from Jinhae Bay, Korea in Axenic cultures. Korean Journal of Environmental Biology, 24(3): 275-281 |
Leong S C Y, Murata A, Nagashima Y et al, 2004. Variability in toxicity of the dinoflagellate Alexandrium tamarense in response to different nitrogen sources and concentrations. Toxicon, 43(4): 407-415 DOI:10.1016/j.toxicon.2004.01.015 |
Li J, Song X X, Zhang Y et al, 2017. An investigation of the space distribution of Ulva microscopic propagules and ship-based experiment of mitigation using modified clay. Marine Pollution Bulletin, 117(1/2): 247-254 |
Li J, Song X X, Zhang Y et al, 2019. Effect of modified clay on the transition of paralytic shellfish toxins within the bay scallop Argopecten irradians and sediments in laboratory trials. Aquaculture, 505: 112-117 DOI:10.1016/j.aquaculture.2019.02.038 |
Liu Y, Cao X H, Yu Z M et al, 2016. Controlling harmful algae blooms using aluminum-modified clay. Marine Pollution Bulletin, 103(1/2): 211-219 |
Lu G Y, Song X X, Yu Z M et al, 2015. Environmental effects of modified clay flocculation on Alexandrium tamarense and paralytic shellfish poisoning toxins (PSTs). Chemosphere, 127: 188-194 DOI:10.1016/j.chemosphere.2015.01.039 |
Macintyre J G, Cullen J J, Cembella A D, 1997. Vertical migration, nutrition and toxicity in the dinoflagellate Alexandrium tamarense. Marine Ecology Progress Series, 148: 201-216 DOI:10.3354/meps148201 |
Morris R J, Williams D E, Luu H A et al, 2000. The adsorption of microcystin-LR by natural clay particles. Toxicon, 38(2): 303-308 DOI:10.1016/S0041-0101(99)00149-X |
Pierce R H, Henry M S, Higham C J et al, 2004. Removal of harmful algal cells (Karenia brevis) and toxins from seawater culture by clay flocculation. Harmful Algae, 3(2): 141-148 DOI:10.1016/j.hal.2003.09.003 |
Sengco M R, Hagström J A, Granëli E et al, 2005. Removal of Prymnesium parvum (Haptophyceae) and its toxins using clay minerals. Harmful Algae, 4(2): 261-274 DOI:10.1016/j.hal.2004.05.001 |
Wang D Z, Hsieh D P H, 2002. Effects of nitrate and phosphate on growth and C2 toxin productivity of Alexandrium tamarense CI01 in culture. Marine Pollution Bulletin, 45(1/12): 286-289 |
Xu J, Ho A Y T, He L et al, 2012. Effects of inorganic and organic nitrogen and phosphorus on the growth and toxicity of two Alexandrium species from Hong Kong. Harmful Algae, 16: 89-97 DOI:10.1016/j.hal.2012.02.006 |
Yu Z M, Song X X, Cao X H et al, 2017. Mitigation of harmful algal blooms using modified clays: Theory, mechanisms, and applications. Harmful Algae, 69: 48-64 DOI:10.1016/j.hal.2017.09.004 |
Yu Z M, Zou J Z, Ma X N, 1994. Application of clays to removal of red tide organisms Ⅱ. Coagulation of different species of red tide organisms with montmorillonite and effect of clay pretreatment. Chinese Journal of Oceanology and Limnology, 12(4): 316-324 DOI:10.1007/BF02850491 |
 2021, Vol. 52
2021, Vol. 52


