中国海洋湖沼学会主办。
文章信息
- 徐小杰, 王学颖, 周莉, 刘清华, 李军. 2021.
- XU Xiao-Jie, WANG Xue-Ying, ZHOU Li, LIU Qing-Hua, LI Jun. 2021.
- 许氏平鲉(Sebastes schlegelii)卵子发生及妊娠过程中雌激素、芳香化酶及其受体的变化规律
- CHANGES OF ESTROGEN, AROMATASE AND ESTROGEN RECEPTOR DURING OOGENESIS AND GESTATION OF SEBASTES SCHLEGELII
- 海洋与湖沼, 52(5): 1236-1243
- Oceanologia et Limnologia Sinica, 52(5): 1236-1243.
- http://dx.doi.org/10.11693/hyhz20210200054
文章历史
-
收稿日期:2021-02-23
收修改稿日期:2021-04-08
2. 中国科学院海洋大科学研究中心 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋生物学与生物技术功能实验室 青岛 266237;
4. 中国科学院大学 北京 100049
2. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
3. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
雌二醇是鱼类卵巢分泌的主要的性类固醇激素之一, 在脊椎动物卵子发生、性别分化、卵黄形成、生理免疫以及中枢神经系统调节等生理过程中发挥重要的作用(Lubzens et al, 2010; McCarthy, 2010; Eick et al, 2011)。雌二醇的合成需要膜细胞层和颗粒层共同完成。首先胆固醇进入到膜细胞层, 胆固醇被CYP11A1酶催化后, 孕烯醇酮和孕酮进行17a-羟基化, 再分别通过C21、17-羟基途径先后得17a-羟基孕酮和雄烯二酮。然后雄烯二酮被转化为雄激素被转运到颗粒层中, 在芳香化酶(P450arom)的作用下被转化成雌二醇(Miller et al, 1997; Kagawa, 2013)。
芳香化酶由cyp19基因编码, 属于细胞色素P450家族, 是催化雄激素向雌激素转化的一种关键酶。在硬骨鱼中, 芳香化酶基因存在两种亚型: P450arom A和450arom B, 分别主要表达于性腺和脑中, 被称为性腺芳香化酶和脑芳香化酶(Tchoudakova et al, 1998)。雌激素需要与分布在细胞膜和细胞核内的雌激素受体(estrogen receptor, ER)结合才能发挥作用(Woods et al, 2009)。在目前的硬骨鱼类的研究中, 人们已经证实, 雌激素与雌激素受体结合可以起到促进卵黄蛋白原产生的作用, 从而维持卵母细胞的正常发育(Flouriot et al, 1996; Sabo-Attwood et al, 2004; Nelson et al, 2010)。并且在对大黄鱼的研究中, Chen等(2015)推测ERα和ERβ1可能参与卵巢发育和排卵等过程。
许氏平鲉(Sebastes schlegelii)隶属于鲉形目(Scorpaeniformes)、鲉科(Scorpaenidae)、平鲉属(Sebastes), 是一种重要的海洋经济鱼种, 广泛分布于中国、日本和韩国海域。许氏平鲉营胎生繁殖, 且经过漫长的卵黄积累期和妊娠期, 这一特殊的生殖方式使得它受到了国内外学者的广泛关注。Mori等(2003)、Shi等(2011)、Kwon等(2013)对许氏平鲉卵巢发育过程中雌二醇的含量变化进行过一定的研究, 但是他们对于处于妊娠期的许氏平鲉的研究较少。本文选取了II、III至孵化前共7个发育期, 通过分析cyp19a和Era在许氏平鲉卵巢上的定位、cyp19a和cyp19b mRNA在不同卵巢发育时期及不同组织中的表达以及不同发育期的卵巢中雌二醇含量变化, 分析许氏平鲉卵巢发育、卵黄积累及其妊娠过程中从卵巢组织结构变化、雌激素水平, 芳香化酶及雌激素受体的表达规律, 为深入解析许氏平鲉胎生生殖特性积累资料。
1 材料与方法 1.1 实验材料实验所用许氏平鲉(Sebastes schlegelii)来自青岛南山市场, 从9月到次年5月每月购买; 所用大菱鲆从威海圣航水产科技有限公司获得, 从3月到7月每月采集。取样之前, 使用麻醉剂(MS-222, Sigma, St. Louis, MO)将所有鱼麻醉, 然后收集每条鱼的脑、心脏、鳃、肾脏、肝脏、脾脏、肠道以及二分之一的卵巢等组织保存在液氮中用于后续的分子实验。四分之一的卵巢组织在Bouin’s液中固定24 h, 然后置换到70%的酒精中保存用于后续的组织学观察; 另外四分之一的卵巢组织在多聚甲醛中固定24 h, 然后置换到70%的酒精中保存用于后续的原位杂交实验。除此之外, 从静脉中抽取血液样品到抗凝管中, 4 ℃保存24 h后16 000 g离心10 min, 将上清液保存在–80 ℃用于后续的激素测定。
1.2 RNA提取和cDNA合成将保存在液氮中组织样品取出, 使用SPARK easy tissue/cell RNArapid extraction kit (SparkJade, China)试剂盒并参考其说明书进行RNA的提取。提取后进行1%的琼脂糖凝胶电泳检测, 并在260 nm和280 nm的紫外光谱下测定浓度, 然后使用PrimeScript™ RT reagent Kit with gDNA Eraser (TaKaRa, Japan)进行反转录, 使终浓度统一为1 000 ng/μL。然后稀释至100 ng/μL, 置于–20 ℃中保存备用。
1.3 组织学固定好的卵巢样品经过梯度酒精脱水(70%, 80%, 85%, 90%, 95%, 100%)、复水环节被包埋到石蜡中。修整蜡块后, 用Leica 2235切片机进行连续切片, 切片厚度为5 μm。然后进行苏木精-伊红(H.E)染色, 染好色的切片置于NikonENi (Japan)下观察处于不同发育期的卵巢的组织形态, 文章中卵母细胞的卵子发育过程参考史丹等(2011)和Grier等(2009)的研究分为五个时期。
1.4 原位杂交Era和cyp19a的cDNA序列从本实验室的转录组数据中获得。第一轮PCR扩增以稀释后的浓度为100 ng/μL卵巢组织的cDNA作为模板, 上下游分别使用F和R引物(Era-F/R, cyp19a-F/R)。第二轮扩增以第一轮扩增的产物为模板, 上下游分别使用F和R-T7引物(Era-F/ISH-RT7, cyp19a-F/ISH-RT7), 得到的产物进行纯化后, 用DIG RNA Labeling Kit (Roche, Mannheim, Germany)合成探针, 进行原位杂交实验。表 1中列出了合成探针过程中所用的引物。
| 引物名称 | 引物序列(5′—3′) |
| Era-F | CCAGGCTTGCCGTCTTAG |
| Era-R | ATGGTGACCTCGGTGTAG |
| Era-ISH-RT7 | TAATACGACTCACTATAGGG ATGGTGACCTCGGTGTAG |
| cyp19a-F | TTCACCATGCGTAAAGCCCT |
| cyp19a-R | GGCTGCTGAGAGAGGTTGTT |
| cyp19a-ISH-T7R | TAATACGACTCACTATAGGGGGCTGCTGAGAGAGGTTGTT |
| cyp19b-F | ACCGCCGTTCTGCTTCTACT |
| cyp19b-R | TCCTTTTCGTTGAGCGGCAC |
| 18S-F | CCTGAGAAACGGCTACCACAT |
| 18S-R | CCAATTACAGGGCCTCGAAAG |
以采集到的体节期的脑、心脏、鳃、肾脏、肝脏、脾脏、肠道和卵巢以及整个发育期的卵巢样品分别作为模板, 针对两个基因设计不同的引物(cyp19a-F/R, cyp19b-F/R), 并选用18S作为内参照进行一同进行PCR扩增, 所用引物同样列在表 1中。PCR扩增体系为: 模板cDNA 0.5 μL、KOD ONE酶12.5 μL、上下游引物各0.75 μL、无菌水10.5 μL。反应程序: 98 ℃反应10 s, 68 ℃反应10 s, 35循环。
1.6 激素测定将采集的血清样品从–80 ℃冰箱中取出, 按照Iodine [125I] Radioimmunoassay (RIA) kits (Beijing, China)的说明书对许氏平鲉雌激素的含量进行测定。该方法与雌激素的结合率高, 对其他甾体的交叉反应性低, 对大多数循环甾体的交叉反应性小于0.1%。
1.7 数据统计与分析使用Spss12.0中的Duncan’s法对实验数据进行处理和分析, 当P < 0.05时认为差异显著。
2 结果 2.1 许氏平鲉卵巢在整个发育期的形态变化见图 1。许氏平鲉的卵巢中含有丰富的间质细胞, 当卵巢发育至II期的时候, 卵巢内以2时初级相卵母细胞为主。2时相初级卵母细胞体积较小且形状不规则, 呈多边形, 胞质呈强嗜碱性, 核质均匀且着色较浅。此时的卵母细胞没有发育出清晰的滤泡层结构, 细胞外仅有一层滤泡细胞结构。一般在11月的时候, 许氏平鲉的卵巢发育至III期, 此时卵巢内以3时相卵母细胞为主。3时相卵母细胞被生殖上皮包围, 呈圆球形, 滤泡细胞发展成2层。滤泡细胞包绕着卵母细胞, 形成独立的卵泡结构。卵母细胞皮质部分出现体积大于皮层小泡的油球, 以后油球数目逐渐增多。雄鱼与雌鱼的交配就发生在这一阶段, 交配后, 精子进入到雌鱼的卵巢腔内。当卵巢发育到IV期的时候, 一般是1月, 卵巢内充满4时相卵母细胞。4时相卵母细胞较3时相卵母细胞体积进一步增大, 卵黄颗粒数量迅速增多, 卵黄颗粒体积迅速增大, 滤泡层被压缩变窄。当卵巢内以5时相卵母细胞为主时, 卵巢发育处于V期(史丹等, 2011)。经过了漫长的卵黄积累过程, 在这一时期, 卵母细胞已充分发育成熟, 细胞内充满成熟卵黄颗粒, 部分卵黄颗粒开始融合, 滤泡层破裂。卵子受精后, 颗粒层脱离透明带(ZP), 与周围的膜细胞层混合, 形成屏障。随后, 它们迅速迁移、侵入周围组织并迅速扩张, 形成滤泡胎盘以支持胚胎发育。在妊娠期早期, 随着胚胎的发育, 滤泡胎盘进一步发育和扩张。当胚胎发育至囊胚期的时候, 胚胎周围包绕着丰富的呈折叠状的滤泡胎盘。随着胚胎的继续发育, 滤泡胎盘逐渐变得疏松。当胚胎发育到体节期的时候, 滤泡胎盘结构较囊胚期疏松, 到了孵化前期, 视野内只能观察到极少的滤泡胎盘的存在。
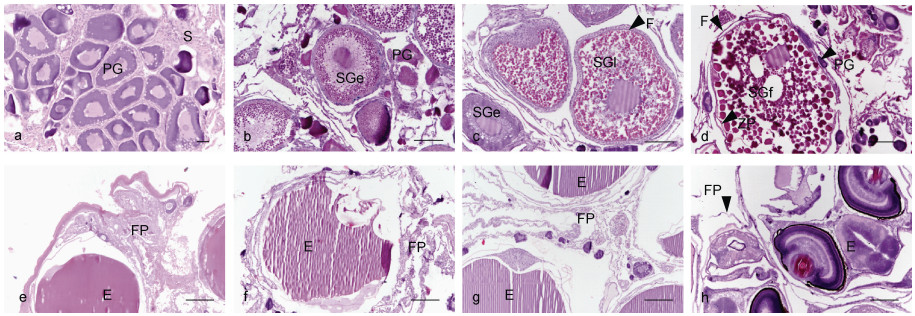 |
| 图 1 许氏平鲉卵巢在整个发育期的组织学观察 Fig. 1 Histology of the black rockfish ovary development 注: a. II期卵巢, 卵巢内主要为形态不规则的2时相早期卵母细胞; b. III期卵巢, 卵巢内主要为3时相卵母细胞, 呈圆球形, 两层滤泡细胞已经出现; c. IV期卵巢, 卵巢内主要为4时相卵母细胞, 卵母细胞体积进一步增大; d. V期卵巢, 卵巢内主要为5时相卵母细胞, 卵母细胞充分发育, 部分卵黄颗粒出现融合, 滤泡层被挤压变窄; e. 卵裂期, 颗粒细胞与卵母细胞分离, 滤泡层(颗粒层, 鞘细胞层, 基底膜)与周围的上皮细胞和基质细胞混合, 形成滤泡胎盘; f. 囊胚期, 滤泡胎盘变得更加丰富且广泛折叠; g. 体节期, 滤泡胎盘进一步向外扩张且变得疏松; h. 孵化前期, 视野内只能观察到极少的滤泡胎盘。PG: 2时相卵母细胞(处于初级生长期的卵母细胞); SGe: 3时相卵母细胞(次级卵母细胞发育早期); SGl: 4时相卵母细胞(次级卵母细胞发育晚期); SGf: 5时相卵母细胞(次级卵母细胞发育成熟期); FP: 滤泡胎盘: F: 滤泡层; E: 胚胎; S: 间质细胞。比例尺=200 μm |
当许氏平鲉的卵巢发育到III期和IV期的时候, cyp19a在滤泡层上有信号, 并且特异的表达在颗粒细胞上(图 2a, 2b)。在V期卵巢中可以观察到, cyp19a的信号变得极其微弱(图 2c), 在囊胚期则观察不到信号(图 2d)。Era在III期和IV期卵巢中检测不到信号(图 2e, 2f), 当卵巢发育至V期的时候, 在5时相卵母细胞的滤泡层上可以观察到非常明显的信号, 除此之外, 滤泡层外面的基质细胞也可以检测到信号表达(图 2g)。在囊胚期, Era的阳性信号出现在滤泡胎盘上并且依然非常明显(图 2h)。图 2(a1)为正义探针的杂交结果。
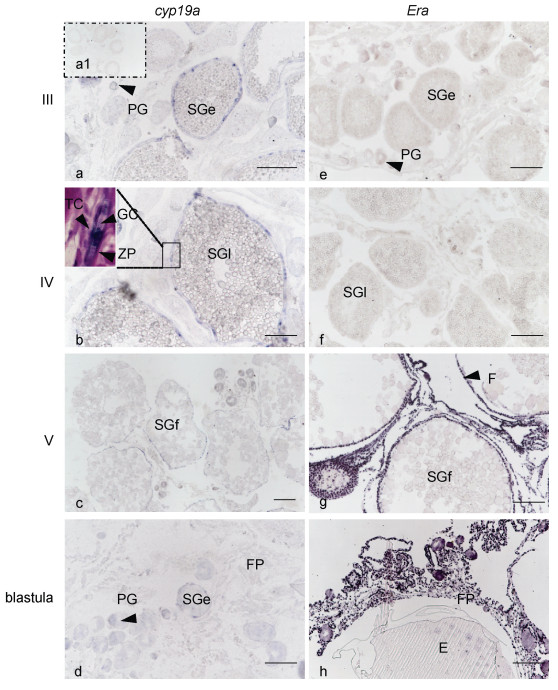 |
| 图 2 cyp19a和Era的原位杂交结果 Fig. 2 In situ hybridization results of cyp19a and Era 注: a—d. cyp19a在卵巢中的原位杂交结果; e—h. Era在卵巢中的原位杂交结果。PG: 2时相卵母细胞(处于初级生长期的卵母细胞); SGe: 3时相卵母细胞(次级卵母细胞发育早期); SGl: 4时相卵母细胞(次级卵母细胞发育晚期); SGf: 5时相卵母细胞(次级卵母细胞发育成熟期); FP: 滤泡胎盘; F: 滤泡层; E: 胚胎; TC: 鞘细胞; GC: 颗粒细胞; ZP: 透明带。比例尺=200 μm |
见图 3。在同一条鱼的不同组织中, cyp19a仅在卵巢和脑中有表达, 且在卵巢中的表达量明显高于脑。cyp19b在卵巢、脾脏、脑和肝脏中都有表达, 其中脑的表达量最高, 卵巢、脾脏和肝脏中微弱表达。在许氏平鲉整个卵巢发育时期, cyp19a在III期、IV期、V期、囊胚期和体节期均有表达, III期、IV期和体节期的表达要强于V期和囊胚期, 孵化前期没有表达。cyp19b在整个卵巢发育过程中只在III期、IV期和体节期有表达, 且体节期的表达强于IV期, III期的条带极其微弱, 在V期、囊胚期和孵化前期没有表达。并且整体来看, 在同一时期, cyp19a的表达要强于cyp19b。
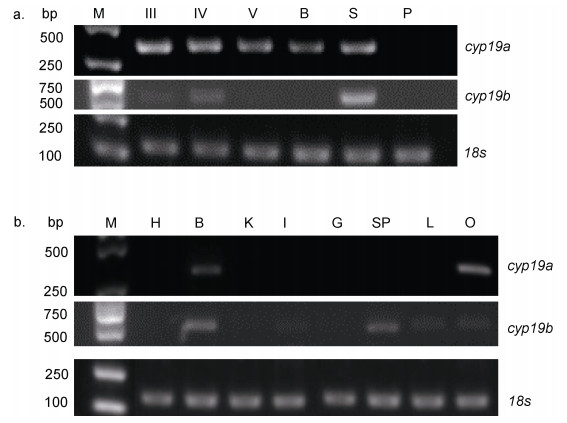 |
| 图 3 cyp19a和cyp19b的表达情况 Fig. 3 The expression of cyp19a and cyp19b 注: a. cyp19a和cyp19b在不同卵巢发育时期的表达; b. cyp19a和cyp19b在雌鱼不同组织发育时期的表达。M: marker; III: III期卵巢; IV: IV期卵巢; V: V期卵巢; B: 囊胚期; S: 体节期; P: 孵化前期; H: 心脏; B: 脑; K: 肾; I: 肠; G: 鳃; SP: 脾; L: 肝脏; O: 卵巢 |
见图 4。在II期和III期卵巢中, 雌二醇含量处于较低的水平。当许氏平鲉雌鱼卵巢发育至IV期的时候, 雌二醇含量极速升高, 达到峰值。此后出现回落, 在体节期再次上升, 回归到峰值水平, IV期和体节期时许氏平鲉体内的雌二醇含量显著高于其他时期。整体看来, 许氏平鲉妊娠期体内的雌二醇的含量保持在较高的水平。大菱鲆在卵子发生过程中体内的雌二醇含量变化趋势与许氏平鲉基本一致, 从III期发育到IV期的时候, 雌二醇含量极速上升, 然后在V期出现回落。
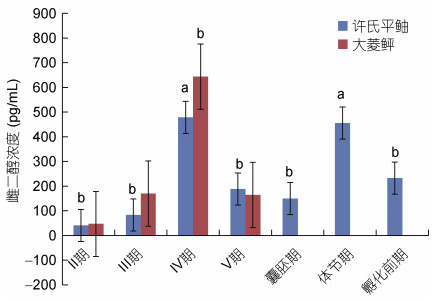 |
| 图 4 不同发育期的卵巢中雌二醇含量变化 Fig. 4 Changes of estradiol content in ovaries at different developmental stages 注: 数据均表示平均数±标准误, 图中标有不同的字母表示存在显著性差异(P < 0.05, Duncan氏多重比较) |
许氏平鲉雌鱼在卵子发生过程中的组织学形态与卵生鱼类相似(朱亮华等, 2018)。当卵巢发育至II期的时候, 卵巢内以2时初级相卵母细胞为主。2时相初级卵母细胞体积较小且形状不规则, 呈多边形, 胞质呈强嗜碱性, 核质均匀且着色较浅。此时的卵母细胞没有发育出清晰的滤泡层结构, 细胞外仅有一层滤泡细胞结构。当卵巢发育至III期的时候, 卵巢内以3时相卵母细胞为主。3时相卵母细胞被生殖上皮包围, 呈圆球形, 滤泡细胞发展成2层。卵母细胞皮质部分出现体积大于皮层小泡的油球, 以后油球数目逐渐增多。当卵巢发育到IV期的时候, 卵巢内充满4时相卵母细胞。4时相卵母细胞较3时相卵母细胞体积进一步增大, 卵黄颗粒数量迅速增多、体积迅速增大, 滤泡层被压缩变窄。当卵巢发育至V期时, 卵母细胞已充分发育成熟, 细胞内充满成熟卵黄颗粒, 部分卵黄颗粒开始融合。
但是许氏平鲉卵子发生过程与卵生鱼类不同的地方在于, 当卵巢发育到III期的时候, 滤泡层发育为2层, 生殖上皮包绕住了3时相卵母细胞, 形成了许多独立的卵泡。雌鱼和雄鱼在这一时期交配, 交配后精子散落的分布在卵巢腔内。独立的卵泡通过茎状结构分别与基质相连, 使得每个卵泡与精子接触的概率大致相同, 并且卵泡能够从基质以及包绕在滤泡层上的血管中直接获得营养, 减少了卵子之间的竞争, 从而保证受精和营养吸收效率。
受精后, 我们在组织学上并没有发现胚胎外的2细胞结构, 说明滤泡层在受精前或者受精过程中就已经破裂, 这与Bretschneider等(1947)的研究结果一致。此后, 滤泡层迅速增殖并侵入周围的结缔组织, 变得高度肥大, 广泛折叠和高度血管化, 并在囊胚期迅速形成滤泡胎盘。该结构在形态上非常类似于哺乳动物绒膜尿囊胎盘的一部分(Grove et al, 1994; Laksanawimol et al, 2006; Kwan et al, 2015)。
在许氏平鲉卵子发生的过程中, 血浆中雌二醇的含量不断增加, 这与史丹等(2011)的研究结果一致。并且我们发现, 当卵巢发育到IV期的时候, 许氏平鲉体内的雌二醇含量显著高于其他时期, 达到峰值。由于Shi等(2011)将IV期和V期的雌二醇含量合并到一起, 所以并没有非常突出的高于II期和III期, 但在整个卵子发育期仍然呈现上升趋势, 进一步印证了雌二醇具有促进卵黄蛋白原产生从而促进卵巢发育的作用。这一结果与一些卵生鱼类, 如: 斜带石斑鱼(Epinephelus coioides) (赵会宏等, 2003)、赤点石斑鱼(Epinephelus akaara) (刘付永忠, 2004)、双棘黄姑鱼(Nibea diacanthus) (沈卓坤等, 2007)等研究结果相同。在胚胎发育的过程中, 当胚胎发育至体节期的时候, 血浆中雌二醇的含量再次上升达到一个小高峰, 同时cyp19a、cyp19b的表达也高于囊胚期, 我们推测这可能说明雌二醇对母体维持妊娠具有一定的支撑作用。
雌激素必须与雌激素受体结合才能发挥作用, 我们通过追踪Era在许氏平鲉卵巢上的定位发现, 在III期和IV期卵巢上没有检测到Era的信号。当卵巢发育到V期的时候, 在滤泡层和基质中都出现了强烈的阳性信号, 并且在囊胚期的时候信号依然非常明显。硬骨鱼类和哺乳类ERa在DNA结合区和配体结合区高度保守, 这两个功能域的可相似性分别达到90%和60%。在哺乳动物中, ERa主要在子宫、乳腺、卵巢以及输卵管中表达(Couse et al, 1997), 因此我们推测许氏平鲉的滤泡胎盘可能与哺乳动物的胎盘存在某些功能上的相似性。
cyp19a在雌性许氏平鲉中仅在卵巢和脑中有表达, 且在卵巢中的表达量高于脑。这与Wen等(2014)的研究结果基本相似, 他们认为cyp19a仅在许氏平鲉的卵巢中有表达, 这可能与所采用的样品处于不同的发育时期或者实验时所用的PCR循环数不同有关。这与金鱼(Carassius auratus) (Tchoudakova et al, 1998)、斑马鱼(Denio rerio) (Kishida et al, 2001)在其他外周组织也有表达的研究结果也有所不同, 这些差异可能与不同鱼类之间物种差异以及发育时期的不同有关。但无论在哪种鱼类中, cyp19a在卵巢中的表达量都是最高的, 这也说明了cyp19a在维持卵巢发育方面具有重要的作用。cyp19b在卵巢、脾脏、脑和肝脏中都有表达, 其中脑的表达量最高, 卵巢、脾脏和肝脏中微弱表达, 这与杨艳平等(2012)的研究结果基本相似, 他们认为cyp19b在脑、卵巢、脾脏和头肾中表达, 这可能与样品处于不同的发育时期有关。我们的研究结果与三斑石斑鱼(Epinephelus trimaculatus)(陈华谱等, 2012)的结果相同。在卵巢发育的不同时期, 在许氏平鲉整个卵巢发育时期, cyp19a在III期、IV期、V期、囊胚期和体节期均有表达, III期、IV期和体节期的表达要强于V期和囊胚期, 孵化前期没有表达。这与Wen等(2014)等的结果一致, 在他们的研究结果中, 从7月到9月、11月次年1月以及3月, cyp19a的表达量基本相同, 5月时表达量有所下降。我们对于发育时期的划分要更为清晰, 并且对妊娠时期的许氏平鲉卵巢中cyp19a的表达量进行了补充。cyp19b在整个卵巢发育过程中只在III期、IV期和体节期有表达, 且体节期的表达强于IV期, III期的条带极其微弱。在V期、囊胚期和孵化前期没有表达。这与杨艳平等(2012)和Kwon等(2013)的研究结果基本一致, 杨艳平等(2012)只研究了卵子发生期和退化期, 在卵子发生期cyp19b只在III期和IV期表达; Kwon等(2013)的研究结果显示cyp19b在卵黄积累期和妊娠期都有表达, 这同样与我们的实验结果吻合, 只是我们对卵黄积累期和妊娠期进行了进一步的细化, 发现cyp19b在整个卵巢发育过程中只在III期、IV期和体节期有表达。我们认为cyp19b在体节期的高表达或许是作为雌二醇来源的一个补充, cyp19a和cyp19b在体节期的高表达共同导致了雌二醇在处于体节期的许氏平鲉体内有较高含量这一结果, 由此我们推测cyp19b对许氏平卵巢的发育同样发挥着重要的作用。
4 结论本文分析了与雌二醇合成及作用密切相关的cyp19a和Era在许氏平鲉卵巢上的定位, 芳香化酶cyp19a、cyp19b mRNA在不同组织中和不同卵巢发育时期的表达, 以及不同发育期的卵巢中雌二醇含量变化。首先, 在V期卵巢的滤泡层、基质和囊胚期的滤泡胎盘上都检测到了强烈的Era的信号。其次, cyp19a和cyp19b在卵巢中均有表达且在不同的卵巢发育期表达量不同。在卵黄积累的过程中, cyp19a和cyp19b在IV期的表达量最高, 在妊娠过程中则是体节期表达量最高。除此之外, 在卵巢发育的过程中, 许氏平鲉体内雌二醇含量的峰值分别出现在IV期和体节期。这些结果说明雌二醇在胎生鱼类卵子发生及妊娠过程中均起到非常重要的作用。本文从雌激素的角度出发, 结合许氏平鲉卵巢自身的组织学结构特点, 就许氏平鲉卵巢发育及其胎生的生殖方式提供了新的解读, 为许氏平鲉胎生这一特殊的生殖方式的研究提供了新的思路。
史丹, 温海深, 杨艳平. 2011. 许氏平鲉卵巢发育的周年变化研究. 中国海洋大学学报, 41(9): 25-30 |
朱亮华, 孙敏, 张鼎元, 等. 2018. 黑鱾卵巢发育的组织学研究. 应用海洋学学报, 37(2): 255-262 DOI:10.3969/J.ISSN.2095-4972.2018.02.013 |
刘付永忠, 2004. 环境因子对赤点石斑鱼繁殖的影响. 广州: 中山大学博士学位论文
|
杨艳平, 温海深, 史丹, 等. 2012. 许氏平鲉(Sebastes schlegeli)CYP19B基因cDNA克隆及在生殖周期中的表达分析. 海洋与湖沼, 43(2): 370-375 |
沈卓坤, 郑剑辉, 陈怀定, 等. 2007. 双棘黄姑鱼血清性类固醇激素的周年变化. 广东海洋大学学报, 27(3): 16-19 DOI:10.3969/j.issn.1673-9159.2007.03.004 |
陈华谱, 舒琥, 肖丹, 等. 2012. 三斑石斑鱼(Epinephelus trimaculatus)两种芳香化酶cDNA的克隆及其表达的组织特异性. 海洋与湖沼, 43(6): 1218-1226 |
赵会宏, 刘晓春, 刘付永忠, 等. 2003. 斜带石斑鱼雌鱼卵巢发育与血清性类固醇激素的生殖周期变化. 中山大学学报(自然科学版), 42(6): 56-59, 63 DOI:10.3321/j.issn:0529-6579.2003.06.015 |
Bretschneider L H, De Witt J J D, 1947. Sexual Endocrinology of Non-Mammalian Vertebrates. Amsterdam: Elsevier
|
Chen S H, Pu L L, Xie F J et al, 2015. Differential expression of three estrogen receptors mRNAs in tissues, growth development, embryogenesis and gametogenesis from large yellow croaker, Larimichthys crocea. General and Comparative Endocrinology, 216: 134-151 DOI:10.1016/j.ygcen.2015.04.005 |
Couse J F, Lindzey J, Grandien K et al, 1997. Tissue distribution and quantitative analysis of estrogen receptor-alpha (ERalpha) and estrogen receptor-beta (ERbeta) messenger ribonucleic acid in the wild-type and ERalpha-knockout mouse. Endocrinology, 138(11): 4613-4621 DOI:10.1210/endo.138.11.5496 |
Eick G N, Thornton J W, 2011. Evolution of steroid receptors from an estrogen-sensitive ancestral receptor. Molecular and Cellular Endocrinology, 334(1/2): 31-38 |
Flouriot G, Pakdel F, Valotaire Y, 1996. Transcriptional and post-transcriptional regulation of rainbow trout estrogen receptor and vitellogenin gene expression. Molecular and Cellular Endocrinology, 124(1/2): 173-183 |
Grier H J, Uribe-Aranzábal M C, Patino R, 2009. The ovary, folliculogenesis, and oogenesis in teleosts. In: Jamieson B G M ed. Reproductive Biology and Phylogeny of Fishes (Agnathans and Bony Fishes). New York: CRC Press, 25-78
|
Grove B D, Wourms J P, 1994. Follicular placenta of the viviparous fish, Heterandria formosa: II. Ultrastructure and development of the follicular epithelium.. Journal of Morphology, 220(2): 167-184 DOI:10.1002/jmor.1052200206 |
Kagawa H, 2013. Oogenesis in teleost fish. Aqua-BioScience Monographs, 6(4): 99-127 DOI:10.5047/absm.2013.00604.0099 |
Kishida M, Callard G V, 2001. Distinct cytochrome P450 aromatase isoforms in zebrafish (Danio rerio) brain and ovary are differentially programmed and estrogen regulated during early development. Endocrinology, 142(2): 740-750 DOI:10.1210/endo.142.2.7928 |
Kwan L, Fris M, Rodd F H et al, 2015. An examination of the variation in maternal placentae across the genus Poeciliopsis (Poeciliidae). Journal of Morphology, 276(6): 707-720 DOI:10.1002/jmor.20381 |
Kwon J Y, Kim J, 2013. Differential expression of two distinct aromatase genes (cyp19a1a and cyp19a1b) during vitellogenesis and gestation in the viviparous black rockfish Sebastes schlegelii. Animal Cells & Systems, 17(2): 88-98 |
Laksanawimol P, Damrongphol P, Kruatrachue M, 2006. Alteration of the brood pouch morphology during gestation of male seahorses, Hippocampus kuda. Marine and Freshwater Research, 57(5): 497-502 DOI:10.1071/MF05112 |
Lubzens E, Young G, Bobe J et al, 2010. Oogenesis in teleosts: how fish eggs are formed. General and Comparative Endocrinology, 165(3): 367-389 DOI:10.1016/j.ygcen.2009.05.022 |
McCarthy M M, 2010. How it's made: organisational effects of hormones on the developing brain. Journal of Neuroendocrinology, 22(7): 736-742 DOI:10.1111/j.1365-2826.2010.02021.x |
Miller W L, Auchus R J, Geller D H, 1997. The regulation of 17, 20 lyase activity. Steroids, 62(1): 133-142 DOI:10.1016/S0039-128X(96)00172-9 |
Mori H, Nakagawa M, Soyano K et al, 2003. Annual reproductive cycle of black rockfish Sebastes schlegeli in captivity. Fisheries Science, 69(5): 910-923 DOI:10.1046/j.1444-2906.2003.00707.x |
Nelson E R, Habibi H R, 2010. Functional significance of nuclear estrogen receptor subtypes in the liver of goldfish. Endocrinology, 151(4): 1668-1676 DOI:10.1210/en.2009-1447 |
Sabo-Attwood T, Kroll K J, Denslow N D, 2004. Differential expression of largemouth bass (Micropterus salmoides) estrogen receptor isotypes alpha, beta, and gamma by estradiol. Molecular and Cellular Endocrinology, 218(1/2): 107-118 |
Shi D, Wen H S, He F et al, 2011. The physiology functions of estrogen receptor α (ERα) in reproduction cycle of ovoviviparous black rockfish, Sebastes schlegeli Hilgendorf. Steroids, 76(14): 1597-1608 |
Tchoudakova A, Callard G V, 1998. Identification of multiple CYP19 genes encoding different cytochrome P450 aromatase isozymes in brain and ovary. Endocrinology, 139(4): 2179-2189 |
Wen H S, Wu W J, Yang Y P et al, 2014. Molecular physiology mechanism of cytochrome P450 aromatase-regulating gonad development in ovoviviparous black rockfish (Sebastes schlegeli). Aquaculture Research, 45(10): 1685-1696 |
Woods M, Kumar A, Barton M et al, 2009. Localisation of estrogen responsive genes in the liver and testis of Murray rainbowfish Melanotaenia fluviatilis exposed to 17β-estradiol. Molecular and Cellular Endocrinology, 303(1/2): 57-66 |
 2021, Vol. 52
2021, Vol. 52


