中国海洋湖沼学会主办。
文章信息
- 王崇懿, 王伦, 刘建勇, 傅学丽. 2022.
- WANG Chong-Yi, WANG Lun, LIU Jian-Yong, FU Xue-Li. 2022.
- 凡纳滨对虾(Litopenaeus vannamei)不同品系生长与耐高盐性状配合力及杂种优势分析
- ANALYSIS OF COMBINING ABILITY AND HETEROSIS ON GROWTH TRAIT AND SALINITY TOLERANCE OF DIFFERENT LITOPENAEUS VANNAMEI POPULATIONS
- 海洋与湖沼, 53(1): 161-167
- Oceanologia et Limnologia Sinica, 53(1): 161-167.
- http://dx.doi.org/10.11693/hyhz20210700165
文章历史
-
收稿日期:2021-07-17
收修改稿日期:2021-08-20
凡纳滨对虾(Litopenaeus vannamei)因具有生长快、盐度适应范围广、产量高以及运输便捷等优点(王兴强等, 2004; De Grave et al, 2013), 在1988年引进后迅速成为我国对虾养殖的主要品种, 到2019年我国年产量达176万t, 占全国甲壳类海水养殖总产量的66% (农业农村部渔业渔政管理局等, 2020)。近几年来, 随着市场需求量不断增长, 培育快长、抗逆性强和高品质的新品种是凡纳滨对虾养殖业可持续发展的重要保障。目前国内外针对凡纳滨对虾遗传育种工作进行了大量研究(冀德伟等, 2018; Ren et al, 2018, 2020; Hasan et al, 2020), 大多国审新品种均是通过规模化的家系选择培育而成(孔杰等, 2020), 而关于凡纳滨对虾杂交育种方面的研究却相对较少(胡志国等, 2016a, 2016b)。随着凡纳滨对虾改良工作不断推进, 对其品种多样化要求逐渐提高, 为培育出具有更多不同优良经济性状的优质亲本, 提升实际应用效果, 亟需开展凡纳滨对虾杂交育种工作。
杂交育种是进行水产动物遗传改良的重要手段之一(张晓娟等, 2019), 将不同品系或基因型的个体间进行杂交, 可使其子一代在生产性能、环境耐受性和肉质等方面优于亲本(Piferrer et al, 2009)。杂种优势与配合力是育种工作中非常重要的参考依据, 可衡量不同品系杂交后获得杂种优势的程度, 反映了目标性状的配套效果。杂交育种已在在贝类(Van In et al, 2017; Xue et al, 2020; Chen et al, 2021)和鱼类(Luo et al, 2014; 魏磊等, 2020)的遗传改良中广泛应用, 在虾类育种研究中也有报道, 如Thanh等(2010)分析了罗氏沼虾(Macrobrachium rosenbergii) 3个不同来源群体生长性状的杂种优势效应; 周发林等(2021)通过完全双列杂交设计, 研究了斑节对虾(Penaeus monodon)3个种质群体体质量性状的杂种优势和配合力; 胡志国等(2016a)利用3个凡纳滨对虾引进群体, 分析了高氨氮和低溶氧耐受性的配合力, 并预测各品系间的非加性效应; Gallaga-Maldonado等(2020)研究了凡纳滨对虾2个地理群体在存活和抗WSD性状方面的杂种优势效应。目前关于凡纳滨对虾不同种质群体盐度耐受性的杂种优势研究相对较少, 国内仅见胡志国等(2016a)针对凡纳滨对虾盐度耐受性状的配合力进行了分析, 但其基础群体数量较少。盐度是凡纳滨对虾养殖水体中重要理化的因子, 我国环黄渤海沿岸高盐水域资源丰富, 部分地区已开展凡纳滨对虾养殖实践(李春玲等, 2009; 董甜甜等, 2020), 且出产的高盐虾口感、肉质具有明显的优势(李娜等, 2018)。但高盐水体中凡纳滨对虾生长速度和单位面积产量均低于其他盐度水体, 针对生长和耐高盐性状选育有助于提高凡纳滨对虾在高盐水体中的生长速度, 提升高盐水资源的利用率。本研究应用5个不同品系凡纳滨对虾不完全双列杂交的子一代资料, 研究不同交配组合生长和耐高盐性状的杂交优势与配合力, 旨在为凡纳滨对虾配套系种苗的商业化生产提供技术指导, 并为耐高盐新品系杂交育种研究提供理论资料。
1 材料与方法 1.1 实验材料实验于2020年4~7月在湛江市国兴水产科技有限公司对虾种业基地进行, 实验材料为10个自主建立的F1代群体。10个群体的父母本来源于5个品系的凡纳滨对虾, 分别为:
凡纳滨对虾“兴海1号”(XH): 从2011年开始, 以国内外多个种质群体为基础, 经连续多代人工选育获得, 并在2017年通过了全国水产原种和良种审定委员会审定, 该品种的主要优点在于生长速度快, 养殖成活率高, 遗传稳定性良好。
泰国正大(Z)、泰国顶丰(D)、泰国日夜快(S)、美国普瑞莫(P): 从2017年开始, 由泰国、美国引进的商业种质群体, 通过家系选育及活体传代技术保存的市场品系。
1.2 群体构建2020年3月下旬, 分别从5个品系中挑选性腺发育良好的亲虾103尾强化促熟, 进行群体内自交和群体间杂交。3 d内构建了10个F1代群体, 其中自交群体5个: XH♂×XH♀、D♂×D♀、Z♂×Z♀、S♂×S♀、P♂×P♀; 杂交组合5个: XH♂×D♀、XH♂×S、D♂×XH♀、S♂×XH♀、P♂×XH♀, 各交配组合建立2~3个家系。
授精成功后, 将雌虾单独移入300 L孵化桶, 孵化水温(31.0±1.0) ℃, 选取每尾雌虾孵化出的无节幼体约3 500尾, 放入500 L的培育桶中按照标准化育苗方式单独培育至仔虾。当各家系仔虾体长达到2 cm左右时, 按照每个交配组合从相应的家系中随机选取500尾个体, 放入40目网框(2.0m×1.5m×1.0m)内, 于同一个64 m2的室外池中进行共同环境养殖, 网框养殖密度为166尾/m2。各交配组合仔虾的养成均保持养殖水质、饲料、养殖密度、养殖管理的一致。
1.3 实验方法共同养殖至60日龄时, 从每个群体中随机抽取出60尾样本用于生长性状测量。电子天平用于体质量称量, 精确到0.01 g; 数显游标卡尺用于体长测量, 精确到0.01 mm。
高盐耐受性试验: 从每个群体中随机抽取出120尾样本用于高盐耐受性试验。以每个群体为一组, 每组3个平行, 每个平行放30尾虾, 同时设置试验组和对照组。试验在2.5 m × 2.5 m × 1 m的水泥池中进行, 水体容积为1 250 L。对照组用水为经砂滤、消毒后的新鲜海水, 试验组用的高盐度海水由新鲜海水和海水晶调配而成。胁迫盐度值为52 (正式试验前一周, 通过高盐胁迫预试验得出48 h半致死盐度值)。正式胁迫过程中, 每2 h观察一次, 及时取出死亡个体, 同时记录死亡时间, 实验持续至所有受试虾死亡。实验过程中不喂料, 溶解氧维持在5.5 mg/L以上, 水温维持在(27.5±0.5) ℃, pH维持在7.8~8.2。
1.4 统计分析利用Excel 2016对凡纳滨对虾高盐胁迫存活时间、体长及体质量等描述性统计参数进行前期整理和初步分析。使用统计学软件Origin9.1进行单因素方差分析(ANOVA)和LSD多重比较和显著性检验(P < 0.05)。杂交群体的平均杂种优势H(%)依照下列公式计算:
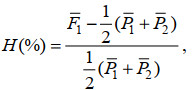 (1)
(1)式中, 

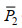
 (2)
(2)式中, yijk为第i个父本与第个j母本交配得到的第k尾虾的生长、耐高盐测量值, μ为总体均值, gi(gj)为第i(j)个群体的父本(母本)一般配合力, sij为第i、j个父本与母本杂交的特殊配合力, eijk为试验误差。
2 结果 2.1 生长和耐高盐性状的描述性统计量和多重比较凡纳滨对虾生长性状和耐高盐性状的描述性统计量见表 1。由表 1可知, 各交配组合体长、体质量、高盐耐受性的平均值分别为77.53 mm、5.31 g和61.82 h, 体质量变异系数为42.10%, 各交配组合间生长性状具有一定的选育空间。各交配组合在高盐胁迫环境下平均存活时间的范围为56.70~73.33 h, 变异系数为8.57%, 表明各交配组合耐高盐性状具有一定的改良潜力。
| 性状 | 均值 | 最小值 | 最大值 | 标准差 | 变异系数(%) |
| 体长(mm) | 77.53 | 33.77 | 105.88 | 11.70 | 15.09 |
| 体质量(g) | 5.31 | 0.51 | 14.53 | 2.24 | 42.10 |
| 高盐耐受性(h) | 61.82 | 56.70 | 73.33 | 5.30 | 8.57 |
凡纳滨对虾各交配组合间生长性状和耐高盐性状多重比较见表 2。部分组合的生长性状存在一定的差异, 其中Z♂×Z♀和P♂×XH♀组合体长、体质量均显著高于D♂×D♀和S♂×XH♀组合群体; S♂×S♀和P♂×XH♀组合高盐耐受性能显著高于XH♂×S♀、S♂×XH♀、D♂×XH♀、D♂×D♀四个群体, 研究结果表明P♂×XH♀组合的生长, 耐高盐性状表现值均较为突出。
| 配套组合 | 体长/mm | 体质量/g | 高盐耐受性/h |
| XH♂×XH♀ | 79.93±11.70ab | 5.65±2.28ab | 59.44±26.38bc |
| D♂×D♀ | 69.07±14.28d | 3.87±2.15d | 56.70±24.67c |
| Z♂×Z♀ | 82.55±11.64a | 6.33±2.23a | 60.80±32.57ab |
| S♂×S♀ | 78.42±11.95abc | 5.24±2.49ab | 70.57±26.82a |
| P♂×P♀ | 76.80±10.98bc | 5.21±2.17bc | 61.80±28.56ab |
| XH♂×D♀ | 78.76±9.83ab | 5.55±1.93ab | 60.51±28.33bc |
| XH♂×S♀ | 78.17±11.95ab | 5.47±2.24b | 59.02±28.66c |
| D♂×XH♀ | 78.73±11.95ab | 5.62±2.54ab | 57.87±29.06c |
| S♂×XH♀ | 74.81±9.90c | 4.60±1.79c | 58.18±26.39c |
| P♂×XH♀ | 80.80±5.54ab | 5.78±1.12ab | 73.33±25.24a |
| 注: 同列中不同上标字母表示差异显著(P < 0.05), 相同字母表示差异不显著(P > 0.05) | |||
凡纳滨对虾生长和耐高盐性状的一般配合力效应值(GCA)列于表 3。由表 3可知, 5个品系生长性状中检测到的一般配合力效应值较小, 表明在本实验条件下, 体长、体质量受特殊配合力的影响较大。对于耐高盐性状, 品系P和S的一般配合力效应值较高, 分别为0.83和0.53。
| 亲本群体 | 一般配合力 | ||
| 体长 | 体质量 | 高盐耐受性 | |
| XH | 4.14×10–6 | 1.74×10–6 | –0.49 |
| D | –7.87×10–6 | –3.81×10–6 | –0.83 |
| Z | 4.34×10–6 | 2.66×10–6 | –0.03 |
| S | –2.44×10–6 | –1.30×10–6 | 0.53 |
| P | 1.83×10–6 | 7.16×10–7 | 0.83 |
凡纳滨对虾10个交配组合生长和耐高盐性状的特殊配合力效应值(SCA)见表 4。配合力分析发现, 对于生长性状XH♂×D♀、XH♂×S♀、D♂×XH♀、P♂×XH♀四个杂交组合均检测到正向特殊配合力, 其中P♂×XH♀组合体长、体质量的特殊配合力最高, 其效应值分别为2.22和0.30。对于耐高盐性状, SCA值范围为–1.71~3.37, 多数交配组合检测到的特殊配合力为负值, 仅S♂×S♀和P♂×XH♀表现出正向特殊配合力, 其效应值为分别为3.37和2.67。
| 交配组合 | 特殊配合力 | ||
| 体长 | 体质量 | 高盐耐受性 | |
| XH♂×XH♀ | 1.97 | 0.26 | –0.61 |
| D♂×D♀ | –7.22 | –1.22 | –1.40 |
| Z♂×Z♀ | 3.48 | 0.69 | –0.09 |
| S♂×S♀ | 0.60 | 0.32 | 3.37 |
| P♂×P♀ | –0.75 | –0.12 | –0.09 |
| XH♂×D♀ | 0.94 | 0.17 | –0.10 |
| XH♂×S♀ | 0.42 | 0.02 | –0.82 |
| D♂×XH♀ | 0.91 | 0.24 | –1.21 |
| S♂×XH♀ | –2.56 | –0.66 | –1.71 |
| P♂×XH♀ | 2.22 | 0.30 | 2.67 |
凡纳滨对虾生长和耐高盐性状配合力的方差组分见表 5。生长性状一般配合力方差值较小, 占表型方差的比例分别为1.07×10–5%和3.04×10–5%; 特殊配合力方差值分别为10.95和0.37, 占表型方差比例分别为8.53%和7.86%。耐高盐性状一般配合力方差和特殊配合力方差数值分别为2.52和7.84, 占表型方差比例分别为0.33%和1.02%。
| 方差组分 | 数值 | ||
| 体长 | 体质量 | 高盐耐受性 | |
| 一般配合力方差(σGCA2) | 1.37×10–5 | 1.43×10–6 | 2.52 |
| 特殊配合力方差(σSCA2) | 10.95 | 0.37 | 7.84 |
| 表型方差(σp2) | 128.43 | 4.71 | 765.38 |
| 一般配合力方差比例(σGCA2/σp2) | (1.07×10–5)% | (3.04×10–5)% | 0.33% |
| 特殊配合力方差比例(σSCA2/σp2) | 8.53% | 7.86% | 1.02% |
材料中5个杂交组合的平均杂种优势率(H)见表 6。由表 6可知, 多数组合生长性状的平均杂种优势率为正值, 其中XH♂×D♀的体长平均杂种优势率最大为5.72%, D♂×XH♀的体质量平均杂种优势最大为18.07%。而S♂×XH♀组合的生长性状则表现出杂交劣势。对于耐高盐性状, XH♂×D♀和P♂×XH♀组合群体表现出不同程度的杂种优势, P♂×XH♀群体平均杂种优势率最高为20.97%; 其余三个杂交组合的高盐耐受性均表现出一定程度的杂交劣势。
| 杂交组合 | 平均杂种优势H/% | ||
| 体长 | 体质量 | 高盐耐受性 | |
| XH♂×D♀ | 5.72 | 16.60 | 4.20 |
| XH♂×S♀ | 1.26 | 0.46 | –9.21 |
| D♂×XH♀ | 5.68 | 18.07 | –0.34 |
| S♂×XH♀ | –5.51 | –19.23 | –10.50 |
| P♂×XH♀ | 3.11 | 6.45 | 20.97 |
盐度是凡纳滨对虾养殖水体中重要的理化因子, 虽然其耐盐范围较广, 但在非等渗环境下也会表现出应激状态(沈敏等, 2019)。应激对虾的生长存活和生理功能均会发生不同程度的变化(Jannathulla et al, 2019; Li et al, 2020)。我国高盐水资源丰富, 仅在辽东半岛、山东半岛沿岸的高盐水域面积就达到1300 km2 (刘永新等, 2016), 山东滨州部分区域已经开展凡纳滨对虾养殖实践, 且出产的高盐虾肉质、口感具有一定优势, 但其生长速度和总产量一直较低(朱芸, 2020)。因此, 通过人工选育的方法培育出高盐耐受性良好的凡纳滨对虾新品系可进一步提高存活率, 并有助于从遗传改良的角度解决其高盐水体中生长速度较慢的问题; 同时, 也有效拓宽对虾养殖业的发展空间, 对缓解淡水资源枯竭和改善盐碱水域生态也具有一定意义。
杂交育种是一种传统而高效的良种选育方法, 根据目标性状对原始材料进行恰当的选种交配, 可以掩盖有害基因效应, 使一些优质经济性状表现明显且稳定(楼允东, 2001)。在虾类育种过程中, 除杂种优势利用外, 性状之间的相关性也极为重要。生长与抗逆性状之间往往存在负相关(Argue et al, 2002), 在对这两个性状同时进行选择时, 家系选育可能无法获得明显的改良效果, 利用杂交育种的方式更为合适。本研究对10个亲本来源不同的凡纳滨对虾群体生长和高盐耐受性测试, 结果显示: 不同来源品系F1代群体的生长和高盐耐受性存在差异, 显示了凡纳滨对虾具有一定的遗传改良空间。杂交组合生长性状的平均杂种优势值几乎均为正向(–19.23%~18.07%)。国内外关于凡纳滨对虾生长性状杂种优势的研究报道较多, 发现杂交组合在生长性能普遍表现出杂种优势(Sui et al, 2016; Lu et al, 2017)。而对于耐高盐性状, XH♂×D♀和P♂×XH♀组合群体表现的杂种优势程度不同, P♂×XH♀群体平均杂种优势率最高为20.97%; 其余三个杂交组合的高盐耐受性均表现出一定程度的杂交劣势(–10.50%~–0.34%)。袁瑞鹏等(2015)比较不同群体凡纳滨对虾子一代的高氨氮和低溶氧耐受性, 也得出类似的结果。杂种优势是一种较复杂的遗传现象, 有研究表明, 不同遗传背景的亲本会分别富集不同位点的隐性有害基因, 如果杂交子代的亲本所提供染色体中的隐性有害基因, 恰好为等位基因, 那么杂交后代生长或抗逆性能衰退的概率就会上升(马大勇等, 2005)。因此, 杂交育种过程中的选配选种十分关键。
配合力分为一般配合力(GCA)与特殊配合力(SCA), 一般配合力是对可遗传的加性效应的测定, 特殊配合力代表的则是不可遗传的显性效应(朱军, 1994), 而显性效应值越大, 表明杂交效果越明显。关于凡纳滨对虾生长、存活(王浩等, 2013)、环境耐受力(胡志国等, 2016a, 2016b)等性状配合力分析已有报道。本研究对5个不同遗传背景凡纳滨对虾生长、高盐耐受性配合力进行分析, 旨在探讨利用其之间的特殊配合力, 将多个优良性状聚合利用的可行性。本文配合力分析结果表明, 生长性状的特殊配合力效应远高于一般配合力效应, 更容易受到特殊配合力的作用, 说明运用不同群体的凡纳滨对虾进行配套制种较易获得杂种优势。但正反交组合XH♂×S♀和S♂×XH♀特殊配合力效应值相反, 这一现象可能与母性效应、性别连锁效应相关(Bentsen et al, 1998), 水产动物杂交过程中, 此类现象也较为常见(Liu et al, 2019), Thoa等(2016)在尼罗罗非鱼(Oreochromis niloticus)中的研究也得出相似的结果。由于一般配合力是对加性效应的度量, 本研究中的5个凡纳滨对虾品系在多代选育的过程中, 纯合基因位点增加, 基因型趋近于纯合, 因此对于生长性状检测到的一般配合力较低, 而对于耐高盐性状的选择为首次开展, 具有较为丰富的遗传变异。已有报道表明, 一般配合力效应值高的群体杂交可以得到良好的杂交效果, 特殊配合力效应值也会较高(林明雪等, 2016)。本研究结果发现品系S和P耐高盐性状一般配合力效应值较高且为正, 分别为0.53和0.83, 表明其耐高盐性状存在丰富的加性遗传变异, 可通过家系内个体选择筛选出更多的亲虾进行留种, 用于下一代选育群体的建立。
通过对配合力、杂种优势分析得出, 这5个品系凡纳滨对虾进行配套利用是可行的。杂交组合P♂×XH♀三个性状的特殊配合力都较高, 且生长和耐高盐性状方面杂种优势明显, 因此笔者认为是最优杂交组合, 可作为进一步家系选育的候选材料, 加强该组合在选育方面的应用。研究结果为新品种开展配套制种提供了数据和材料基础, 也为凡纳滨对虾进一步良种选育提供了新的方向。
4 结论本研究利用统计学和混合线性模型分析了5个不同品系凡纳滨对虾之间生长及耐高盐性状的一般配合力和特殊配合力, 并在此基础上分析了5个杂交组合的平均杂种优势。结果显示: 对于生长性状, 5个品系中检测到的一般配合力效应值较低, 本研究中生长性状主要受特殊配合力的影响, Z♂×Z♀、P♂×XH♀ 2个组合生长性状的特殊配合力最高, 存在较强的非加性效应; 对于耐高盐性状, 品系P、S的一般配合力最高, P♂×XH♀、S♂×S♀ 2个组合耐高盐性状特殊配合力最高; P♂×XH♀组合在生长和耐高盐性状方面杂种优势明显, 可以考虑加强该组合在选育及生产方面的应用。
马大勇, 胡红浪, 孔杰. 2005. 近交及其对水产养殖的影响. 水产学报, 29(6): 849-856 |
王浩, 罗坤, 栾生, 等. 2013. 凡纳滨对虾多个引进群体的杂交配合力分析. 水产学报, 37(4): 489-495 |
王兴强, 马甡, 董双林. 2004. 凡纳滨对虾生物学及养殖生态学研究进展. 海洋湖沼通报, (4): 94-100 DOI:10.3969/j.issn.1003-6482.2004.04.016 |
孔杰, 栾生, 谭建, 等. 2020. 对虾选择育种研究进展. 中国海洋大学学报, 50(9): 81-97 |
朱军. 1994. 广义遗传模型与数量遗传分析新方法. 浙江农业大学学报, 20(6): 551-559 |
朱芸, 2020. 高盐养虾池塘的环境特性及温度、盐度对凡纳滨对虾生理特性的影响[D]. 上海: 上海海洋大学: 1-3.
|
刘永新, 方辉, 来琦芳, 等. 2016. 我国盐碱水渔业现状与发展对策. 中国工程科学, 18(3): 74-78 DOI:10.3969/j.issn.1009-1742.2016.03.013 |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2020. 中国渔业统计年鉴-2020. 北京: 中国农业出版社, 21-36
|
李娜, 赵玉超, 王仁杰, 等. 2018. 高盐胁迫对凡纳滨对虾消化及免疫相关酶活力的影响. 生态学报, 38(4): 1411-1417 |
李春玲, 王继苏, 裴秀艳, 等. 2009. 南美白对虾苗种盐化技术. 齐鲁渔业, 26(5): 32-33 |
沈敏, 赵玉超, 凌涛, 等. 2019. 高盐突变对凡纳滨对虾(Litopenaeus vannamei)生长性能及相关酶活力的影响. 海洋与湖沼, 50(1): 204-209 |
张晓娟, 周莉, 桂建芳. 2019. 遗传育种生物技术创新与水产养殖绿色发展. 中国科学: 生命科学, 49(11): 1409-1429 |
林明雪, 杨洁, 岳武成, 等. 2016. "吉富"系列罗非鱼生长性状的配合力、杂种优势与遗传相关分析. 南方水产科学, 12(2): 1-6 DOI:10.3969/j.issn.2095-0780.2016.02.001 |
周发林, 杨其彬, 姜松, 等. 2021. 斑节对虾3个种质群体体质量性状配合力及杂种优势分析. 南方水产科学, 17(1): 39-44 |
胡志国, 刘建勇, 袁瑞鹏, 等. 2016a. 3个凡纳滨对虾引进群体对温度和盐度耐受力的配合力分析. 海洋科学, 40(1): 25-31 |
胡志国, 刘建勇, 袁瑞鹏, 等. 2016b. 凡纳滨对虾高氨氮和低溶氧抗逆性状的杂交配合力分析. 南方水产科学, 12(1): 43-49 |
袁瑞鹏, 刘建勇, 张嘉晨, 等. 2015. 凡纳滨对虾群体杂交与自交F1低溶氧与高氨氮耐受性比较. 中国水产科学, 22(3): 410-417 |
董甜甜, 崔彦婷, 王忠凯, 等. 2020. 高盐胁迫对凡纳滨对虾(Litopenaeus vannamei)生长、代谢和抗氧化酶活力的影响. 海洋与湖沼, 51(5): 1239-1245 |
楼允东. 2001. 鱼类育种学. 北京: 中国农业出版社, 56-63
|
冀德伟, 胡利华, 闫茂仓, 等. 2018. 凡纳滨对虾野生群体F1与近交群体杂交和自交子代的抗逆、生长性状比较. 中国水产科学, 25(6): 1227-1235 |
魏磊, 朱书琴, 刘伟, 等. 2020. 鳜回交子代与亲本子代间体型和体斑特征比较. 南方水产科学, 16(2): 1-7 |
ARGUE B J, ARCE S M, LOTZ J M et al, 2002. Selective breeding of Pacific white shrimp (Litopenaeus vannamei) for growth and resistance to Taura Syndrome Virus. Aquaculture, 204(3/4): 447-460 |
BENTSEN H B, EKNATH A E, PALADA-DE VERA M S et al, 1998. Genetic improvement of farmed tilapias: growth performance in a complete diallel cross experiment with eight strains of Oreochromis niloticus. Aquaculture, 160(1/2): 145-173 |
CHEN J, LUO H, ZHAI Z Q et al, 2021. Estimates of additive and non-additive genetic effects on growth traits in a diallel cross of three strains of pearl oyster (Pinctada fucata). Aquaculture International, 29(3): 1359-1371 DOI:10.1007/s10499-021-00702-9 |
DE GRAVE S, ASHELBY C W, 2013. A re-appraisal of the systematic status of selected genera in Palaemoninae (Crustacea: Decapoda: Palaemonidae). Zootaxa, 3734(3): 331-344 DOI:10.11646/zootaxa.3734.3.3 |
GALLAGA-MALDONADO E P, MONTALDO H H, CASTILLO-JUÁREZ H et al, 2020. Crossbreeding effects for White Spot Disease resistance in challenge tests and field pond performance in Pacific white shrimp Litopenaeus vannamei involving susceptible and resistance lines. Aquaculture, 516: 734527 DOI:10.1016/j.aquaculture.2019.734527 |
HASAN M, TULLOCH R L, THOMSON P C et al, 2020. Meta-analysis of genetic parameters of production traits in cultured shrimp species. Fish and Fisheries, 21(6): 1150-1174 DOI:10.1111/faf.12495 |
JANNATHULLA R, CHITRA V, VASANTHAKUMAR D et al, 2019. Effect of dietary lipid/essential fatty acid level on Pacific whiteleg shrimp, Litopenaeus vannamei (Boone..1931) reared at three different water salinities-Emphasis on growth, hemolymph indices and body composition. Aquaculture, 513: 734405 DOI:10.1016/j.aquaculture.2019.734405 |
LI C, LI N, DONG T T et al, 2020. Analysis of differential gene expression in Litopenaeus vannamei under high salinity stress. Aquaculture Reports, 18: 100423 DOI:10.1016/j.aqrep.2020.100423 |
LIU F, LIU Y Y, CHU T Q et al, 2019. Interspecific hybridization and genetic characterization of Larimichthys polyactis (♀) and L. crocea (♂). Aquaculture International, 27(3): 663-674 DOI:10.1007/s10499-019-00353-x |
LU X, LUAN S, CAO B X et al, 2017. Heterosis and heritability estimates for the survival of the Pacific white shrimp (Litopenaeus vannamei) under the commercial scale ponds. Acta Oceanologica Sinica, 36(2): 62-68 DOI:10.1007/s13131-016-0942-6 |
LUO W, ZENG C, YI S K et al, 2014. Heterosis and combining ability evaluation for growth traits of blunt snout bream (Megalobrama amblycephala) when crossbreeding three strains. Chinese Science Bulletin, 59(9): 857-864 DOI:10.1007/s11434-014-0115-y |
PIFERRER F, BEAUMONT A, FALGUIÈRE J C et al, 2009. Polyploid fish and shellfish: production, biology and applications to aquaculture for performance improvement and genetic containment. Aquaculture, 293(3/4): 125-156 |
REN S J, MATHER P B, TANG B G et al, 2018. Levels of genetic diversity and inferred origins of Penaeus vannamei culture resources in China: implications for the production of a broad synthetic base population for genetic improvement. Aquaculture, 491: 221-231 DOI:10.1016/j.aquaculture.2018.03.036 |
REN S J, PRENTIS P, MATHER P B et al, 2020. Genetic parameters for growth and survival traits in a base population of Pacific white shrimp (Litopenaeus vannamei) developed from domesticated strains in China. Aquaculture, 523: 735148 DOI:10.1016/j.aquaculture.2020.735148 |
SUI J, LUAN S, LUO K et al, 2016. Genetic parameters and response to selection for harvest body weight of pacific white shrimp, Litopenaeus vannamei. Aquaculture Research, 47(9): 2795-2803 DOI:10.1111/are.12729 |
THANH N M, NGUYEN N H, PONZONI R W et al, 2010. Estimates of strain additive and non-additive genetic effects for growth traits in a diallel cross of three strains of giant freshwater prawn (Macrobrachium rosenbergii) in Vietnam. Aquaculture, 299(1/4): 30-36 |
THOA N P, NINH N H, HOA N T et al, 2016. Additive genetic and heterotic effects in a 4 × 4 complete diallel cross-population of Nile tilapia (Oreochromis niloticus, Linnaeus..1758) reared in different water temperature environments in Northern Vietnam. Aquaculture Research, 47(3): 708-720 DOI:10.1111/are.12530 |
VAN IN V, VAN SANG V, O'CONNOR W et al, 2017. Are strain genetic effect and heterosis expression altered with culture system and rearing environment in the Portuguese oyster (Crassostrea angulata)?. Aquaculture Research, 48(8): 4058-4069 DOI:10.1111/are.13227 |
XUE B B, SHEN B L, LI H et al, 2020. Heterosis analysis at early generations for complete diallel crosses in three different geographical culture populations of Sinonovacula constricta (Lamarck 1818) in Zhejiang, China. Aquaculture Research, 51(4): 1388-1397 DOI:10.1111/are.14484 |
 2022, Vol. 53
2022, Vol. 53


