中国海洋湖沼学会主办。
文章信息
- 陈静, 陆化杰, 王芮, 欧玉哲, 陈新军. 2022.
- CHEN Jing, LU Hua-Jie, WANG Rui, OU Yu-Zhe, CHEN Xin-Jun. 2022.
- 基于碳氮稳定同位素的西北印度洋鸢乌贼摄食习性研究
- FEEDING ECOLOGY OF STHENOTEUTHIS OUALANIENSIS BASED ON CARBON AND NITROGEN STABLE ISOTOPE ANALYSIS IN THE NORTHWEST INDIAN OCEAN
- 海洋与湖沼, 53(5): 1250-1257
- Oceanologia et Limnologia Sinica, 53(5): 1250-1257.
- http://dx.doi.org/10.11693/hyhz20220200044
文章历史
-
收稿日期:2022-02-28
收修改稿日期:2022-05-12
2. 自然资源部海洋生态监测与修复技术重点实验室 上海 201306;
3. 国家远洋渔业工程技术研究中心 上海海洋大学 上海 201306;
4. 农业农村部大洋渔业资源环境科学观测实验站 上海海洋大学 上海 201306
2. Key Laboratory of Marine Ecological Monitoring and Restoration Technologies, Ministry of Natural Resources, Shanghai 201306, China;
3. National Distant-water Fisheries Engineering Research Center, Shanghai Ocean University, Shanghai 201306, China;
4. Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China
鸢乌贼(Sthenoteuthis oualaniensis)广泛分布在印度洋、太平洋的赤道和亚热带海域, 在西北印度洋分布尤其广泛(叶旭昌等, 2004)。我国于2003年首次对西北印度洋鸢乌贼资源分布及渔场特征等进行了调查, 取得了良好效果。近几年西北印度洋鸢乌贼已经是我国头足类渔业重要的捕捞对象(邵锋等, 2008; 王洪浩等, 2021)。近年来稳定同位素技术逐渐成为生态学研究中的一种重要手段, 相对于传统胃含物分析法, 该方法局限性小, 并且可以对生物长期食性特征进行定量研究(Ibanez et al, 2008; 李云凯等, 2014)。生物体组织中的碳、氮稳定同位素可提供较长时间的摄食及物质能量传递等信息, 因此可以通过生物体硬组织连续取样对个体或种群一定时期内的摄食习性和栖息环境进行研究(Guerra et al, 2010; 陆化杰等, 2014a; Liu et al, 2018; 刘娜, 2020)。由几丁质和蛋白质分子构成的内壳结构具有从尾椎向头部生长的特性(Lorrain et al, 2011), 这一特性使其成为头足类整个生活史信息记录的良好载体(Cherel et al, 2009a), 可用于其渔业生物学的研究(Cherel et al, 2009b; Vander Zanden et al, 2010), 而且内壳结构具有形态稳定、易提取、研磨方便等优点, 越来越受到学者的关注(Lorrain et al, 2011; Queirós et al, 2019)。然而, 目前为止, 国内外尚没有利用内壳碳氮稳定同位素开展西北印度洋鸢乌贼摄食生态的研究。鉴于此, 本研究根据2019年3~5月中国灯光罩网渔船在西北印度洋生产调查期间采集的鸢乌贼样本, 对内壳叶轴进行连续切割, 对切割后各片段的碳、氮稳定同位素进行测定, 通过分析个体间的营养生态位关系和内壳片段上稳定同位素比值的连续序列, 探究鸢乌贼生长发育过程中摄食习性变化, 以期为后续利用内壳结构研究其摄食习性和种群特征等提供方法参考。
1 材料与方法 1.1 材料来源和生物学测定本研究样品采集于西北印度洋, 采集时间为2019年3~5月, 采集海域为西北印度洋13°12′~19°42′N、61°17~67°43′E, 共采集1 009尾样本, 样本经冷冻保存运回实验室。样本解冻后, 对其胴长(mantle length, ML)、体重(body weight, BW)等基础生物学数据进行测量, 对性别、性腺成熟度等进行目测和鉴定, 测量时胴长精确至0.1 cm, 体重精确至0.1 g。
 |
| 图 1 采样站点图 Fig. 1 The sampling stations |
考虑样本时空分布, 个体大小和性成熟等渔业生物学特性, 在不同采样时间和采样地点选取不同大小、性腺成熟度和不同性别的鸢乌贼样本各6尾作为研究对象, 分别标记为S1, S2, S3, …, S12, 解剖后取出内壳, 分别标记为G1, G2, G3, …, G12。使用超纯水对内壳进行清洗, 去除内壳表面残留的有机物质。从早期生长端沿着生长方向叶轴中线每2 cm进行标记分段(Li et al, 2017), 测量每段内壳距离近端的长度(以生长方向为正值), 按标记将其叶轴沿V型生长纹进行切段处理(图 2), 分段将处理的内壳片段放入冷冻干燥机, 在–50 ℃条件下冷冻干燥24 h, 使用混合型球磨仪将片段磨碎成粉末(Li et al, 2017)。
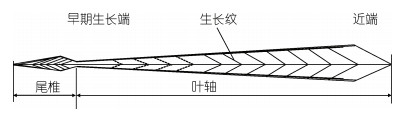 |
| 图 2 鸢乌贼内壳结构图 Fig. 2 The structure of S. oualaniensis gladius |
碳稳定同位素比值(δ13C)和氮稳定同位素比值(δ15N)的测定, 具体见文献(贡艺, 2015)。每12个样品中放入3个标准样以确保实验结果的精确度, 分析精度为0.05‰ (δ13C)和0.06‰ (δ15N) (Li et al, 2017)。稳定同位素测定在上海海洋大学稳定同位素分析实验室进行。
1.4 数据处理使用RStudio软件中的siar程序包计算δ13C-δ15N双位图中各凸多边形的面积(total area of convex hull, TA)和矫正标准椭圆面积(corrected the standard ellipse area, SEAc), 用来表示鸢乌贼的生态位宽幅和核心生态位, 并绘制出营养生态位图(汪惠琼等, 2020), 分析鸢乌贼不同个体之间的营养生态位关系; 对内壳片段稳定同位素序列进行分析, 对比分析雌、雄鸢乌贼群体间的差异, 并讨论其群体摄食情况。
2 结果与分析 2.1 样本组成本研究所选取的12尾鸢乌贼体重范围为311.9~ 479.5 g, 胴长范围为21.5~25.3 cm。具体基础生物学数据参见表 1。
| 编号 | 性别 | 体重/g | 胴长/cm | 内壳长/cm | 捕获日期(年.月.日) | 捕获地点 |
| S1 | M | 458.3 | 24.1 | 23.4 | 2019.03.22 | 62°30′E, 16°58′N |
| S2 | M | 468.2 | 24.6 | 25.0 | 2019.03.28 | 63°34′E, 16°45′N |
| S3 | M | 391.6 | 23.2 | 25.2 | 2019.04.07 | 63°17′E, 16°38′N |
| S4 | M | 368.7 | 22.2 | 22.7 | 2019.04.16 | 64°48′E, 19°44′N |
| S5 | M | 396.3 | 24.0 | 22.8 | 2019.04.22 | 61°42′E, 15°48′N |
| S6 | M | 438.8 | 22.3 | 24.5 | 2019.05.03 | 67°18′E, 15°13′N |
| S7 | F | 375.4 | 22.4 | 23.6 | 2019.04.07 | 63°17′E, 16°38′N |
| S8 | F | 327.6 | 21.5 | 20.6 | 2019.04.12 | 65°41′E, 14°52′N |
| S9 | F | 479.5 | 25.3 | 25.4 | 2019.04.22 | 61°42′E, 15°48′N |
| S10 | F | 311.9 | 22.3 | 21.8 | 2019.04.02 | 62°41′E, 17°12′N |
| S11 | F | 380.2 | 22.0 | 18.8 | 2019.05.03 | 67°18′E, 15°13′N |
| S12 | F | 334.5 | 22.1 | 22.8 | 2019.03.22 | 62°30′E, 16°58′N |
| 注: M: 雄性; F: 雌性 | ||||||
通过内壳片段稳定同位素分析, 结果显示内壳叶轴切割片段的δ13C变化范围为–18.70‰~ –17.42‰ (1.28‰); δ15N的变化范围为7.21‰~ 10.67‰ (3.46‰), 详见表 2。雄性个体δ13C值范围为–18.67‰~–17.24‰ (1.43‰), 雌性个体δ13C值范围为–18.70~–17.85‰ (0.85‰); 雌雄个体δ15N值变化范围相近, 雄性个体7.21‰~10.22‰ (3.01‰), 雌性个体7.37‰~10.67‰ (3.30‰), 雌、雄个体δ13C、δ15N平均值的变化趋势情况如图 3。方差分析(Analysis of variance, ANOVA)表明, 鸢乌贼雌、雄个体内壳δ13C不存在显著性差异(P > 0.05), δ15N存在显著性差异(P < 0.05)。
| 序号 | 分段数目 | δ13C/‰ | δ15N/‰ | |||||||
| 平均值 | 标准偏差 | 最大值 | 最小值 | 平均值 | 标准偏差 | 最大值 | 最小值 | |||
| G1 | 10 | –18.27 | 0.16 | –18.05 | –18.52 | 7.95 | 0.66 | 9.56 | 7.39 | |
| G2 | 10 | –17.97 | 0.13 | –17.82 | –18.26 | 7.87 | 0.83 | 9.66 | 7.21 | |
| G3 | 9 | –17.85 | 0.25 | –17.42 | –18.19 | 8.62 | 0.90 | 10.22 | 7.44 | |
| G4 | 9 | –18.23 | 0.17 | –18.05 | –18.58 | 8.79 | 0.37 | 9.39 | 8.25 | |
| G5 | 9 | –18.02 | 0.21 | –17.76 | –18.34 | 8.23 | 0.77 | 10.04 | 7.45 | |
| G6 | 10 | –18.32 | 0.19 | –18.00 | –18.67 | 8.82 | 0.68 | 9.47 | 7.56 | |
| G7 | 9 | –18.32 | 0.16 | –18.05 | –18.46 | 8.45 | 0.78 | 9.88 | 7.41 | |
| G8 | 8 | –18.31 | 0.23 | –17.99 | –18.64 | 8.66 | 0.61 | 10.12 | 8.37 | |
| G9 | 10 | –18.12 | 0.19 | –17.85 | –18.35 | 9.17 | 1.24 | 10.67 | 7.37 | |
| G10 | 9 | –18.12 | 0.14 | –17.97 | –18.38 | 9.11 | 0.35 | 10.11 | 9.13 | |
| G11 | 7 | –18.09 | 0.09 | –17.97 | –18.21 | 9.53 | 0.66 | 10.10 | 8.03 | |
| G12 | 9 | –18.36 | 0.22 | –18.07 | –18.70 | 9.01 | 0.51 | 9.81 | 8.05 | |
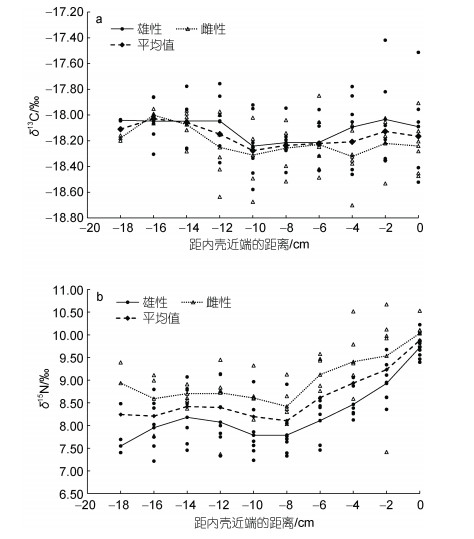 |
| 图 3 雌、雄个体δ13C、δ15N平均值的变化趋势 Fig. 3 The trend of the average values of δ13C and δ15N in females and males |
鸢乌贼内壳C、N稳定同位素分析结果可以反映个体间的营养生态位关系, 根据Hammerschlag-Peyer等(2011)提出的个体营养生态位变化研究框架, 以本研究中同位素测定结果数据绘制出营养生态位图(图 4, 图 5)。
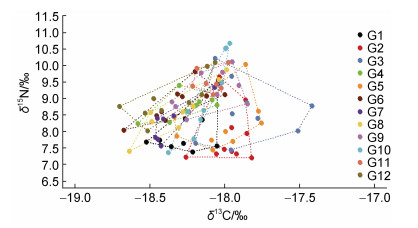 |
| 图 4 鸢乌贼个体间营养生态位的关系 Fig. 4 Relationships of trophic niche of S. oualaniensis among the individuals |
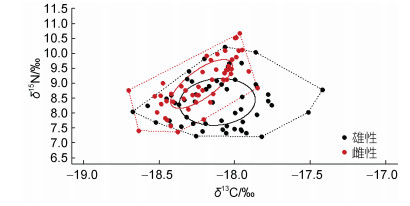 |
| 图 5 鸢乌贼雌性和雄性群体营养生态位的关系 Fig. 5 Relationship in trophic niche between females and males of S. oualaniensis |
结果显示, 12尾鸢乌贼的营养生态位均存在相互重叠的现象。雌性的生态位宽幅(TA)和核心生态位(SEAc)值分别为0.362‰和1.582‰; 雄性的TA和SEAc值分别为0.6152‰和2.352‰, 雄性群体的TA和SEAc值均大于雌性群体。
2.4 鸢乌贼生长对δ13C和δ15N的影响ANOVA分析表明, 雌、雄个体内壳叶轴生长对δ13C均没有显著影响(P > 0.05), 但雌、雄个体内壳叶轴生长对δ15N均有影响显著(F=2.84, P < 0.05; F=5.15, P < 0.05)。
δ13C值随着内壳长度的增加呈现稳定趋势, 而δ15N值前期上下波动较为平稳, 雌性个体在内壳长度生长到6 cm (内壳生长距近端–16 cm~–10 cm阶段)后δ15N值呈现持续增大的趋势, 当雄性个体内壳长度生长到8 cm (内壳生长距近端–18 cm~–10 cm阶段)后δ15N值逐渐升高(图 6)。δ15N的变化表明其摄食对象和栖息环境在一定时期内发生了变化。
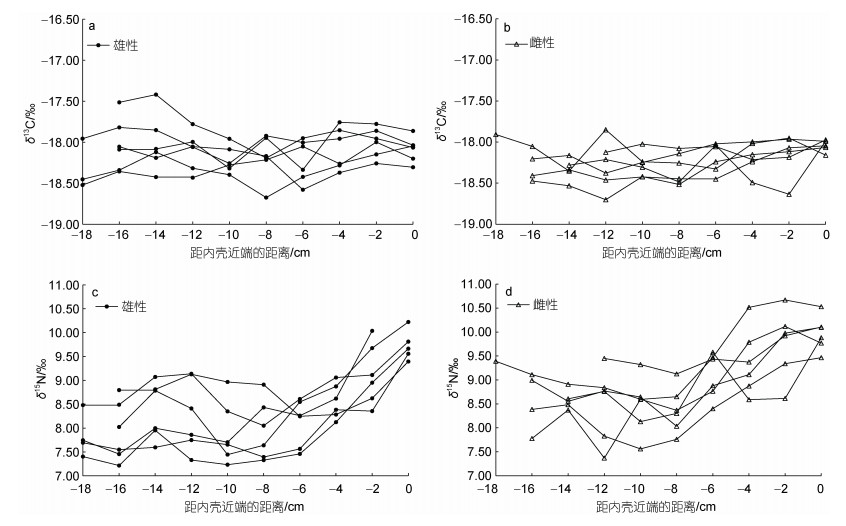 |
| 图 6 鸢乌贼个体碳、氮稳定同位素值随内壳长度的变化 Fig. 6 Variation in carbon and nitrogen stable isotopic values with gladius length |
生物体内C、N稳定同位素比值受到生物个体摄食和生活环境等的影响。δ15N在不同营养级间具有富集效应, 因此可用于指示生物在食物网中的营养层次(Deniro et al, 1981), δ13C则可以反映出摄食变化与栖息环境的改变(李忠义等, 2005), 多用于追溯生物栖息地和洄游模式。Ruiz-Cooley等(2012)分析了大洋性头足类肌肉δ13C值和δ15N值与纬度、离岸距离和胴长的关系, 结果表明δ13C值和δ15N值与个体生长和纬度变化无固定趋势, 但均随离岸距离增大而降低。通过对鸢乌贼内壳连续切割片段的碳、氮稳定同位素的分析, 可以了解鸢乌贼在不同生活时期的食性转变以及栖息地环境的变化情况(Perez et al, 1996; Ruiz-Cooley et al, 2010)。鸢乌贼洄游规律虽没有明确定论, 但相关研究表明, 在印度洋海域鸢乌贼个体大小随着纬度变化由南向北增长趋势显著(Nesis, 1977; 陈新军等, 2007)。在本研究中西北印度洋鸢乌贼在内壳生长长度 < 8 cm (内壳生长距近端–18 cm~–10 cm阶段)的范围内δ13C平均值变化范围介于–18.28‰~ –18.03‰ (0.25‰) (图 3), 且不同个体δ13C值的分散程度逐渐增大, 这表明鸢乌贼幼体在产卵场附近水域摄食, 随着个体的生长, 鸢乌贼行动能力增强, 其不同个体间活动和摄食方式有不同的选择; 随着个体继续生长, δ13C值也逐渐增加, 表明此时期个体开始趋向于近岸水域摄食, 随着个体增长鸢乌贼摄食对象发生了改变。与本研究结果相似, 在Merten等(2017)对翼柄柔鱼的研究中所有个体的δ13C值都大幅波动, 并在内壳长度达到20 cm后显著增加。操亮亮等(2022)对秘鲁公海茎柔鱼的研究中δ13C值也发现相似的变化趋势, 肌肉的δ13C值在胴长200~270 mm范围内显著减小, 胴长 > 270 mm后δ13C值升高, 表明其开始转向近岸海域摄食, 与本研究中鸢乌贼内壳δ13C值发生变化的时期有所不同, 这可能是由头足类不同群体间的生长差异造成的。
内壳片段中δ15N变化产生的原因主要是鸢乌贼食性发生改变, 另一原因是不同海域碳氮稳定同位素基线对鸢乌贼δ15N产生了影响。西北印度洋鸢乌贼内壳δ15N平均值在内壳长度 < 8 cm (内壳生长距近端–18 cm~–10 cm阶段)范围内变化很小, 表明早期幼体活动能力受限, 摄食对象结构单一; 随着内壳生长, δ15N平均值的变化范围介于8.10‰~9.88‰ (提升1.78‰), 鸢乌贼摄食能力随着个体的生长逐渐提高, 摄食更高营养层级的食物。有研究认为, 鸢乌贼生活前期多以甲壳类生物为食, 随着个体的生长而逐渐转向摄食营养级较高的鱼类和头足类(Rodhouse, 2005)。这一研究结果与鸢乌贼的生存策略相符, 即摄食方式由早期阶段随水流进行被动随机摄食逐渐转化为主动选择性的摄食(Stephens et al, 1986; Sajikumar et al, 2018), 这与谢嘉仪等(2021)对南沙海域鸢乌贼的营养级关系研究结论一致, 即随着个体的生长营养级大小出现明显增长的趋势。随着内壳长度的增加, δ15N值并没有趋于平稳, 仍有增长的趋势, 这可能与采样环境中营养物质有关, 也可能是鸢乌贼个体尚未达到最高的摄食水平, 鸢乌贼的垂直移动也可能对δ15N值产生影响。有研究提出, 在鸢乌贼胃组织中微塑料含量与年龄有显著的线性相关关系(陆化杰等, 2021a, 2022), 微塑料污染也可能对同位素测定产生影响, 后续可深入研究。
3.2 鸢乌贼营养生态位差异自然存在的碳、氮稳定同位素可以反映食物来源和食物网中的营养水平信息(Hobson et al, 1992; Peterson, 1999), 利用内壳各片段δ15N和δ13C值绘制出鸢乌贼的营养生态位图可以很直观地反映个体之间生态位关系(Hammerschlag-Peyer et al, 2011)。Fang等(2015)比较北太平洋东、西部的柔鱼群体角质颚中δ15N值, 发现两个群体的摄食生态位分散, 重叠很小。而在本研究中12尾鸢乌贼的生态位相互有不同程度的重叠, 即可能在其生活史过程中, 个体的食物和生活环境相似。对雌、雄个体生态位分析结果表明雌雄生态位发生重叠, 说明雌雄个体在不同阶段摄食对象的营养等级存在差异, 同时也可能存在群体间摄食竞争关系, 本研究与张宇美(2014)对南海鸢乌贼摄食习性的研究结果一致。通常生态位宽度越大表明其对空间食物资源的利用和对环境的适应能力越强, 本研究中雄性群体的TA和SEAc值均大于雌性群体, 表明雄性群体营养生态位宽幅较雌性群体范围更广, 陆化杰等(2014b)的研究中发现, 雄性样本明显少于雌性, 且雄性鸢乌贼个体较雌性个体偏小, 这些因素让雄性鸢乌贼在种内竞争中处于劣势, 因此雄性鸢乌贼需要拓宽生态位宽度以满足生存需求, 这一结果与谢嘉仪等(2021)对南沙海域鸢乌贼的研究结果一致。而Kato等(2016)在分析茎柔鱼稳定同位素时发现, 雌、雄茎柔鱼群体在摄食、洄游过程存在差异, 雄性个体在较狭窄的纬度范围内觅食, 与本研究中雄性群体占有更大的生态位恰好相反, 这可能与头足类不同种类间摄食习性差异有关, 也可能与采样季节和个体大小等有关, 后续还需要开展深入研究。
3.3 鸢乌贼生长对δ13C和δ15N的影响鸢乌贼摄取食物体内的营养物质, 其中部分蛋白质分子和几丁质构成了内壳的稳定结构(Perez et al, 1996; Ruiz-Cooley et al, 2010; 李云凯等, 2014)。有研究发现, 在海洋生态系统中海水温度、光照强度和海水中CO2浓度等差异会导致基线生物的δ13C和δ15N发生时空变化(Germain et al, 2013; Ruiz-Cooley et al, 2013), 营养转移对δ15N值的影响较为显著(Mariotti, 1983), 因此洄游与摄食以及生物自身的生长代谢等过程也会对生物体内C、N稳定同位素比值产生不同影响(Deniro et al, 1981)。本研究中δ13C值在雌、雄群体间无显著性差异, 可能是由于厄尔尼诺的影响, 特殊的气候条件不仅会对西北印度洋鸢乌贼生长产生影响(陆化杰等, 2020; 汪惠琼等, 2020; 陆化杰等, 2021b), 而且海水温度等条件对鸢乌贼活动和摄食空间范围也有限制, 使得鸢乌贼群体活动受限, 导致δ13C值在雌、雄群体间的差异不明显。内壳生长对δ15N影响显著(P < 0.05), 可能由于头足类随着胴长增加, 食性发生改变, 营养级提高导致的。雌性群体当内壳长度 > 6 cm (内壳生长距近端–16 cm~–10 cm阶段)时δ15N值逐渐增加, 表明此时摄食水平开始提高, 对食物的选择逐渐转向营养等级较高的物种, 这一结果与张宇美等(2013)的研究相同。δ15N值在雌性个体中明显高于雄性个体, 这表明雌、雄群体在对食物营养级的选择上有所不同, 雌性群体摄食等级高于雄性群体, 这可能是因为雌性个体在生长阶段和性腺发育过程中需要更多的能量累积。陆化杰等(2021b)的研究结果显示不同年间鸢乌贼胃饱满度雌性均高于雄性, 更多的营养获取利于雌性个体生长。张宇美等(2013)对南海鸢乌贼的研究结果也表明, 雌性个体摄食等级以3、4级为主, 雄性则以2、3级为主, 雌性群体摄食等级高于雄性群体, 且雌、雄个体摄食等级均随胴长的增加而增加, 这与本研究结果相同。结合何静茹等(2021)对西北印度洋海域鸢乌贼角质颚形态研究, 西北印度洋鸢乌贼雌性个体的角质颚结构明显大于雄性个体, 本研究中雌性群体内壳δ15平均值明显高于雄性个体, 也进一步说明了鸢乌贼雌性个体在摄食能力和摄食水平上高于雄性个体。摄食营养层级的不同也可能与雌雄个体采样时间和采样位置不同有关, 在后续研究中将会深入探讨。
4 结语关于鸢乌贼生物学的研究多基于耳石、角质颚等硬组织结构展开, 到目前为止基于鸢乌贼内壳的研究少有报告。本研究通过对西北印度洋鸢乌贼内壳连续切段, 进行碳氮稳定同位素测定, 以定量的方法对鸢乌贼生长过程中食性转换及洄游展开初步研究, 弥补了传统胃含物研究方法的局限, 并进一步说明该方法在头足类摄食及洄游方向研究的可行性。本研究受采样时空跨度影响及缺少年龄数据, 仅反映出了鸢乌贼生活史过程中摄食和洄游的变化的大致时期, 下一步研究中可以对西北印度洋不同海域和不同季节鸢乌贼, 结合年龄数据对鸢乌贼摄食变化与洄游路径等信息进一步探索。
王洪浩, 何涛, 陆化杰, 等, 2021. 性成熟和个体大小对西北印度洋鸢乌贼耳石形态的影响. 水产学报, 45(8): 1350-1360 |
叶旭昌, 陈新军, 2004. 印度洋西北海域鸢乌贼生物学特性初步研究. 上海水产大学学报, 13(4): 316-322 |
刘娜, 2020. 赤道茎柔鱼不同组织稳定同位素分析[D]. 上海: 上海海洋大学: 16-18.
|
贡艺, 2015. 基于内壳稳定同位素信息的秘鲁外海茎柔鱼摄食与洄游研究[D]. 上海: 上海海洋大学: 25-28.
|
李云凯, 贡艺, 陈新军, 2014. 稳定同位素技术在头足类摄食生态学研究中的应用. 应用生态学报, 25(5): 1541-1546 |
李忠义, 金显仕, 庄志猛, 等, 2005. 稳定同位素技术在水域生态系统研究中的应用. 生态学报, 25(11): 3052-3060 DOI:10.3321/j.issn:1000-0933.2005.11.036 |
何静茹, 陆化杰, 陈炫妤, 等, 2021. 西北印度洋鸢乌贼角质颚外形变化的影响因素. 应用生态学报, 32(5): 1881-1889 |
汪惠琼, 陈洁南, 李云凯, 等, 2020. 厄尔尼诺对柔鱼亚科近缘种茎柔鱼与鸢乌贼营养生态位的影响. 海洋渔业, 42(5): 524-532 DOI:10.3969/j.issn.1004-2490.2020.05.002 |
张宇美, 2014. 基于碳氮稳定同位素的南海鸢乌贼摄食生态与营养级研究[D]. 湛江: 广东海洋大学: 23-29.
|
张宇美, 颜云榕, 卢伙胜, 等, 2013. 西沙群岛海域鸢乌贼摄食与繁殖生物学初步研究. 广东海洋大学学报, 33(3): 56-64 DOI:10.3969/j.issn.1673-9159.2013.03.010 |
陆化杰, 王从军, 陈新军, 2014b. 4-6月东太平洋赤道公海鸢乌贼生物学特性初步研究. 上海海洋大学学报, 23(3): 441-447 |
陆化杰, 王洪浩, 刘凯, 等, 2020. 厄尔尼诺发生期冬春季西北印度洋鸢乌贼耳石外形生长特性. 生态学杂志, 39(11): 3694-3703 |
陆化杰, 宁欣, 刘维, 等, 2021b. 不同气候条件下南海西沙海域鸢乌贼(Sthenoteuthis oualaniensis)渔业生物学比较研究. 海洋与湖沼, 52(4): 1029-1038 |
陆化杰, 刘凯, 陈子越, 等, 2022. 南海西沙群岛海域鸢乌贼Sthenoteuthis oualaniensis胃组织微塑料沉积特性研究. 海洋与湖沼, 53(1): 187-194 |
陆化杰, 刘凯, 欧玉哲, 等, 2021a. 微塑料染污及其对不同栖息地、不同食性海洋鱼类影响的研究进展. 水产学报, 45(12): 2099-2111 |
陆化杰, 陈新军, 马金, 2014a. 西北太平洋柔鱼耳石微量元素. 应用生态学报, 25(8): 2411-2417 |
陈新军, 刘金立, 2007. 利用形态学方法分析印度洋西北部海域鸢乌贼种群结构. 上海水产大学学报, 16(2): 174-179 |
邵锋, 陈新军, 2008. 印度洋西北海域鸢乌贼渔场分布与海面高度的关系. 海洋科学, 32(11): 88-92 |
谢嘉仪, 张丽姿, 吴文秀, 等, 2021. 南沙群岛海域鸢乌贼摄食习性与营养生态位. 水产学报, 45(12): 1993-2002 |
操亮亮, 刘必林, 李建华, 2022. 基于稳定同位素技术的东南太平洋公海茎柔鱼摄食生态分析. 大连海洋大学学报, 37(1): 120-128 |
CHEREL Y, FONTAINE C, JACKSON G D, et al, 2009a. Tissue, ontogenic and sex-related differences in δ13C and δ15N values of the oceanic squid Todarodes filippovae (Cephalopoda: Ommastrephidae). Marine Biology, 156(4): 699-708 DOI:10.1007/s00227-008-1121-x |
CHEREL Y, KERNALÉGUEN L, RICHARD P, et al, 2009b. Whisker isotopic signature depicts migration patterns and multi-year intra- and inter-individual foraging strategies in fur seals. Biology Letters, 5(6): 830-832 DOI:10.1098/rsbl.2009.0552 |
DENIRO M J, EPSTEIN S, 1981. Influence of diet on the distribution of nitrogen isotopes in animals. Geochimica et Cosmochimica Acta, 45(3): 341-351 DOI:10.1016/0016-7037(81)90244-1 |
FANG Z, XU L L, CHEN X J, et al, 2015. Beak growth pattern of purpleback flying squid Sthenoteuthis oualaniensis in the eastern tropical Pacific equatorial waters. Fisheries Science, 81(3): 443-452 DOI:10.1007/s12562-015-0857-8 |
GERMAIN L R, KOCH P L, HARVEY J, et al, 2013. Nitrogen isotope fractionation in amino acids from harbor seals: implications for compound-specific trophic position calculations. Marine Ecology Progress Series, 482: 265-277 DOI:10.3354/meps10257 |
GUERRA Á, Rodríguez-NAVARRO A B, GONZÁLEZ Á F, et al, 2010. Life-history traits of the giant squid Architeuthis dux revealed from stable isotope signatures recorded in beaks. ICES Journal of Marine Science, 67(7): 1425-1431 DOI:10.1093/icesjms/fsq091 |
HAMMERSCHLAG-PEYER C M, YEAGER L A, ARAÚJO M S, et al, 2011. A hypothesis-testing framework for studies investigating ontogenetic niche shifts using stable isotope ratios. PLoS One, 6(11): e27104 DOI:10.1371/journal.pone.0027104 |
HOBSON K A, WELCH H E, 1992. Determination of trophic relationships within a high arctic marine food web using δ13C and δ15N analysis. Marine Ecology Progress Series, 84: 9-18 DOI:10.3354/meps084009 |
IBANEZ C M, ARANCIBIA H, CUBILLOS L A, 2008. Biases in determining the diet of jumbo squid Dosidicus gigas (D'Orbigny 1835) (Cephalopoda: Ommastrephidae) off southern-central Chile (34°S-40°S). Helgoland Marine Research, 62: 331 DOI:10.1007/s10152-008-0120-0 |
KATO Y, SAKAI M, NISHIKAWA H, et al, 2016. Stable isotope analysis of the gladius to investigate migration and trophic patterns of the neon flying squid (Ommastrephes bartramii). Fisheries Research, 173: 169-174 DOI:10.1016/j.fishres.2015.09.016 |
LI Y K, GONG Y, ZHANG Y Y, et al, 2017. Inter-annual variability in trophic patterns of jumbo squid (Dosidicus gigas) off the exclusive economic zone of Peru, implications from stable isotope values in gladius. Fisheries Research, 187: 22-30 DOI:10.1016/j.fishres.2016.11.005 |
LIU B L, LIN J Y, CHEN X J, et al, 2018. Inter- and intra-regional patterns of stable isotopes in Dosidicus gigas beaks: biological, geographical and environmental effects. Marine and Freshwater Research, 69(3): 464-472 DOI:10.1071/MF17144 |
LORRAIN A, ARGÜELLES J, ALEGRE A, et al, 2011. Sequential isotopic signature along gladius highlights contrasted individual foraging strategies of jumbo squid (Dosidicus gigas). PLoS One, 6(7): e22194 DOI:10.1371/journal.pone.0022194 |
MARIOTTI A, 1983. Atmospheric nitrogen is a reliable standard for natural 15N abundance measurements. Nature, 303(5919): 685-687 DOI:10.1038/303685a0 |
MERTEN V, CHRISTIANSEN B, JAVIDPOUR J, et al, 2017. Diet and stable isotope analyses reveal the feeding ecology of the orangeback squid Sthenoteuthis pteropus (Steenstrup 1855) (Mollusca, Ommastrephidae) in the eastern tropical Atlantic. PLoS One, 12(12): e0189691 DOI:10.1371/journal.pone.0189691 |
NESIS K N, 1977. Population structure of the squid Sthenoteuthis oualaniensis (Lesson, 1830) in the tropical West Pacific. Trudy IOAN SSSR, 107: 15-29 |
PEREZ J A A, O'DOR R K, BECK P, et al, 1996. Evaluation of gladius dorsal surface structure for age and growth studies of the short-finned squid, Illex illecebrosus (Teuthoidea: Ommastrephidae). Canadian Journal of Fisheries and Aquatic Sciences, 53(12): 2837-2846 |
PETERSON B J, 1999. Stable isotopes as tracers of organic matter input and transfer in benthic food webs: a review. Acta Oecologica, 20(4): 479-487 DOI:10.1016/S1146-609X(99)00120-4 |
QUEIRÓS J P, PHILLIPS R A, BAETA A, et al, 2019. Habitat, trophic levels and migration patterns of the short-finned squid Illex argentinus from stable isotope analysis of beak regions. Polar Biology, 42(12): 2299-2304 DOI:10.1007/s00300-019-02598-x |
RODHOUSE P G, 2005. C2. World squid resources. Review of the State of World Marine Fisheries, 5: 175-187 |
RUIZ-COOLEY R I, BALLANCE L T, MCCARTHY M D, 2013. Range expansion of the jumbo squid in the NE Pacific: δ15N decrypts multiple origins, migration and habitat use. PLoS One, 8(3): e59651 DOI:10.1371/journal.pone.0059651 |
RUIZ-COOLEY R I, GERRODETTE T, 2012. Tracking large-scale latitudinal patterns of δ13C and δ15N along the E Pacific using epi-mesopelagic squid as indicators. Ecosphere, 3(7): 1-17 |
RUIZ-COOLEY R I, VILLA E C, GOULD W R, 2010. Ontogenetic variation of δ13C and δ15N recorded in the gladius of the jumbo squid Dosidicus gigas: Geographic differences. Marine Ecology Progress Series, 399: 187-198 DOI:10.3354/meps08383 |
SAJIKUMAR K K, RAGESH N, VENKATESAN V, et al, 2018. Morphological development and distribution of paralarvae and juveniles of purpleback flying squid Sthenoteuthis Oualaniensis (Ommastrephidae), in the Southeastern Arabian Sea. Vie et Milieu - Life and Environment, 68(2/3): 75-86 |
STEPHENS D W, KREBS J R, 1986. Foraging Theory. Princeton: Princeton University Press, 22-24
|
VANDER ZANDEN H B, BJORNDAL K A, REICH K J, et al, 2010. Individual specialists in a generalist population: Results from a long-term stable isotope series. Biology Letters, 6(5): 711-714 DOI:10.1098/rsbl.2010.0124 |
 2022, Vol. 53
2022, Vol. 53


