中国海洋湖沼学会主办。
文章信息
- 杨娜, 花传祥, 朱清澄, 胡贯宇, 梁佳伟. 2023.
- YANG Na, HUA Chuan-Xiang, ZHU Qing-Cheng, HU Guan-Yu, LIANG Jia-Wei. 2023.
- 西北太平洋公海秋刀鱼碳、氮稳定同位素特征研究
- CHARACTERISTICS OF CARBON AND NITROGEN STABLE ISOTOPE OF PACIFIC SAURY IN THE NORTHWEST PACIFIC HIGH SEAS
- 海洋与湖沼, 54(2): 412-423
- Oceanologia et Limnologia Sinica, 54(2): 412-423.
- http://dx.doi.org/10.11693/hyhz20220700189
文章历史
-
收稿日期:2022-07-19
收修改稿日期:2022-09-29
2. 国家远洋渔业工程技术研究中心 上海 201306;
3. 大洋渔业资源可持续开发教育部重点实验室 上海 201306
2. National Distant-water Fisheries Engineering Research Center, Shanghai Ocean University, Shanghai 201306, China;
3. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education; Shanghai Ocean University, Shanghai 201306, China
秋刀鱼(Cololabis saira)隶属颌针鱼亚目(Belonoidei)竹刀鱼科(Scomberesocidae)秋刀鱼属(Cololabis), 是一种广泛分布于西北太平洋的小型中上层鱼类(Hubbs et al, 1980; Tian et al, 2003), 属于大洋性高度洄游物种, 是中国、日本、俄罗斯、韩国和瓦努阿图等国家和地区重要的渔业捕捞鱼种之一(花传祥等, 2019), 被北太平洋渔业管理委员会(the North Pacific Fisheries Commission, NPFC)列为优先管理对象(https://www.npfc.int/)。秋刀鱼的生命周期一般为2 a, 冬季, 秋刀鱼在黑潮海域产卵, 春季, 幼鱼和部分成鱼开始向北洄游并在夏季到达亲潮海域, 在该海域摄食水平较高(Ito et al, 1979; 张孝民等, 2015; 花传祥等, 2017)。已有研究表明, 秋刀鱼主要摄食对象有桡足类、磷虾、毛颚类、端足类等浮游生物(Sugisaki et al, 2004; Miyamoto et al, 2020), 同时也是一些大型鱼类[如鲸鱼(Mitani et al, 2006)、海鸟(Minami et al, 1995)]等的捕食对象, 在生态系统中起着承上启下的作用, 因此, 开展秋刀鱼摄食生态学研究具有重要的意义。
稳定同位素技术是生物摄食生态学研究的重要方法, 主要利用生物体中天然存在的重稳定同位素与轻稳定同位素之比(如14C/13C、15N/14N)来获取关于生物摄食以及营养关系的信息, 可以反映数周至数月的摄食信息(Wada et al, 1987; Hobson et al, 1992; Voigt et al, 2003)。生物体内的δ13C在营养级之间的富集度很低, 大约在0~1‰, 因此可以用来分析食物来源(Deniro et al, 1978); 而δ15N在生物体内逐级积累(3‰~4‰), 因此可用来分析生物所处的营养层次(Post, 2002)。由于生物组织中的稳定同位素来源于其所经过的所有营养途径, 提供了关于生物的食物来源以及栖息地等信息, 因此可以作为表征营养生态位的一种手段(Newsome et al, 2007)。
Fuji等(2021)分析了0龄和1龄秋刀鱼样本的δ13C值、δ15N值的地理分布, 表明170°W以东和以西海域的秋刀鱼处于两种生态系统。在西北太平洋公海海域, 秋刀鱼渔场主要集中在35°~47.5°N、140°~ 165°E之间(花传祥等, 2019), 该海域主要受亲潮延伸区以及西北亚北极环流的影响(Qiu et al, 2017), 其中亲潮延伸区(Oyashio Extension, OE; 38°~43°N、145°~173°E)处于亚热带和亚北极环流之间, 具有高温、高盐的特点, 浮游生物丰度较高(Wu et al, 2019; 张武昌等, 2021); 西北亚北极环流海区(western subarctic gyre, WSG; 43°~50°N、150°~170°E)由阿拉斯加暖流向西流动而成, 具有低温、低叶绿素浓度的特征, 该海区浮游生物丰度较低(Sakurai, 2007; Qiu et al, 2017)。分析秋刀鱼样本在两个海域间的稳定同位素差异, 有助于了解秋刀鱼在不同海洋环境中的摄食生态特征。另外, 有些鱼类(如鳀鱼、日本金线鱼等)在生长发育过程中存在食性转变的现象(郭旭鹏等, 2007; 王锦溪等, 2021), 且雌雄间对食物的利用策略也存在差异(Lin et al, 2015), 因此, 分析雌雄间及各体长组间的秋刀鱼样本稳定同位素差异, 有助于了解秋刀鱼各生活史阶段的食性变化及营养结构特征。
为此, 本文通过稳定同位素技术, 分析西北太平洋公海秋刀鱼雌雄体、各体长组及海区间的碳、氮稳定同位素和生态位特征, 以期为研究秋刀鱼在各生活史阶段、栖息海域等的摄食生态学提供参考。
1 材料与方法 1.1 样品来源采样调查船为蓬莱京鲁渔业有限公司所属“鲁蓬远渔027”生产船, 采样时间为2018年7~12月, 采样地点为西北太平洋公海海域(40°00′~49°00′N、150°00′~ 164°30′E)。采集秋刀鱼样本126尾, 采样记录包括日期、经度、纬度等(图 1)。
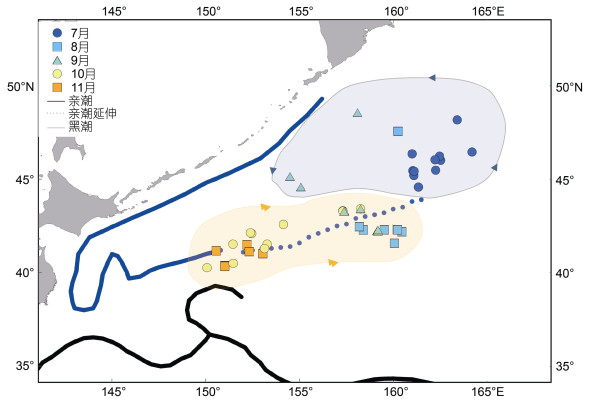 |
| 图 1 西北太平洋公海秋刀鱼采样站点 Fig. 1 Sampling stations of Pacific saury in the Northwest Pacific Ocean 注: 橙色阴影是亲潮延伸海域, 蓝色阴影是亚北极环流海域(Qiu et al, 2017), 箭头代表环流走向 |
分别测定秋刀鱼样本的雌雄、体长等基础生物学参数, 体长精确到1 mm。经测定, 雌性个体样本37尾, 雄性个体样本89尾; 样本体长范围在253~307 mm之间, 本文以10 mm为组距, 将样本分为6个体长组。
1.2.2 稳定同位素测定将秋刀鱼腹部肌肉用纯净水冲洗干净后放入冷冻干燥机, 在−55℃的真空状态下冷冻干燥24 h; 使用MM400冷冻混合型球磨仪将冻干的秋刀鱼肌肉组织研磨成粉末; 由于秋刀鱼样品的脂肪含量较高(叶彬清等, 2013), 因此使用氯甲烷︰甲醇(2︰1)溶液对研磨后的粉末进行脱脂处理(Post et al, 2007); 用微分天平称取1 mg的粉末并包于锡舟中, 然后放入Sercon Integra2型元素分析-稳定同位素比值质谱联用仪(elementary analysis-isotope ratio mass spectrometers, EA-IRMS), 分别测定脱脂样品的碳、氮稳定同位素比值, 用‰表示。
EA-IRMS分析样品时采用公式(1)计算δ13C值、δ15N值(Wada et al, 1987):
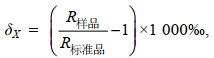 (1)
(1)其中, δX代表δ13C值或δ15N值, R样品代表所测样品的碳、氮稳定同位素比值, 其中, 碳稳定同位素比值为13C/12C、氮稳定同位素比值为15N/14N; R标准品为标准品的碳、氮稳定同位素比值, 其中, 碳稳定同位素标准品为箭石(Pee Dee Belemnite, PDB)、氮稳定同位素标准品为大气中的氮气(N2)。为了保证测定结果的可靠性, 每测定12个样品后, 加测两个标准品。
1.3 数据预处理 1.3.1 采样渔区划分本文将1°×1°定义为一个渔区, 并按渔区统计δ13C值、δ15N值。
1.3.2 营养结构参数计算本文用于分析的营养结构参数包括: (1) δ13C范围(δ13C Range, CR)指秋刀鱼δ13C最高值与最低值之差, 反映基础食物来源的多样性(Layman et al, 2007); (2) δ15N范围(δ15N Range, NR)指秋刀鱼δ15N最高值与最低值之差, 反映摄食的营养长度(Layman et al, 2007); (3) 总生态位(total area of convex hull, TA)为δ13C-δ15N散点图中最外围点围成的凸多边形面积, 反映物种对资源利用能力的强弱(Layman et al, 2007); (4) 核心生态位(standard ellipse area, SEA)为δ13C-δ15N散点图中所有点围成的标准椭圆面积, SEAc为矫正后的标准椭圆面积, 可减少样本数量对结果的影响(Jackson et al, 2011)。
使用R软件中的SIBER (stable isotope Bayesian ellipses in R)包(Jackson et al, 2011)分别计算雌雄样本、各体长组样本、各海域样本的TA、SEAc、SEAc重叠率和SEAc重叠面积。
1.3.3 营养级计算营养级LT按公式(2)进行计算(Minagawa et al, 1984):
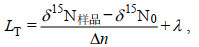 (2)
(2)其中, δ15N样品代表所测样品的δ15N值, δ15N0代表基线生物的δ15N值, 本研究选取西北太平洋海域常年存在且稳定、食性较简单的初级消费者桡足类N. cristatus作为基线生物, 由于缺乏对浮游动物稳定同位素直接测定的数值, 因此OE海域δ15N0参考值为6.3‰ (Aita et al, 2011), WSG海域δ15N0参考值为6.0‰ (Kobari et al, 2022)。λ代表生态系统基线生物的营养级, 本研究取值为2.3 (Gorbatenko, et al, 2014)。Δn代表δ15N在每级营养级之间的判别值, 本研究选取3.4‰作为判别值(Minagawa et al, 1984)。
1.4 数据分析 1.4.1 差异性分析统计分析雌雄样本间、各体长组样本间、各海域样本间的δ13C值、δ15N值、营养级等分布特征, 并使用单因素方差分析(one-way analysis of variance, ANOVA)进行显著性差异检验(α=0.05)。
1.4.2 相关性分析使用广义可加模型(generalized additive model, GAM)分别对样本δ13C值、δ15N值、营养级与体长、经度、纬度进行建模, 分析其变化趋势, GAM模型为
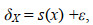 (3)
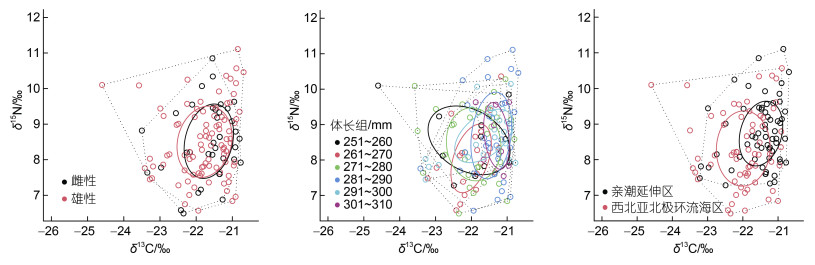
(3)其中, δX为因变量(δ13C值、δ15N值或营养级); x为解释变量(体长、经度或纬度), ε为残差。
1.4.3 聚类分析根据δ13C值、δ15N值和标准化的欧氏距离方法, 使用R软件中的hclust函数分别对各体长组样本间、各渔区样本间进行聚类分析; 使用ANOVA对聚类分析结果进行显著性差异检验(α=0.05)。
2 结果 2.1 雌雄间分布特征全部样本δ13C均值为−21.74‰ (σ=0.73‰), CR为3.91‰; 雌性样本δ13C均值为−21.67‰ (σ=0.73‰), CR为2.7‰; 雄性样本δ13C均值为−21.77‰ (σ=0.73‰), CR为3.91‰ (表 1); 雌、雄样本之间的δ13C值无显著性差异(P > 0.05)。
| 分类标准 | 样本量/个 | 体长范围/mm | 平均体长/mm | δ13C/‰ | δ15N/‰ | CR/‰ | NR/‰ | SEAc/‰2 | TA/‰2 | 营养级 | |
| 性别 | 雌性 | 37 | 260~306 | 281.05±11.92 | −21.67±0.73 | 8.79±1.00 | 2.70 | 4.53 | 2.18 | 7.72 | 3.08 |
| 雄性 | 89 | 244~303 | 280.44±13.10 | −21.77±0.73 | 8.41±0.99 | 3.91 | 4.08 | 2.37 | 11.72 | 2.97 | |
| 体长组 | 251~260 mm | 12 | 253~260 | 258.17±3.02 | −22.01±1.01 | 8.49±0.87 | 3.66 | 2.82 | 3.31 | 6.36 | 2.99 |
| 261~270 mm | 20 | 264~270 | 267.10±2.10 | −22.01±0.53 | 8.05±0.92 | 2.05 | 3.78 | 1.54 | 4.46 | 2.88 | |
| 271~280 mm | 31 | 271~280 | 276.42±3.08 | −21.94±0.74 | 8.44±0.99 | 2.78 | 3.79 | 2.46 | 8.53 | 2.99 | |
| 281~290 mm | 32 | 281~290 | 285.41±2.70 | −21.46±0.55 | 8.75±1.16 | 2.73 | 4.54 | 2.13 | 7.83 | 3.06 | |
| 291~300 mm | 23 | 291~300 | 295.30±2.42 | −21.65±0.78 | 8.68±0.72 | 2.51 | 2.70 | 1.69 | 4.42 | 3.02 | |
| 301~310 mm | 8 | 301~307 | 303.88±2.03 | −21.30±0.31 | 8.68±0.81 | 0.93 | 2.08 | 1.01 | 1.49 | 3.02 | |
| 海域 | OE | 62 | 244~306 | 283.82±12.78 | −21.49±0.73 | 8.74±1.00 | 2.53 | 3.83 | 1.71 | 7.22 | 3.02 |
| WSG | 64 | 260~307 | 277.52±12.03 | −21.99±0.73 | 8.31±1.00 | 3.71 | 4.08 | 2.53 | 10.41 | 2.98 | |
| 总体 | 126 | 251~307 | 280.62±13.10 | −21.74±0.73 | 8.51±1.00 | 3.91 | 4.62 | 2.27 | 12.02 | 3.00 |
全部样本δ15N均值为8.51‰ (σ=1.00‰), NR为4.62‰; 雌性样本δ15N均值为8.79‰ (σ=1.00‰), NR为4.53‰; 雄性样本δ15N均值为8.41‰ (σ=1.00‰), NR为4.08‰ (表 1); 雌、雄样本之间的δ15N值无显著性差异(P > 0.05)。
全部样本营养级范围在2.44~3.71之间, 平均值为3.00 (σ=0.29); 雌性样本营养级范围为2.47~3.71之间, 平均值为3.08 (σ=0.29); 雄性样本营养级范围在2.44~3.64之间, 平均值为2.97 (σ=0.29) (表 1)。雌、雄样本之间的营养级无显著性差异(P > 0.05)。
雄性样本的TA、SEAc均高于雌性(图 2); 雌、雄样本间的SEAc重叠率为0.81, SEAc重叠面积分别占雌性样本和雄性样本的93.12%和85.73%。
 |
| 图 2 秋刀鱼TA、SEAc构建图 Fig. 2 TA and SEAc based on δ13C and δ15N values of Pacific saury 注: 图中虚线部分表示总营养生态位(TA), 实线部分表示核心生态位(SEAc) |
样本δ13C值在301~310 mm体长组间最大, 在251~260 mm体长组间最小。δ13C值在体长组之间存在显著性差异(P < 0.05), 其中, 体长组小于280 mm的样本与280~290 mm体长组以及301~310 mm体长组样本之间存在显著性差异(P < 0.05), 其余体长组间不存在显著性差异(P > 0.05)(表 2); δ13C值与体长可完成GAM模型拟合(P < 0.05), δ13C值随体长增加而增大(图 3a); CR在251~260 mm体长组间最大, 在301~310 mm体长组间最小, 除261~270 mm体长组外, CR在体长组间整体呈降低的趋势(表 1)。
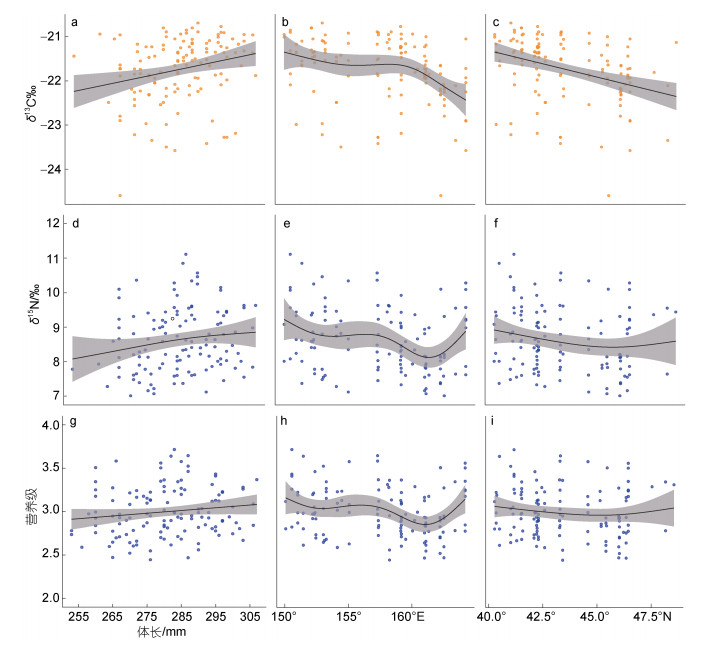 |
| 图 3 体长和经纬度对秋刀鱼δ13C值、δ15N值和营养级的影响 Fig. 3 Effects of length, longitude, and latitude on δ13C, δ15N, and trophic level of Pacific saury 注: 图中点为δ13C值、δ15N值在不同体长组、经纬度下的分布; 黑色曲线为δ13C值、δ15N值和营养级与经纬度、体长之间的相关趋势; 灰色区域为95%置信区间 |
样本δ15N值在281~290 mm体长组间最大, 在261~270 mm体长组间最小。δ15N值在体长组之间不存在显著性差异(P > 0.05); δ15N值与体长可完成GAM模型拟合(P < 0.05), δ15N值随体长的增加而增大(图 3d)。NR在281~290 mm体长组间最大, 在301~ 310 mm体长组间最小, NR在体长组间呈先增加后降低的趋势(表 1)。
营养级在281~290 mm体长组间最高, 在261~ 270 mm体长组间最低。营养级在体长组之间不存在显著性差异(P > 0.05); 营养级与体长可完成GAM模型拟合(P < 0.05), 营养级随体长的增长而增大(图 3g)。
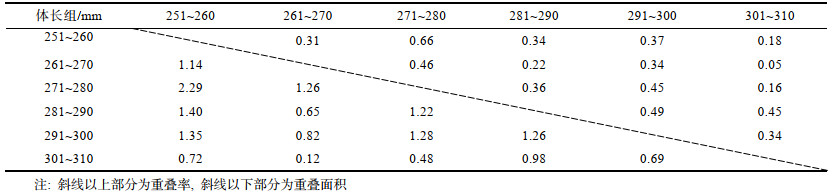
251~260 mm体长组间的SEAc最大, 301~ 310 mm体长组间的SEAc、TA最小, SEAc在整体间呈降低趋势(表 1, 图 2)。251~260 mm体长组和271~280 mm体长组间的重叠率最高, 重叠面积分别占251~260 mm和271~280 mm的76.92%和96.20%; 261~270 mm体长组和301~310 mm体长组间的重叠率最低, 重叠面积分别占261~270 mm和301~ 310 mm的7.50%和11.41% (表 3)。
|
聚类分析结果显示体长组可分为280 mm以下[δ13C: −21.97‰ (σ=0.74‰); δ15N: 8.33‰ (σ=0.97‰)]以及280 mm以上[δ13C: −21.51‰ (σ=0.63‰); δ15N: 8.72‰ (σ=0.98‰)]两组(图 4)。体长为280 mm以下样本和280 mm以上样本之间的δ13C值、δ15N值均存在显著性差异(P < 0.05)。
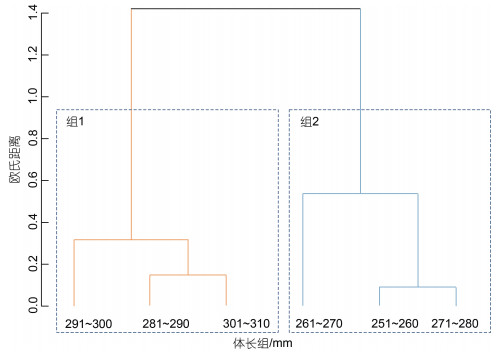 |
| 图 4 不同体长组δ13C值、δ15N值的聚类分析 Fig. 4 Clustering analysis of δ13C and δ15N values in different body length groups |
OE海域样本的δ13C均值为−21.49‰ (σ=0.73‰), CR为2.53, δ13C值在雌雄间不存在显著差异(P > 0.05), 在体长组间不存在显著性差异(P > 0.05); WSG海域样本的δ13C均值为−21.99‰ (σ=0.73‰), CR为3.71, δ13C值在雌雄间不存在显著差异(P > 0.05), 在体长组间不存在显著性差异(P > 0.05)。δ13C值在两个海域之间存在显著性差异(P < 0.05); δ13C值与经度、纬度可完成GAM模型拟合(P < 0.05), δ13C值在150°~165°E, 40°~49°N范围内呈下降趋势(图 3b, 3c)。
OE海域样本的δ15N均值为8.74‰ (σ=1.00‰), NR为3.83, δ15N值在雌雄间存在显著差异(P < 0.05), 在体长组间不存在显著性差异(P > 0.05); WSG海域样本的δ15N均值为8.31‰ (σ=1.00‰), NR为4.08, δ15N值在雌雄间不存在显著差异(P > 0.05), 在体长组间不存在显著性差异(P > 0.05)。δ15N值在两个海域之间存在显著性差异(P < 0.05); δ15N值与经度、纬度可完成GAM模型拟合(P < 0.05), δ15N值在150°~160°E范围内呈下降趋势, 在161°E附近处于最低值, 随后呈上升趋势(图 3e); δ15N值在40°~49°N范围内呈下降趋势, 在45°N附近处于最低值, 随后上升(图 3f)。
OE海域样本营养级范围为2.59~3.71, 平均值为3.02 (σ=0.29), WSG海域样本营养级范围为2.44~3.64, 平均值为2.98 (σ=0.29)。营养级在两个海域之间存在显著性差异(P < 0.05); 营养级与经度、纬度可完成GAM拟合, 营养级在150°~164°E范围内呈先降低后增加的趋势, 在161°E附近达到最低值; 在40°~48°N范围内呈先降低后增加的趋势, 在45°N附近达到最低值(图 3h, 3i)。
OE海域样本的TA、SEAc均低于WSG海域(图 2); OE海域样本和WSG海域样本间的SEAc重叠率为0.46, SEAc重叠面积分别占OE海域和WSG海域的77.62%和85.48%。
聚类分析结果表明, 在44°N以南海域的样本中, 均为组1, 44°N以北海域的样本中组1占45%, 组2占55% (图 5, 图 6)。ANOVA检验表明, 44°N以南[δ13C: −21.49‰ (σ=0.61‰); δ15N: 8.74‰ (σ=0.89‰)]和44°N以北[δ13C: −21.99‰ (σ=0.75‰); δ15N: 8.31‰ (σ=1.04‰)]样本之间的δ13C值、δ15N值均存在显著性差异(P < 0.05)。
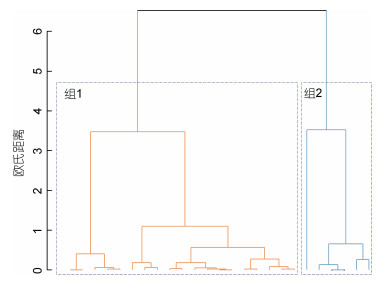 |
| 图 5 各渔区(1°×1°) δ13C值、δ15N值的聚类分析 Fig. 5 Clustering analysis of δ13C and δ15N values in different fishing area |
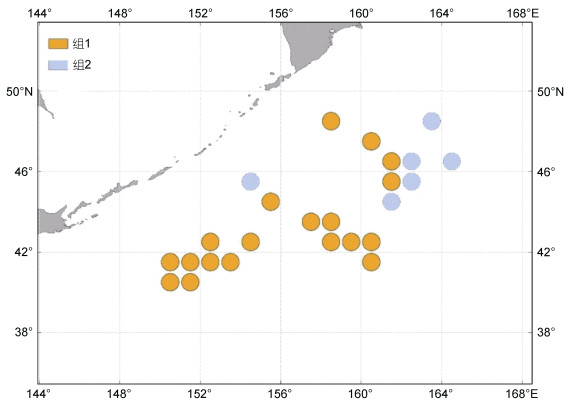 |
| 图 6 组1、组2的空间分布 Fig. 6 Spatial distribution in Group 1and Group 2 |
Mitani等(2006)研究西北太平洋海域(41°10′~ 41°14′N, 143°14′~143°15′E)小须鲸胃含物的碳、氮稳定同位素发现, 秋刀鱼的δ13C平均值为−19.6‰, δ15N平均值为9.3‰; Minami等(1995)研究西北太平洋海域(39°22′N, 155°04′E)海鸟摄食对象的稳定同位素发现, 秋刀鱼的δ13C平均值为−18.5‰、δ15N平均值为9.2‰ (表 4)。另有研究表明, 初级生产者的δ13C值在不同海域间存在差异, 低纬度海域生态系统中δ13C值要高于高纬度海域, 近岸海域食物网中的δ13C值高于远洋食物网(Rubenstein et al, 2004)。本研究结果显示, δ13C平均值为–21.74‰、δ15N平均值为8.51‰, 均低于文献中的δ13C平均值、δ15N平均值, 可能的原因是采样海域不同, 本研究的采样海域主要为40°N以北, 150°E以东的西北太平洋公海海域。此外, 分析方法、采样年份不同等(Blanco-Parra et al, 2012; Ogloff et al, 2020)均可导致测定结果有差异。
| 海域 | 样本数/个 | δ13C范围 /‰ |
δ13C平均值 /‰ |
δ15N范围 /‰ |
δ15N平均值 /‰ |
体长 /mm |
出处 |
| 39°22′N, 155°04′E | 15 | −18.5±0.58 | 9.2±0.58 | Minami et al, 1995 | |||
| 41°10′~41°14′N, 143°14′~143°15′E |
15 | −19.6 ± 0.6 | 9.3±1.4 | Mitani et al, 2006 | |||
| 32°~44°N, 128°~164°E | 19 | −20.4±0.5 | 8.1±1.3 | ||||
| 39°08′N~48°34′N, 154°58′E~169°02′W |
277 | −21.9~−18.9 | 5.6~14 | 249~331 | Fuji et al, (2021) | ||
| 37°~49°N, 146°~163°E | 80 | −24.37~−20.97 | 4.19~8.60 | 210~330 | 闫鲁鑫等, 2020 |
Fuji等(2021)研究西北太平洋海域(9°08′~48°34′N, 154°58′~169°02′W)不同年龄秋刀鱼碳、氮稳定同位素发现, 秋刀鱼δ13C值范围在−21.9‰~−18.9‰之间, CR值为3, δ15N值范围在5.6‰~14‰之间, NR值为8.4; 闫鲁鑫等(2020)研究西北太平洋公海海域(37°~49°N、146°~163°E)秋刀鱼的碳、氮稳定同位素发现, 秋刀鱼δ13C值范围为−24.37‰~−20.97‰, CR值为3.4, δ15N值范围为4.19‰~8.60‰, NR值为4.41。本研究结果的CR值为3.91, 结果高于FUJI等研究结果, 而与闫鲁鑫等研究结果相近; 本研究结果的NR值为4.62, 结果低于Fuji等(2021)研究结果, 而与闫鲁鑫等研究结果相近。可能的原因是Fuji等(2021)研究海域纬度范围较小, 食物来源多样性较少, 而跨经度范围更广, 研究样本可能有其他海域高营养水平的秋刀鱼群体; 本研究海域范围与闫鲁鑫等研究范围相似, 均在165°E以西, 本研究结果中δ13C值、δ15N值整体均高于上述研究结果, 可能是由于本研究进行了去脂质处理, 从而导致测得的δ13C值、δ15N值升高(贡艺等, 2014), 然而去脂处理会降低脂质对δ13C值的影响, 但使δ15N值高于正常值(杨蕊等, 2020), 因此在后续的研究中可使用未去脂样品对δ15N值进行分析。
Miller等(2010)以桡足类作为基线生物研究北加利福尼亚流域中上层鱼类食物网发现, 秋刀鱼营养级平均值为3.1, 本文研究发现, 以桡足类为基线时秋刀鱼营养级平均值为3.0, 在OE海域营养级平均值为3.02, 在WSG海域营养级平均值为2.98, 与文献研究结果相近, 表明在不同海域秋刀鱼所处食物网中的营养位置相近。
3.2 雌雄间碳、氮稳定同位素差异本研究中, δ13C值、δ15N值在雌、雄样本间不存在显著性差异(P > 0.05), 表明秋刀鱼的雌、雄个体食物来源和营养级相近。研究发现, 雌鱼会摄食更高营养级饵料来获取更多能量以满足生长、繁殖需求(Liu et al, 2020)。王开立等(2022)在研究蓝圆鲹的生态位时发现, 雌性个体的δ13C值、δ15N值显著高于雄性, 说明雌鱼通过摄取更高营养级的饵料来满足卵巢发育的要求。本文整体样本以及WSG海域雌雄样本δ13C值、δ15N值不存在显著性差异, 而OE海域雌性样本δ15N值和营养级显著高于雄性, 可能的原因是此时秋刀鱼更靠近产卵区, 雌鱼分配给生殖的能量主要通过食物的摄入来满足(Lin et al, 2015)。
CR值可用来反映鱼类食物来源多样性, NR值可用来反映营养长度(Layman et al, 2007)。本文研究发现雄性样本的CR值(3.91‰)高于雌性(2.7‰), 表明雄性个体摄食饵料多样性更高; 雌性样本的NR值(4.53‰)高于雄性(4.08‰), 表明雌性个体营养长度更大。SEAc可反映物种对资源利用能力的强弱, SEAc重叠率可反映物种摄食饵料的相似程度, SEAc重叠率越高, 对食物的竞争程度越大(王凤等, 2006)。本研究中, 雄性样本的SEAc (2.37)高于雌性样本(2.18), 表明雄性样本活动范围更广、摄食饵料种类更多, 对资源利用能力更强。雌、雄样本的SEAc重叠率较高(0.81), 说明雌、雄样本间摄食饵料基本一致, 在摄食过程中存在一定的竞争。
3.3 稳定同位素的体长间变化本文聚类分析结果显示, 体长在280 mm以下样本和280 mm以上样本之间的δ13C值、δ15N值均存在显著性差异(P < 0.05), 另有研究表明, 体长小于280 mm的秋刀鱼为未成熟体, 体长大于280 mm的秋刀鱼为成熟体(Tian et al, 2004), 说明秋刀鱼成熟前后的δ13C值、δ15N值发生明显变化。本文GAM模型结果显示, δ13C值随体长的增加而增大, 表明随个体生长秋刀鱼会摄食δ13C值更高的饵料生物。已有研究表明, 秋刀鱼在摄食过程中会出现选择性摄食现象, 主动选择桡足类、磷虾以及毛颚类(Miyamoto et al, 2020) [δ13C值、δ15N值平均值大小关系为: 桡足类<磷虾<端足类<毛颚类(Aita et al, 2011)]。本文研究结果显示, CR在体长组间呈降低的趋势, 表明随生长发育, 秋刀鱼摄食的饵料来源多样性降低, 可能的原因是秋刀鱼成熟以后在摄食过程中出现选择性摄食的情况, 摄食种类减少。
随着个体的生长, 捕食者体内δ15N值会逐渐增加, 营养级升高(Hobson et al, 2004)。王静等(2021)研究鳀鱼的摄食生态时发现, 鳀鱼营养级随叉长的增加而增大。本文GAM模型结果显示, 秋刀鱼的δ15N值随体长增加而增大, 反映随着体长的增加, 秋刀鱼可以捕食营养级更高的种类, 如磷虾和毛颚类(Moeseneder et al, 1995; Aita et al, 2011)。本研究结果显示, 秋刀鱼的NR值在整体间呈下降趋势, 反映随着体长的增长, 营养长度减小。
朱国平等(2007)研究大西洋西部大眼金枪鱼摄食生态时发现, 当体长大于160 mm时, 其生态位宽度H′随体长增加呈下降趋势。本研究中, 体长大于271 mm时, 样本SEAc在体长组间呈降低的趋势。251~260 mm体长组间的SEAc最大, 说明该体长组秋刀鱼对资源的利用能力最强; 301~310 mm体长组间的SEAc值最低, 说明该体长组秋刀鱼对资源利用能力最低。301~310 mm与280 mm以下样本的SEAc重叠率均低于0.2, 说明301~310 mm体长组样本与未成熟体摄食饵料的差异较大, 选择性摄食浮游动物的种类不同。
3.4 稳定同位素的空间分布本文聚类分析结果显示, 44°N以南和44°N以北秋刀鱼样本的δ13C值、δ15N值存在显著性差异(P < 0.05), 边界纬度与Qiu等(2017)划分的OE和WSG边界纬度(43°N)接近, 同时反映出秋刀鱼在OE海域和WSG海域的食物来源和营养级存在差异。在海洋生态系统中, 浮游植物、颗粒有机物(particle organic matter, POM)常被认为是海洋生物的营养基础和潜在碳源(高世科等, 2021)。研究发现, 浮游植物的δ13C值与初级生产者的生长速率之间存在显著正相关关系(Takahashi et al, 1991), OE海域主要分布于亲潮-黑潮混合区北部海域(Qiu et al, 2017), 受黑潮影响水温较高, 利于浮游植物的生长和集聚(沈新强等, 2004); 而WSG海域受亚北极环流影响, 水温较低(Endoh et al, 2004), 不利于浮游植物生长。本文研究发现, OE海域的秋刀鱼样本具有较高的δ13C值, 且显著高于WSG海域(P < 0.05), 这可能是由于该海域较高的浮游植物生长速率所致; 另外, δ13C值大小与溶解无机碳(dissolved inorganic carbon, DIC)浓度呈负相关关系, 西北太平洋高纬度海域的DIC浓度高于低纬度海域(Yasunaka et al, 2013), 因此, OE海域的DIC浓度可能低于WSG海域, 说明OE海域的δ13C值可能高于WSG海域, 本文的研究结果与上述结果一致。
研究表明, OE海域硝酸盐浓度较低(Yoshikawa et al, 2018), 而WSG海域硝酸盐浓度较高(Frost et al, 1999)。海表面硝酸盐浓度与POM的δ15N值呈负相关关系, 在硝酸盐浓度低的海域, δ15N富集更明显(Horii et al, 2018)。本文研究发现, OE海域秋刀鱼样本的δ15N值高于WSG海域(P < 0.05), 与上述研究结果一致。除此之外, 摄食环境中浮游生物组成的变化会导致秋刀鱼δ15N值变化(Fuji et al, 2021), 本研究中, OE海域样本的采样时间为秋冬季节, 此时桡足类分布在深度大于500m的海域(Kobari et al, 2008), 而秋刀鱼主要分布在0~200m水层(花传祥等, 2019), 因此秋冬季秋刀鱼在OE海域可能较少摄食桡足类; WSG海域样本采样季节桡足类含量高, 磷虾含量低(朱清澄等, 2008), 秋刀鱼在该海域可能更多的摄食桡足类。本研究结果显示, OE海域样本的δ15N值和营养级高于WSG海域, 说明秋刀鱼在OE海域摄食浮游生物的营养级高于WSG海域, 与上述研究结果相似。
OE海域样本的CR值和NR值均低于WSG海域, 表明秋刀鱼在WSG海域摄食饵料多样性和营养长度高于OE海域。WSG海域样本的SEAc高于OE海域, 表明WSG海域秋刀鱼对资源的利用能力更强。OE海域和WSG海域样本的SEAc重叠率为0.46, 表明秋刀鱼在不同海域中, 摄食来源存在较大差异。不同海域中浮游生物组成存在差异, 秋刀鱼选择摄食的饵料也不同。
4 结论本研究主要分析了西北太平洋公海海域秋刀鱼样本的碳、氮稳定同位素特征, 讨论了秋刀鱼的碳、氮稳定同位素在雌雄个体间、不同体长组间、各海域间的分布及其与摄食之间的关系。分析发现, 生长和栖息海域均可影响秋刀鱼的碳、氮稳定同位素分布, 而稳定同位素值在雌雄间差异不大。δ15N值和营养级随秋刀鱼体长的增加而增大, 表明秋刀鱼在生长过程中可捕食更高营养水平的浮游生物。OE海域和WSG海域秋刀鱼营养级和食物来源均存在差异, 其中, OE海域秋刀鱼的营养级更高, WSG海域秋刀鱼摄食饵料多样性更高。
王开立, 龚玉艳, 陈作志, 等, 2022. 基于稳定同位素技术的南海北部蓝圆鲹的营养生态位. 生态学杂志, 41(4): 724-731 |
王凤, 鞠瑞亭, 李跃忠, 等, 2006. 生态位概念及其在昆虫生态学中的应用. 生态学杂志, 25(10): 1280-1284 |
王锦溪, 罗孔兰, 范瀛方, 等, 2021. 北部湾日本金线鱼摄食生态[J/OL]. (2021-09-10). 渔业科学进展: 1-12, https://doi.org/10.19663/j.issn2095-9869.20210606001.
|
王静, 蒋日进, 胡翠林, 等, 2021. 基于胃含物分析和稳定同位素技术研究鳀的摄食生态. 应用生态学报, 32(6): 2035-2044 |
叶彬清, 陶宁萍, 王锡昌, 等, 2013. 秋刀鱼营养成分分析、贮藏加工及副产物综合利用研究进展. 食品工业科技, 34(22): 367-370, 374 |
朱国平, 周应褀, 许柳雄, 等, 2007. 大西洋西部大眼金枪鱼摄食生态的初步研究. 水产学报, 31(1): 23-30 DOI:10.3321/j.issn:1000-0615.2007.01.004 |
朱清澄, 夏辉, 花传祥, 等, 2008. 西北太平洋公海秋刀鱼夏季索饵场浮游动物的分布. 水产学报, 32(6): 890-898 |
闫鲁鑫, 张弛, 刘世刚, 等, 2020. 西北太平洋公海渔场秋刀鱼群体渔业生物学特征初步研究. 浙江海洋大学学报(自然科学版), 39(5): 415-421 |
贡艺, 陈新军, 高春霞, 等, 2014. 脂类抽提对北太平洋柔鱼肌肉碳、氮稳定同位素测定结果的影响. 应用生态学报, 25(11): 3349-3356 |
花传祥, 朱清澄, 许巍, 等, 2019. 北太平洋秋刀鱼生活史和资源渔场研究进展. 中国水产科学, 26(4): 811-821 |
花传祥, 高玉珍, 朱清澄, 等, 2017. 基于耳石微结构的西北太平洋秋刀鱼(Cololabis saira)年龄与生长研究. 海洋学报, 39(10): 46-53 |
杨蕊, 田思泉, 高春霞, 等, 2020. 浙江南部近海前肛鳗肌肉脂质去除对其稳定同位素测定结果的影响. 中国水产科学, 27(9): 1085-1094 |
沈新强, 王云龙, 袁骐, 等, 2004. 北太平洋鱿鱼渔场叶绿素a分布特点及其与渔场的关系. 海洋学报, 26(6): 118-123 |
张孝民, 朱清澄, 花传祥, 2015. 2013年北太平洋公海秋刀鱼渔场与海洋环境的关系. 上海海洋大学学报, 24(5): 773-782 |
张武昌, 赵苑, 董逸, 等, 2021. 上层海洋浮游生物地理分布. 海洋与湖沼, 52(2): 332-345 |
高世科, 黄金玲, 于雯雯, 等, 2021. 吕泗渔场两种石首鱼科鱼类营养生态学特征: 来自稳定同位素的证据. 应用海洋学学报, 40(3): 413-420 |
郭旭鹏, 李忠义, 金显仕, 等, 2017. 采用碳氮稳定同位素技术对黄海中南部鳀鱼食性的研究. 海洋学报, 29(2): 98-104 |
AITA M N, TADOKORO K, OGAWA N O, et al, 2011. Linear relationship between carbon and nitrogen isotope ratios along simple food chains in marine environments. Journal of Plankton Research, 33(11): 1629-1642 |
BLANCO-PARRA M P, GALVÁN-MAGAÑA F, MÁRQUEZ-FARÍAS J F, et al, 2012. Feeding ecology and trophic level of the banded guitarfish, Zapteryx exasperata, inferred from stable isotopes and stomach contents analysis. Environmental Biology of Fishes, 95(1): 65-77 |
DENIRO M J, EPSTEIN S, 1978. Influence of diet on the distribution of carbon isotopes in animals. Geochimica et Cosmochimica Acta, 42(5): 495-506 |
ENDOH T, MITSUDERA H, XIE S P, et al, 2004. Thermohaline structure in the subarctic North Pacific simulated in a general circulation model. Journal of Physical Oceanography, 34(2): 360-371 |
FROST B W, KISHI M J, 1999. Ecosystem dynamics in the eastern and western gyres of the Subarctic Pacific—a review of lower trophic level modelling. Progress in Oceanography, 43(2/3/4): 317-333 |
FUJI T, NAKAGAMI M, SUYAMA S, et al, 2021. Geographical differences in the stable isotope ratios of Pacific saury in the North Pacific Ocean. Fisheries Science, 87(4): 529-540 |
GORBATENKO K M, LAZHENTSEV A E, KIYASHKO S I, 2014. Seasonal dynamics of the trophic status of zooplankton in the Sea of Okhotsk (based on data from stable carbon-and nitrogen-isotope analysis). Russian Journal of Marine Biology, 40(7): 519-531 |
HOBSON K A, CLARK R G, 1992. Assessing avian diets using stable isotopes I: turnover of 13C in Tissues. The Condor, 94(1): 181-188 |
HOBSON K A, SINCLAIR E H, YORK A E, et al, 2004. Retrospective isotopic analyses of Steller sea lion tooth annuli and seabird feathers: a cross-taxa approach to investigating regime and dietary shifts in the Gulf of Alaska. Marine Mammal Science, 20(3): 621-638 |
HORII S, TAKAHASHI K, SHIOZAKI T, et al, 2018. Stable isotopic evidence for the differential contribution of diazotrophs to the epipelagic grazing food chain in the mid‐Pacific Ocean. Global Ecology and Biogeography, 27(12): 1467-1480 |
HUBBS C L, WISNER R L, 1980. Revision of the sauries (Pisces, Scomberesocidae) with descriptions of two new genera and one new species. US Fish and Wildlife Service Fishery Bulletin, 77: 521-566 |
ITO S I, SUGISAKI H, TSUDA A, et al, 2004. Contributions of the VENFISH program: mesozooplankton, Pacific saury (Cololabis saira) and walleye pollock (Theragra chalcogramma) in the northwestern Pacific. Fisheries Oceanography, 13: 1-9 |
JACKSON A L, INGER R, PARNELL A C, et al, 2011. Comparing isotopic niche widths among and within communities: SIBER - Stable Isotope Bayesian Ellipses in R. Journal of Animal Ecology, 80(3): 595-602 |
KOBARI T, MOKU M, TAKAHASHI K, 2008. Seasonal appearance of expatriated boreal copepods in the Oyashio–Kuroshio mixed region. ICES Journal of Marine Science, 65(3): 469-476 |
KOBARI T, NAKAMURA R, AITA M N, et al, 2022. Mesopelagic community supported by epipelagic production in the western North Pacific Ocean based on stable isotope ratios of carbon and nitrogen. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 182: 103722 |
LAYMAN C A, ARRINGTON D A, MONTAÑA C G, et al, 2007. Can stable isotope ratios provide for community-wide measures of trophic structure?. Ecology, 88(1): 42-48 |
LIN D M, CHEN X J, CHEN Y, et al, 2015. Sex‐specific reproductive investment of summer spawners of Illex argentinus in the Southwest Atlantic. Invertebrate Biology, 134(3): 203-213 |
LIU B L, XU W, CHEN X J, et al, 2020. Ontogenetic shifts in trophic geography of jumbo squid, Dosidicus gigas, inferred from stable isotopes in eye lens. Fisheries Research, 226: 105507 |
MILLER T W, BRODEUR R D, RAU G, et al, 2010. Prey dominance shapes trophic structure of the northern California Current pelagic food web: evidence from stable isotopes and diet analysis. Marine Ecology Progress Series, 420: 15-26 |
MINAGAWA M, WADA E, 1984. Stepwise enrichment of 15N along food chains: further evidence and the relation between δ15N and animal age. Geochimica et Cosmochimica Acta, 48(5): 1135-1140 |
MINAMI H, MINAGAWA M, OGI H, 1995. Changes in stable carbon and nitrogen isotope ratios in sooty and short-tailed shearwaters during their northward migration. The Condor, 97(2): 565-574 |
MITANI Y, BANDO T, TAKAI N, et al, 2006. Patterns of stable carbon and nitrogen isotopes in the baleen of common minke whale Balaenoptera acutorostrata from the western North Pacific. Fisheries Science, 72(1): 69-76 |
MIYAMOTO H, VIJAI D, KIDOKORO H, et al, 2020. Geographic variation in feeding of Pacific saury Cololabis sairain June and July in the North Pacific Ocean. Fisheries Oceanography, 29(6): 558-571 |
MOESENEDER M M, HERNDL G J, 1995. Influence of turbulence on bacterial production in the sea. Limnology and Oceanography, 40(8): 1466-1473 |
NEWSOME S D, DEL RIO C M, BEARHOP S, et al, 2007. A niche for isotopic ecology. Frontiers in Ecology and the Environment, 5(8): 429-436 |
OGLOFF W R, FERGUSON S H, TALLMAN R F, et al, 2020. Diet of capelin (Mallotus villosus) in the Eastern Canadian Arctic inferred from stomach contents and stable isotopes. Polar Biology, 43(9): 1273-1285 |
POST D M, 2002. Using stable isotopes to estimate trophic position: models, methods, and assumptions. Ecology, 83(3): 703-718 |
POST D M, LAYMAN C A, ARRINGTON D A, et al, 2007. Getting to the fat of the matter: models, methods and assumptions for dealing with lipids in stable isotope analyses. Oecologia, 152(1): 179-189 |
QIU B, CHEN S M, SCHNEIDER N, 2017. Dynamical links between the decadal variability of the Oyashio and Kuroshio Extensions. Journal of Climate, 30(23): 9591-9605 |
RUBENSTEIN D R, HOBSON K A, 2004. From birds to butterflies: animal movement patterns and stable isotopes. Trends in Ecology & Evolution, 19(5): 256-263 |
SAKURAI Y, 2007. An overview of the Oyashio ecosystem. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 54(23/24/25/26): 2526-2542 |
SUGISAKI H, KURITA Y, 2004. Daily rhythm and seasonal variation of feeding habit of Pacific saury (Cololabis saira) in relation to their migration and oceanographic conditions off Japan. Fisheries Oceanography, 13(S1): 63-73 |
TAKAHASHI K, WADA E, SAKAMOTO M, 1991. Relationship between carbon isotope discrimination and the specific growth rate of green alga Chlamydomonas reinhardtii. Japanese Journal of Limnology, 52(2): 105-112 |
TIAN Y J, AKAMINE T, SUDA M, 2003. Variations in the abundance of Pacific saury (Cololabis saira) from the northwestern Pacific in relation to oceanic-climate changes. Fisheries Research, 60(2/3): 439-54 |
TIAN Y J, AKAMINE T, SUDA M, 2004. Modeling the influence of oceanic-climatic changes on the dynamics of Pacific saury in the northwestern Pacific using a life cycle model. Fisheries Oceanography, 13(S1): 125-137 |
VOIGT C C, MATT F, MICHENER R, et al, 2003. Low turnover rates of carbon isotopes in tissues of two nectar-feeding bat species. Journal of Experimental Biology, 206(8): 1419-1427 |
WADA E, TERAZAKI M, KABAYA Y, et al, 1987. 15N and 13C abundances in the Antarctic Ocean with emphasis on the biogeochemical structure of the food web. Deep Sea Research Part A. Oceanographic Research Papers, 34(5/6): 829-841 |
WU B L, LIN X P, QIU B, 2019. On the seasonal variability of the Oyashio Extension fronts. Climate Dynamics, 53(11): 7011-7025 |
YASUNAKA S, NOJIRI Y, NAKAOKA S, et al, 2013. Monthly maps of sea surface dissolved inorganic carbon in the North Pacific: basin-wide distribution and seasonal variation. Journal of Geophysical Research: Oceans, 118(8): 3843-3850 |
YOSHIKAWA C, MAKABE A, MATSUI Y, et al, 2018. Nitrate isotope distribution in the subarctic and subtropical North Pacific. Geochemistry, Geophysics, Geosystems, 19(7): 2212-2224 |
 2023, Vol. 54
2023, Vol. 54