中国海洋湖沼学会主办。
文章信息
- 吴紫琪, 何语堂, 羊妍珂, 陶玉林, 吴骏男, 蒋振楠, 严小军, 廖智, 刘雪珠, 何建瑜. 2023.
- WU Zi-Qi, HE Yu-Tang, YANG Yan-Ke, TAO Yu-Lin, WU Jun-Nan, JIANG Zhen-Nan, YAN Xiao-Jun, LIAO Zhi, LIU Xue-Zhu, HE Jian-Yu. 2023.
- 厚壳贻贝(Mytilus coruscus)养殖区沉积物微生物多样性及固碳潜力研究
- MICROBIAL DIVERSITY AND THE POTENTIAL CAPABILITY FOR CARBON FIXATION IN SEDIMENTS OF MYTILUS CORUSCUS FARMING AREAS
- 海洋与湖沼, 54(2): 502-513
- Oceanologia et Limnologia Sinica, 54(2): 502-513.
- http://dx.doi.org/10.11693/hyhz20220600157
文章历史
-
收稿日期:2022-06-15
收修改稿日期:2022-08-31
海洋是地球上最大的活跃碳库, 亦是全球气候变化巨大的“缓冲器”(Friedlingstein et al, 2020), 其对CO2的吸收和长期储存主要由海洋生物介导的碳固定和碳转化作用所驱动(焦念志等, 2018)。在海洋生态系统中, 海岸带及陆架海蓝碳(Blue Carbon, BC)系统的碳汇潜力巨大, 可显著影响全球碳循环过程(Trevathan-Tackett et al, 2015; Moritsch et al, 2021)。尽管现已充分认识到近海蓝碳的潜力, 但对其碳汇过程的认识还主要停留在对各生境的定性水平上, 缺乏定量分析和系统研究(王秀君等, 2016)。沉积物是海洋碳存储和转化的主要场所。一般来说, 近海沉积物的有机碳来源主要包括陆源输入和浮游植物沉积(高立蒙等, 2016)。近年来研究表明近岸沉积物中微生物对无机碳的固定同样具有不容忽视的作用。例如, 近海沉积物中的化能自养微生物每年可固定高达370 Tg碳, 相当于整个海洋化能自养微生物碳固定的48% (Middelburg, 2011)。Boschker等(2014)在荷兰东谢尔特河口生态系统中发现其潮间带沉积物的总暗碳固定率高达3.2~6.8 µmol C/(cm3·d), 远高于湖泊沉积物。在此情况下, 有必要对不同生境的固碳潜力加以评估, 以更加全面的视角评估蓝碳系统的碳汇贡献。
不同生境往往意味着不同的微生物群落组成, 不同微生物类群对于碳固定的贡献也不尽相同。一般而言, 微生物依赖不同功能基因或固碳途径参与碳固定过程(Hügler et al, 2011; 袁红朝等, 2011; Ducat et al, 2012; 刘洋荧等, 2017; Hoshino et al, 2020), 其固碳途径涉及的可能代谢通路主要包括卡尔文循环(Calvin cycle)、还原柠檬酸循环(rTCA cycle)、还原乙酰辅酶A途径(WL pathway)、3-羟基丙酸双循环(3-HP cycle)、3-羟基丙酸/4-羟基丁酸循环(3-HP/4-HB cycle)、二羧酸/4-羟基丁酸循环(DC/4-HB cycle)等。另一方面, 这些固碳途径中的关键基因, 例如cbbL、cbbM、aclB等, 可成为表征生态系统中固碳微生物多样性、潜在固碳能力和固碳类型的重要指示分子。例如, Campbell等(2004)利用aclB、porA、oorA、nifJ等功能基因对深海热液口样品进行研究发现, ε-变形菌是深海热液口环境中的主要微生物类群, 且主要依赖还原型三羧酸循环固定CO2。因此, 本研究将利用固碳途径中的关键功能基因对近海蓝碳生境中的沉积物固碳潜力进行评估。
我国作为世界上最大的贻贝产地, 其养殖年产量一直保持增长态势, 2020年养殖面积超4万hm2, 产量超85万t, 主要品种包括地中海贻贝、紫贻贝和厚壳贻贝。厚壳贻贝(Mytilus coruscus)隶属于双壳纲、贻贝目、贻贝科(Mytilidae)、贻贝属(Mytilus), 主要以滤食水体中的藻类为生, 在黄海、渤海、东海等均有分布。因厚壳贻贝病原菌少、营养价值高、味道鲜美、环境适应性强而被广泛养殖(何建瑜等, 2012; Liu et al, 2014; He et al, 2022; Yang et al, 2022), 尤其在被称为“贻贝之乡”的浙江嵊泗海域, 年产量超5万t。随着贻贝养殖业的急剧发展, 养殖海域已经逐渐形成为一种较为稳定、独立, 但结构相对单一的局部生态域, 从而构成近海蓝碳系统下的一个特殊且不可忽视的重要生境。由于高密度养殖模式、高效滤食特征和大量的生物沉积物, 贻贝养殖可提高所在海区的沉积速率(周毅等, 2003), 并影响所在海域中的微生物群落结构(李斯远等, 2021)。已有研究表明, 贻贝的生物沉积速率为每克贻贝(包括贝壳)每年的生物沉积中可产生0.33 g有机质, 0.13 g碳(Kautsky et al, 1987)。如果按照其生物沉积速率, 2020年预计贻贝在其所在海区生产出约0.28 Tg有机质, 这将对贻贝养殖海区的底层沉积物环境产生极大的影响, 也为微生物的生长和潜在固碳能力的变化提供了条件。为更全面地了解贻贝养殖区沉积物中的微生物群落结构及其固碳潜力, 本研究以浙江嵊泗枸杞岛厚壳贻贝养殖区及其邻近非养殖区作为研究海域, 通过测定沉积物中的碳组分含量, 利用16S rDNA扩增子测序获取沉积物微生物的群落结构, 结合aclB等固碳关键基因进行固碳潜力表征, 系统评估贻贝养殖区沉积物的特征及其与微生物的相互作用。本文结果将对今后近海贝类养殖区沉积物碳存储机制研究提供基础数据, 同时也为贻贝养殖业的优化布局与生态调整提供新的思路。
1 材料与方法 1.1 研究海域概况2021年8~10月, 对浙江嵊泗厚壳贻贝养殖区(30°42′N, 122°46′E)生态环境展开调查, 考虑到养殖区面积大等特点, 对养殖区中心及边缘海域共4个位点进行沉积物采集, 随后将样本充分混合后代表养殖区样本(T1)。考虑到海水流动及洋流的影响, 依托浙江海洋大学自主航次——海洋锋面与渔业资源长期调查计划(Sophisticated Ocean Front and Fisheries Investigation, SOPHI), 采集 > 30 km的四个站位(N1、M1、N2和P2)的沉积物设定为非养殖区样本(图 1)。在每个站位, 沉积物采集参考《海洋调查规范》(GB12763), 利用有缆抓斗(QNC型, 0.025 m2)采集样品, 将获取的沉积物取顶部约5 cm装入无菌采样瓶中, 标记相关信息后密封–20 ℃保存, 返回实验室后进行沉积物理化特征分析。
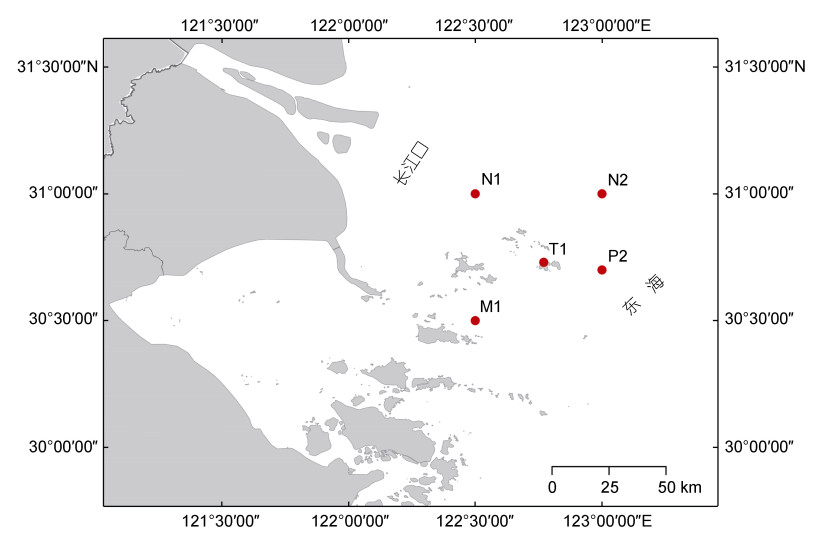 |
| 图 1 采样位点图 Fig. 1 Map of the sampling sites 注: T1为贻贝养殖区, N1、M1、N2和P2为非养殖区 |
沉积物样本的处理参考《海洋调查规范》(GB12763)进行, 随后对各站位沉积物样本的粒径、碳组分、氮组分、可溶性磷酸盐等环境理化指标进行测定。沉积物粒径利用激光粒度仪(Malvern Mastersizer 2000)进行。沉积物总碳(total carbon, TC)采用燃烧-红外吸收光谱法(DZ/T 0279-2016)测定。总有机碳(total organic carbon, TOC)采用非色散红外吸收法(GB/T 30740- 2014)测定。溶解性有机碳(dissolved organic carbon, DOC)参照土壤观测指标与规范中的重铬酸钾氧化法进行测定(潘贤章等, 2019); 颗粒有机碳(particulate organic carbon, POC)参考Cambardella等(1992)提供的方法: 将沉积物充分风干后过2 mm筛, 经50 ℃烘干过夜后保存于4 ℃冰箱; 称取10 g预处理样本, 加入30 mL 5 g/L六偏磷酸溶液后充分振荡分散15 h (25 ℃, 90 r/min); 分散溶液置于53 μm筛, 用清水冲洗后筛子上保留 > 53 μm的颗粒即为沉积物颗粒有机碳(方华军等, 2006; 陈宗定等, 2019)。易氧化有机碳(readily oxidizable carbon, ROC)采用1︰0.2 K2Cr2O7-H2SO4改良法(周伟等, 2019)进行测定: 取风干后的沉积物样品0.5 g (过0.15 mm筛), 放入干燥的三角瓶中, 加入10 mL 0.1 mol/L K2Cr2O7和2 mL浓H2SO4充分混合后置于石棉网上静置0.5 h, 随后利用0.1 mol/L FeSO4·7H2O标准溶液滴定过量的K2Cr2O7, 进而计算出被氧化的碳量即为易氧化有机碳。ROC是沉积物有机碳中具有较高活性的部分, 为沉积物微生物提供能量和养分, 是沉积物碳库变化的重要指标。惰性碳(recalcitrant carbon, RC)采用酸水解法测定(王义祥等, 2016; 陈宗定等, 2019): 称取50~ 100 g沉积物, 用6 mol/L盐酸消煮16 h后过180 μm筛, 用重铬酸钾容量法测定惰性碳含量。惰性碳通常难以被微生物进一步降解, 因而是评价沉积物碳存储的重要指标。
沉积物总氮(total nitrogen, TN)采用凯氏蒸馏-容量法(DZ/T 0279-2016)测定。沉积物铵态氮(ammonium nitrogen, NH3-N)、硝态氮(nitrate nitrogen, NO3--N)、亚硝态氮(nitrite nitrogen, NO2-)依据国家环境保护标准中的氯化钾溶液提取-分光光度法(HJ 634-2012)进行。沉积物微生物量碳(microbial biomass carbon, MBC)和微生物量氮(microbial biomass nitrogen, MBN)采用氯仿熏蒸浸提后用碳氮分析仪进行测定(陈宗定等, 2019; 李万年等, 2020), 微生物量碳和微生物量氮是沉积物微生物生长重要的碳源和氮源, 可反映沉积物中微生物可利用的碳源和氮源。根据陈宗定等(2019)对活性有机碳(active organic carbon, AOC)的表述, 本研究将溶解性有机碳DOC、易氧化有机碳ROC和微生物量碳MBC的总和占总碳TC的比值定义为沉积物活性有机碳占比, 即AOC = (DOC+ROC+ MBC) / TC × 100%。为表征沉积物中总有机碳的动态变化, 利用微生物熵碳(qMBC)来反映总有机碳与微生物量碳的转化关系, 即qMBC = MBC/TOC × 100%, 用于指示沉积物的累积和消耗变化。沉积物碳氮比定义为总有机碳TOC与总氮TN的比值, 在一定程度上反映沉积物中碳的来源(Emerson et al, 1988)。沉积物可溶性磷酸盐采用碳酸氢钠浸提-钼锑抗分光光度法(HJ 704-2014)进行测定。
1.3 微生物总DNA提取、文库构建和16S rDNA高通量测序为进一步解析沉积物微生物群落分布特征, 采用16S rDNA高通量测序方法研究其物种组成和多样性水平。用土壤基因组DNA提取试剂盒(DP336, TIANGEN, 中国)提取沉积物样本总DNA, 经1.2%琼脂糖凝胶电泳和Qubit Fluorometer检测, 其浓度及纯度达到要求后进行16S rDNA测序文库(V3~V4区)构建。依托细菌通用引物(Klindworth et al, 2013) B341F (5′-CCTACGGGNGGCWGCAG-3′)和B785R (5′-ACTACHVGGGTATCTAATCC-3′), 参照试剂盒KAPA HiFi HotStart PCR Kit (KAPA Biosystems, Roche, 美国)说明书进行。测序文库经KAPA Library Quantification Kit定量检验合格后, 采用Illumina MiSeq测序平台(美国)进行两端并行测序(PE250)。所有测序分析在浙江杭州开泰生物技术有限公司进行。
1.4 生物信息学分析原始序列(Raw reads)的质控, 包括去除序列标签Barcode、低质量序列、嵌合体序列以及长度小于100 bp的序列等利用Vsearch v2.13.6 (Rognes et al, 2016)中的相应模块进行, 从而获得高质量序列(Clean reads)。OTU (Operational Taxonomic Unite)聚类的阈值按照97%相似度, 依据SILVA_132数据库进行物种注释, 所有分析在MOTHUR (Schloss et al, 2009)中完成。去除低丰度OTU (Reads < 2)后进行抽平分析(栗洋洋等, 2022), 获得样本的物种分类丰度表。样本Alpha多样性、Beta多样性、冗余分析(redundancy analysis, RDA)均在R v4.0.3环境下利用Microeco (Liu et al, 2021)、Phyloseq (McMurdie et al, 2013)、Vegan (Oksanen et al, 2007)等软件包进行。
1.5 微生物固碳途径中功能基因的相对丰度分析为进一步理解沉积物中微生物的固碳潜力, 参考前期预实验和相关文献(Takai et al, 2005; 王北辰, 2019), 利用qRT-PCR对卡尔文循环和还原三羧酸循环中6种关键功能基因在沉积物样本中相对丰度进行分析, 其特异性引物如表 1所示。利用16S rDNA为内参, 以提取的细菌组总DNA为模板, 利用不同功能基因的特异性引物进行定量分析。10 μL PCR反应体系参照试剂盒(TaKaRa, 日本): 5 μL 2×SYBR, 2 μL DNA模板(10 ng/μL), 0.2 μL Primer-F (10 μmol/L), 0.2 μL Primer-R (10 μmol/L), 0.2 μL ROX和2.4 μL RNase-free water。反应在ABI 7900HT仪中进行, 采用两步法扩增, 即95 ℃预变性30 s, 循环过程为95 ℃变性5 s, 60 ℃退火30 s, 72 ℃延伸30 s, 共40个循环, 结束后从60 ℃升高到95 ℃制备熔解曲线。每次反应3个平行重复孔。
| 固碳途径 | 关键酶 | 功能基因 | 引物序列(5′→3′) |
| 卡尔文循环 | 核酮糖-1, 5-二磷酸羧化/加氧酶 | cbbL | RubIgF: GAYTTCACCAARGAYGAYGA; RubIgR: TCRAACTTGATYTCYTTCCA |
| cbbM | RubII331F: AACAACCARGGYATGGGYGA; RuIIR2: TGRCCIGCICGRTGRTARTGCA |
||
| 还原三羧酸循环 | 丙酮酸: 铁氧化还原蛋白酶 | porA | porA900F: GATCAGGTCCTTCAGNCCNTTCCC; porA1101R: RTCICTTYCICCIARACC |
| nifJ | nifJ2459F: CIGGITGYGGIGAAACICC; nifJ2933R: CCIATRTCRTAIGCCCAICCRTC |
||
| 2-氧化戊二酸: 铁氧化还原蛋白酶 | oorA | oorA67F: TTCTTCGCTGGGTAYCCNATHACNCC; oorA345R: CTTGCAGCCTGTNGGMAKNCCNGT |
|
| ATP-柠檬酸裂解酶 | aclB | 892F: TGGACMATGGTDGCYGGKGGT; 1204R: ATAGTTKGGSCCACCTCTTC |
|
| 内参基因 | 16S rDNA | 1369F: CGGTGAATACGTTCYCGG; 1492R: GGWTACCTTGTTACGACTT |
样本Alpha多样性指数及基因相对定量的显著性差异主要采用方差分析(ANOVA), 组间多重比较采用Student-Newman-Keuls (SNK)检验进行。P < 0.05表示具有显著差异。
2 结果 2.1 厚壳贻贝养殖区沉积物理化性质差异显著本文主要针对贻贝养殖区(T1)和非养殖区区域的四个站位(N1、M1、N2、P2)的沉积物样本中粒径、碳氮组分等理化性质进行分析。所有沉积物样本的pH在7.2~7.8之间。通过激光粒度分析仪对沉积物的粒径进行表征, 结果(图 2)显示养殖区体积占比最大的粒径为13.18 μm, 仅次于P2 (208.93 μm)和N1 (19.95 μm)。通过对沉积物黏粒(< 2 μm)、粉粒(2~ 20 μm)和砂粒(> 20 μm)的占比分析(图 2a), 除P2位点是以砂粒为主(69.72%)外, 其余4个位点均是以粉粒为主, 其中贻贝养殖区(T1)的粉粒占比(68.80%)仅次于M1位点(78.60%)。
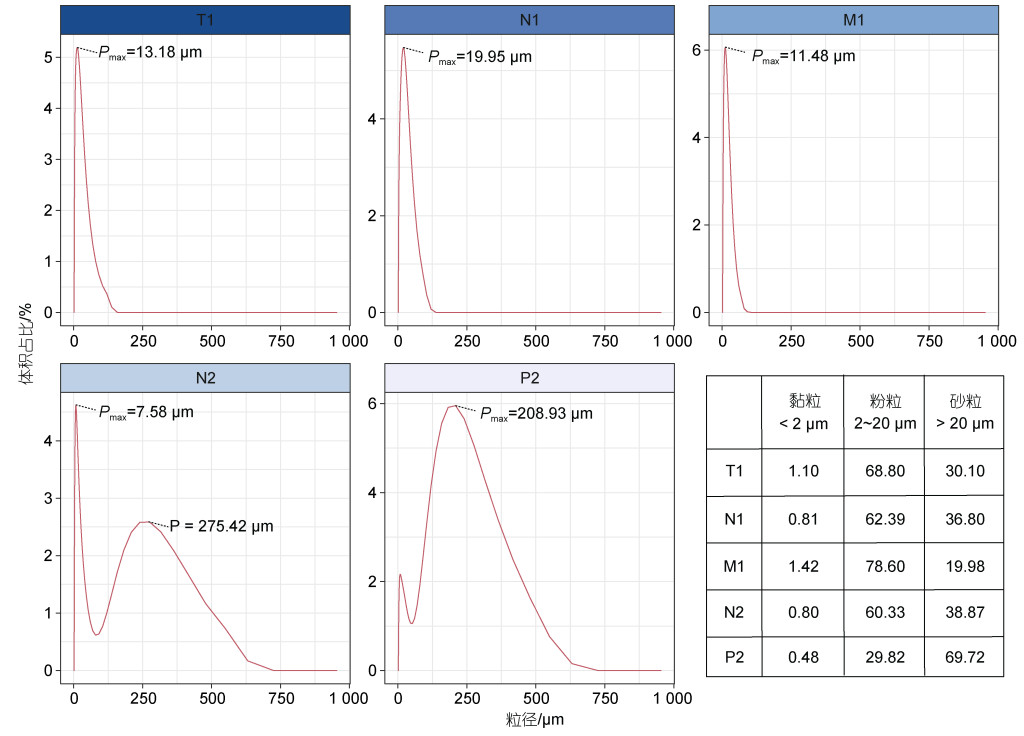 |
| 图 2 沉积物粒径分析 Fig. 2 Sediment particle size analysis |
沉积物不同碳氮组分测定结果(表 2)显示, 惰性碳(RC)占总碳比例最高为贻贝养殖区T1 (27.92%), 其次为N1 (26.87%)、M1 (20.22%)和N2 (19.22%), 最低为P2 (8.28%)。养殖区沉积物中活性有机碳(DOC+ROC+MBC)占总碳高达12.32%, 是其他站位的3~4倍。微生物量碳占总碳比最高为T1 (7.3%), 其是N2的70倍、其他3个非养殖区站位的11~15倍。微生物熵碳(qMBC)最高也在T1 (27.3%), 比4个非养殖区位点高约20倍。这表明了贻贝养殖区和非养殖区的碳组分格局差异明显, 养殖区沉积物活性很高, 大量的颗粒有机质容易被微生物进一步分解利用, 最后以惰性碳形式累积。虽然五个位点沉积物氮组分主要形式均为氨氮, 但微生物量氮(MBN)表现为T1 (4.35%) > P2 (1.33%) > M1 (0.68%) > N2 (0.43%) > N1 (0.36%)。养殖区沉积物中的碳氮比(TOC: TN)最高为16.65, 其余位点均小于9。沉积物中可溶性磷酸盐浓度为: T1 (18.96 mg/kg) > N1 (13.27 mg/kg) > P2 (11.15 mg/kg) > N2 (10.54 mg/kg) > M1 (9.44 mg/kg)。
| 理化指标 | T1 | N1 | N2 | M1 | P2 |
| 总碳TC/(g/kg) | 12.5 | 14.7 | 14.1 | 13.8 | 12.2 |
| 总有机碳/总碳/% | 26.64 | 42.38 | 33.76 | 41.16 | 34.43 |
| 溶解性有机碳/总碳/% | 2.32 | 0.95 | 0.85 | 1.45 | 1.07 |
| 易氧化有机碳/总碳/% | 2.72 | 2.11 | 1.84 | 1.88 | 1.48 |
| 微生物量碳/总碳/% | 7.28 | 0.48 | 0.14 | 0.58 | 0.66 |
| 颗粒有机碳/总碳/% | 1.52 | 1.43 | 8.87 | 1.88 | 12.62 |
| 惰性碳/总碳/% | 27.92 | 26.87 | 19.22 | 20.22 | 8.28 |
| 活性有机碳/总碳/% | 12.32 | 3.54 | 2.84 | 3.91 | 3.20 |
| 微生物熵碳/% | 27.33 | 1.12 | 0.42 | 1.41 | 1.90 |
| 总氮TN/(g/kg) | 0.2 | 0.9 | 0.8 | 0.7 | 0.6 |
| 氨氮/总氮/% | 5.06 | 1.12 | 0.78 | 0.72 | 1.19 |
| 硝基氮/总氮/% | 0.75 | 0.11 | 0.13 | 0.16 | 0.24 |
| 亚硝基氮/总氮/% | 0.22 | 0.07 | 0.07 | 0.10 | 0.13 |
| 微生物量氮/总氮/% | 4.35 | 0.36 | 0.43 | 0.68 | 1.33 |
| 碳氮比(TOC/TN) | 16.65 | 6.92 | 5.95 | 8.11 | 7.00 |
为进一步理解沉积物的性质差异, 对干燥后的沉积物粉末表面进行元素表征分析(图 3): 相比于非养殖区, O1s峰在养殖区沉积物中占比最高, 达49.5%。通过C1s峰进行高分辨率窄谱表征, 结合C-C、C-O-C、O-C=O分峰拟合, 结果(图 3)显示: 养殖区沉积物的碳氢化合物(C-C峰面积为61.41%)低于非养殖区(67.52%~71.56%), 但其碳氧化合物(C-O-C和O-C=O峰面积, 养殖区 > 16%)较高。以上结果显示了贻贝养殖区沉积物特殊的理化性质, 也表明了其可能具备塑造特殊微生物群落的潜力。
 |
| 图 3 沉积物X射线光电子能谱分析 Fig. 3 Examination of X-Ray photoelectron spectroscopy for sediment |
利用16S rDNA扩增子高通量测序对嵊泗贻贝养殖区沉积物细菌群落结构展开研究。尽管贻贝养殖区沉积物中发现超过6 000个OTU, 但细菌alpha多样性(Chao1指数和Inverse simpson指数)较非养殖区位点(N1、M1、N2、P2)差异较小(图 4a~4c)。贻贝养殖区沉积物微生物主要以Gamma变形菌纲和Delta变形菌纲为主(> 40%, 图 4d), 与其他非养殖区位点沉积物群落结构相似。通过与环境理化指标的关联分析, RDA结果清晰地指出沉积物中某些微生物类群与惰性碳RC、颗粒有机碳POC、溶解性有机碳DOC等碳组分存在明显的相关性(图 5a)。通过随机森林和环境理化指标的关联分析(图 5b), 硫微螺菌科(Thiomicrospiraceae)和JTB23类群与RC存在明显的正相关关系。与颗粒有机碳POC存在明显正相关的微生物共有9种, 分别是Schekmanbacteria_unclassified、Sandaracinaceae、Thermoanaerobaculaceae、Pirellulaceae、Cyanobiaceae、Moritellaceae、AT-s3-28、Syntrophobacteraceae、Izimaplasmatales。硫微螺菌科、Oligosphaeraceae科和Lachnospiraceae科与MBC和DOC存在显著的正相关关系。本文进一步分析了与惰性碳含量密切相关的硫微螺菌科和JTB23类群在不同样本中的相对丰度。结果(图 5c)发现硫微螺菌科在贻贝养殖区(T1)中相对丰度最高, JTB23类群的最高丰度则出现在N1位点。
 |
| 图 4 沉积物微生物群落结构分析 Fig. 4 Analysis of microbial community in sediment 注: a. OTU; b. Chao1指数; c. Inverse Simpson指数; d. 细菌纲水平可视化。T1为贻贝养殖区, N1、M1、N2和P2为非养殖区站位 |
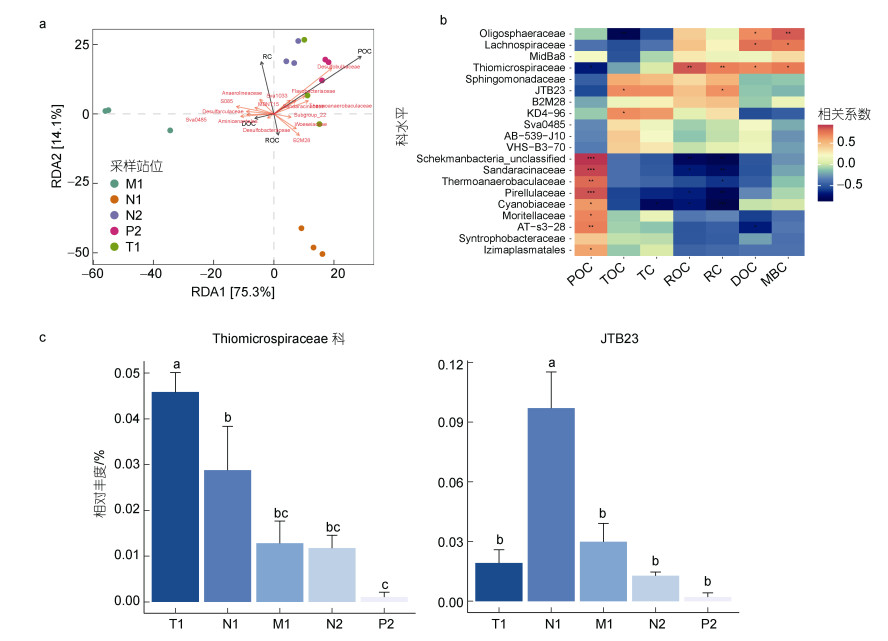 |
| 图 5 微生物与环境理化指标的关联分析 Fig. 5 Correlation analysis of microbiota and environmental factors 注: a. RDA分析; b. 应用随机森林法对环境指标与重要微生物类群的关联分析。*表示P < 0.05; **表示P < 0.01; c. Thiomicrospiraceae科和JTB23类群的相对丰度。T1为贻贝养殖区, N1、M1、N2和P2为非养殖区站位 |
为更好地了解沉积物微生物的固碳潜力, 我们利用qRT-PCR技术验证卡尔文循环和还原三羧酸循环中6种关键功能基因在不同沉积物样本中的相对丰度。结果显示所有沉积物样品均包含6种功能基因(图 6)。相比于非养殖区, 贻贝养殖区沉积物部分固碳基因相对丰度较高, 如cbbM显著高于N1、N2、M1等三个站位; nifJ则显著高于M1站位, 而与其他站位无差异。这些结果提示贻贝养殖区固碳微生物的固碳潜力较高, 但相较于非养殖区, 固碳途径的关键功能基因丰度差异较小。
 |
| 图 6 微生物固碳途径中不同功能基因相对丰度分析 Fig. 6 Relative abundance of various function genes in carbon fixation pathways of microbes 注: 16S rDNA作为内参基因, 养殖区T1站位作为基线。相对丰度分析采用2-ΔΔCt进行计算(N=3)。T1为贻贝养殖区, N1、M1、N2和P2为非养殖区站位 |
近海碳循环以及海洋渔业增汇是当前海洋蓝碳研究的前沿热点。厚壳贻贝作为我国东南沿海典型的经济养殖生物, 具滤食性特征和较强的环境适应性, 其生长主要依赖于微藻等天然饵料生物, 但随着贻贝养殖规模的不断扩大以及对天然海域的严重依赖, 特别是当前主流的筏式养殖模式以及为追求单位产量而采取的高密度养殖策略, 贻贝养殖区已开始显现出对局部海域生态环境的重要影响。
本文主要探讨了于厚壳贻贝养殖区沉积物中的碳氮组分格局及其微生物群落组成。通过碳氮组分的理化指标分析, 结果清晰地显示贻贝养殖区沉积物碳周转周期较快, 更多的以惰性碳形式存储, 这与周围四个非养殖区沉积物存在较大的差异。浙江嵊泗厚壳贻贝养殖区位于长江口毗邻海域, 独特的地理区域位置会影响着底层沉积物的理化组成。王华新等(2011)研究也发现长江口毗邻海域表层沉积物主要以细砂和粉砂为主。不同粒径的沉积物在碳转化过程中占据不同的地位。据相关文献报道, 活性有机碳主要分布在粒径 > 50 μm和 < 2 μm的颗粒中, 分布在粉砂粒的有机碳转化很慢(Balesdent et al, 1987)。碳氮比(TOC/TN)是区分海源藻类和陆源植物有机质的重要指标, 受陆源高等植物影响较大的沉积物TOC/TN较高, 通常 > 15 (Emerson et al, 1988), 受海源藻类影响较大的沉积物TOC/TN往往介于4~10之间, 而长江口毗邻海域中沉积物的TOC/TN在6~23之间(薛斌等, 2011)。贻贝养殖区沉积物的碳氮比相较于非养殖区的站位大, TOC/TN超过15。造成如此特殊的贻贝养殖区沉积物理化环境一方面是受长江径流的影响, 大量陆源淡水为周围毗邻海域带来含丰富陆源有机质的泥沙(Pang et al, 2021); 其次, 也可能受到上层贻贝养殖活动的影响。作为营滤食性策略的贻贝, 通过不断摄食藻类, 通过“粪”形式的生物沉积作用加速沉积物中颗粒有机碳的沉积(周毅等, 2003; 王俊等, 2005), 从而改变了沉积物的组成形式。另一方面, 尽管本文对贻贝养殖区中心及边缘区的4个站位进行沉积物采集并混合进行理化指标的分析, 依然可能存在一定的局限性和代表性不足的问题。不同养殖区之间存在地理差异、养殖密度不同等原因, 可能会造成底层沉积物理化性质的差异。虽然本文中并没有对沉积物来源进行探讨, 但相较于非养殖区, 贻贝养殖区沉积物粒径适中, 碳、氮、磷等关键元素存在明显差异。这也为接下来进一步系统研究不同贻贝养殖区沉积物理化差异及沉积物碳累积的时空差异分析奠定基础。
微生物是全球海洋生命有机碳的主体组分, 也是海洋生态系统碳流和能流的主要承担者, 筛选和分析重要固碳微生物丰度对理解生态系统中的碳循环具有重要的科学价值和研究意义。本文主要分析了沉积物微生物与碳组分之间的相关性。结果显示贻贝养殖区沉积物以Gamma变形菌为主要优势类群, 这是一类深度参与沉积物碳循环过程的重要微生物。已有研究表明Gamma变形菌含有RuBisCO I和RuBisCO II (cbbL, cbbM)和ATP柠檬酸裂解酶(aclAB)的基因序列, 通过对西欧和澳大利亚沿岸沉积物固碳过程研究后发现, Gamma变形菌主导了沿海沉积物暗碳固定过程, 通过进一步测算, 其参与近海沉积物中暗碳固定总量的70%~86% (Dyksma et al, 2016)。
沉积环境的差异可以支持不同功能的微生物生长, 具备塑造特殊微生物固碳过程及群落组成的潜力, 从而有可能促进沉积物中特异固碳微生物群落和代谢过程的产生。本文有关基因相对定量的分析结果指示了贻贝养殖区沉积物中拥有含cbbL、cbbM、aclB、porA、oorA、nifJ为关键基因的微生物, 可通过卡尔文循环和还原型三羧酸循环介导的固碳途径进行碳固定, 其微生物群落可能较为丰富。还原型三羧酸循环是海洋典型生境中的主要固碳途径, 如深海热液口(Campbell et al, 2004)。Hügler等(2011)概述了目前已知的不同微生物类群中6种主要固碳途径, 不同固碳途径的微生物在能量需求、金属离子需求、辅酶和氧需求方面均存在差异, 特别是还原型三羧酸循环介导固碳途径在Gamma变形菌中有一定关联。Chen等(2022)利用宏基因组也发现aclB基因介导的还原型三羧酸循环是澳大利亚菲利普港湾沉积物主要固定途径。对于沉积物中固碳微生物的来源, 可能与贻贝的养殖活动存在关联。Pfister等(2010)利用宏基因组技术研究加州贻贝(M. californianus)表面微生物群落, 结果显示这些微生物参与了碳和氮的相关循环, 其中碳固定和卡尔文循环酶约占1%。这些固碳微生物可能会随着贻贝的生物沉积作用沉降到底部, 从而参与沉积物的固碳过程。贻贝养殖区沉积物中硫微螺菌科显著富集, 这是一类与沉积物碳固定与转化有关的重要类群。Tourova等(2006)将含有卡尔文循环关键固碳基因RubisCO的Thiomicrospira-Thioalkalimicrobium- Hydrogenovibrio类群归属于硫微螺菌科, 参与生境中碳的固定, 并认为某些海洋贝类可能也是此类微生物的宿主之一。最新研究表明, 硫微螺菌科还可以参与环境中硫元素的循环(McKay et al, 2022)。这可能与沉积物高比例惰性碳具有明显的关联, 为下一步研究微生物与沉积物碳周转提供了新的思路。
4 结论与展望本文以近海特殊养殖生境为研究系统, 探讨贻贝养殖区沉积物的碳氮组分格局, 诠释特殊生境中的微生物群落组成。研究结果一方面证实了贻贝养殖区沉积物理化性质的特殊性, 另一方面也重点突出了贻贝养殖区微生物群落组成的差异性。接下来将进一步聚焦还原型三羧酸循环等固碳途径在贻贝养殖区中沉积物碳固定中的贡献及其与贻贝养殖的关联研究, 同时将深入挖掘以硫微螺菌科为代表的特殊功能微生物在沉积物惰性碳累积方面的贡献。我们认为贻贝养殖活动对底层沉积物的影响是直接且显著的, 贻贝通过摄食藻类, 如同一个“碳转运泵”加速改变着沉积物的结构和微生物群落, 这为进一步深入研究贻贝养殖“生境增汇”和贻贝-微生物生态关联提供了新的研究思路。
王义祥, 王峰, 叶菁, 等, 2016. 菌渣施用对柑橘园土壤团聚体有机碳和惰性有机碳的影响. 生态科学, 35(1): 27-33 |
王北辰, 2019. 青藏高原北部湖泊沉积物固碳微生物群落结构与固碳功能及其环境影响因素研究[D]. 武汉: 中国地质大学: 16.
|
王华新, 线薇微, 2011. 长江口表层沉积物有机碳分布及其影响因素. 海洋科学, 35(5): 24-31 |
王秀君, 章海波, 韩广轩, 2016. 中国海岸带及近海碳循环与蓝碳潜力. 中国科学院院刊, 31(10): 1218-1225 |
王俊, 姜祖辉, 陈瑞盛, 2005. 厚壳贻贝的同化率及其生物沉积作用. 中国水产科学, 12(2): 150-155 DOI:10.3321/j.issn:1005-8737.2005.02.007 |
方华军, 杨学明, 张晓平, 等, 2006. 东北黑土区坡耕地表层土壤颗粒有机碳和团聚体结合碳的空间分布. 生态学报, 26(9): 2847-2854 DOI:10.3321/j.issn:1000-0933.2006.09.009 |
刘洋荧, 王尚, 厉舒祯, 等, 2017. 基于功能基因的微生物碳循环分子生态学研究进展. 微生物学通报, 44(7): 1676-1689 |
李万年, 黄则月, 赵春梅, 等, 2020. 望天树人工幼林土壤微生物量碳氮及养分特征. 北京林业大学学报, 42(12): 51-62 DOI:10.12171/j.1000-1522.20200191 |
李斯远, 何治江, 吕泓玥, 等, 2021. 厚壳贻贝(Mytilus coruscus)养殖海域与天然生长海域的微生物群落比较研究. 海洋与湖沼, 52(1): 196-205 |
何建瑜, 赵荣涛, 刘慧慧, 2012. 舟山海域厚壳贻贝软体部分营养成分分析与评价. 南方水产科学, 8(4): 37-42 |
陈宗定, 许春雪, 安子怡, 等, 2019. 土壤碳赋存形态及分析方法研究进展. 岩矿测试, 38(2): 233-244 |
周伟, 吴红慧, 张运龙, 等, 2019. 土壤活性有机碳测定方法的改良. 土壤通报, 50(1): 70-75 |
周毅, 杨红生, 张福绥, 2003. 海水双壳贝类的生物沉积及其生态效应. 海洋科学, 27(2): 23-26 |
袁红朝, 秦红灵, 刘守龙, 等, 2011. 固碳微生物分子生态学研究. 中国农业科学, 44(14): 2951-2958 |
栗洋洋, 贾梦雪, 王锦乙, 等, 2022. 厚壳贻贝(Mytilus coruscus)中抗生素耐受细菌多样性研究. 海洋与湖沼, 53(2): 405-413 |
高立蒙, 姚鹏, 王金鹏, 等, 2016. 渤海表层沉积物中有机碳的分布和来源. 海洋学报, 38(6): 8-20 |
焦念志, 梁彦韬, 张永雨, 等, 2018. 中国海及邻近区域碳库与通量综合分析. 中国科学: 地球科学, 48(11): 1393-1421 |
潘贤章, 郭志英, 潘恺, 等, 2019. 陆地生态系统土壤观测指标与规范. 3版. 北京: 中国环境出版集团
|
薛斌, 张海生, 潘建明, 等, 2011. 长江口不同沉积环境沉积物中碳的分布和来源. 海洋学研究, 29(3): 187-193 |
BALESDENT J, MARIOTTI A, GUILLET B, 1987. Natural 13C abundance as a tracer for studies of soil organic matter dynamics. Soil Biology and Biochemistry, 19(1): 25-30 |
BOSCHKER H T S, VASQUEZ-CARDENAS D, BOLHUIS H, et al, 2014. Chemoautotrophic carbon fixation rates and active bacterial communities in intertidal marine sediments. PLoS One, 9(7): e101443 |
CAMBARDELLA C A, ELLIOTT E T, 1992. Particulate soil organic-matter changes across a grassland cultivation sequence. Soil Science Society of America Journal, 56(3): 777-783 |
CAMPBELL B J, CARY S C, 2004. Abundance of reverse tricarboxylic acid cycle genes in free-living microorganisms at deep-sea hydrothermal vents. Applied and Environmental Microbiology, 70(10): 6282-6289 |
CHEN Y J, LEUNG P M, COOK P L M, et al, 2022. Hydrodynamic disturbance controls microbial community assembly and biogeochemical processes in coastal sediments. The ISME Journal, 16(3): 750-763 |
DUCAT D C, SILVER P A, 2012. Improving carbon fixation pathways. Current Opinion in Chemical Biology, 16(3/4): 337-344 |
DYKSMA S, BISCHOF K, FUCHS B M, et al, 2016. Ubiquitous Gammaproteobacteria dominate dark carbon fixation in coastal sediments. The ISME Journal, 10(8): 1939-1953 |
EMERSON S, HEDGES J I, 1988. Processes controlling the organic carbon content of open ocean sediments. Paleoceanography, 3(5): 621-634 |
FRIEDLINGSTEIN P, O'SULLIVAN M, JONES M W, et al, 2020. Global carbon budget 2020. Earth System Science Data, 12(4): 3269-3340 |
HE Z J, HE J Y, WANG J X, et al, 2022. Comparative transcriptomic analysis of gill and gonad from Mytilus under antibiotics treatment followed by different bacteria challenge. Aquaculture, 547: 737457 |
HOSHINO T, DOI H, URAMOTO G I, et al, 2020. Global diversity of microbial communities in marine sediment. Proceedings of the National Academy of Sciences of the United States of America, 117(44): 27587-27597 |
HüGLER M, SIEVERT S M, 2011. Beyond the Calvin cycle: autotrophic carbon fixation in the ocean. Annual Review of Marine Science, 3(1): 261-289 |
KAUTSKY N, EVANS S, 1987. Role of biodeposition by Mytilus edulis in the circulation of matter and nutrients in a Baltic coastal ecosystem. Marine Ecology Progress Series, 38(3): 201-212 |
KLINDWORTH A, PRUESSE E, SCHWEER T, et al, 2013. Evaluation of general 16S ribosomal RNA gene PCR primers for classical and next-generation sequencing-based diversity studies. Nucleic Acids Research, 41: e1 |
LIU C, CUI Y M, LI X Z, et al, 2021. microeco: An R package for data mining in microbial community ecology. FEMS Microbiology Ecology, 97(2): fiaa255 |
LIU H H, HE J Y, CHI C F, et al, 2014. Differential HSP70 expression in Mytilus coruscus under various stressors. Gene, 543(1): 166-173 |
MCKAY L J, NIGRO O D, DLAKIĆ M, et al, 2022. Sulfur cycling and host-virus interactions in Aquificales-dominated biofilms from Yellowstone's hottest ecosystems. The ISME Journal, 16(3): 842-855 |
MCMURDIE P J, HOLMES S, 2013. phyloseq: An R package for reproducible interactive analysis and graphics of microbiome census data. PLoS One, 8(4): e61217 |
MIDDELBURG J J, 2011. Chemoautotrophy in the ocean. Geophysical Research Letters, 38(24): L24604 |
MORITSCH M M, YOUNG M, CARNELL P, et al, 2021. Estimating blue carbon sequestration under coastal management scenarios. Science of the Total Environment, 777: 145962 |
OKSANEN J, KINDT R, LEGENDRE P, et al, 2007. The vegan package. Community Ecology Package, 10: 719 |
PANG Y, WANG K, SUN Y G, et al, 2021. Linking the unique molecular complexity of dissolved organic matter to flood period in the Yangtze River mainstream. Science of the Total Environment, 764: 142803 |
PFISTER C A, MEYER F, ANTONOPOULOS D A, 2010. Metagenomic profiling of a microbial assemblage associated with the California mussel: a node in networks of carbon and nitrogen cycling. PLoS One, 5(5): e10518 |
ROGNES T, FLOURI T, NICHOLS B, et al, 2016. VSEARCH: a versatile open source tool for metagenomics. PeerJ, 4: e2584 |
SCHLOSS P D, WESTCOTT S L, RYABIN T, et al, 2009. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities. Applied and Environmental Microbiology, 75(23): 7537-7541 |
TAKAI K, CAMPBELL B J, CARY S C, et al, 2005. Enzymatic and genetic characterization of carbon and energy metabolisms by deep-sea hydrothermal chemolithoautotrophic isolates of Epsilonproteobacteria. Applied & Environmental Microbiology, 71(11): 7310-7320 |
TOUROVA T P, SPIRIDONOVA E M, BERG I A, et al, 2006. Occurrence, phylogeny and evolution of ribulose-1, 5-bisphosphate carboxylase/oxygenase genes in obligately chemolithoautotrophic sulfur-oxidizing bacteria of the genera Thiomicrospira and Thioalkalimicrobium. Microbiology, 152(Pt 7): 2159-2169 |
TREVATHAN-TACKETT S M, KELLEWAY J, MACREADIE P I, et al, 2015. Comparison of marine macrophytes for their contributions to blue carbon sequestration. Ecology, 96(11): 3043-3057 |
YANG J Y, HE J Y, LIU L, et al, 2022. Expression profiles of antimicrobial peptides in Mytilus coruscus. Aquaculture, 548: 737709 |
 2023, Vol. 54
2023, Vol. 54


