中国海洋湖沼学会主办。
文章信息
- 张伟佳, 李海东, 高阳, 储张杰. 2023.
- ZHANG Wei-Jia, LI Hai-Dong, GAO Yang, CHU Zhang-Jie. 2023.
- MS-222对大黄鱼(Larimichthys crocea)麻醉保活运输效果研究
- EFFECT OF ANESTHETIC TRANSPORTATION OF LARIMICHTHYS CROCEA IN MS-222
- 海洋与湖沼, 54(2): 559-565
- Oceanologia et Limnologia Sinica, 54(2): 559-565.
- http://dx.doi.org/10.11693/hyhz20220600171
文章历史
-
收稿日期:2022-06-27
收修改稿日期:2022-08-30
随着消费者对鲜活水产品需求量的日益增加, 保活运输成为商品鱼养殖及销售过程中重要的一环(秦旭等, 2018)。然而, 在保活运输过程中鱼体会因拥挤胁迫、水体振荡等因素产生应激反应导致免疫系统功能下降, 产生疾病甚至导致死亡(Tacchi et al, 2015; 吴波等, 2018)。传统车载充气运输、塑料袋充氧运输等运输方式很难降低鱼体应激反应。麻醉保活运输可以避免挣扎、创伤等机械性损伤并降低鱼体应激反应, 从而提高保活存活率。
MS-222 (间氨基苯甲酸乙酯甲磺酸盐)是一种经过美国食品与药物管理局(FDA)认可的渔用麻醉剂(吕海燕等, 2013)。因其具有非常高的脂溶性使其适合在淡水和海水中使用(Maricchiolo et al, 2011), 且对于水产品及人体均无毒害作用, 常被应用于水产品运输。迄今已报道了MS-222对多种鱼类的麻醉研究, 如牙鲆(Paralichthys olivaceus) (王秀华等, 2009)、大口黑鲈(Micropterus salmoides) (王利娟等, 2015)、大菱鲆(Scophthalmus maximus) (曹杰等, 2021)、虹鳟(Oncorhynchus mykiss) (Bowman et al, 2019)、白梭吻鲈(Sander lucioperca) (Rożyński et al, 2018, 2019), 研究结果均具有较高的实际应用价值。
大黄鱼(Larimichthys crocea)隶属于鲈形目(Perciformes), 石首鱼科(Perciformes), 黄鱼属(Larimichthys), 2020年我国大黄鱼养殖产量高达2.54×105 t (王丹等, 2021), 是我国规模最大的海水养殖鱼类。尽管目前大黄鱼人工繁育与养殖技术已逐渐成熟(张伟等, 2014), 但长途运输难、运输成本高的问题依然是大黄鱼产业链推广的技术瓶颈。其原因在于大黄鱼在运输过程中应激反应强烈, 保活死亡率极高, 因而市场上鲜活的大黄鱼少之又少。如何长时间、低成本保活运输, 如采用多少剂量的麻醉剂可以提升保活运输效果并降低麻醉损耗成为大黄鱼运输的重要研究内容。因此, 了解MS-222麻醉剂对大黄鱼运输效果及鱼体生理指标的影响, 对解决大黄鱼运输难题有重要意义。迄今有关大黄鱼麻醉保活仅限于短时间内麻醉效果的研究(张丽等, 2011), 关于长时间模拟麻醉运输的研究尚未见报道。本研究通过实验模拟麻醉运输, 研究了不同浓度MS-222麻醉剂对大黄鱼运输存活率、复苏效果、呼吸代谢、鱼体生理生化指标的影响, 为优化大黄鱼麻醉运输技术提供科学依据。
1 材料与方法 1.1 实验材料选取健康、规格相近的大黄鱼[体长(20±1) cm, 体重(50±5) g] 200尾用于实验。将大黄鱼分别置于20个100 L的容器中暂养2 d, 暂养箱水体的平均水温为(13±0.5) ℃, 水体溶解氧含量≥8 mg/L。麻醉剂选用MS-222, 模拟运输容器为45 L圆柱状水箱, 实验用水为曝气48 h以上的海水。
1.2 实验方法 1.2.1 不同浓度MS-222模拟麻醉运输保活效果运输桶平均水温为(13±0.5) ℃, 将MS-222配制0、10、20、30 mg/L四个浓度梯度, 对照组麻醉剂浓度为0 mg/L。每个容积为45 L的保活桶中放置10尾健康的大黄鱼(每组三个重复), 分别记录大黄鱼在0、2、4、6、8、10、12 h时的呼吸频率, 呼吸频率通过大黄鱼1 min内鳃盖张合次数来表达(每组重复10尾), 并测定水体溶解氧含量。运输结束后, 将大黄鱼转入充气的洁净海水中进行复苏, 记录复苏时间及复苏率。
1.2.2 实验结束后鱼体生理生化指标的测定模拟运输12 h后, 每个平行组随机选取5尾鱼, 进行尾静脉取血(无抗凝剂), 合并为一个混合样, 全血样品在4 ℃下静置2 h后, 3 000 r/min离心10 min, 收集血清, 每个浓度共三组重复样品。测定血清中皮质醇(Cortisol)含量、血糖(GLU)含量、乳酸脱氢酶(LDH)活性、谷草转氨酶(GOT)活性和葡萄糖-6-磷酸酶(G6P)活性。同时对大黄鱼的背部肌肉进行取样, 测定肌肉中的糖原(GN)和乳酸(BLA)含量。所有样品送至南京建成生物工程研究所进行测定。
1.3 数据处理使用SPSS 19.0软件对实验结果进行统计分析。采用单因素方差分析及Duncan氏多重比较法进行差异分析, 所有数据均以“平均数±标准差”表示, 显著性水平为P < 0.05。
2 结果 2.1 不同浓度MS-222模拟麻醉运输实验中溶解氧变化规律由图 1可知, 运输2 h后, 三个麻醉组水体溶解氧含量均显著高于对照组(P < 0.05)。运输6 h时, 所有实验组溶解氧含量均随时间延长显著降低(P < 0.05), 其中对照组下降速度最快。相较于运输8 h, 运输10 h时, 各处理组水体溶解氧含量随时间变化均不显著。运输10 h后, 各处理组溶解氧含量趋于稳定, 且同一处理组不同时间点之间差异不显著。另外, 在运输8~12 h时, 30 mg/L麻醉组溶解氧含量均显著高于其他处理组(P < 0.05)。
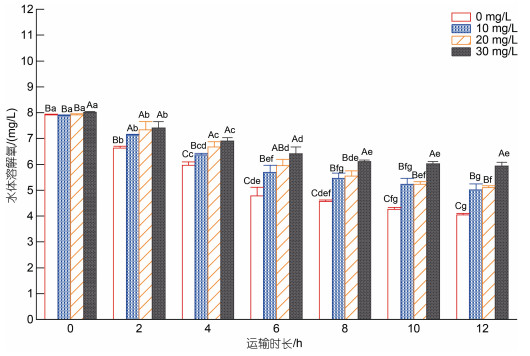 |
| 图 1 运输过程中水体溶解氧含量变化 Fig. 1 Changes of the dissolved oxygen contents in water during transportation 注: 不同的大写字母表示不同处理组之间差异显著(P < 0.05), 不同的小写字母表示同一处理组在不同时间点差异显著(P < 0.05)。下同 |
由图 2a可知, 12 h模拟运输后, 对照组大黄鱼呼吸频率显著高于三个麻醉组(P < 0.05)。在运输过程中, 30 mg/L麻醉组呼吸频率呈下降趋势, 其他三个处理组呈上升趋势。运输1 h时, 三个麻醉组呼吸频率均下降至15次/min, 且对照组呼吸频率上升至17次/min。运输3 h后, 对照组呼吸频率仍保持上升趋势; 20和10 mg/L麻醉组呈上升趋势; 30 mg/L麻醉组保持下降趋势。运输4 h后, 30 mg/L麻醉组呼吸频率显著低于其他处理组(P < 0.05)。
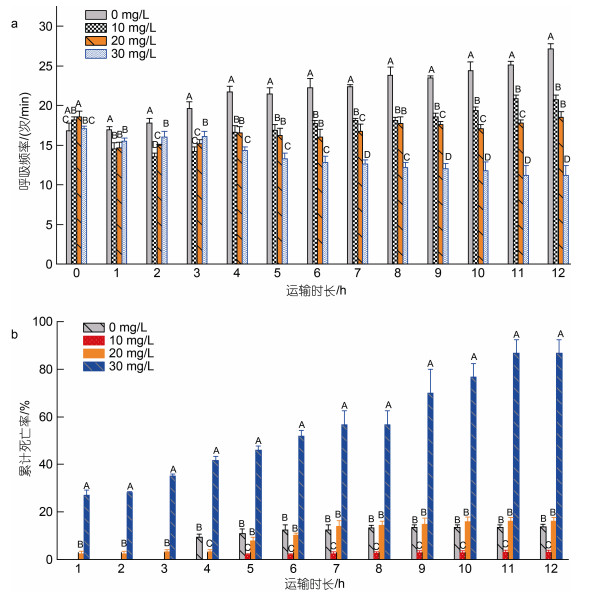 |
| 图 2 运输过程中大黄鱼呼吸频率变化及累计死亡率 Fig. 2 Changes in respiratory rate and cumulative mortality rate of L. crocea during transportation |
由图 2b可知, 对照组在运输3 h内开始出现鱼体死亡, 12 h后累计死亡率达13.7%。10 mg/L麻醉组运输12 h后累计死亡率达3%, 且显著低于其他实验组(P < 0.05)。20 mg/L麻醉组在运输1 h内出现少量鱼体死亡, 12 h后累计死亡率达16.2%。30 mg/L麻醉组在运输1 h内死亡率近30%, 且累计死亡率持续上升, 在6 h时已高于50%。由此可见, 麻醉剂浓度为10 mg/L时, 保活效果最好。
2.3 不同浓度MS-222模拟麻醉运输大黄鱼复苏时间及复苏率由表 1可知, 30 mg/L麻醉组复苏时间显著高于10 mg/L麻醉组和20 mg/L麻醉组(P < 0.05), 其复苏率显著低于10 mg/L麻醉组和20 mg/L麻醉组(P < 0.05)。10和20 mg/L麻醉组大黄鱼复苏率分别为89%±10%和63%±19%, 复苏时间分别达(90±19) min和(116±27) min, 且两组间差异不显著。
| MS-222浓度/(mg/L) | 复苏时间/min | 复苏率/% |
| 10 | 90±19b | 89±10a |
| 20 | 116±27b | 63±19a |
| 30 | 235±29a | 11±10b |
| 注: 上标a、b标注组间差异(P<0.05), 字母相同表示无显著差异 | ||
由图 3可知, 10和20 mg/L麻醉组大黄鱼血清皮质醇水平显著低于麻醉组(P < 0.05), 且两个麻醉组间皮质醇水平差异不显著。各组间血糖水平差异均不显著。
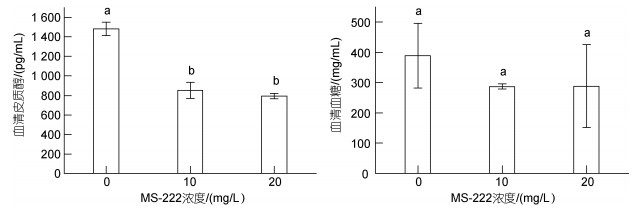 |
| 图 3 各处理组大黄鱼血清中皮质醇和血糖含量 Fig. 3 The levels of serum cortisol and blood sugar of L. crocea 注: 组间字母不同者差异显著(P < 0.05), 下同; 30 mg/L麻醉组存活样本数较少, 不具实际应用意义。下同 |
由图 4可知, 随麻醉剂浓度升高, 大黄鱼肌肉乳酸水平显著降低(P < 0.05), 其肌糖原水平显著升高(P < 0.05)。对照组肌肉乳酸水平显著高于两个麻醉组(P < 0.05), 且10 mg/L麻醉组显著高于20 mg/L麻醉组(P < 0.05)。对照组肌糖原水平显著低于两个麻醉组(P < 0.05), 且20 mg/L麻醉组显著高于10 mg/L麻醉组(P < 0.05)。
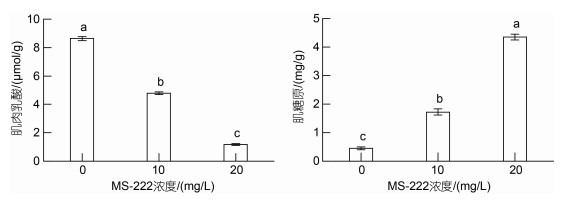 |
| 图 4 各处理组大黄鱼肌肉中乳酸和糖原含量 Fig. 4 The levels of muscle lactic acid and muscle glycogen of L. crocea |
由图 5可知, 随麻醉剂浓度升高, 大黄鱼血清中谷草转氨酶、葡萄糖-6-磷酸酶活性显著降低(P < 0.05)。对照组血清谷草转氨酶、乳酸脱氢酶及葡萄糖-6-磷酸酶活性显著高于两个麻醉组(P < 0.05), 且10 mg/L麻醉组血清谷草转氨酶、葡萄糖-6-磷酸酶活性显著高于20 mg/L麻醉组(P < 0.05), 但两个麻醉组间乳酸脱氢酶活性差异不显著。
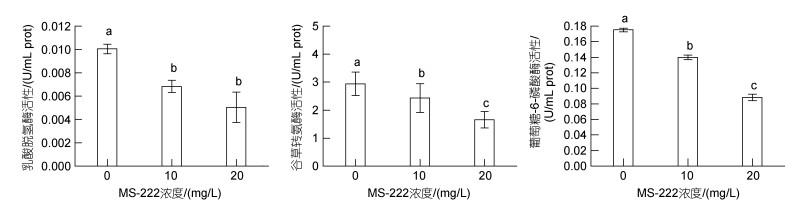 |
| 图 5 各处理组大黄鱼血清生化指标 Fig. 5 Serum biochemical indices of L. crocea |
在运输过程中添加一定剂量麻醉剂可以降低鱼体呼吸代谢水平、应激反应程度, 有效提高运输存活率(吕海燕等, 2013)。由本研究可知, MS-222浓度对大黄鱼运输效果有明显影响, 使用MS-222麻醉运输的大黄鱼呼吸频率显著降低, 且麻醉组水体溶解氧含量均显著高于对照组。当MS-222浓度升高至30 mg/L时, 大黄鱼复苏率显著降低, 复苏所需时间显著增长。当MS-222浓度为10 mg/L时, 大黄鱼保活运输存活率最高, 复苏效果最佳, 这与大口黑鲈(Micropterus salmoides) (MS-222, 10~20 mg/L)研究结果相似(王利娟等, 2015), 与大菱鲆(Scophthalmus maximus) (MS-222, 40~60 mg/L)、牙鲆(Paralichthys olivaceus) (MS-222, 60 mg/L)结果差别较大(王秀华等, 2009; 曹杰等, 2021), 与张丽等(2011)认为的大黄鱼(400 g/尾)有效麻醉浓度(MS-222, 50~60 mg/L)并不一致。这说明对于不同品种的鱼类, MS-222有效麻醉保活浓度存在较大差异(王昊龙等, 2016), 相比起其他鱼种, 大黄鱼对MS-222较为敏感。而对于同种类的鱼, MS-222的有效麻醉浓度与鱼体体重呈正相关。
30 mg/L麻醉组大黄鱼呼吸频率呈下降趋势, 水体溶解氧含量显著高于其他三个处理组, 积累死亡率在运输6 h时已高于50%, 鱼体在运输容器中一直处于翻身漂浮水面的状态。研究发现, 麻醉剂通过鳃被吸收, 并通过动脉血液输送到中枢神经系统(Cliff Rankin, 1992; Sundin et al, 2002)。Betts(2009)认为鱼体在过高浓度麻醉剂作用下, 中枢神经系统深度麻醉导致延髓的呼吸中枢功能被抑制, 引起心动过缓、低血压、呼吸频率下降和短暂停止游泳。由此推测, 30 mg/L麻醉剂会造成大黄鱼因缺氧致死。
20和10 mg/L麻醉组大黄鱼呼吸频率在1 h内下降至15次/min并保持稳定, 在3 h后持续上升, 但仍低于对照组。由此推测, MS-222在1 h内对大黄鱼麻醉作用最强, 至3 h后麻醉作用开始逐渐减轻, 但鱼体呼吸中枢功能仍未完全恢复。
对照组大黄鱼呼吸频率呈上升趋势, 水体溶解氧含量显著低于麻醉组, 且下降速度最快。运输过程中, 对照组大黄鱼活动量最大, 并伴随着浮头呼吸的现象。这可能由于鱼体处于运输胁迫下的代谢速率加快, 继而引起耗氧率增加(张云龙等, 2018), 浮头呼吸说明鱼体正处于缺氧状态, 水体中溶解氧含量过低导致大黄鱼通过增加呼吸频率来缓解机体缺氧。
3.2 MS-222麻醉保活运输对大黄鱼肌肉及血清生化指标的影响鱼体皮质醇水平是一种评判鱼体应激程度的敏感指标(张云龙等, 2018)。在研究中发现MS-222会减少或阻断与应对压力相关的下丘脑-垂体-内分泌轴(HPI)的激活, 若运输期间未能抑制HPI轴的激活会导致皮质醇的释放, 进而导致各种继发性应激反应(Rotllant et al, 2001; Parodi et al, 2014)。本实验中, 对照组大黄鱼血清皮质醇水平显著高于麻醉组。由此推测, MS-222在12 h内可以有效减轻大黄鱼的运输应激反应, 降低鱼体皮质醇水平。关于缺帘鱼(Brycon cephalus)的研究发现, 缺帘鱼存在严重的领地意识, 在运输过程中的“侵略行为”会造成鱼体损耗(Urbinati et al, 2004)。运输过程中急性拥挤胁迫会造成鱼体应激反应及血液皮质醇浓度升高(李佩等, 2020)。本实验研究发现大黄鱼不存在“侵略行为”, 运输过程中处于正常期和轻微麻醉期下的大黄鱼对外界刺激反应剧烈, 并保持聚集的状态。深度麻醉状态的大黄鱼呈无规律的散点分布于运输容器。由此推测, MS-222麻醉剂一方面通过抑制HPI轴的激活达到对大黄鱼运输的抗应激效果; 另一方面可能是通过降低大黄鱼在封闭容器中的拥挤胁迫间接减轻鱼体应激反应。
在保活运输过程中, 由于封闭水体中含氧量逐渐降低, 鱼体在供氧不足的环境中通过糖酵解提供能量, 此代谢过程导致鱼体乳酸含量升高(彭士明等, 2011)。运输胁迫中肌糖原的消耗主要与肌肉活动强度相关, 应激因子影响较小(Barcellos et al, 2010)。本实验结果显示, 随麻醉剂浓度升高, 大黄鱼肌肉乳酸水平显著降低, 其肌糖原水平显著升高。麻醉组大黄鱼肌肉糖原含量显著高于对照组, 其肌肉乳酸含量显著低于对照组, 这与鳊鱼(Parabramis pekinensis)的研究结果相似(丁亚涛等, 2019)。对应各组水体溶解氧含量的差异可以推测, 麻醉组大黄鱼在保活过程中的无氧呼吸及运动量明显低于对照组。这说明在保活运输中应用MS-222麻醉剂可以达到降低鱼体运动量, 从而减少能量损耗的效果。
乳酸脱氢酶(LDH)是一种分布于心肌细胞的糖代谢酶(田家元等, 2011), 可以作为评价组织损伤程度的指标。在点带石斑鱼(Epinephelus malabaricus)幼鱼的研究中发现, 其通过无氧呼吸供能来应对急性拥挤胁迫, 鱼体乳酸脱氢酶活性随之升高(逯尚尉等, 2011)。这是由于鱼体在应激胁迫下心肌细胞代谢加快导致细胞受损、通透性增加, 导致乳酸脱氢酶渗透至血液(Sardella et al, 2014; 金元等, 2017)。谷草转氨酶在肝脏中起到连接糖、脂质、蛋白质代谢的作用(张永嘉等, 1994), 当鱼体因应激胁迫造成肝功能受损, 会引起血清中谷草转氨酶(AST)活性的增强(Firat et al, 2011), 以应对应激损伤。本实验中, 模拟运输12 h后麻醉处理组的大黄鱼血清中乳酸脱氢酶、谷草转氨酶活性显著低于对照组, 且随不同实验组麻醉剂浓度升高, 大黄鱼血清中乳酸脱氢酶、谷草转氨酶活性显著降。这可能是由于对照组大黄鱼经长时间模拟保活运输通过分解糖原、脂质的方式为机体提供能量应对应激, 导致肝脏、心脏组织损伤。麻醉组大黄鱼呼吸代谢降低、心率较缓, 水体溶解氧含量相对较高, 无氧呼吸代谢相对较少。
葡萄糖-6-磷酸酶在机体中起到调节血糖稳态的作用(Printz et al, 1993), 当机体处于饥饿状态时, 葡萄糖-6-磷酸酶通过水解作用产生葡萄糖为鱼体供能, 因此血糖水平升高被视为是鱼体应激第二阶段的特征(Mithieux, 2005; 张云龙等, 2018)。本实验中, 对照组大黄鱼血清中葡萄糖-6-磷酸酶活性显著高于两个麻醉处理组, 对照组大黄鱼血糖水平也高于麻醉处理组, 但差异不显著。这可能是由于麻醉组大黄鱼肌肉活动强度低, 糖异生作用少, 长时间运输胁迫导致对照组大黄鱼更多地需要分解糖原维持机体供能, 过度地分解糖原引起肝脏受损, 从而影响存活率。
4 结论添加一定剂量的MS-222麻醉剂至运输水体, 可以通过降低大黄鱼呼吸代谢、应激反应程度及能量损耗, 有效提高运输存活率。低浓度(10 mg/L) MS-222可以达到最佳效果, 将运输时长增至12 h。而高浓度(30 mg/L) MS-222处理会引起大黄鱼呼吸被抑制, 造成运输存活率下降, 不适合应用于大黄鱼的保活运输。
丁亚涛, 汪之和, 王林林, 等, 2019. MS-222对鳊鱼麻醉保活运输效果的研究. 水产科学, 38(3): 296-304 DOI:10.16378/j.cnki.1003-1111.2019.03.002 |
王丹, 吴反修, 宋丹丹, 等, 2021. 中国渔业统计年鉴-2021. 北京: 中国农业出版社
|
王利娟, 程守坤, 张饮江, 等, 2015. MS-222在加州鲈鱼模拟运输中的麻醉效果. 上海海洋大学学报, 24(2): 235-241 |
王秀华, 张烨伟, 杨春志, 2009. MS-222对牙鲆麻醉效果. 渔业科学进展, 30(3): 1-6 DOI:10.3969/j.issn.1000-7075.2009.03.001 |
王昊龙, 徐弘, 安苗, 等, 2016. MS-222对杂交鲟幼鱼的麻醉效果及模拟运输试验. 山地农业生物学报, 35(1): 40-44, 50 |
田家元, 王京树, 万建义, 等, 2011. MS-222不同处理方式对史氏鲟和中华鲟麻醉效果的影响. 水生态学杂志, 32(5): 87-90 |
吕海燕, 王群, 刘欢, 等, 2013. 鱼用麻醉剂安全性研究进展. 中国渔业质量与标准, 3(2): 24-28 |
李佩, 陈见, 余登航, 等, 2020. 运输密度和时间对黑尾近红鲌皮质醇、乳酸、糖元含量的影响. 水生生物学报, 44(2): 415-422 |
吴波, 谢晶, 2018. 鱼类保活运输中应激反应诱发因素及其影响研究进展. 食品与机械, 34(7): 169-172, 203 |
张云龙, 贺亚蒙, 袁娟, 等, 2018. 运输过程中水质和鱼类生理指标的变化及运输控制策略. 水生生物学报, 42(2): 439-450 |
张永嘉, 吴泽阳, 许其爵, 等, 1994. 网箱养殖罗非鱼综合症的血清分析. 水利渔业, (2): 8-9, 47 |
张伟, 王有基, 李伟明, 等, 2014. 运输密度和盐度对大黄鱼幼鱼皮质醇、糖元及乳酸含量的影响. 水产学报, 38(7): 973-980 |
张丽, 2011. 大黄鱼保活运输及冰温保鲜的研究[D]. 上海: 上海海洋大学: 3-11.
|
金元, 何雅静, 程波, 等, 2017. 丁香酚类麻醉剂的安全性探讨. 食品安全质量检测学报, 8(1): 33-40 |
秦旭, 涂宗财, 王辉, 等, 2018. 彭泽鲫夏季低温休眠保活技术研究. 食品与机械, 34(3): 111-115 |
曹杰, 谢晶, 2021. 间氨基苯甲酸乙酯甲磺酸盐在大菱鲆模拟保活运输中的作用效果. 食品科学, 42(23): 237-244 |
逯尚尉, 刘兆普, 余燕, 2011. 密度胁迫对点带石斑鱼幼鱼生长、代谢的影响. 中国水产科学, 18(2): 322-328 |
彭士明, 施兆鸿, 李杰, 等, 2011. 运输胁迫对银鲳血清皮质醇、血糖、组织中糖元及乳酸含量的影响. 水产学报, 35(6): 831-837 |
BARCELLOS L J G, MARQUEZE A, TRAPP M, et al, 2010. The effects of fasting on cortisol, blood glucose and liver and muscle glycogen in adult jundiá Rhamdia quelen. Aquaculture, 300(1/2/3/4): 231-236 |
BETTS T, 2009. Anaesthetic and sedative techniques for aquatic animals, 3rd ed. Fish and Fisheries, 10(2): 231-232 |
BOWMAN J, HJELMSTEDT P, GRÄNS A, 2019. Non-invasive recording of brain function in rainbow trout: evaluations of the effects of MS-222 anaesthesia induction. Aquaculture Research, 50(11): 3420-3428 |
CLIFF RANKIN J, 1992. Physiology and form of fish circulation. Reviews in Fish Biology and Fisheries, 2(4): 345-347 |
FIRAT Ö, COGUN H Y, YÜZEREROĞLU T A, et al, 2011. A comparative study on the effects of a pesticide (cypermethrin) and two metals (copper, lead) to serum biochemistry of Nile tilapia, Oreochromis niloticus. Fish Physiology and Biochemistry, 37(3): 657-666 |
MARICCHIOLO G, GENOVESE L, 2011. Some contributions to knowledge of stress response in innovative species with particular focus on the use of the Anaesthetics. The Open Marine Biology Journal, 5(1): 24-33 |
MITHIEUX G, 2005. The new functions of the gut in the control of glucose homeostasis. Current Opinion in Clinical Nutrition and Metabolic Care, 8(4): 445-449 |
PARODI T V, CUNHA M A, BECKER A G, et al, 2014. Anesthetic activity of the essential oil of Aloysia triphylla and effectiveness in reducing stress during transport of albino and gray strains of silver catfish, Rhamdia quelen. Fish Physiology and Biochemistry, 40(2): 323-334 |
PRINTZ R L, MAGNUSON M A, GRANNER D K, 1993. Mammalian glucokinase. Annual Review of Nutrition, 13(1): 463-496 |
ROTLLANT J, BALM P H M, PÉREZ-SÁNCHEZ J, et al, 2001. Pituitary and interrenal function in Gilthead Sea bream (Sparus aurata L., Teleostei) after handling and confinement stress. General and Comparative Endocrinology, 121(3): 333-342 |
ROŻYŃSKI M, HOPKO M, STAWECKI K, et al, 2018. Impact of fish size, water temperature, and MS-222 concentration on inducing general anesthesia in pikeperch (Sander lucioperca). Aquaculture Research, 49(8): 2774-2781 |
ROŻYŃSKI M, ZIOMEK E, DEMSKA-ZAKĘŚ K, et al, 2019. Impact of inducing general anaesthesia with MS-222 on haematological and biochemical parameters of pikeperch (Sander lucioperca). Aquaculture Research, 50(8): 2125-2132 |
SARDELLA B A, KÜLTZ D, 2014. The physiological responses of green sturgeon (Acipenser medirostris) to potential global climate change stressors. Physiological and Biochemical Zoology, 87(3): 456-463 |
SUNDIN L, NILSSON S, 2002. Branchial innervation. Journal of Experimental Zoology, 293(3): 232-248 |
TACCHI L, LOWREY L, MUSHARRAFIEH R, et al, 2015. Effects of transportation stress and addition of salt to transport water on the skin mucosal homeostasis of rainbow trout (Oncorhynchus mykiss). Aquaculture, 435: 120-127 |
URBINATI E C, DE ABREU J S, DA SILVA CAMARGO A C, et al, 2004. Loading and transport stress of juvenile matrinxã (Brycon cephalus, Characidae) at various densities. Aquaculture, 229(1/2/3/4): 389-400 |
 2023, Vol. 54
2023, Vol. 54


