中国海洋湖沼学会主办。
文章信息
- 郭琳琳, 梁萌萌. 2023.
- GUO Lin-Lin, LIANG Meng-Meng. 2023.
- 氨基脲急性暴露对雄性斑马鱼(Danio rerio)的内分泌干扰效应研究
- ENDOCRINE DISRUPTING EFFECTS OF ACUTE EXPOSURE TO SEMICARBAZIDE ON MALE ZEBRAFISH (DANIO RERIO)
- 海洋与湖沼, 54(3): 821-828
- Oceanologia et Limnologia Sinica, 54(3): 821-828.
- http://dx.doi.org/10.11693/hyhz20220900234
文章历史
-
收稿日期:2022-09-12
收修改稿日期:2022-11-17
2. 河北省水产养殖微生物菌剂创新技术中心 河北沧州 061001
2. Hebei Aquaculture Microbial Agent Innovation Technology Center, Cangzhou 061001, China
氨基脲(semicarbazide, SEM)属于硝基呋喃类化合物, 是呋喃类药物的有机合成中间体(朱盼盼等, 2021)。SEM因具有极强的亲水性, 并可形成网状结构在水中稳定存在(马桂霞等, 2003)。其主要通过自然生成或加工过程产生并进入环境, 最终通过食物链富集到生物体内(Stadler et al, 2015)。2003年, 欧洲食品安全局表示, 氨基脲存在于某些玻璃罐装的食品中, 另外, 在奶粉、蜂蜜、海产品、卡拉胶等不同的食品和食品添加剂中均检出氨基脲残留(Maranghi et al, 2009)。徐英江等(2010)首次在潮河入海口邻近海域等的水环境中检测出氨基脲残留, 浓度为(46.41±21.22) μg/L, 在贝类中的最高浓度可达6.46 μg/kg。Yang等(2021)首次在儿童尿液中检测出氨基脲, 残留量在1.0~41.5 μg/L。可见, 氨基脲作为一种新型污染物, 已经对环境和人类造成了威胁。
已有的研究发现, 氨基脲通过抑制γ-氨基丁酸(gamma-aminobutyric acid, GABA)合成酶和拮抗N-甲基-D-天氡氨酸受体(N-methyl-D-aspartate receptors, NMDARs)发挥神经毒性效应(Maranghi et al, 2009, 2010); 另外, 通过组织学检查发现氨基脲对心脏、肝脏和肾脏均有一定的损伤作用(李嘉等, 2008; 黄卉颖等, 2021)。Maranghi等(2009)的试验发现SEM长期暴露能影响大鼠的睾丸管直径从而降低雄性生殖能力, 降低雌性大鼠体内的血浆17β-雌二醇(17β-estradiol, E2)水平。另外, Gao等(2014)的研究发现, SEM能够下调雌性斑马鱼肝脏中雌激素效应基因vtg、雌激素受体基因ERα、ERβ的表达量, Yu等(2016)的研究发现, SEM 28 d暴露通过下调卵巢中CYP17、CYP19A的基因相对表达量, 进一步降低雌性斑马鱼体内的E2水平, 发挥潜在的抗雌激素效应。上述研究多集中于SEM的抗雌激素效应上, 但是研究发现, SEM也会对雄性生物体发挥一定的内分泌扰乱效应, 例如, SEM暴露130 d后, 会影响雄性牙鲆HPG轴、kiss/gpr54系统和GABA的合成(Yue et al, 2018), 而SEM暴露雄性斑马鱼28 d的研究发现, SEM能够下调性激素相关基因的表达量影响睾酮(testosterone, T)和E2的合成(Yu et al, 2017)。
综上可知, 对于SEM的内分泌干扰效应的研究基本都集中在其对生物体的长期暴露所带来的慢性或亚慢性作用上。然而, 不同的暴露时间是导致生物体出现不同毒性效应的重要因素。例如, 药用植物卡瓦急性暴露斑马鱼20 min引起全鱼体内皮质醇水平上调, 而7 d长期暴露未引起体内皮质醇的变化(Wang et al, 2020)。纳米银材料暴露96 h增加了蚯蚓体内过氧化氢酶(catalase, CAT)的活性, 可能引起了生物体的氧化应激反应, 而暴露28 d后, 蚯蚓体内的CAT并无显著性变化(Little et al, 2021)。Cd2+暴露96 h降低华溪蟹胰腺中葡萄糖-6-磷酸脱氢酶活性(glucose-6-phosphate dehydrogenase, G6PDH)和还原型辅酶Ⅱ的(nicotinamide adenine dinucleotide phosphate, NADPH)含量, 而在Cd2+暴露21 d后, 检测到G6PDH活性和NADPH含量增加; 另外, 两种暴露条件下, X器官-窦腺复合体的组织学和超微结构也表现出不同的变化(Xuan et al, 2021)。以上研究, 进一步揭示了污染物不同的暴露时长所导致的相关指标的不同变化。而由于水生生物的游动性和所处环境的不断变化, 外源物质经常会以短期脉冲的形式对生物体造成毒理学效应。而查阅以往的研究, 有关SEM短期急性暴露对水生生物可能产生的内分泌干扰效应的报道却屈指可数。
随着斑马鱼全基因组测序的完成, 其被认为是检测内分泌干扰效应最常用的水生模式生物(Sun et al, 2010; Dai et al, 2014; Wang et al, 2020)。为了进一步完善SEM的内分泌干扰效应机制研究, 与SEM长期暴露引起的内分泌干扰效应进行对比分析, 本研究采用SEM暴露5月龄成年雄性斑马鱼, 通过对其性腺指数、性激素水平、性激素合成酶和HPG轴相关基因相对表达量的测定, 初步探究SEM急性暴露对雄性斑马鱼的内分泌的干扰效应及机制, 为进一步完善SEM对水生雄性生物的生殖影响提供更为详实的理论依据。
1 材料与方法 1.1 供试材料性成熟的5月龄雄性斑马鱼(Danio rerio), 体重(0.36±0.06) g, 体长(2.87±0.18) cm。驯养时间为4周左右。驯养期间, 将斑马鱼置于已曝气处理的自来水中, 隔天换水一次, 每天喂食水蚯蚓两次, 实验前24 h停止喂食。驯养时环境条件为: pH 7.5±0.5, 溶解氧浓度(7.0±0.1) mg/L, 光暗比控制在14(L) : 10(D), 水温控制为(27±1) ℃ (高素, 2013)。
1.2 仪器与试剂仪器: SN-682型放射免疫γ计数器(上海核福光电仪器有限公司); TGL-16M台式高速冷冻离心机(上海卢湘仪离心机仪器有限公司); UV-2102C分光光度计(上海尤尼柯仪器有限公司); JS-380C全自动凝胶成像分析仪(上海培清科技有限公司); 琼脂糖凝胶电泳仪(美国Cosmo Bio公司); MycyclerTM Thermal cycler PCR仪(美国Bio-Rad公司); Mastercycler® ep realplex实时荧光定量PCR仪(德国Eppendorf公司)。
试剂: 暴露实验用盐酸氨基脲(semicarbazide hydrochloride, 纯度≥99.0%, CAS No: 563-41-7)购自Sigma公司(sigma-84940); 碘[I125]17β-雌二醇放射免疫分析药盒(100T)、碘[I125]睾酮放射免疫分析药盒(100T)均购自北京北方生物技术研究所; RNA反转录试剂盒PrimeScript® Treagent Kit With gDNA Eraser (Perfect Real Time)购自TaKaRa (Dalian, China)公司; 荧光实时定量RT-PCR试剂盒SYRB® Premix Ex TaqTM Ⅱ (Tli RNaseH Plus)试剂盒购自TaKaRa (Dalian, China)公司; 引物由上海生工生物工程技术服务有限公司合成。
1.3 氨基脲暴露实验本实验采用盐酸氨基脲(Semicarbazide hydrochloride, 纯度≥99.0%, CAS No: 563-41-7)进行暴露, 氨基脲对成年雄性斑马鱼的暴露采用半静态毒性试验方法。由于氨基脲的半数致死浓度为26.29 mg/L (高素, 2013)和氨基脲的最高环境检出浓度为46.41 µg/L (徐英江等, 2010), 以及在毒理学的实验室研究中为了诱导生物体产生明显的效应从而推测毒物可能的毒理机制, 通常会选用相对较高的毒物暴露浓度(Xu et al, 2013)。在本研究中我们将盐酸氨基脲溶于去离子水中, 制备浓度为10 mg/mL的氨基脲母液, 并置于4 ℃冰箱保存备用。SEM的暴露浓度设置为1、10、100、1 000 µg/L, 并设置空白对照组。将曝气处理后的自来水装入10 L烧杯中, 并添加氨基脲暴露液至相应浓度, 每个处理组设置三个平行, 每个烧杯内含16条雄性成年斑马鱼, 每天更换暴露液一次, 连续暴露96 h。
暴露结束后, 按照空白对照组、1、10、100、1 000 µg/L氨基脲浓度组从低到高依次取样。采用50%的乙醇将斑马鱼麻醉, 称重并进行活体解剖, 取其精巢和脑组织(Yu et al, 2017)。将每4条成年雄性斑马鱼的精巢或脑组织设为一个样本, n=4, 称重后液氮速冻置于后–80 ℃冰箱保存, 用于后续实验。
1.4 性激素水平测定将冻存于–80 ℃冰箱的雄鱼的性腺组织取出, 平衡至室温后, 加入磷酸缓冲液充分研磨, 采用乙醚法对性激素进行抽提。成年雄性斑马鱼精巢中E2和T两种性激素水平的测定采用北京北方生物技术有限公司购入的放免试剂盒进行放射性免疫分析法测定(Tian et al, 2010)。
1.5 实时定量PCR测定基因相对表达量Trizol法对成年雄性斑马鱼性腺和脑进行总RNA提取。采用分光光度法测定RNA浓度以及电泳法测定RNA质量, 只有OD260/280比值在1.9~2.0范围内的RNA样本可以被用来进行下一步实验(Yu et al, 2016)。根据反转录试剂盒说明将各处理组样品中等量的总RNA样本反转为cDNA。
引物序列来源于文献(Hoffmann et al, 2006), 或Primer Premier 5.0设计(见表 1)。随后进行实时定量PCR检测相关基因的转录水平。操作依照SYRB® Premix Ex TaqTM Ⅱ试剂盒说明进行: 反应体系为20 μL, 包括10 μL SYBR® Premix Ex TaqTM Ⅱ, 0.4 μL ROX Reference Dye, 0.6 μL正引物(10 μmol/L)和0.6 μL反应物(10 μmol/L), 4 μL cDNA, 4.4 μL dH2O; 反应程序为: 95 ℃ 10 min; 95 ℃ 15 s, 56 ℃ 30 s, 72 ℃ 30 s 40 cycles; 融解曲线为95 ℃ 15 s, 由60 ℃步升至95 ℃, 每10 s升温0.5 ℃。
| 基因名称 | 序列(5′~3′) | 序列号 | 参考文献 |
| CYP19A | CTGAAAGGGCTCAGGACAA | AF226620.1 | Hoffmann et al, 2006 |
| TGGTCGATGGTGTCTGATG | |||
| CYP11A | TGCTGTGGACGCTTTATGA | NM 152953.2 | Hoffmann et al, 2006 |
| CAATACGAGCGGCTGAGAT | |||
| CYP17 | GACAGTCCTCCGCACATCT | NM 212806.3 | Hoffmann et al, 2006 |
| GCATGATGGTGGTTGTTCA | |||
| 3β-HSD | AAAGAGCGGTGGTGGGGGGAAA | BC093118.1 | |
| CAGCAGAAAGATGGGCAGAATGGG | |||
| FSHβ | TGAGCGCAGAATCAGAATG | NM 205624.1 | Hoffmann et al, 2006 |
| AGGCTGTGGTGTCGATTGT | |||
| LHβ | TTGGCTGGAAATGGTGTCT | AY714132.1 | Hoffmann et al, 2006 |
| TCCACCGATACCGTCTCAT | |||
| sGnRH | GTTTGTGTGTTGGAGGTCAGT | NM_182887.2 | |
| TTGGAGAATCAGCAGGAATAG | |||
| cGnRH | GGGGCTGATGCTGTGTCTGA | NM_181439.4 F | |
| GGATGTTTCTTCCCTGCGGT | |||
| CYP19B | CGACAGGCCATCAATAACA | AF183908 | Hoffmann et al, 2006 |
| CGTCCACAGACAGCTCATC | |||
| β-actin | AGGTCATCACCATTGGCAAT | AF057040.1 | |
| GATGTCGACGTCACACTTCAT | |||
| Elf-α | TGCCAGTGTTGCCTTCGTC | L23807.1 | |
| AATCTTCCATCCCTTGAACCAG |
解剖并称重性腺和全鱼质量, 用来计算性腺指数(gonadosomatic index, GSI) (Yu et al, 2016):
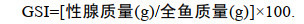 (1)
(1)用两种内参基因elf-α和β-actin的Ct值的几何平均数修正目的基因的Ct值, 并进行相应的对数转换(Gao et al, 2014), 则:
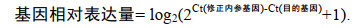 (2)
(2)使用SPSS23.0软件对实验数据进行处理, 采用单因素方差分析(One-way ANOVA)比较不同浓度SEM暴露条件下与空白对照组之间的差异。采用GraphPad Prism 8进行作图, 若0.01<P<0.05表示差异显著; 若P<0.01则表示差异极显著。
2 结果与分析 2.1 SEM暴露96 h对雄性斑马鱼性腺指数的影响脏器系数的变化可较好地反映外源物质对该脏器的毒性综合情况(孙建新等, 2009)。SEM暴露结束后雄性斑马鱼的性腺指数见图 1。研究发现, 96 h的SEM急性暴露条件下, 最高浓度1 000 µg/L暴露组性腺指数显著低于对照组(P<0.05), 其他浓度组无差异显著性。该结果表明, SEM急性暴露96 h能够对雄性斑马鱼的精巢产生毒性作用, 引起性腺指数降低。
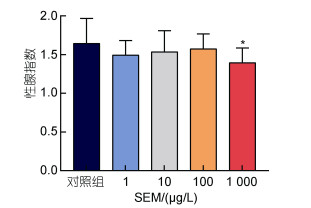 |
| 图 1 氨基脲急性暴露96 h对雄性斑马鱼性腺指数的影响 Fig. 1 Effects of 96 h acute SEM exposure on gonadosomatic index in male zebrafish 注: *P<0.05, **P<0.01 |
精巢是成年雄性斑马鱼性激素合成的主要场所, 为进一步研究SEM对成年雄性斑马鱼的内分泌干扰效应, 本实验选择E2和T这两种斑马鱼体内的雌激素和雄激素进行研究。
如图 2所示, SEM暴露成年雄性斑马鱼96 h后, 在100、1 000 µg/L较高浓度组, 精巢内E2含量极显著降低(P<0.01), 在1、10 µg/L暴露组E2含量无显著性变化。而精巢内T含量, 在1 µg/L出现显著降低(0.01<P<0.05), 1 000 µg/L暴露组极显著降低(P<0.01), 而10、100 µg/L SEM暴露对T含量无显著影响。
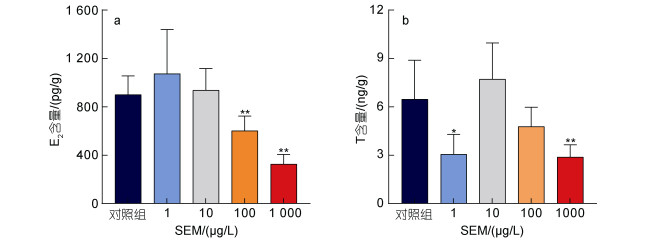 |
| 图 2 氨基脲急性暴露96 h对雄性斑马鱼精巢内性激素含量的影响 Fig. 2 Effects of 96 h acute SEM exposure on sex hormones in male zebrafish sperms 注: a. 雄性斑马鱼精巢内E2含量的变化; b. 雄性斑马鱼精巢内T含量的变化。*P<0.05, **P<0.01 |
雄性斑马鱼精巢内CYP19A、3β-HSD、CYP17和CYP11A等一系列类固醇基因所编码的合成酶, 参与T和E2的合成(Ma et al, 2012)。
如图 3所示, SEM急性暴露成年雄性斑马鱼96 h后, 精巢内CYP11A、CYP17和3β-HSD的基因相对表达量在SEM不同浓度组均显著低于空白对照组。芳香化酶基因CYP19A的相对表达量在1、10、100 µg/L三个浓度组均出现极显著升高(P<0.01), 而在1 000 µg/L浓度组无显著性变化。
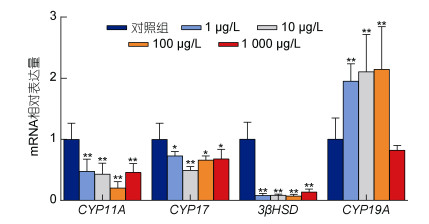 |
| 图 3 氨基脲急性暴露96 h对雄性斑马鱼类固醇合成酶基因相对表达量的影响 Fig. 3 Effects of 96 h acute SEM exposure on steroid synthetase gene expression in male zebrafish 注: *P<0.05, **P<0.01 |
斑马鱼体内类固醇合成酶受到HPG轴上游调控, 下丘脑分泌GnRHs (gonadotrophin releasing hormones)作用于垂体, 垂体分泌GtHs包括FSH (follicle-stimulating hormone)和LH (luteinizing hormone)两种促性腺激素, 对性腺中T和E2进行调控(Hachfi et al, 2012)。同时, T和E2又可以通过负反馈调节影响GnRHs、FSH以及LH的分泌。
如图 4所示, SEM急性暴露成年雄性斑马鱼96 h后, 脑中sGnRH的基因相对表达量在SEM不同浓度均出现极显著下降, 而cGnRH除了在1 µg/L无显著变化外, 在其余三个浓度组均升高。FSHβ、LHβ的基因相对表达量均在1 µg/L SEM暴露组极显著低于对照组(P<0.01), 其余浓度组无显著性变化。而脑中芳香化酶基因P450aromB的相对表达量在1 µg/L浓度组极显著降低, 10、100 µg/L两个浓度组均显著升, 而在1 000 µg/L浓度组低于对照组, 但无显著性差异。
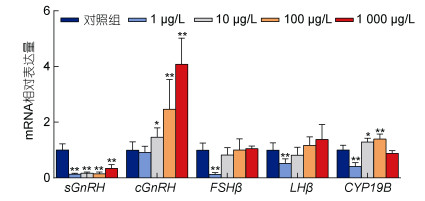 |
| 图 4 氨基脲急性暴露96 h对雄性斑马鱼脑内HPG轴基因相对表达量的影响 Fig. 4 Effects of 96 h acute exposure to SEM on the expression of HPG axis genes in male zebrafish brain 注: *P<0.05, **P<0.01 |
GSI是评价鱼类性腺成熟度的标志之一, 也是研究鱼类繁殖的关键指标(Jimoh et al, 2021)。Hassanzadeh(2017)研究发现, 对羟基苯甲酸甲酯暴露21 d通过显著降低雄性斑马鱼的GSI抑制其性腺的发育。朱乐玫等(2012)的研究发现, SEM染毒组雄性小鼠睾丸和附睾脏器系数均低于对照组。本研究中, 高浓度1 000 µg/L SEM急性暴露96 h引起雄性斑马鱼GSI显著降低, 这与Yu等(2017)采用SEM暴露雄性斑马鱼28 d的结果一致, 进一步说明精巢是SEM作用的靶器官, 长期和短期的SEM暴露都会导致性腺组织的退行性变化。
为进一步研究SEM对成年雄性斑马鱼的内分泌干扰效应, 我们对斑马鱼精巢内主要的雌激素E2和雄激素T进行了测定, 研究发现SEM急性暴露96 h雄性斑马鱼性腺内E2含量和T含量在不同浓度组下降。已有的研究发现, SEM不能直接与雌激素受体结合, 而是通过降低内源性E2水平发挥其抗雌激素作用(Maranghi et al, 2010)。Yue等(2018)和Yu等(2017)采用SEM长期暴露雄性牙鲆和雄性斑马鱼, 血浆内E2和T含量在不同浓度组(1、10、100和1 000 µg/L)均显著降低。而在本次急性暴露实验中, E2仅在中高浓度组(100和1 000 µg/L)极显著降低, SEM对雌性斑马鱼暴露96 h的研究中, E2也仅在中高浓度组降低(Yu et al, 2016), 我们认为, 这主要与暴露时间的长短有关。斑马鱼体内的E2主要是在性腺中由T转化而来, 本研究中T含量仅在1 µg/L和1 000 µg/L降低, 一方面可能与性激素合成相关基因CYP11A、3β-HSD1、CYP17、CYP19A的调控有关, 另一方面SEM作用下E2含量的降低也会促进T的转化, 从而导致T含量的变化。
鱼类的性激素在合成过程中, CYP11A (cytochrome P450 11A)首先将胆固醇转化为孕烯醇酮, 3β-HSD (3β-hydroxysteroid dehydrogenase)和CYP17 (cytochrome P450 17)是催化孕烯醇酮的关键酶, 在T合成中发挥重要作用(Tokarz et al, 2015), 而CYP19A (cytochrome P450 19A)能够催化T向E2的转化, 是E2合成的关键限速酶(Cheshenko et al, 2008)。本研究中, CYP11A、3β-HSD、CYP17三种酶的mRNA相对表达量在SEM不同暴露组均显著下调, 这与SEM暴露雄性斑马鱼28 d的结果一致(Yu et al, 2017), 说明SEM通过抑制CYP11A、3β-HSD1、CYP17等类固醇合成酶的表达抑制T的合成。而CYP19A是调控T向E2表达的关键酶, 本研究中, CYP19AmRNA表达水平在1、10、100 µg/L显著上调, 而28 d不同浓度SEM暴露均抑制了CYP19AmRNA的相对表达水平(Yu et al, 2017), 这与本研究的结论相反, 研究发现, 急性应激会引起生物体神经元活动的快速变化, 伴随着内分泌和神经递质的释放, 迅速重建生理稳态; 相反, 慢性应激涉及外源物质的重复、长期作用, 导致神经递质、激素和基因表达的持续变化和稳定适应(Demin et al, 2021)。因此, 我们认为SEM 96 h暴露后CYP19AmRNA相对表达量的升高可能与诱发了斑马鱼体内的代偿机制有关(Ankley et al, 2007)。
鱼体内性激素的水平还受到下丘脑-垂体-性腺轴(hypothalamic-pituitary-gonad axis, HPG)的调控(Hachfi et al, 2012), 斑马鱼下丘脑中含有cGnRH (chicken gonadotropin-releasing hormone)和sGnRH (seabream gonadotropin-releasing hormone)两种促垂体形态, 而sGnRH被认为是斑马鱼体内促性腺激素释放的主要调节器(Bassi et al, 2016)。已有的研究表明, SEM能够拮抗下丘脑内的NMDAR, 而NMDAR可刺激下丘脑分泌GnRH, 本研究中, 不同浓度的SEM急性暴露均引起sGnRHmRNA表达水平的下调, 可能与SEM的这种潜在神经毒性有关(Maranghi et al, 2010; Yu et al, 2017; Yue et al, 2018)。而相反的是, cGnRHmRNA的表达水平却出现不同程度的上调, 已有的研究发现, 不同外源污染物暴露雄性斑马鱼也会导致同样的变化, 即下调sGnRHmRNA表达水平而上调cGnRHmRNA的表达水平(Liu et al, 2013; Liang et al, 2018)。GnRHs作为斑马鱼体内性激素的重要调节因子, GnRHs的任何改变都可能影响鱼体内性激素的平衡, 而性激素也会通过负反馈机制影响GnRHs的分泌(Wang et al, 2019), 本研究中cGnRH的升高, 很可能与性激素E2和T的降低引起了HPG轴的这种负反馈调节机制有关。而SEM暴露雄性斑马鱼28 d的研究中, sGnRH的mRNA相对表达量并未发生显著性变化, 这可能与长期暴露条件下, 体内E2对sGnRH的负反馈调节作用有关(Yu et al, 2017), 而本研究96 h的急性暴露由于作用时间尚短, 主要受到SEM神经毒性的影响。
FSH作为斑马鱼体内主要的促性腺激素, 能够促进芳香化酶转录, 进而促进雄激素向雌激素的合成(Espigares et al, 2015), LH与睾丸间质细胞膜上LH受体相互作用, 导致类固醇合成关键酶活性的改变, 从而影响胆固醇向T的合成(Kwon et al, 2016), 本研究中, 1 µg/LSEM暴露下调FSHβ和LHβmRNA水平, 我们认为这也是相同暴露浓度下类固醇生成酶基因和性激素降低的主要原因, 而28 d SEM暴露在10、100和1 000 µg/L也引起FSHβ、LHβmRNA相对表达量的下降, 而本研究96 h在这三个浓度下并无显著变化, 我们认为这可能与cGnRHmRNA表达水平上调引起机体的负反馈调节, 从而弱化了sGnRH降低对FSHβ、LHβ的影响有关。
CYP19B (cytochrome P450 19B)作为斑马鱼体内的另一种重要的芳香化酶, 主要在脑中存在并表达, 参与神经内分泌代谢过程, 并维持精巢的活动。研究发现, 硬骨鱼脑中CYP19B的表达受到性激素的反馈调节(相福生等, 2018), 本研究中CYP19B在1 µg/L SEM下降, 可能主要与该浓度下T水平的降低有关, 而在10、100 µg/L出现显著上调, 可能与机体的反馈调节机制和急性暴露引起的补偿效应有关。另外, 鳗鱼脑中CYP19B表达量的上调伴随着LHβ的升高(Zhang et al, 2014), 本研究中, 1 µg/L SEM暴露下LHβ表达量的下调可能也与该浓度下CYP19BmRNA相对表达量的降低有关, 而10、100 µg/L SEM暴露下CYP19B表达量的升高可能与LHβ表达量的升高有关。而以往的研究中, 还没有关于SEM暴露下对雄性水生生物脑中CYP19B的影响分析。
在对SEM可能引起的基因表达变化进行分析时, 我们发现1 000 µg/L SEM暴露并未引起CYP19A、CYP19B、FSHβ和LHβ表达量的变化, 而10 µg/L SEM暴露的影响反而较为明显, 这可能是因为许多内分泌干扰物(EDCs)的扰乱效应与浓度之间并不具有简单的剂量效应线性关系, 而往往呈现U型或者倒U型曲线(Vandenberg et al, 2012), 这一现象也在SEM暴露雌性斑马鱼的相关研究中有所体现(Yu et al, 2016)。
4 结论通过SEM对成年雄性斑马鱼的急性暴露实验发现, 在低剂量(1 µg/L)暴露条件下, SEM通过抑制雄性斑马鱼下丘脑内HPG轴起始因子sGnRHmRNA的表达, 进一步下调垂体中FSHβ、LHβ、CYP19BmRNA相对表达量, 在中高剂量(10、100、1 000 µg/L)暴露条件下, SEM抑制雄性斑马鱼下丘脑内HPG轴起始因子sGnRHmRNA的表达, 上调cGnRH、CYP19BmRNA的表达, 从而减弱了sGnRH的降低对FSHβ、LHβ的抑制作用; 不同浓度的SEM暴露会降低精巢内的E2水平, 抑制类固醇合成酶基因CYP11A、3β-HSD1、CYP17mRNA相对表达量, 抑制T的合成, 而T和E2短期内的降低诱发机体的补偿机制从而上调CYP19A的表达量, 促进T向E2的转化, 并诱导HPG轴的负反馈调节。综上所述, SEM通过影响雄性斑马鱼脑中HPG轴相关因子, 抑制性腺中类固醇合成酶的表达, 进一步抑制性激素的合成, 从而发挥潜在的内分泌干扰效应。
马桂霞, 张同来, 张建国, 等, 2003. 盐酸氨基脲的分子结构及热分解特性. 火炸药学报, 26(2): 58-61 DOI:10.3969/j.issn.1007-7812.2003.02.020 |
朱乐玫, 袁萍, 张贝贝, 等, 2012. 原花青素对氨基脲致雄性小鼠生殖毒性的拮抗作用. 实用预防医学, 19(2): 165-168 DOI:10.3969/j.issn.1006-3110.2012.02.002 |
朱盼盼, 邢丽红, 李兆新, 等, 2021. 甲壳类水产品中氨基脲研究进展. 青岛大学学报(工程技术版), 36(3): 55-64 |
孙建新, 安娟, 连军, 2009. 影响实验动物脏器重量及脏器系数因素分析. 实验动物科学, 26(1): 49-51 DOI:10.3969/j.issn.1006-6179.2009.01.014 |
李嘉, 2008. 食品添加剂副产物氨基脲的毒理学研究[D]. 长春: 吉林农业大学: 17-20.
|
相福生, 黄天晴, 谷伟, 等, 2018. 硬骨鱼脑芳香化酶的表达调节、功能推测以及类固醇合成酶的研究进展. 水产学杂志, 31(1): 42-51 DOI:10.3969/j.issn.1005-3832.2018.01.009 |
徐英江, 孙玉增, 宋秀凯, 等, 2010. 潮河口邻近海域氨基脲污染现状调查研究. 海洋与湖沼, 41(4): 538-542 |
高素, 2013. 氨基脲对斑马鱼(Danio rerio)抗雌激素效应研究[D]. 青岛: 中国海洋大学: 12-16.
|
黄卉颖, 贺永健, 刘焕, 等, 2021. 氨基脲诱导的SD大鼠氧化应激与肝脏代谢损伤研究. 食品安全质量检测学报, 12(18): 7357-7363 |
ANKLEY G T, JENSEN K M, KAHL M D, et al, 2007. Ketoconazole in the fathead minnow (Pimephales promelas): reproductive toxicity and biological compensation. Environmental Toxicology and Chemistry, 26(6): 1214-1223 DOI:10.1897/06-428R.1 |
BASSI I, ANDRÉ V, MARELLI F, et al, 2016. The zebrafish: an emerging animal model for investigating the hypothalamic regulation of reproduction. Minerva Endocrinologica, 41(2): 250-265 |
CHESHENKO K, PAKDEL F, SEGNER H, et al, 2008. Interference of endocrine disrupting chemicals with aromatase CYP19 expression or activity, and consequences for reproduction of teleost fish. General and Comparative Endocrinology, 155(1): 31-62 DOI:10.1016/j.ygcen.2007.03.005 |
DAI Y J, JIA Y F, CHEN N, et al, 2014. Zebrafish as a model system to study toxicology. Environmental Toxicology and Chemistry, 33(1): 11-17 DOI:10.1002/etc.2406 |
DEMIN K A, TARANOV A S, ILYIN N P, et al, 2021. Understanding neurobehavioral effects of acute and chronic stress in zebrafish. Stress, 24(1): 1-18 |
ESPIGARES F, CARRILLO M, GÓMEZ A, et al, 2015. The forebrain-midbrain acts as functional endocrine signaling pathway of Kiss2/Gnrh1 system controlling the gonadotroph activity in the teleost fish European sea bass (Dicentrarchus labrax). Biology of Reproduction, 92(3): 70 |
GAO S, WANG W, TIAN H, et al, 2014. An emerging water contaminant, semicarbazide, exerts an anti-estrogenic effect in zebrafish (Danio rerio). Bulletin of Environmental Contamination and Toxicology, 93(3): 280-288 |
HACHFI L, COUVRAY S, SIMIDE R, et al, 2012. Impact of endocrine disrupting chemicals[EDCs] on hypothalamic-pituitary-gonad-liver [HPGL] axis in fish. World Journal of Fish and Marine Sciences, 4(1): 14-30 |
HASSANZADEH N, 2017. Histopathological evaluation of the zebrafish (Danio rerio) testis following exposure to methyl paraben. International Journal of Aquatic Biology, 5(2): 71-78 |
HOFFMANN J L, ORIS J T, 2006. Altered gene expression: a mechanism for reproductive toxicity in Zebrafish exposed to benzo[a]pyrene. Aquatic Toxicology, 78(4): 332-340 |
JIMOH O A, RAIMI C O, ADEBAYO E T, et al, 2021. Relationship between body measurement and gonadosomatic index of Clarias gariepinus (BURCHELL 1822) and Heterobranchus longifilis (VALENCIENNES 1840) broodstocks. International Journal of Fisheries and Aquaculture, 7(1): 1-10 |
KWON B, SHIN H, MOON H B, et al, 2016. Effects of tris (2-butoxyethyl) phosphate exposure on endocrine systems and reproduction of zebrafish (Danio rerio). Environmental Pollution, 214: 568-574 |
LIANG Y Q, HUANG G Y, LIN Z, et al, 2018. Reproductive effects of synthetic progestin norgestrel in zebrafish (Danio rerio). Chemosphere, 190: 17-24 |
LITTLE S, JOHNSTON H J, STONE V, et al, 2021. Acute waterborne and chronic sediment toxicity of silver and titanium dioxide nanomaterials towards the oligochaete, Lumbriculus variegatus. NanoImpact, 21: 100291 |
LIU X S, JI K, JO A, et al, 2013. Effects of TDCPP or TPP on gene transcriptions and hormones of HPG axis, and their consequences on reproduction in adult zebrafish (Danio rerio). Aquatic Toxicology, 134/135: 104-111 |
MA Y B, HAN J, GUO Y Y, et al, 2012. Disruption of endocrine function in in vitro H295R cell-based and in in vivo assay in zebrafish by 2, 4-dichlorophenol. Aquatic Toxicology, 106/107: 173-181 |
MARANGHI F, TASSINARI R, LAGATTA V, et al, 2009. Effects of the food contaminant semicarbazide following oral administration in juvenile Sprague-Dawley rats. Food and Chemical Toxicology, 47(2): 472-479 |
MARANGHI F, TASSINARI R, MARCOCCIA D, et al, 2010. The food contaminant semicarbazide acts as an endocrine disrupter: evidence from an integrated in vivo/in vitro approach. Chemico-Biological Interactions, 183(1): 40-48 |
STADLER R H, VERZEGNASSI L, SEEFELDER W, et al, 2015. Why semicarbazide (SEM) is not an appropriate marker for the usage of nitrofurazone on agricultural animals. Food Additives & Contaminants: Part A, 32(11): 1842-1850 |
SUN L W, WEN L L, SHAO X L, et al, 2010. Screening of chemicals with anti-estrogenic activity using in vitro and in vivo vitellogenin induction responses in zebrafish (Danio rerio). Chemosphere, 78(7): 793-799 |
TIAN H, RU S G, BING X, et al, 2010. Effects of monocrotophos on the reproductive axis in the male goldfish (Carassius auratus): potential mechanisms underlying vitellogenin induction. Aquatic Toxicology, 98(1): 67-73 |
TOKARZ J, MÖLLER G, DE ANGELIS M H, et al, 2015. Steroids in teleost fishes: a functional point of view. Steroids, 103: 123-144 |
VANDENBERG L N, COLBORN T, HAYES T B, et al, 2012. Hormones and endocrine-disrupting chemicals: low-dose effects and nonmonotonic dose responses. Endocrine Reviews, 33(3): 378-455 |
WANG D M, YANG L E, WANG J T, et al, 2020. Behavioral and physiological effects of acute and chronic kava exposure in adult zebrafish. Neurotoxicology and Teratology, 79: 106881 |
WANG Q, YANG H R, YANG M, et al, 2019. Toxic effects of bisphenol A on goldfish gonad development and the possible pathway of BPA disturbance in female and male fish reproduction. Chemosphere, 221: 235-245 |
XU T, CHEN L G, HU C Y, et al, 2013. Effects of acute exposure to polybrominated diphenyl ethers on retinoid signaling in zebrafish larvae. Environmental Toxicology and Pharmacology, 35(1): 13-20 |
XUAN R J, WU H, LI Y J, et al, 2021. Comparative responses of Sinopotamon henanense to acute and sub-chronic Cd exposure. Environmental Science and Pollution Research, 28(26): 35038-35050 DOI:10.1007/s11356-021-13230-z |
YANG H M, JIANG X L, WANG Y L, et al, 2021. Determination of semicarbazide residue in human urine samples using liquid chromatography-tandem mass spectrometry. Food Additives & Contaminants: Part A, 38(6): 922-930 |
YU M, FENG Y L, ZHANG X N, et al, 2017. Semicarbazide disturbs the reproductive system of male zebrafish (Danio rerio) through the GABAergic system. Reproductive Toxicology, 73: 149-157 |
YU M, ZHANG X N, GUO L L, et al, 2016. Anti-estrogenic effect of semicarbazide in female zebrafish (Danio rerio) and its potential mechanisms. Aquatic Toxicology, 170: 262-270 |
YUE Z H, YU M, ZHANG X N, et al, 2018. The anti-androgenic effect of chronic exposure to semicarbazide on male Japanese flounder (Paralichthys olivaceus) and its potential mechanisms. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 210: 30-34 |
ZHANG S, ZHANG Y, CHEN W P, et al, 2014. Aromatase (Cyp19a1b) in the pituitary is dynamically involved in the upregulation of lhb but not fshb in the vitellogenic female ricefield eel Monopterus albus. Endocrinology, 155(11): 4531-4541 |
 2023, Vol. 54
2023, Vol. 54

