中国海洋湖沼学会主办。
文章信息
- 展建强, 蔡廷柱, 郭希瑞, 张柯馨, 卢怡凝, 刘志刚. 2023.
- ZHAN Jian-Qiang, CAI Ting-Zhu, GUO Xi-Rui, ZHANG Ke-Xin, LU Yi-Ning, LIU Zhi-Gang. 2023.
- 温度和盐度对三倍体葡萄牙牡蛎(Crassostrea angulata)稚贝生长和存活的影响
- EFFECTS OF TEMPERATURE AND SALINITY ON GROWTH AND SURVIVAL OF TRIPLOID CRASSOSTREA ANGULATA JUVENILES
- 海洋与湖沼, 54(4): 1158-1164
- Oceanologia et Limnologia Sinica, 54(4): 1158-1164.
- http://dx.doi.org/10.11693/hyhz20221100284
文章历史
-
收稿日期:2022-11-01
收修改稿日期:2023-02-28
2. 青岛前沿海洋种业有限公司 山东青岛 266105;
3. 广东省海产无脊椎动物科技创新中心 广东湛江 524088
2. Qingdao Frontier Marine Seed Co. Ltd., Qingdao 266105, China;
3. Guangdong Marine Invertebrate Science and Technology Innovation Center, Zhanjiang 524088, China
葡萄牙牡蛎(Crassostrea angulata)又称福建牡蛎, 属于软体动物门(Mollusca), 双壳纲(Bivalvia), 珍珠贝目(Pterioida), 牡蛎科(Ostreidae), 巨蛎属(Crassostrea), 喜好高温环境, 其广泛分布在福建、浙江、广东等南方沿海(张跃环等, 2014)。由于牡蛎食物链短、生长快、产量高, 且经济效益好(巫旗生等, 2015; 杜俊鹏等, 2018)。近年来, 随着养殖规模的扩大和产量不断提高, 葡萄牙牡蛎呈现养殖个体小型化、生长慢、死亡率升高、出肉率低等性状衰退现象(巫旗生等, 2013), 严重影响其产量和经济效益。因此, 获得经济性状好、品质高的优良品种成为解决葡萄牙牡蛎养殖产业可持续发展的关键。
三倍体具有生长速率快、个体大、糖原含量高等优点(贾圆圆, 2021), 其育种技术首次应用在贝类是在1981年利用细胞松弛素B (Cytochalasin B, CB)成功诱导出的美洲牡蛎(Crassostrea virginica)三倍体(Stanley et al, 1981), 之后, 在海湾扇贝(Argopecten irradians) (Tabarini, 1984)、栉孔扇贝(Chlamys farreri) (张晨晨等, 2010)、长牡蛎(Crassostrea gigas) (Wang et al, 2002)、近江牡蛎(Crossostrea ariakensis) (王康, 2014)等在许多贝类中都开展过三倍体的诱导的研究, 但成功应用的仅在牡蛎中。三倍体由于性腺发育较低, 因此用于性腺发育的能量可用于生长, 其在繁殖时期肥满度高, 生长速度加快。同时, 在繁育期间可避免因产卵导致软体部消瘦影响口感和出肉率等问题。近年来, 三倍体牡蛎为养殖产业的热点之一。国内外关于三倍体葡萄牙牡蛎的研究多集中在育种(贾圆圆, 2021)、介质诱导(崔玉婷等, 2020)、生长(Zhang et al, 2022)等, 而关于环境因子如温度、盐度对三倍体葡萄牙牡蛎生长和存活的影响研究尚未见报道。本文通过研究不同温度和盐度对三倍体葡萄牙牡蛎稚贝生长和存活的影响, 旨在探究稚贝的存活和生长的适宜温度和盐度范围, 提高稚贝存活率, 为三倍体葡萄牙牡蛎人工养殖提供参考依据。
1 材料与方法 1.1 材料实验所用三倍体葡萄牙牡蛎稚贝取自福建莆田, 2022年4月2日运回广东海洋大学广东省南海经济无脊椎动物健康养殖工程研究中心实验室暂养7 d。暂养期间, 水温26~28 ℃, 盐度31~33, pH 8.0~8.3, 持续微充气, 饵料为微拟球藻(Nannochloropsis sp.)。从运回的稚贝中随机抽取60个健康、壳型完整的稚贝, 测得稚贝平均壳长为(2.26±0.11) mm, 平均壳高为(2.10±0.17) mm。
1.2 方法根据预实验结果, 三倍体葡萄牙牡蛎稚贝温度耐受性实验, 以2 ℃为梯度设置6个低温组(4~14 ℃)、以1 ℃为梯度设置6个高温组(34~39 ℃)和1个常温对照组(26.5 ℃); 生长和存活温度实验, 均以2 ℃为梯度在8~34 ℃范围设置14组。盐度耐受性实验, 以2.6为梯度设置11个低盐组(5.2~31.2)、以2.4为梯度设置11个高盐组(36.0~60.0)以及1个自然海水对照组(32.5); 生长和存活盐度实验, 均以2.6为梯度在10.4~46.8范围设置15组。各组实验均在装有800 mL过滤海水的烧杯(容积1 000 mL)中进行, 每组设置3个重复, 每个烧杯放稚贝30个, 温度实验采用将烧杯置于恒温槽中控温, 控温精度±0.1 ℃, 盐度实验通过向实验海水中添加海水晶溶液或经曝气淡水, 盐度测量使用光学盐度计(型号LH-Y100)测定, 温度计和盐度计在使用前均经过严格校正。每隔8 h升高或降低温度1~2 ℃和盐度2.4~2.6, 达到各组预设温度和盐度后开始实验。
1.3 日常管理温度和盐度耐受性实验周期均为4 d, 温度和盐度生长存活实验均进行15 d。各实验均在室内自然光照下进行, 实验期间各组均持续微充气, 每天投喂微拟球藻(Nannochloropsis sp.)液3次, 温度和盐度各组饵料投喂前分别进行等温和等盐处理, 各组每天需等温或等盐换水1/2, 隔天进行一次全换水。在实验过程中将死贝及时移出, 记录其死亡时间及数量, 吸除污物以防止污染水质, 实验结束时用游标卡尺(精确度: 0.01 mm)测量所有存活稚贝壳长、壳高, 并计算成活率。
1.4 指标测定 1.4.1 存活率和增长率的测定实际存活率和相对存活率的计算:
 (1)
(1)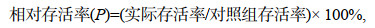 (2)
(2)增长率计算:
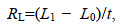 (3)
(3)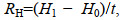 (4)
(4)式中, RL为壳长增长率(mm/d), L1和L0分别为实验结束和实验开始时稚贝的平均壳长(mm); RH为壳高增长率(mm/d), H1和H0分别为实验结束和实验开始时稚贝的平均壳高(mm); t为实验时间(d)。稚贝死亡的界定以贝壳完全张开, 针刺激无反应为标准。
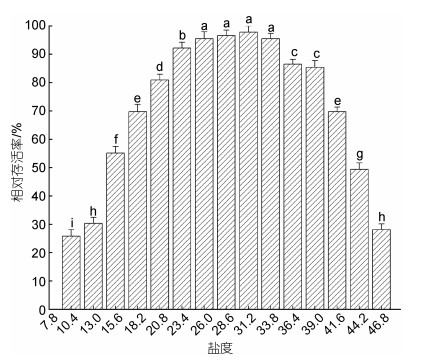
1.4.2 半致死温(盐)度的测定实验结束时, 可计算三倍体葡萄牙牡蛎稚贝在48 h和96 h两个时间节点的半致死温(盐)度。在实验周期内稚贝50%死亡的温度(LT50)和盐度(LS50), 采用二点法(刘志刚等, 2007b)计算, 公式为
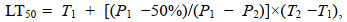 (5)
(5)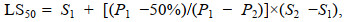 (6)
(6)式中, T1、T2分别为稚贝存活率接近50%的高、低端温度, S1、S2分别为稚贝存活率接近50%的高、低端盐度, P1、P2为对应的相对存活率。
1.4.3 稚贝适宜、较适宜以及最适宜生存温(盐)度的界定在实验周期15 d内, 以稚贝50%死亡的温度作为生存临界温度, 上下限之间的温度作为稚贝适宜生存温度范围, 临界温度采用上述公式(1)计算; 较适宜生存温度为以稚贝30%死亡的温度为临界温度, 上下限之间的温度作为较适宜生存温度范围; 最适生存温度为经多重比较无显著差异且存活率最高的几组对应的温度范围(刘志刚等, 2006)。
稚贝适宜、较适宜以及最适宜生存盐度求法同上。
1.4.4 稚贝适宜、较适宜以及最适宜生长温(盐)度的测定将实验期间稚贝壳长、壳高增长率为最优组增长率的30%所对应的温度作为壳长和壳高增长临界温度(求法采用二点法), 上下限之间的温度作为稚贝壳长、壳高适宜生长温度范围, 将上述2个指标范围的重叠部分作为稚贝适宜生长温度; 将实验期间稚贝壳长、壳高增长率为最优组增长率的70%所对应的温度作为壳长和壳高增长临界温度, 上下限之间的温度则为壳长、壳高较适宜生长温度范围, 把上述2个指标温度范围的重叠部分作为稚贝较适宜生长温度; 最适生长温度为经多重比较无明显差异且存活率最高的几组所对应的温度范围(刘志刚等, 2007a)。
稚贝适宜、较适宜以及最适宜生长盐度求法同上。
1.5 数据处理实验数据采用平均值±标准差(
三倍体葡萄牙牡蛎稚贝在不同温度48 h和96 h下相对存活率如表 1, 由方差分析结果得出, 温度对三倍体葡萄牙牡蛎稚贝存活率影响显著(P < 0.05)。以48 h和96 h为时间节点, 采用二点法计算, 得出48 h稚贝半致死低、高温分别为(4.71±0.04) ℃和(37.08±0.02) ℃; 96 h稚贝半致死低、高温分别为(7.83±0.45) ℃和(36.31±0.11) ℃。
| 温度/℃ | 相对存活率/% | |
| 48 h | 96 h | |
| 4 | 47.19±1.01e | 16.83±3.06f |
| 6 | 55.06±2.02d | 31.46±4.08e |
| 8 | 59.55±3.03cd | 51.69±3.06d |
| 10 | 61.80±1.01c | 53.93±3.06cd |
| 12 | 66.29±2.02c | 58.43±2.04c |
| 14 | 74.16±1.01b | 67.42±1.02b |
| 26(对照) | 100.00±0.00a | 100.00±0.00a |
| 34 | 79.78±1.01b | 66.29±3.06b |
| 35 | 75.28±2.02b | 61.80±3.06b |
| 36 | 66.29±1.01c | 58.43±3.06c |
| 37 | 51.69±3.03d | 31.46±5.10d |
| 38 | 31.46±1.01e | 16.85±2.04e |
| 39 | 28.09±1.01f | 8.99±1.01f |
| 注: 上标不同字母表示各组之间差异显著(P < 0.05) | ||
实验周期15 d内, 各温度组三倍体葡萄牙牡蛎稚贝的存活率见图 1。当水温为22~28 ℃时, 稚贝存活率均在90%以上, 且随着温度向两极的变化, 相对存活率逐渐降低。
 |
| 图 1 不同温度下三倍体葡萄牙牡蛎稚贝相对存活率 Fig. 1 elative survival rates of triploid C. angulata juveniles at different temperatures 注: 不同字母表示差异显著(P < 0.05) |
由适宜、较适宜和最适宜生存温度的界定, 通过二点法计算得稚贝适宜生存温度为11.05~33.81 ℃, 较适宜生存温度为17.24~30.65 ℃, Duncan法比较表明, 温度为22.00~28.00 ℃时, 存活率最高且均在90%以上, 各组间差异不显著(P > 0.05), 因而三倍体葡萄牙牡蛎稚贝最适宜生存温度为22.00~28.00 ℃。
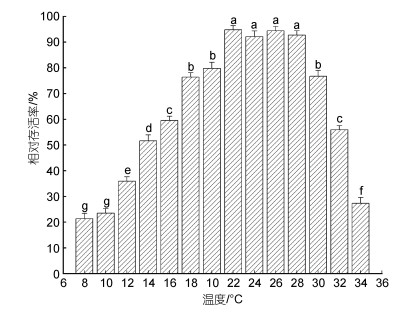
2.1.3 三倍体葡萄牙牡蛎稚贝适宜、较适宜和最适宜生长温度温度对葡萄牙牡蛎稚贝壳长和壳高生长影响如图 2, 由图 2可知, 随温度升高, 壳长和壳高日增长率趋势基本一致, 先增大后减小, 且二者增长率分别在26~28 ℃均无明显差异(P > 0.05), 水温26 ℃时日增长率均达到最大, 分别为0.062 mm/d和0.0593 mm/d。二点法计算结果, 壳长增长的适宜温度为11.68~33.63 ℃, 较适宜温度为18.65~31.05 ℃; 壳高增长的适宜温度为12.00~33.35 ℃, 较适宜温度为18.46~29.83 ℃。由适宜、较适宜和最适宜生长温度的界定, 稚贝适宜生长温度为12.00~33.35 ℃, 较适宜生长温度为18.46~29.83 ℃, 最适宜生长温度为26.00~28.00 ℃。
 |
| 图 2 不同温度下三倍体葡萄牙牡蛎稚贝的壳长和壳高日增长率 Fig. 2 Daily growth rates of shell length and shell height of triploid C. angulata juveniles at different temperatures 注: 不同字母表示差异显著(P < 0.05) |
葡萄牙牡蛎稚贝在不同盐度48 h和96 h下实际存活率和相对存活率如表 2, 由方差分析结果得出, 盐度对葡萄牙牡蛎稚贝存活率影响显著(P < 0.05)。以48 h和96 h为时间节点, 采用二点法计算, 得出48 h稚贝半致死盐度中, 低盐端和高盐端分别为(7.28±0.97)和(56.31±0.76); 96 h稚贝半致死盐度中, 低盐端和高盐端分别为(11.09±0.35)和(53.16±0.67)。
| 盐度 | 相对存活率/% | |
| 48 h | 96 h | |
| 5.2 | 9.57±1.02e | 2.25±1.02e |
| 7.8 | 58.42±6.06d | 12.35±1.02e |
| 10.4 | 74.15±4.04c | 46.07±8.16d |
| 13.0 | 83.14±2.02b | 58.42±5.10c |
| 15.6 | 85.39±1.01b | 76.53±5.10b |
| 18.2 | 85.39±2.02b | 82.65±4.08b |
| 20.8 | 97.75±1.01a | 97.75±3.06a |
| 23.4 | 97.75±0.00a | 97.75±1.02a |
| 26.0 | 97.75±1.01a | 97.75±1.02a |
| 28.6 | 98.88±1.01a | 97.75±1.02a |
| 31.2 | 98.88±1.01a | 98.88±1.02a |
| 32.5(对照) | 100.00±1.01a | 100.00±0.00a |
| 36.0 | 98.99±1.01a | 98.99±1.02a |
| 38.4 | 98.99±1.01a | 97.96±1.02a |
| 40.8 | 98.99±1.01a | 97.96±1.02a |
| 43.2 | 98.99±1.01a | 94.38±2.04a |
| 45.6 | 97.98±2.02a | 92.86±2.04ab |
| 48.0 | 97.98±1.01a | 78.57±4.08b |
| 50.4 | 75.76±3.03b | 75.51±4.08b |
| 52.8 | 61.80±2.02c | 52.81±3.06c |
| 55.2 | 57.30±6.06c | 27.66±5.10d |
| 57.6 | 39.32±4.04d | 17.98±7.14d |
| 60.0 | 12.35±2.02e | 0.00±0.00e |
| 注: 上标不同字母表示各组之间差异显著(P < 0.05) | ||
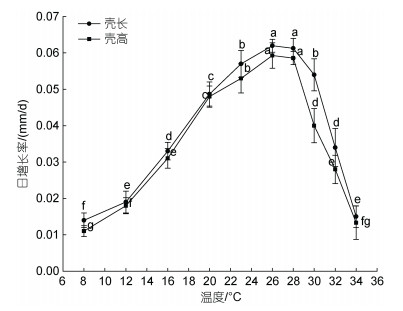
实验周期15 d内, 各盐度组三倍体太平洋牡蛎稚贝的存活率见图 3。由适宜、较适宜和最适宜生存盐度的界定, 通过二点法计算稚贝低端存活临界盐度为15.06, 高端存活盐度为44.13, 三倍体葡萄牙牡蛎稚贝适宜生存盐度为15.06~44.13, 较适宜盐度为18.27~41.57, Duncan法比较表明, 盐度为23.4、26.0、28.6、31.2和33.8四组存活率均在90%以上, 且各组间差异不显著(P > 0.05), 因而可认为三倍体葡萄牙牡蛎稚贝最适宜生存盐度为23.4~33.8。
 |
| 图 3 不同盐度下三倍体葡萄牙牡蛎稚贝相对存活率 Fig. 3 Relative survival rates of triploid C. angulata juveniles at different salinities 注: 不同字母表示差异显著(P < 0.05) |
随盐度增加, 稚贝壳长、壳高均先增大后减小, 且不同盐度对三倍体葡萄牙牡蛎稚贝壳长和壳高日增长率差异显著(P < 0.05) (图 4)。盐度为23.4时, 稚贝壳长、壳高日增长率最大, 分别为0.062 mm/d和0.0593 mm/d, 经二点法及多重比较得稚贝壳长适宜增长盐度为11.61~45.63, 较适宜盐度18.20~28.60, 最适盐度为23.40~26.00; 葡萄牙牡蛎稚贝的壳高增长的适宜盐度为11.76~45.39, 较适盐度为20.80~ 28.60, 最适盐度为23.40~26.00。即葡萄牙牡蛎稚贝适宜生长盐度为11.76~45.39, 较适宜生长盐度为20.80~28.60, 最适生长盐度为23.40~26.00。
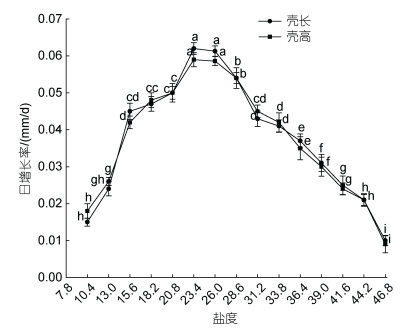 |
| 图 4 不同盐度下三倍体葡萄牙牡蛎稚贝的壳长、壳高日增长率 Fig. 4 Daily growth rates of shell length and shell height of triploid C. angulata juveniles at different salinities 注: 不同字母表示差异显著(P < 0.05) |
温度和盐度是影响海水贝类动物存活和生长的重要环境因子, 对海洋生物的行为、生长和生命周期具有显著影响(包永波等, 2004; 阎希柱等, 2009; Kim et al, 2009; Brucet et al, 2012)。有关学者对这两个因素的相互作用加以研究, 结果表明, 只有当其中一个因子接近极限范围, 另一个处于安全范围时, 二者才能表现出明显的相互作用(Tettelbach et al, 1981)。因此通过单因素的实验亦能反映温度和盐度分别对稚贝生长和存活的影响。
3.1 温度对三倍体葡萄牙牡蛎稚贝存活和生长的影响外界温度的不适或剧烈变化会影响双壳贝类的血细胞和酶活性, 导致贝类体内免疫防御能力降低, 从而对生长发育产生消极影响(Gagnaire et al, 2006)。温度过低导致岩扇贝(Crassadoma gigantea)免疫酶活力下降, 影响扇贝的正常生长发育(王潇, 2018)。在适宜温度范围内, 升高温度, 其纤毛活动加强, 摄食活动增强, 因此升温更有利于稚贝的生长(王丹丽等, 2005; 包永波等, 2006; 王冲等, 2018)。熊本牡蛎(C. sikamea) (王涛等, 2017)稚贝适宜生长温度和适宜存活温度分别为24~28 ℃和20~28 ℃, 表明在适宜温度范围内高温对其生长和存活更有利, 皱肋文蛤(Meretrix lyrata) (栗志民等, 2010)、泥蚶(Tegillarca granosa) (尤仲杰等, 2001)等研究中也有相似变化规律。本研究三倍体葡萄牙牡蛎稚贝最适生存温度为22~28 ℃, 最适生长温度为26~28 ℃, 在最适宜温度范围内高温更有利于稚贝生长存活, 与上述研究报道一致。这可能与其是南方养殖品种有关。
在实验温度范围内, 随温度的升高稚贝存活率和壳长、壳高日增长率均表现为先升高后降低的趋势。壳金长牡蛎(徐成勋等, 2017)幼虫培育适宜水温为25 ℃, 栉江珧(Atrina pectinata) (李浩浩等, 2017)早期幼虫生长适宜温度和最适温度分别为22~30 ℃和26 ℃, 皱肋文蛤(栗志民等, 2010)最适生存温度和最适生长温度分别为24~30 ℃和27~30 ℃, 大珠母贝(Pinctada maxima) (谭杰等, 2016)最适存活温度为25.01 ℃。以上双壳贝类各生长指标均为先升高后降低趋势。与本实验中壳长、壳高日增长率和存活率趋势基本一致, 在对壳黑长牡蛎温度耐受性研究中, 从水温20 ℃升高到33 ℃, 黑长牡蛎幼虫生长速率增加, 而存活率却不断减少(许岚等, 2017), 与本研究结果不一致, 可能的原因是长牡蛎温度耐受性较高, 实验所设温度梯度在其所承受范围之内, 因而在实验中生长速率未曾下降。
3.2 盐度对三倍体葡萄牙牡蛎稚贝存活和生长的影响三倍体葡萄牙牡蛎稚贝适宜生存盐度为15.06~ 44.13, 较适宜生长盐度为18.27~41.57, 表明该贝属于广盐性贝类, 其适宜生存盐度低盐端比文蛤(Meretrix meretrix Linnaeus) (6.5~39.5) (曹伏君等, 2010)、皱肋文蛤(4.3~40.5) (栗志民等, 2010)、缢蛏(Sinonovacula constricta) (8.4~32.4) (林笔水等, 1990)适宜生存盐度分别高8.56、10.76和6.66, 可能的原因是后者为滩涂性贝类, 受突变盐度变化机会多, 从而更适应大范围的变化。三倍体葡萄牙牡蛎稚贝在盐度为26.0~33.8范围存活率均在90%以上, 随盐度增加, 壳长、壳高生长却明显受到抑制, 可能的原因在高盐或低盐度环境下, 渗透压的改变超过贝类本身可调控范围, 正常生理平衡被打破, 会对贝类摄食率产生影响, 导致用于生长的能量减少, 最终稚贝生长速度变慢, 长期处于此环境中甚至会因摄食不足导致死亡, 影响存活率(Pechenik et al, 2000)。本研究表明, 三倍体葡萄牙牡蛎稚贝最适宜生存盐度为23.4~ 33.8, 最适宜生长盐度为23.40~26.00, 在最适宜盐度范围内低盐更有利于葡萄牙牡蛎的生长和存活。这与葡萄牙牡蛎自然分布在沿海或潮间带等低盐地区有关。稳定且适宜的盐度更有利于三倍体葡萄牙牡蛎稚贝的生长和存活, 因此, 为提高三倍体葡萄牙牡蛎稚贝存活率和生长速率, 盐度应控制在23.40~ 26.00。
4 结论本实验研究了不同温度和盐度对三倍体葡萄牙牡蛎稚贝生长和存活的影响。结果发现, 三倍体葡萄牙牡蛎稚贝适宜生存温度为11.05~33.81 ℃, 最适宜生存温度为22~28 ℃, 适宜生长温度为12.00~33.35 ℃, 最适宜生长温度为26~28 ℃; 最适宜生存盐度为23.4~33.8, 最适宜生长盐度为23.40~26.00。因此三倍体葡萄牙牡蛎在温度为26~28 ℃, 盐度为23.40~ 626.00的海区更有利于稚贝的存活和生长。
王丹丽, 徐善良, 尤仲杰, 等, 2005. 温度和盐度对青蛤孵化及幼虫、稚贝存活与生长变态的影响. 水生生物学报, 29(5): 495-501 DOI:10.3321/j.issn:1000-3207.2005.05.004 |
王冲, 孙同秋, 曾海祥, 等, 2018. 温度、盐度和规格对毛蚶滤水率的影响. 水产学杂志, 31(6): 30-35 |
王涛, 李琪, 2017. 不同盐度和温度对熊本牡蛎(Crassostrea sikamea)稚贝生长与存活的影响. 海洋与湖沼, 48(2): 297-302 |
王康, 2014. 盐度诱导太平洋牡蛎和近江牡蛎三倍体的研究[D]. 青岛: 中国海洋大学: 38-44.
|
王潇, 2018. 温度对岩扇贝免疫酶、无水保活的影响及通径分析[D]. 大连: 大连海洋大学: 15-20.
|
尤仲杰, 徐善良, 边平江, 等, 2001. 海水温度和盐度对泥蚶幼虫和稚贝生长及存活的影响. 海洋学报, 23(6): 108-113 |
包永波, 尤仲杰, 2004. 几种环境因子对海洋贝类幼虫生长的影响. 水产科学, 23(12): 39-41 DOI:10.3969/j.issn.1003-1111.2004.12.013 |
包永波, 尤仲杰, 2006. 海洋滤食性贝类摄食率影响因子研究现状. 海洋水产研究, 27(1): 76-80 |
刘志刚, 王辉, 栗志民, 等, 2007a. 温度对不同大小墨西哥湾扇贝生长的影响. 热带海洋学报, 26(5): 47-52 |
刘志刚, 王辉, 栗志民, 等, 2007b. 墨西哥湾扇贝高起始致死温度的研究. 中国水产科学, 14(5): 778-785 |
刘志刚, 刘建勇, 王辉, 等, 2006. 墨西哥湾扇贝稚贝盐度适应性的研究. 湛江海洋大学学报, 26(6): 12-16 |
许岚, 李琪, 孔令锋, 等, 2017. 温度和盐度对壳黑长牡蛎幼虫生长和存活的影响. 中国海洋大学学报, 47(8): 44-50 |
杜俊鹏, 王昭萍, 于瑞海, 等, 2018. 盐度对香港巨牡蛎♀×葡萄牙牡蛎♂杂交子代早期杂种优势的影响. 中国海洋大学学报, 48(1): 31-39 |
巫旗生, 宁岳, 曾志南, 等, 2013. 福建沿海葡萄牙牡蛎养殖群体遗传多样性的AFLP分析. 上海海洋大学学报, 22(3): 328-333 |
巫旗生, 曾志南, 宁岳, 等, 2015. 葡萄牙牡蛎工厂化人工育苗技术. 福建水产, 37(5): 399-405 |
李浩浩, 于瑞海, 杨智鹏, 等, 2017. 温度和盐度对栉江珧受精卵孵化及早期幼虫生长与存活的影响. 中国海洋大学学报, 47(4): 22-27 |
张晨晨, 王昭萍, 于瑞海, 等, 2010. 低渗诱导栉孔扇贝三倍体及与其它方法的比较. 中国海洋大学学报, 40(S1): 71-75 |
张跃环, 王昭萍, 喻子牛, 等, 2014. 养殖牡蛎种间杂交的研究概况与最新进展. 水产学报, 38(4): 613-624 |
林笔水, 吴天明, 1990. 温度与盐度和缢蛏幼体生存、生长及发育的关系. 水产学报, 14(3): 171-178 |
栗志民, 刘志刚, 姚茹, 等, 2010. 温度和盐度对皱肋文蛤幼贝存活与生长的影响. 生态学报, 30(13): 3406-3413 |
贾圆圆, 2021. 牡蛎三倍体育种技术研究进展. 渔业研究, 43(3): 330-338 |
徐成勋, 李琪, 2017. 温度与盐度对壳金长牡蛎面盘幼虫生长和存活的影响. 中国海洋大学学报, 47(S1): 42-47 |
曹伏君, 刘志刚, 罗正杰, 2010. 文蛤稚贝盐度适应性的研究. 海洋通报, 29(2): 156-160 |
崔玉婷, 王昭萍, 李阳春, 等, 2020. 不同介质对低渗诱导葡萄牙牡蛎三倍体的影响. 中国海洋大学学报, 50(S1): 56-63 |
阎希柱, 王桂忠, 李少菁, 2009. 盐度对九孔鲍能量收支的影响. 生态学杂志, 28(8): 1520-1524 |
谭杰, 陈振江, 刘付少梅, 等, 2016. 温度和盐度对大珠母贝稚贝存活和生长的互作效应. 广东海洋大学学报, 36(6): 44-51 |
BRUCET S, BOIX D, NATHANSEN L W, et al, 2012. Effects of temperature, salinity and fish in structuring the macroinvertebrate community in shallow lakes: implications for effects of climate change. PLoS One, 7(2): e30877 |
GAGNAIRE B, FROUIN H, MOREAU K, et al, 2006. Effects of temperature and salinity on haemocyte activities of the Pacific oyster, Crassostrea gigas (Thunberg). Fish & Shellfish Immunology, 20(4): 536-547 |
KIM M, AHN I Y, CHEON J, et al, 2009. Molecular cloning and thermal stress-induced expression of a pi-class glutathione S-transferase (GST) in the Antarctic bivalve Laternula elliptica. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 152(2): 207-213 |
PECHENIK J A, BERARD R, KERR L, 2000. Effects of reduced salinity on survival, growth, reproductive success, and energetics of the euryhaline polychaete Capitella sp. I. Journal of Experimental Marine Biology and Ecology, 254(1): 19-35 |
STANLEY J G, ALLEN JR S K, HIDU H, 1981. Polyploidy induced in the American oyster, Crassostrea virginica, with cytochalasin B. Aquaculture, 23(1/2/3/4): 1-10 |
TABARINI C L, 1984. Induced triploidy in the bay scallop, Argopecten irradians, and its effects on growth and gametogenesis. Aquaculture, 42(2): 151-160 |
TETTELBACH S T, RHODES E W, 1981. Combined effects of temperature and salinity on embryos and larvae of the northern bay scallop Argopecten irradians irradians. Marine Biology, 63(3): 249-256 |
WANG Z P, GUO X M, ALLEN S K, et al, 2002. Heterozygosity and body size in triploid Pacific Oysters, Crassostrea gigas Thunberg, produced from meiosis Ⅱ inhibition and tetraploids. Aquaculture, 204(3/4): 337-348 |
ZHANG Y H, QIN Y P, YU Z N, 2022. Comparative study of tetraploid-based reciprocal triploid Portuguese oysters, Crassostrea angulata, from seed to marketsize. Aquaculture, 547: 737523 |
 2023, Vol. 54
2023, Vol. 54


