中国海洋湖沼学会主办。
文章信息
- 刘田, 李硕, 汪铭书, 赵立宁, 黄锦炉, 吴艺琳, 贾爱卿. 2023.
- LIU Tian, LI Shuo, WANG Ming-Shu, ZHAO Li-Ning, HUANG Jin-Lu, WU Yi-Lin, JIA Ai-Qing. 2023.
- 抗杂交鳢(Channa argus×C. maculate)弹状病毒卵黄抗体制备及ELISA检测方法的建立
- PREPARATION OF ANTI-HYBRID SNAKEHEAD RHABDOVIRUS IGY AND DEVELOPMENT OF INDIRECT ELISA
- 海洋与湖沼, 54(6): 1756-1765
- Oceanologia et Limnologia Sinica, 54(6): 1756-1765.
- http://dx.doi.org/10.11693/hyhz20230500108
文章历史
-
收稿日期:2023-05-18
收修改稿日期:2023-09-24
2. 广东海大集团股份有限公司畜牧水产研究中心 广东广州 511400;
3. 广东海大畜牧兽医研究院 广东广州 511400;
4. 四川农业大学预防兽医研究所 四川成都 611100
2. Animal Husbandry and Fisheries Research Center of Guangdong Haid Group Co., Ltd., Guangzhou 511400, China;
3. Guangdong Haid Institute of Animal Husbandry and Veterinary, Guangzhou 511400, China;
4. Institute of Preventive Veterinary Medicine, Sichuan Agricultural University, Chengdu 611100, China
杂交鳢由乌鳢(Channa argus)和斑鳢(C. maculate)人工杂交而成, 属于鲈形目(Perciformes), 鳢科(Channidae)鱼类。该鱼分布广、繁殖力强, 因其鱼骨刺少、鱼肉含量高且蛋白质滋补价值突出而具有极高的食用营养和药用保健价值(钟小庆等, 2021; 李元跃等, 2022)。目前杂交鳢作为优特新品种已实现全人工高密度养殖, 随着养殖密度的不断增加, 细菌和病毒性传染疾病成为制约该品种鱼健康养殖的关键。2012年7月在广东省广州、佛山、中山、清远等多地发现一种可引起杂交鳢暴发性大规模死亡的疾病, 给杂交鳢养殖业带来了严重的经济损失。曾伟伟等(2013)经病原学分析确定造成杂交鳢死亡的病原为弹状病毒, 并将其定义为杂交鳢弹状病毒(Hybrid snakehead rhabdovirus, HSHRV)。
鱼类弹状病毒毒株种类多、毒力强, 是一类可使多种鱼出现高发病率和致死率的病毒病原体。已报道感染鱼类弹状病毒20多种, 分布于诺拉弹状病毒属(Novirhabdovirus)和水泡性病毒属(Vesiculovirus)。HSHRV属于水泡性病毒属, 为单股负链线性RNA病毒。该病毒呈典型子弹状, 病毒粒子大小为60 nm× 160 nm, 具有L、G、N、P、M共5种主要结构蛋白(Einer-Jensen et al, 2004; Teng et al, 2007)。回归感染试验表明, 发病鱼肝、脾、肾肿大且表面有出血点, 鱼鳔表面血管肿胀、出血严重, 死亡率达90%以上(曾伟伟等, 2013)。HSHRV易自然感染苗期杂交鳢, 死亡高峰为感染后第3天, 死亡持续时间为7~15 d, 高峰期日死亡量可过千尾, 死亡率高达80%以上, 日经济损耗达数万元。中成鱼感染后日死亡量较苗期降低, 约百尾, 死亡率约5%, 日经济损耗也可达万元, 目前尚无预防和治疗该病的特效药物(Hoffmann et al, 2005)。因此急需开发一款可预防、紧急治疗杂交鳢弹状病毒的生物制品, 提高杂交鳢存活率、降低饲养经济损耗。
卵黄抗体(Immunoglobulin of egg yolk, IgY)是一类经抗原免疫蛋鸡后于蛋黄中提取的可用于预防和紧急治疗特定疾病的抗体。与IgG等血清抗体相比, IgY具有提取方法简单、产量高、成本低、化学性质稳定等特点(张小莺等, 2004, 2006; Schade et al, 2004; 张桂枝等, 2009)。因其具有良好的被动免疫疗效, 常作为母源抗体的替代品, 用于治疗和预防幼龄动物疾病, 在动物免疫力较弱的时期为其提供持续免疫保护。目前卵黄抗体在畜禽疾病的预防和紧急治疗上的应用已得到市场的充分认可和广泛验证, 同时卵黄抗体在水产疾病的应用也屡见文献报道。特异性卵黄抗体可针对鱼、虾、海参和鲍等细菌和病毒性疾病产生较好的保护效果(Lu et al, 2008; Qin et al, 2018; 闫茂仓等, 2019; Hu et al, 2019; Xu et al, 2020)。由于HSHRV主要危害0.2~50 g杂交鳢苗种, 这一阶段鱼苗免疫系统不成熟, 依靠鱼苗主动免疫系统预防该疾病较为困难, 加之发病急且死亡率高、发病病程短, 经卵黄抗体为鱼苗提供被动免疫保护更具有生产和实践意义。本研究将杂交鳢弹状病毒经BEI灭活剂灭活处理后, 在固定的抗原剂量下免疫蛋鸡, 经三次常规免疫和一次加强免疫后收集高免蛋, 制备HSHRV卵黄抗体。同时建立HSHRV卵黄抗体ELISA检测方法, 用以检测特异性抗体效价产生规律。通过中和效价检测试验, 明确HSHRV卵黄抗体中和病毒的效果, 为杂交鳢弹状病毒的防治提供理论基础。
1 材料与方法 1.1 毒株、细胞及实验动物杂交鳢弹状病毒江门Ⅰ株(HSHRV-JMI)、鳜鱼脑细胞(Mandarin fish brain cell, MBC)由海大研究院保存。200日龄海蓝灰蛋鸡300只, 由丰牧公司和海大研究院提供。
1.2 主要试剂L-15培养基(biosharp, BL313A)、胎牛血清(Excell, FSP500)、双抗(新赛美, C100C5)、BEI (Aladdin, P104878-25ml)、五水合硫代硫酸钠(西陇科学, B220708)、吐温-80 (Diamond, A100442-0500)、Marcol52白油(埃克森美孚化工商务(上海)有限公司, 70133758)、牛血清白蛋白V (广州瑞舒生物科技有限公司, J0121B)、包被液(Biopanda, CB-003)、羊抗鸡酶标二抗(Abcam, ab6877)、TMB显色液(湖州英创生物科技有效公司, TMB-S-004)、终止液(Biopanda, STP-001)。
1.3 试验方法 1.3.1 病毒培养及滴度测定冻存MBC细胞经37 ℃恒温水浴充分融解、离心后, 以含10% FBS的L-15培养基28 ℃无CO2培养24 h, 待细胞密度长至90%时, 接种1000 TCID50 HSHRV-JMI, 28 ℃无CO2培养72 h, 至90%以上病变时收集病毒。病毒–80 ℃反复冻融2次、离心、过滤除菌后分装, –80 ℃保存备用。制备MBC细胞并接种96孔细胞板, 28 ℃无CO2培养24 h备用。10倍倍比稀释收集的病毒后接种细胞, 稀释度为10–1至10–9, 每个稀释度接种8孔。28 ℃孵育2 h后弃上清, 加入含2% FBS的L-15培养基, 28 ℃无CO2培养7 d, 观察并记录细胞病变孔数, 经Reed-Mench法计算病毒滴度。
1.3.2 灭活疫苗制备HSHRV-JMI融解后加入BEI至终浓度为0.5%, 充分吹打混匀后, 37 ℃, 120 r/min, 灭活24 h。加入五水合硫代硫酸钠至终浓度为10%终止灭活。取96份灭活HSHRV-JMI加入4份吐温-80, 7 000 r/min乳化5 min。取3份乳化后样品加入7份Marcol52白油, 12 000 r/min乳化15 min。乳化后样品3 500 r/min离心10 min后不分层, 4 ℃保存备用。
1.3.3 蛋鸡免疫灭活疫苗组200只、对照组100只。蛋鸡免疫共计四次, 每次每只蛋鸡胸肌多点注射1 mL灭活疫苗。首次免疫病毒剂量为1×107 TCID50/mL。14 d后开展二次免疫, 免疫剂量为1×108 TCID50/mL。二次免疫后14 d开展第三次免疫, 免疫剂量为1×108 TCID50/mL。第三次免疫后每隔20 d采集30枚鸡蛋并于中和效价小于1︰43时进行第四次加强免疫, 免疫剂量为1×107 TCID50/mL。其中对照组均注射1 mL L-15培养基。
1.3.4 卵黄抗体制备收集免疫前鸡蛋及各收蛋期包括对照组和免疫组高免蛋, 蛋壳表面进行清洗、消毒。无菌条件下使用蛋清蛋黄分离器收集蛋黄。加入蛋黄总重3倍体积的醋酸-醋酸钠(pH=4.8)的缓冲液后, 48 ℃条件下充分搅拌1 h。加入3%辛酸48 ℃条件下充分搅拌1 h。无菌过滤布过滤除杂, 获得纯化后抗体。
1.3.5 抗HSHRV卵黄抗体ELISA检测方法建立杂交鳢弹状病毒按一定滴度包被酶标板, 对包被条件、封闭条件进行系统优化, 以制备的卵黄抗体为一抗1︰100倍起进行倍比稀释, HRP标记羊抗鸡IgY为二抗按说明书1︰50 000稀释, 450 nm波长下测定吸光度值, 判定标准OD450 > 0.1且检测样品/阴性对照比值S/N (sample/negative) > 2.1的最高稀释度为此次检测样品的效价。
阳性阴性对照筛选 将弹状病毒作为包被抗原, 使用包被液对其分别进行1︰10、1︰50、1︰100、1︰200、1︰400倍稀释后100 μL/孔包被酶标板, 4 ℃孵育18 h, 洗涤3次, 每次5 min, 拍干。使用封闭液, 200 μL/孔加入酶标板中, 37 ℃封闭2 h, 洗涤3次, 每次5 min, 拍干。取二免、三免、三免后10 d、三免后20 d纯化后卵黄抗体, 使用封闭液1︰100倍稀释后, 100 μL/孔加入酶标板, 37 ℃孵育1 h, 洗涤3次, 每次5 min, 拍干。使用PBS按说明书1︰50 000稀释羊抗鸡酶标二抗, 100 μL/孔加入酶标板, 37 ℃孵育50 min, 洗涤3次, 每次5 min, 拍干。100 μL/孔加入TMB底物显色液, 37 ℃条件避光下孵育10 min。50 μL/孔加入终止液, 终止显色反应, 使用酶标仪OD450读取数据。
抗原条件优化 使用棋盘法在96孔酶标板中, 横向将弹状病毒以1︰100倍起进行2倍倍比稀释12个梯度, 纵向将阳性对照、阴性对照以1︰100倍起进行2倍倍比稀释8个梯度。
包被条件优化 4 ℃孵育18 h、37 ℃孵育1 h、37 ℃孵育2 h、室温孵育1 h、室温孵育2 h。
封闭条件优化 4 ℃孵育18 h、37 ℃孵育1 h、37 ℃孵育2 h、室温孵育1 h、室温孵育2 h。
特异性验证 按1.3.4分别制备SPF鸡蛋蛋黄提取液、免疫前鸡蛋蛋黄提取液、大口黑鲈蛙虹彩病毒(largemouth bass virus, LMBV)高免蛋卵黄抗体。以优化后的条件进行包被、封闭, 抗原设立MBC空细胞对照组、PBS空白对照组、细胞毒抗原组。抗体设立SPF鸡蛋蛋黄提取液、免疫前鸡蛋蛋黄提取液、大口黑鲈蛙虹彩病毒卵黄抗体组。以1.3.5确定的样品为阳性、阴性对照进行特异性验证。
敏感性验证 将阳性样品1︰100倍起进行2倍倍比稀释12个梯度, 验证检测方法敏感性。
重复性验证及方法应用 对各收蛋期共计8个批次的卵黄抗体进行效价监测。每组卵黄抗体样品及阳性、阴性对照设立三组平行组, 分别1︰100倍起进行倍比稀释12个梯度, 并由3个不同的检测员于3个不同时间完成重复检测, 验证检测方法重复性。
1.3.6 卵黄抗体中和效果评估将MBC细胞经1︰3传代后接种96孔细胞板, 28 ℃、无CO2孵育培养过夜。10倍比稀释病毒滴度为107.8 TCID50/0.1 mL杂交鳢弹状病毒至200 TCID50。取500 μL 2倍稀释蛋黄液于56 ℃水浴中补体灭活40 min后4倍倍比稀释。取100 μL灭活补体的蛋黄稀释液和100 μL病毒稀释液充分混匀后28 ℃、85 r/min充分中和3 h。取中和后混合液加入96孔细胞板中, 28 ℃、无CO2孵育3 h。PBS清洗细胞1次, 加入10% FBS L-15完全培养基28 ℃、无CO2孵育培养7 d后观察细胞病变情况。
2 结果 2.1 HSHRV-JMI扩繁和滴度确定HSHRV-JMI接种MBC细胞后, 24 h内开始出现细胞病变, 24 h后20%~30%细胞出现收缩变圆、内部空洞、聚集成团的现象, 并形成明显的空斑。48 h后40%~60%的细胞出现病变, 72 h后90%以上的细胞出现病变(图 1)。72 h后收集病毒, 测定滴度为107.8 TCID50/0.1 mL。
 |
| 图 1 HSHRV-JMI在鳜鱼脑细胞(MBC)的病变情况 Fig. 1 Lesions of HSHRV-JMI in mandarin fish brain cell (MBC) 注: a. 接毒前细胞; b. 接毒后24 h细胞; c. 接毒后48 h细胞; d. 接毒后72 h细胞 |
结果可知(表 1), 抗原稀释倍数小于1︰100时, 不同免疫时间点对应的对照组OD450值基本无变化, 判断为非特异性反应。抗原在1︰100~1︰400倍稀释条件下, 优先选取OD450值> 1、同一抗原稀释度下相邻倍比稀释样品OD450值有较大变化的样品, 三免后20 d样品S/N=3.8, 即三免20 d免疫组卵黄抗体为阳性对照样品, 同期对照组卵黄抗体为阴性对照样品。
| 免疫程序 | 二免 | 三免 | 三免后10 d | 三免后20 d | ||||||||||||
| 阳性 | 阴性 | S/N | 阳性 | 阴性 | S/N | 阳性 | 阴性 | S/N | 阳性 | 阴性 | S/N | |||||
| 抗原稀释度 | 1︰10 | 0.945 | 0.547 | 1.73 | 1.384 | 0.599 | 2.31 | 1.833 | 0.585 | 3.13 | 2.14 | 0.587 | 3.65 | |||
| 1︰50 | 0.524 | 0.515 | 1.02 | 0.885 | 0.566 | 1.56 | 1.288 | 0.53 | 2.43 | 1.783 | 0.581 | 3.07 | ||||
| 1︰100 | 0.254 | 0.12 | 2.12 | 0.576 | 0.151 | 3.81 | 0.945 | 0.288 | 3.28 | 1.384 | 0.364 | 3.80 | ||||
| 1︰200 | 0.23 | 0.127 | 1.81 | 0.328 | 0.152 | 2.16 | 0.524 | 0.204 | 2.57 | 0.885 | 0.317 | 2.79 | ||||
| 1︰400 | 0.153 | 0.108 | 1.42 | 0.254 | 0.154 | 1.65 | 0.383 | 0.201 | 1.91 | 0.604 | 0.289 | 2.09 | ||||
最适条件应选在可检测稀释度范围内S/N最大且对应的阴性对照OD450值较小的样品, 采用该样品对应的抗原稀释度为最佳抗原工作浓度。结果可知(表 2), 抗原稀释倍数为1︰200, 病毒滴度为0.5×105.8 TCID50/0.1 mL时, S/N=3.94, 同时阴性对照OD450值较小。
| 抗原稀释倍数 | 1︰100 | 1︰200 | 1︰400 | 1︰800 | 1︰1 600 | 1︰3 200 | 1︰6 400 | 1︰12 800 | 1︰25 600 | 1︰51 200 | ||
| 抗体稀释倍数 | 1︰25 | 阳性 | 2.185 | 1.747 | 1.248 | 0.808 | 0.485 | 0.307 | 0.205 | 0.144 | 0.078 | 0.083 |
| 阴性 | 0.561 | 0.475 | 0.339 | 0.244 | 0.169 | 0.117 | 0.088 | 0.106 | 0.089 | 0.106 | ||
| S/N | 3.89 | 3.68 | 3.68 | 3.31 | 2.87 | 2.62 | 2.33 | 1.36 | 0.88 | 0.78 | ||
| 1︰50 | 阳性 | 1.597 | 1.181 | 0.799 | 0.491 | 0.318 | 0.209 | 0.134 | 0.104 | 0.074 | 0.075 | |
| 阴性 | 0.586 | 0.45 | 0.317 | 0.207 | 0.133 | 0.105 | 0.074 | 0.084 | 0.077 | 0.089 | ||
| S/N | 2.73 | 2.62 | 2.52 | 2.37 | 2.39 | 1.99 | 1.81 | 1.24 | 0.96 | 0.84 | ||
| 1︰100 | 阳性 | 1.286 | 0.998 | 0.626 | 0.376 | 0.253 | 0.161 | 0.117 | 0.097 | 0.077 | 0.081 | |
| 阴性 | 0.368 | 0.253 | 0.174 | 0.134 | 0.117 | 0.074 | 0.07 | 0.074 | 0.073 | 0.072 | ||
| S/N | 3.49 | 3.94 | 3.60 | 2.81 | 2.16 | 2.18 | 1.60 | 1.31 | 1.05 | 1.13 | ||
| 1︰200 | 阳性 | 0.795 | 0.501 | 0.304 | 0.186 | 0.137 | 0.104 | 0.088 | 0.08 | 0.079 | 0.081 | |
| 阴性 | 0.344 | 0.269 | 0.157 | 0.098 | 0.07 | 0.073 | 0.076 | 0.073 | 0.076 | 0.074 | ||
| S/N | 2.31 | 1.86 | 1.94 | 1.90 | 1.96 | 1.42 | 1.16 | 1.10 | 1.04 | 1.09 | ||
最适条件应选在可检测稀释度范围内S/N > 2.1且对应的阴性对照OD450值较小的样品, 结果可知(表 3, 表 4, 表 5), 阳性抗体在1︰100至1︰1 600倍的条件下稀释时, 37 ℃孵育2 h, 对应的S/N值为各包被条件中最大。确定包被条件为37 ℃孵育2 h。
| 抗原包被条件 | 4 ℃孵育18 h | 37 ℃孵育1 h | 37 ℃孵育2 h | 室温孵育1 h | 室温孵育2 h | |
| 阳性抗体稀释倍数 | 1︰100 | 1.142 | 1.243 | 1.393 | 1.19 | 1.107 |
| 1︰200 | 0.776 | 0.813 | 1.025 | 0.818 | 0.697 | |
| 1︰400 | 0.505 | 0.545 | 0.674 | 0.523 | 0.43 | |
| 1︰800 | 0.31 | 0.359 | 0.398 | 0.337 | 0.271 | |
| 1︰1 600 | 0.197 | 0.236 | 0.242 | 0.201 | 0.176 | |
| 1︰3 200 | 0.136 | 0.153 | 0.156 | 0.14 | 0.125 | |
| 1︰6 400 | 0.106 | 0.118 | 0.114 | 0.104 | 0.102 | |
| 1︰12 800 | 0.092 | 0.093 | 0.091 | 0.089 | 0.092 | |
| 抗原包被条件 | 4 ℃孵育18 h | 37 ℃孵育1 h | 37 ℃孵育2 h | 室温孵育1 h | 室温孵育2 h | |
| 阴性抗体稀释倍数 | 1︰100 | 0.593 | 0.451 | 0.349 | 0.551 | 0.573 |
| 1︰200 | 0.378 | 0.324 | 0.212 | 0.358 | 0.367 | |
| 1︰400 | 0.231 | 0.262 | 0.145 | 0.231 | 0.237 | |
| 1︰800 | 0.152 | 0.188 | 0.114 | 0.164 | 0.16 | |
| 1︰1 600 | 0.116 | 0.149 | 0.097 | 0.116 | 0.116 | |
| 1︰3 200 | 0.094 | 0.079 | 0.088 | 0.105 | 0.097 | |
| 1︰6 400 | 0.09 | 0.095 | 0.086 | 0.096 | 0.088 | |
| 1︰12 800 | 0.079 | 0.09 | 0.079 | 0.096 | 0.096 | |
| 抗原包被条件 | 4 ℃孵育18 h | 37 ℃孵育1 h | 37 ℃孵育2 h | 室温孵育1 h | 室温孵育2 h | |
| 一抗稀释倍数 | 1︰100 | 1.93 | 2.76 | 3.99 | 2.16 | 1.93 |
| 1︰200 | 2.05 | 2.51 | 4.83 | 2.28 | 1.90 | |
| 1︰400 | 2.19 | 2.08 | 4.65 | 2.26 | 1.81 | |
| 1︰800 | 2.04 | 1.91 | 3.49 | 2.05 | 1.69 | |
| 1︰1 600 | 1.70 | 1.58 | 2.49 | 1.73 | 1.52 | |
| 1︰3 200 | 1.45 | 1.94 | 1.77 | 1.33 | 1.29 | |
| 1︰6 400 | 1.18 | 1.24 | 1.33 | 1.08 | 1.16 | |
| 1︰12 800 | 1.16 | 1.03 | 1.15 | 0.93 | 0.96 | |
最适条件应选在可检测稀释度范围内阴性对照OD450值较小的样品, 结果可知(表 6, 表 7, 表 8)在1︰100至1︰1 600倍的条件下稀释时, 阴性对照OD450值最小的封闭条件为抗原37 ℃孵育2 h。确定封闭条件为37 ℃孵育2 h。
| 封闭条件 | 4 ℃孵育18 h | 37 ℃孵育1 h | 37 ℃孵育2 h | 室温孵育1 h | 室温孵育2 h | |
| 阳性抗体稀释倍数 | 1︰100 | 1.784 | 1.466 | 1.425 | 1.754 | 1.675 |
| 1︰200 | 1.371 | 0.931 | 1.038 | 1.254 | 1.310 | |
| 1︰400 | 1.088 | 0.712 | 0.597 | 1.187 | 1.000 | |
| 1︰800 | 0.807 | 0.499 | 0.470 | 0.843 | 0.697 | |
| 1︰1 600 | 0.581 | 0.374 | 0.325 | 0.691 | 0.507 | |
| 1︰3 200 | 0.430 | 0.268 | 0.225 | 0.544 | 0.385 | |
| 1︰6 400 | 0.213 | 0.202 | 0.297 | 0.339 | 0.353 | |
| 1︰12 800 | 0.188 | 0.193 | 0.144 | 0.223 | 0.184 | |
| 封闭条件 | 4 ℃孵育18 h | 37 ℃孵育1 h | 37 ℃孵育2 h | 室温孵育1 h | 室温孵育2 h | |
| 阴性抗体稀释倍数 | 1︰100 | 0.586 | 0.695 | 0.410 | 0.760 | 0.590 |
| 1︰200 | 0.372 | 0.443 | 0.261 | 0.467 | 0.478 | |
| 1︰400 | 0.336 | 0.273 | 0.172 | 0.288 | 0.350 | |
| 1︰800 | 0.253 | 0.172 | 0.130 | 0.237 | 0.264 | |
| 1︰1 600 | 0.215 | 0.127 | 0.115 | 0.233 | 0.216 | |
| 1︰3 200 | 0.193 | 0.096 | 0.094 | 0.166 | 0.196 | |
| 1︰6 400 | 0.190 | 0.097 | 0.086 | 0.188 | 0.188 | |
| 1︰12 800 | 0.184 | 0.099 | 0.076 | 0.183 | 0.086 | |
| 封闭条件 | 4 ℃孵育18 h | 37 ℃孵育1 h | 37 ℃孵育2 h | 室温孵育1 h | 室温孵育2 h | |
| 一抗稀释倍数 | 1︰100 | 3.04 | 2.11 | 3.48 | 2.31 | 2.84 |
| 1︰200 | 3.69 | 2.10 | 3.98 | 2.69 | 2.74 | |
| 1︰400 | 3.24 | 2.61 | 3.47 | 4.12 | 2.86 | |
| 1︰800 | 3.19 | 2.90 | 3.62 | 3.56 | 2.64 | |
| 1︰1 600 | 2.70 | 2.94 | 2.83 | 2.97 | 2.35 | |
| 1︰3 200 | 2.23 | 2.79 | 2.39 | 3.28 | 1.96 | |
| 1︰6 400 | 1.12 | 2.08 | 3.45 | 1.80 | 1.88 | |
| 1︰12 800 | 1.02 | 1.95 | 1.89 | 1.22 | 2.14 | |
经ELISA特异性验证结果分析(表 9), 以OD450 > 1且S/N (sample/negative) > 2.1为特异性反应评判标准。相同条件下当抗原为MBC空细胞或PBS时, 抗HSHRV卵黄抗体均无信号产生, 结果为阴性; 当抗原为HSHRV-JMI时, HSHRV卵黄抗体产生特异性信号结果为阳性, 其余卵黄抗体组信号均与阴性对照组相同, 即无特异性反应信号产生。
| 抗体或包被物 | OD450均值 | 结果 |
| 阳性对照组 | 1.441 | + |
| 阴性对照组 | 0.282 | – |
| 大口黑鲈蛙虹彩病毒卵黄抗体IgY | 0.287 | – |
| SPF蛋黄提取物 | 0.282 | – |
| 免疫前蛋黄提取物 | 0.285 | – |
| MBC细胞包被组 | 0.079 | – |
| 空白对照 | 0.085 | – |
对灭活疫苗组各收蛋期共计8个批次的卵黄抗体进行效价监测。在第三次免疫后20 d检测到抗体效价, 在第四次免疫后抗体效价大幅度上升, 最高效价可达1︰25 600 (图 2)。
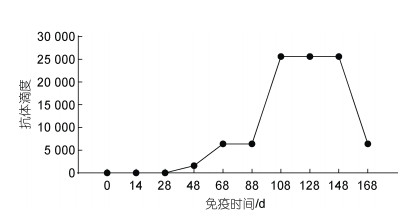 |
| 图 2 特异性抗体产生规律 Fig. 2 Regularity of the production of specific antibody |
分别测定不同时间点蛋黄IgY中和抗体水平, 蛋黄液稀释2倍后进行中和效价评估。结果显示, 首免后14 d即可检测到中和抗体, 三免后20 d抗体效价达到44.7左右, 随后逐渐下降。第四次免疫后, 中和抗体效价水平迅速达到峰值, 最高中和抗体效价上升至46.3左右, 并随着时间延长而逐步降低。四免后80 d时, 中和抗体效价低于43 (图 3)。蛋黄IgY中和效价可以直接反映抗体在体外中和病毒的能力。灭活疫苗可诱导蛋鸡产生较高水平的中和抗体以中和病毒。
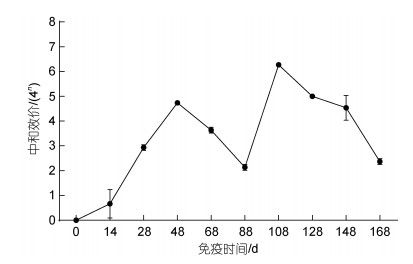 |
| 图 3 中和效果评估 Fig. 3 Evaluation of neutralizing effects |
杂交鳢弹状病毒病是一种暴发性、高致死性和高传染性的病毒性疾病, 可经亲鱼垂直传播给苗种, 苗期易感, 高峰期死亡率达80%以上。常通过养殖过程中池塘和人员严格消毒、降低放养密度、定期调水改底、优质饲料投喂的方式预防该疾病的发生, 该病治疗效果不佳(雷燕, 2015)。针对鳜鱼源弹状病毒病、大口黑鲈源弹状病毒病的预防和治疗方法已有文献报道(Chen et al, 2012; Zhang et al, 2018; 袁雪梅等, 2020; 杭小英等, 2021; 罗霞等, 2022), 目前尚无预防杂交鳢弹状病毒病疫苗和治疗杂交鳢弹状病毒病药物的研究。鉴于杂交鳢弹状病毒对杂交鳢养殖的危害, 急需开发一款针对杂交鳢弹状病毒病的生物制品以验证预防和治疗该病的可能性。
本研究结合苗期杂交鳢极易暴发弹状病毒的特点和卵黄抗体被动免疫的功效, 制备杂交鳢弹状病毒卵黄抗体、构建间接ELISA检测方法以检测IgY的免疫反应活性, 同时通过中和效价检测手段明确卵黄抗体中和杂交鳢弹状病毒的效果。
3.1 卵黄抗体的制备卵黄抗体制备过程中免疫原的选择与对蛋鸡免疫过程的参数控制是保证免疫效果的关键。实验动物的免疫效果受诸多变量因素影响, 通常包括免疫原类型、免疫原剂量、佐剂、免疫间隔与次数、实验动物自身情况。研究表明在一定剂量范围内, 免疫效果会随着抗原浓度的增加而加强, 同时剂量过高会导致免疫耐受情况的发生(Hendriksen, 2001; Schade et al, 2005)。张小莺等(2010)用7.2×108 pfu/mL抗原免疫蛋鸡, 免疫荧光试验表明抗体在1︰100 000倍稀释下仍可稳定表达, 当免疫抗原滴度降低至7.0×106 pfu/mL时, 仅能在1︰10倍稀释下检测到抗体。因此为确保最终抗体收获较高的滴度并规避可能发生的免疫耐受情况, 我们将首免和四免的病毒滴度设置为1×107 TCID50/mL, 二免和三免病毒滴度设置为1×108 TCID50/mL。本次免疫中免疫间隔为14 d, 为避免免疫耐受情况发生, 本研究待中和抗体效价降低至1︰64以下时进行第四次免疫。有研究表明免疫间隔大于4周甚至数月, 均取得了较好的免疫效果(Tini et al, 2002)。
在佐剂的选择中, 弗氏佐剂价格相对昂贵不适合规模化蛋鸡免疫, 我们选择相对价格低廉可适宜大规模免疫的白油佐剂, 同时也得到良好的免疫效果。蛋鸡免疫方式优选肌肉注射, 有研究表明皮下注射效果优于肌肉注射, 静脉注射效果最佳, 但存在安全隐患(Schade et al, 2005)。
在疫苗的类型选择中, 多肽亚单位疫苗可根据病毒或细菌的结构蛋白进行分析, 通过筛选并提取具有优势抗原表位的片段, 其特异性会远远大于灭活疫苗, 但其不足之处却是免疫原性较低, 需与相对价格较高的佐剂配合使用才能产生更好的免疫效果(Snippe et al, 1979)。本研究选择免疫原性较强且价格相对低廉可大规模免疫生产的灭活疫苗进行蛋鸡免疫。
卵黄抗体纯化方式的选择中, 传统的有机试剂沉淀法在粗分离的卵黄抗体中残留的有机溶剂较多, 不易去除, 且大量生产会对环境造成严重污染。盐析与凝胶过滤及色谱纯化等方法均存在制备步骤多、获得批量小、产品安全性不高及回收率低等普遍问题, 适用于高纯度、高浓度的实验室早期开发阶段。本研究使用醋酸-醋酸盐-辛酸法进行纯化、制备, 其回收率高, 成本低, 制备过程中使用的化学试剂很少, 合大规模生产的同时也遵从绿色提取理念(王洪新等, 2003; 胡瑞鸿, 2020)。
3.2 卵黄抗体ELISA检测方法卵黄抗体效价检测常用方法如琼脂扩散、血凝抑制、中和试验及ELISA检测等。与其他检测方法相比, ELISA检测方法的优势在于其特异性好、灵敏度高(Lee et al, 2009; Li et al, 2014)。
为配合后期中和试验验证卵黄抗体中和病毒的效果, 本研究使用HSHRV作为免疫原及检测方法的包被抗原, 其免疫原性要高于多肽亚单位疫苗, 但相对检测方法的特异性来说会较低。从结果来看, 在检测过程中随着抗体稀释度越高, 检测方法特异性越好。结合建立此方法的初衷为检测卵黄抗体效价水平消减规律, 即每一批次卵黄抗体最高效价为当批次卵黄抗体效价水平。在ELISA反应中, 为避免卵黄抗体低稀释度时非特异性反应对检测结果的影响, 本研究通过棋盘法确定抗原最适工作浓度为0.5×105.8 TCID50/0.1 mL, 通过对包被、封闭条件的筛选确定最适条件为37 ℃包被2 h及37 ℃封闭2 h, 通过优化以上检测条件, 来降低非特异性信号造成的假阴性结果。以MBC空细胞包被组及PBS空白包被组为抗原对照组, 以实验室保存的大口黑鲈蛙虹彩病毒卵黄抗体, 免疫前蛋黄提取物及SPF蛋黄提取物为抗体对照组, 验证检测方法的抗原抗体结合的特异性, 以OD450 > 1且S/N (sample/negative) > 2.1为特异性反应评判标准, 结果显示此检测方法具有良好的特异性。对各收蛋期共计8个批次的卵黄抗体进行效价监测, 选取其中效价最高的实验组别作为阳性对照组, 以其为标准验证检测方法敏感性可达1︰25 600。同时确定在免疫周期内, 卵黄抗体效价平台期可持续40~60 d。
此方法最终可应用于蛋鸡免疫试验过程中, 可对任意收蛋期内收集高免蛋卵黄抗体效价进行检测。
3.3 卵黄抗体中和病毒效果评估为验证卵黄抗体对病毒的中和效果, 中和效价可反映抗体中和病毒的能力, 研究发现通过中和试验检测灭活疫苗组免疫后高免蛋表现出高水平的中和病毒能力, 同时发现在ELISA检测卵黄抗体效价于四免后达到最高峰1︰25 600并进入平台期持续40~60 d, 卵黄抗体中和效价也于四免后达到高峰46.3平台期持续60 d, 中和效果可保护50%的细胞不发生病变, 这说明了高效价的卵黄抗体具有良好的中和病毒的能力。在平台期60 d左右可持续产出高效价的卵黄抗体, 这为高效价的卵黄抗体生产提供了充足的抗体源。
3.4 卵黄抗体在水产疾病中的应用卵黄抗体相关产品制备工艺简单, 生产成本相对较低, 在临床使用中会相对便利, 其生产也不受南北地域、季节或时间的限制, 在疾病治疗方面, 具有高效、无公害、安全等优势, 是一种接近理想的疾病预防、治疗的药物。
本研究以HSHRV灭活疫苗作为免疫原对蛋鸡进行免疫, 其免疫原性良好, 通过建立ELISA检测方法对免疫期内高免蛋所产卵黄抗体进行实时效价监测, 确定平台期以便在平台期内可大量收集高免蛋。通过中和试验验证卵黄抗体中和病毒效果。高滴度抗杂交鳢弹状病毒卵黄抗体具有被开发为被动免疫的新型抗杂交鳢弹状病毒生物制品的潜力, 为杂交鳢弹状病毒病的防治提供了理论基础, 亦为其他水产疾病的预防与治疗提供了研究方向。
4 结论本研究用灭活杂交鳢弹状病毒制备特异性卵黄抗体, 特异性抗体效价消长规律经构建的间接ELISA检测方法实时监测。通过细胞中和试验明确抗杂交鳢弹状病毒卵黄抗体具有良好的中和病毒效果, 表明灭活杂交鳢弹状病毒可以有效刺激具有中和能力的卵黄抗体的产生。该研究表明, 高中和滴度的抗杂交鳢弹状病毒卵黄抗体具有开发为新型抗杂交鳢弹状病毒生物制品的潜力, 为该病的防治奠定了理论基础。
王洪新, 刘学贤, 穆海波, 等, 2003. 鸡新城疫卵黄抗体IgY的分离提纯研究[J]. 中国家禽, 25(19): 11-14. |
闫茂仓, 王瑶华, 胡利华, 等, 2019. 副溶血弧菌特异性卵黄抗体(AHPND-VpIgY)对凡纳滨对虾幼体被动免疫和育苗成活率的影响[J]. 海洋与湖沼, 50(2): 443-448. |
李元跃, 李容伟, 陈融斌, 等, 2022. 红树林下人工笼养中华乌塘鳢(Bostrychus sinensis)肌肉营养成分的分析与评价[J]. 海洋与湖沼, 53(5): 1170-1179. |
张小莺, 陈琛, 赵建乐, 等, 2010. 卵黄抗体技术中不同因素对免疫效果的影响[J]. 中国家禽, 32(1): 23-26. |
张小莺, 郑礼, SCHADE R, 2006. 卵黄抗体技术的医药应用与研究动态[C] //中国药理学会制药工业专业委员会第十二届学术会议、中国药学会应用药理专业委员会第二届学术会议、2006年国际生物医药及生物技术论坛(香港)会议论文集. 天津: 《中草药》杂志编辑部.
|
张小莺, 郑礼, SCHADE R, 等, 2004. 免疫鸡产生IgY抗体的技术[J]. 中国药理学通报, 20(10): 1102-1106. |
张桂枝, 靳双星, 2009. 抗鸡新城疫和传染性法氏囊病二联卵黄抗体的研制及应用[J]. 中国畜牧兽医, 36(8): 136-138. |
杭小英, 袁雪梅, 吕孙建, 等, 2021. 抗大口黑鲈弹状病毒中草药的筛选及抗病毒效果[J]. 江苏农业科学, 49(14): 155-159. |
罗霞, 付小哲, 林强, 等, 2022. 鳜鱼传染性脾肾坏死病和弹状病毒病二联灭活疫苗毒种及种子批的研究[J]. 西北农林科技大学学报(自然科学版), 50(1): 1-9. |
胡瑞鸿, 2020. 抗H株小鹅瘟病毒卵黄抗体的研制与质量评估[D]. 哈尔滨: 东北农业大学.
|
钟小庆, 杨菁, 2021. 全国生鱼看广东, 广东生鱼看三角! 这个渔业重镇游出的乌斑杂交鳢, 能否引领产业发展新高峰?[J]. 当代水产, 46(10): 72-74. |
袁雪梅, 吕孙建, 施伟达, 等, 2020. 大口黑鲈弹状病毒的分离培养及其卵黄抗体的制备[J]. 渔业科学进展, 41(3): 151-157. |
曾伟伟, 王庆, 王英英, 等, 2013. 一株鳢科鱼源弹状病毒的分离及鉴定[J]. 水产学报, 37(9): 1416-1424. |
雷燕, 2015. 杂交鳢弹状病毒病综合防控技术[J]. 海洋与渔业·水产前沿, (4): 87-88. |
SCHADE R, 张小莺, 郑礼, 2004. IgY技术及其医药应用: 理论基础[J]. 中国药理学通报, 20(5): 491-495. |
CHEN Z Y, LEI X Y, ZHANG Q Y, 2012. The antiviral defense mechanisms in mandarin fish induced by DNA vaccination against a rhabdovirus[J]. Veterinary Microbiology, 157(3/4): 264-275. |
EINER-JENSEN K, AHRENS P, FORSBERG R, et al, 2004. Evolution of the fish rhabdovirus viral haemorrhagic septicaemia virus[J]. Journal of General Virology, 85(5): 1167-1179. |
HENDRIKSEN C, 2001. Book Review: Chicken egg yolk antibodies, production and application, IgY-technology[J]. Alternatives to Laboratory Animals, 29(3): 373-374. |
HOFFMANN B, BEER M, SCHÜTZE H, et al, 2005. Fish rhabdoviruses: molecular epidemiology and evolution [M] // FU Z F. The World of Rhabdoviruses. Berlin, Heidelberg: Springer: 81-117.
|
HU B C, YANG XC D, GUO E P, et al, 2019. The preparation and antibacterial effect of egg yolk immunoglobulin (IgY) against the outer membrane proteins of Vibrio parahaemolyticus[J]. Journal of the Science of Food and Agriculture, 99(5): 2565-2571. |
LEE S H, LILLEHOJ H S, PARK D W, et al, 2009. Induction of passive immunity in broiler chickens against Eimeria acervulina by hyperimmune egg yolk immunoglobulin Y[J]. Poultry Science, 88(3): 562-566. |
LI C H, LU X J, LI D F, et al, 2014. Passive protective effect of chicken egg yolk immunoglobulins against experimental Vibrio anguillarum infection in ayu (Plecoglossus altivelis)[J]. Fish & Shellfish Immunology, 37(1): 108-114. |
LU Y N, LIU J J, JIN L J, et al, 2008. Passive protection of shrimp against white spot syndrome virus (WSSV) using specific antibody from egg yolk of chickens immunized with inactivated virus or a WSSV-DNA vaccine[J]. Fish & Shellfish Immunology, 25(5): 604-610. |
QIN Z D, BABU S V, LI N Q, et al, 2018. Protective effects of chicken egg yolk immunoglobulins (IgY) against experimental Aeromonas hydrophila infection in blunt snout bream (Megalobrama amblycephala)[J]. Fish & Shellfish Immunology, 78: 26-34. |
SCHADE R, CALZADO E G, SARMIENTO R, et al, 2005. Chicken egg yolk antibodies (IgY-technology): a review of progress in production and use in research and human and veterinary medicine[J]. Alternatives to Laboratory Animals, 33(2): 129-154. |
SNIPPE H, WILLERS J M N, 1979. Cell co-operation in antibody formation on hapten-carrier complexes: some regulatory aspects[J]. Developmental & Comparative Immunology, 3: 509-522. |
TENG Y, LIU H, LV J Q, et al, 2007. Characterization of complete genome sequence of the spring viremia of carp virus isolated from common carp (Cyprinus carpio) in China[J]. Archives of Virology, 152(8): 1457-1465. |
TINI M, JEWELL U R, CAMENISCH G, et al, 2002. Generation and application of chicken egg-yolk antibodies[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 131(3): 569-574. |
XU L, CHE J, XU Y P, et al, 2020. Oral administration of microencapsulated egg yolk immunoglobulin (IgY) in turbot (Scophthalmus maximus) to combat against Edwardsiella tarda 2CDM001 infections[J]. Fish & Shellfish Immunology, 106: 609-620. |
ZHANG L J, LI N Q, LIU Q, et al, 2018. An avirulent Micropterus salmoides rhabdovirus vaccine candidate protects Chinese perch against rhabdovirus infection[J]. Fish & Shellfish Immunology, 77: 474-480. |
 2023, Vol. 54
2023, Vol. 54


