文章信息
- 刘洪艳, 王珊. 2019.
- LIU Hong-yan, WANG Shan. 2019.
- 海洋沉积物中异化铁还原细菌还原重金属Cr(Ⅵ)研究
- Characteristics of chromate reduction by Fe(Ⅲ) reduction using mixed bacteria from marine sediment
- 海洋科学, 43(5): 19-26
- Marine Sciences, 43(5): 19-26.
- http://dx.doi.org/10.11759/hykx20190211001
-
文章历史
- 收稿日期:2019-02-11
- 修回日期:2019-04-14
异化铁还原细菌是一类以Fe(Ⅲ)为电子受体, 并将Fe(Ⅲ)还原成Fe(Ⅱ)的微生物总称[1]。异化铁还原作用是自然界中一种十分重要的生物地球化学过程, 在异化还原Fe(Ⅲ)过程中, 异化铁还原细菌不仅影响环境中铁元素的价态变化, 还能够影响一些重金属元素的价态形式。微生物异化铁还原过程通过参与铀氧化还原循环, 即由微生物异化铁代谢产生Fe(Ⅱ)以非生物方式还原U(Ⅵ), 最终导致毒性较大且溶解度大容易扩散的U(Ⅵ)转化成为毒性较小U(Ⅳ), 解决重金属铀污染[2-3]。异化铁还原细菌能够在还原Fe(Ⅲ)同时将As(Ⅲ)氧化形成As(Ⅴ), 相比较As(Ⅲ)毒性, 氧化产物As(Ⅴ)毒性较小, 从而减轻砷污染的问题[4]。Si等研究表明[5], 异化铁还原菌Geobacter sulfurreducens能够介导甲基汞(MeHg)的产生, HgCl2的初始浓度为500 nmol/L时, 该菌株可累计获得MeHg浓度为177 nmol/L。可见, 微生物介导铁还原过程可以有效降低金属污染, 是重金属污染修复领域的一个新兴研究方向[6]。
铬污染是一种典型重金属污染类型。重金属铬存在Cr(Ⅵ)和Cr(Ⅲ)两种价态, 其中, Cr(Ⅲ)的毒性较Cr(Ⅵ)降低100倍。Wielinga等研究发现[7], 当铁氧化物存在时, 菌株Shewanella alga BrY还原Cr(Ⅵ)为Cr(Ⅲ)的速率和效率明显提高。Xu等利用异化铁还原细菌还原Fe(Ⅲ)生成Fe(Ⅱ), 进而再以非生物方式将Cr(Ⅵ)还原为Cr(Ⅲ), 达到去除废水中目的Cr(Ⅵ)[8]。在微生物燃料电池中, 对于Cr(Ⅵ)去除率, 加入Fe(Ⅲ)是未加Fe(Ⅲ)的1.6倍[9]。杜艳影等研究表明[10], 异化铁还原作用能够促进并加速菌株Shewanella oneidensis MR-1对Cr(Ⅵ)的还原, Cr(Ⅵ)还原率从空白组(未加Fe(Ⅲ))88%提高至实验组100%(加Fe(Ⅲ))。铬还原细菌采用直接还原重金属Cr(Ⅵ)为Cr(Ⅲ), 从而解决重金属Cr(Ⅵ)污染问题[11]。异化铁还原细菌则采用间接还原的方式还原重金属Cr(Ⅵ), 电子受体Fe(Ⅲ)在异化铁还原过程中产生Fe(Ⅱ), Fe(Ⅱ)作为还原剂将Cr(Ⅵ)还原为Cr(Ⅲ)。
在自然环境中, 除了细菌直接酶促生物还原铬, 非生物方式的铬还原也占据十分重要地位[12], 而异化铁还原细菌还原重金属Cr(Ⅵ)过程包括了生物-非生物还原过程。在自然环境的还原条件下, 可能存在Cr(Ⅵ)还原产物的复杂混合物, 这将影响环境中关于Cr(Ⅵ)还原效率的精确预测[13]。因此, 了解异化铁还原细菌的菌群组成以及异化铁还原性质, 对于评估异化铁还原细菌还原重金属Cr(Ⅵ)的可行性至关重要。海洋沉积物因其特殊的厌氧环境而成为铁还原微生物的重要生境, 微生物还原产生的Fe(Ⅱ)参与海洋中的生物过程[14]。利用海洋沉积物中微生物异化铁还原过程治理重金属污染, 具有重要意义[15]。本文以渤海底泥为研究材料, 厌氧富集异化铁还原细菌, 并分析异化铁还原性质及其对重金属Cr(Ⅵ)的还原效率。旨在为利用微生物介导的异化Fe(Ⅲ)还原治理重金属污染提供实验依据。
1 材料与方法 1.1 混合菌群的富集培养海洋沉积物样品采自于渤海(塘沽海域)。沉积物样品进行厌氧富集培养, 培养基成分为(g/L):葡萄糖20.00, 胰蛋白胨4.00, MgCl2 0.10, NaCl 4.00, L-半胱氨酸0.50, K2HPO4 1.50, pH值7.00 ± 0.50。称取沉积物样品10.00 g于150 mL血清瓶中, 加入100 mL富集培养基和1.0 mL人工合成Fe(OH)3溶液, 合成步骤见参考文献[16]。充氮气10 min, 保证血清瓶内无氧培养环境, 泥浆混合物于120 r/min, 30℃恒温培养72 h。富集培养步骤重复3次。
1.2 菌群组成分析培养结束, 提取菌群基因组DNA。采用通用引物515F: GTGCCAGCMGCCGCGGTAA和806R: GGACTACHVGGGTWTCTAAT对细菌进行16S rRNA V4区PCR扩增。反应条件为: 98℃预变性2 min, 98℃变性10S, 55℃退火45S, 72℃延伸1 min, 25个循环, 72℃最终延伸10 min。PCR产物进行电泳检测后, 对目的DNA条带进行产物回收。使用建库试剂盒(TruSeq® DNA PCR-Free Sample Preparation Kit)进行DNA文库的构建, 采用Qubit和Q-PCR对文库进行定量。文库合格, HiSeq2500 PE250进行上机测序。基于Illumina HiSeq测序平台, 根据所扩增16S区域特点, 利用双末端测序(Paired-End)方法, 构建小片段文库进行双末端测序, 通过对Reads拼接过滤, OTUs(Operational Taxonomic Units)聚类, 进行物种注释及丰度分析。测序由北京诺禾致源生物信息科技有限公司完成。
1.3 异化铁还原性质分析Fe(Ⅲ)分别以可溶性(柠檬酸铁)和不可溶性[人工合成Fe(OH)3]添加到富集培养基中。间隔12 h取样, 测定菌体生长量OD600及培养液Fe(Ⅱ)浓度, 绘制菌群在不同Fe(Ⅲ)形态条件下细胞生长和Fe(Ⅲ)还原性质随时间变化曲线。
1.4 Cr(Ⅵ)的还原设置初始Cr(Ⅵ)浓度: 0, 10, 20, 30, 40, 50 mg/L。将菌株分别接种于不同Cr(Ⅵ)浓度的培养基, 测定菌株细胞生长量OD600, 蛋白质含量及培养液剩余Cr(Ⅵ)浓度, 分析Cr(Ⅵ)浓度对菌株细胞生长的影响。设置不同初始Fe(Ⅲ)浓度: 0, 280, 560, 1120, 1680, 2240 mg/L, 分别添加至含铬浓度为20 mg/L培养基中, 测定菌群细胞生长量OD600, 培养液生成Fe(Ⅱ)浓度及Cr(Ⅵ)还原率, 分析Fe(Ⅲ)还原性质对Cr(Ⅵ)还原的影响。
1.5 分析方法利用分光光度计(752PC, 上海光谱有限公司)测定培养液在600 nm吸收值, 指示细菌细胞生长。菌群蛋白质含量测定根据考马斯亮蓝G250染色法。异化还原Fe(Ⅲ)性质通过测定培养液中产生Fe(Ⅱ)浓度表示。采用邻菲啰啉分光光度法测定Fe(Ⅱ), 计算Fe(Ⅱ)浓度, 具体步骤参考文献[17]。采用二苯碳酰二肼分光光度法测定培养液Cr(Ⅵ)浓度[12], 步骤:取1.0 mL培养液, 离心(3 000 g, 5 min), 上清液0.5 mL, 与1.0 mL DPC显色剂混合, 加蒸馏水定容至5 mL, 反应10 min, 测定反应液在波长540 nm处吸收值, 利用标准曲线计算出培养液中Cr(Ⅵ)浓度。Cr(Ⅵ)还原率的计算根据公式:还原率=(Ci–Cf)/Ci×100%, 其中Ci代表初始Cr(Ⅵ)浓度(mg/L), Cf代表终止Cr(Ⅵ)浓度(mg/L)。
2 结果与讨论 2.1 菌群异化铁还原性质分析设置可溶性Fe(Ⅲ)(柠檬酸铁)和不可溶性Fe(Ⅲ) (氢氧化铁)两组实验条件, 分析Fe(Ⅲ)形态对菌群异化铁还原性质的影响, 见图 1。不同Fe(Ⅲ)形态对细菌异化铁还原性质的影响表现在, 混合菌群以柠檬酸铁为电子受体时, 培养体系累积产生Fe(Ⅱ)浓度为85.08 ± 5.85 mg/L; 当菌群利用氢氧化铁为电子受体时, 其累积Fe(Ⅱ)浓度为32.55 ± 4.78 mg/L。由此可见, 菌群更容易利用可溶性Fe(Ⅲ)作为电子受体进行异化铁还原过程。这可能是由于不同电子受体条件下的电子传递链的组分不同, 导致电子传递途径存在差异[18]。异化铁还原细菌最容易利用的电子受体是络合态Fe(Ⅲ)和可溶性Fe(Ⅲ), 其次是弱晶体Fe(Ⅲ)氧化物, 而Fe(Ⅲ)氧化物晶体是最难利用, 不同形态Fe(Ⅲ)作为电子受体, 影响其对异化铁还原细菌呼吸获能过程[19]。对于不接种菌株的空白组, 在60 h培养时间内, 培养液中都没有测定出Fe(Ⅱ)浓度。这表明培养液中累积Fe(Ⅱ)浓度, 是菌株以Fe(Ⅲ)为电子受体异化铁还原过程中累积产生。
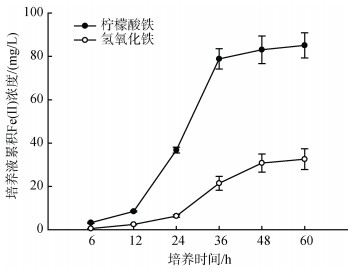 |
| 图 1 电子受体对混合菌群异化Fe (Ⅲ)还原性质的影响 Fig. 1 Effect of different electron acceptors on Fe(Ⅲ)- reducing characterization of the mixed culture |
不同电子受体下, 高通量测序分析菌群组成, 见图 2。在无添加Fe(Ⅲ)空白对照组中, 检测到78 291个门, 77 268个属和53 262种细菌, 在属水平上, 前3个优势属分别为芽孢乳杆菌属Sporolactobacillus, 类芽孢杆菌属Paenibacillus, 梭菌属Clostridium_ sensu_stricto_12, 相对丰度分别为36.7%, 16.3%和14.7%;在柠檬酸铁为电子受体的实验组, 检测到75 837个门, 71 871个属和12 627种细菌, 前3个优势属分别为梭菌属Clostridium_sensu_stricto_12, 芽孢乳杆菌属Sporolactobacillus, 芽孢杆菌属Bacillus, 相对丰度分别为25.4%, 23.1%和22.6%;在氢氧化铁为电子受体的实验组, 检测到75 006个门, 73 526个属和50 444种细菌, 前3个优势属分别芽孢乳杆菌属Sporolactobacillus, 梭菌属Clostridium_sensu_stricto_ 1, 梭菌属Clostridium_sensu_stricto_12, 相对丰度分别为24.8%, 15.4%和13.9%。在以Fe(Ⅲ)为电子受体的培养体系中, 异化铁还原混合菌群显著富集优势菌是Clostridium, 该菌隶属梭菌目Clostridiales, 变形菌门Firmicutes, Wang XJ等[20]研究发现, 梭菌能够利用多种电子受体进行细胞生长。在可溶性柠檬酸铁为电子受体条件下, 菌群的多样性指数最高(shannon指数4.615);在以氢氧化铁为电子受体时, 混合菌群多样性指标shannon指数相对降低, 为4.158。这表明异化铁还原过程中, 混合菌群利用电子受体柠檬酸铁进行生长的效率更高。这可能是因为混合菌群进行异化铁还原时, 相比较不溶性铁, 更易利用可溶性铁进行细胞生长。
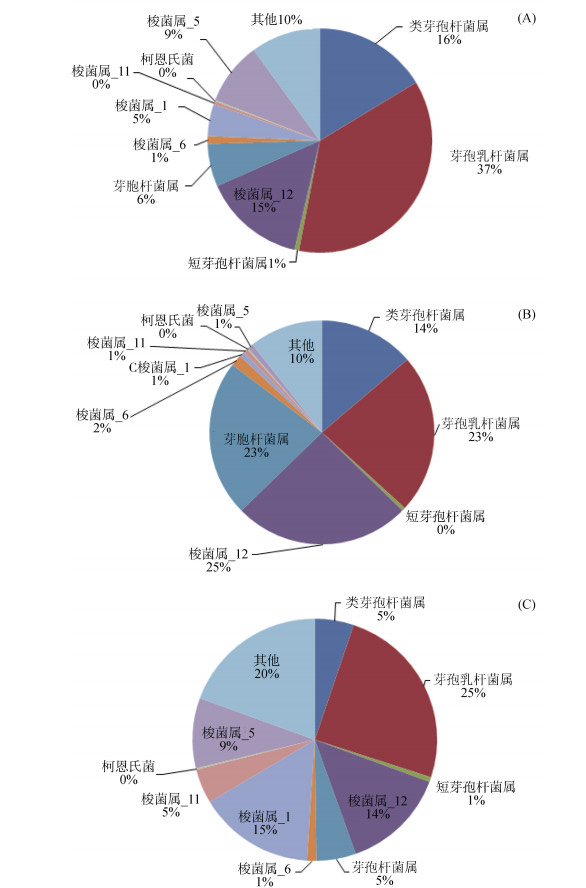 |
| 图 2 不同电子受体培养下菌群在属水平上的分类组成(A无添加Fe(Ⅲ); B柠檬酸铁; C氢氧化铁) Fig. 2 Bacterial community compositions, at genus levels, of the mixed cultures under different electron acceptors (A) without adding Fe(Ⅲ); (B) adding citric acid iron; (C) adding iron hydroxide |
设置不同Cr(Ⅵ)浓度: 0, 10, 20, 30, 40, 50 mg/L, 分析Cr(Ⅵ)对菌群生长的影响, 见图 3。在低浓度Cr(Ⅵ)(0~10 mg/L)条件下, 富集培养的混合菌群细胞能够正常生长。Cr(Ⅵ)浓度为10 mg/L时, 菌群细胞密度OD600为0.23 ± 0.02, 菌群蛋白质含量19.22 ± 1.85 mg/L, 对Cr(Ⅵ)还原率达到29%。随着Cr(Ⅵ)浓度增加, 较高Cr(Ⅵ)浓度(20~30 mg/L)条件下, 混合菌群细胞生长表现出明显抑制。当Cr(Ⅵ)20 mg/L时, 菌群细胞生长受到严重抑制, Cr(Ⅵ)还原率只有18%。菌群在30 mg/L Cr(Ⅵ)时基本停止生长。伍迪等报道了粘质沙雷氏菌对Cr(Ⅵ)浓度耐受范围, 当Cr(Ⅵ)达到20 mg/L时, 菌株细胞生长受到严重抑制, 30 mg/L Cr(Ⅵ)导致菌株停止生长[21]。Cr(Ⅵ)浓度大于5 mmol/L, 对海洋沉积物腐殖质还原菌生长明显抑制[22]。可见, Cr(Ⅵ)作为一种重金属污染物, 严重抑制细胞生长, 对微生物产生毒害抑制作用大。
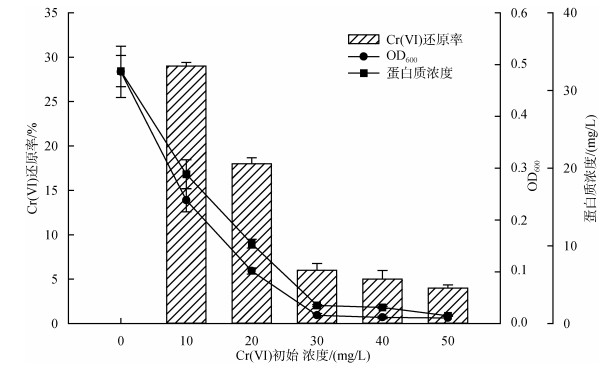 |
| 图 3 Cr(Ⅵ)浓度对菌群细胞生长及Cr(Ⅵ)还原率影响 Fig. 3 Effects of Cr(Ⅵ) concentration on Cr(Ⅵ) reduction and cell growth by the mixed culture |
固定Cr(Ⅵ)浓度为20 mg/L, 分别添加置不同电子受体的培养体系中, 分析重金属Cr(Ⅵ)对细菌菌群组成的影响, 见图 4。高通量测序分类结果表明, 不含Fe(Ⅲ)的空白对照组, 即含铬培养条件下混合菌群优势菌属发生改变, 空白对照组中芽孢乳杆菌属Sporolactobacillus(36.7%)和类芽孢杆菌属Paeni ba cillus(16.3%)丰度下降明显, 分别为1.9%和1.2%, 而且其他菌属的相对丰度也明显下降。含铬实验组中, 优势菌属是梭菌属Clostridium_sensu_stricto_6相对丰度提高, 达到22.2%。
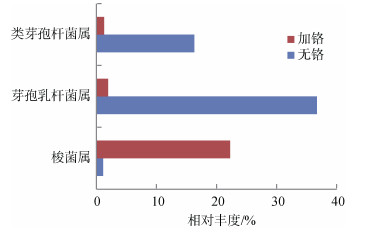 |
| 图 4 混合菌群在属水平上相对丰度的变化 Fig. 4 Variation of relative abundance by the mixed culture at genus levels |
由此可见, Cr(Ⅵ)的添加明显减少了混合菌群的组成种类, 菌群多样性下降明显, 优势菌属被替代。在含Cr(Ⅵ)培养环境中, 由于Cr(Ⅵ)对细胞的毒害效应, 生存竞争逐渐加剧, 竞争能力较弱的Bacillus菌属逐渐被竞争能力较强的Clostridium所取代, 成为绝对优势类型。以Fe(Ⅲ)为电子受体的培养体系, 无论是柠檬酸铁还是氢氧化铁为电子受体, Cr(Ⅵ)的添加没有显著改变菌群优势菌的组成。异化铁还原细菌产生的Fe(Ⅱ)以非生物方式, 即是一种化学作用将Cr(Ⅵ)还原为Cr(Ⅲ)。反应式为: 3Fe2++HCrO4–+8H2O=3Fe(OH)3+ Cr(OH)3+5H+。以解除Cr(Ⅵ)对细胞毒害效应[23]。因此, Cr(Ⅵ)的添加没有明显改变异化铁还原细菌菌群组成。异化铁还原细菌还原重金属Cr(Ⅵ)包含着生物-非生物氧化还原过程, 这将拓展Cr(Ⅵ)还原机制的研究。
2.4 异化铁还原性质对Cr(Ⅵ)还原效率的影响Fe(Ⅲ)浓度对异化铁还原菌群细胞生长及还原Cr(Ⅵ)的影响见图 5, 固定Cr(Ⅵ)浓度20 mg/L。空白组(未添加Fe(Ⅲ))菌群细胞生长指标OD600值只有0.10 ± 0.01。细胞生长在含铬环境中受到显著抑制。异化铁还原细菌还原Cr(Ⅵ)效率随着柠檬酸铁添加而显著提高。浓度为1 120 mg/L时, 异化铁还原细菌还原Cr(Ⅵ)效率达100%, 是对照组5.6倍。以氢氧化铁为电子受体时, 在设置Fe(Ⅲ)浓度范围内, 异化铁还原细菌细胞生长及还原Cr(Ⅵ)效率随着氢氧化铁浓度增加表现出先提高后降低规律。Fe(Ⅲ)浓度为1680 mg/L时, 菌群细胞生长及还原Cr(Ⅵ)效率最高, OD600 = 0.44 ± 0.02(图中未显示)及还原率72%。继续提高氢氧化铁浓度, 异化铁还原细菌细胞生长及还原Cr(Ⅵ)效率并没有随之提高, OD600 = 0.35 ± 0.03 (图中未显示)及还原率67%。这可能是由于高浓度Fe(Ⅲ)可能对菌株细胞表面产生阻碍摩擦, 最终影响细菌生长及异化铁还原过程[24]。可见, 异化铁还原细菌还原Cr(Ⅵ)效率与异化铁还原过程关系紧密。Fe(Ⅱ)来源于异化铁还原过程并作为还原剂影响Cr(Ⅵ)转化, 从而能有效还原Cr(Ⅵ)并解除Cr(Ⅵ)对细胞生长的毒害抑制作用[25]。
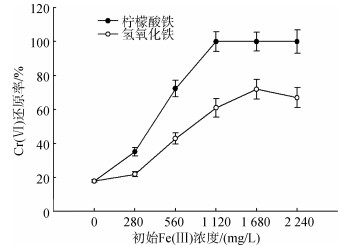 |
| 图 5 Fe(Ⅲ)浓度对异化铁还原细菌还原Cr(Ⅵ)的影响 Fig. 5 Effects of Fe(Ⅲ) concentration on Cr(Ⅵ) reduction by Fe(Ⅲ)-reducing bacteria |
混合菌群富集于海洋沉积物, 菌群能利用不同形态Fe(Ⅲ)作为电子受体进行异化铁还原。以可溶性柠檬酸铁和不可溶性氢氧化铁为电子受体时, 累积Fe(Ⅱ)浓度分别为85.08 ± 5.85 mg/L和32.55 ± 4.78 mg/L。在柠檬酸铁和氢氧化铁为电子受体培养体系中, 细菌种群优势属组成基本一致, 相对丰度存在差异, 优势菌属Clostridium, 属于梭菌目Clostridiales, 表明梭菌是参与Fe(Ⅲ)还原的主要优势菌。无添加Fe(Ⅲ)时, 菌群在含不同初始Cr(Ⅵ)浓度培养条件下细胞生长量都有不同程度降低, 特别是当Cr(Ⅵ)浓度高于20 mg/L时, 重金属Cr(Ⅵ)对菌群细胞生长的抑制作用显著。添加不同浓度Fe(Ⅲ), 菌群利用异化铁还原过程间接还原Cr(Ⅵ)。柠檬酸铁为电子受体, Fe(Ⅲ)浓度1120 mg/L时, 异化铁还原细菌还原Cr(Ⅵ)效率达100%。菌群利用氢氧化铁作为电子受体, Fe(Ⅲ)浓度1680 mg/L, 还原Cr(Ⅵ)效率较高, 是对照组4倍。利用微生物的异化铁还原过程间接还原重金属Cr(Ⅵ), 是利用微生物解决重金属Cr(Ⅵ)污染的重要方式。
| [1] |
Anderson R T, ovley D R. Hexadecane decay by methanogenesis[J]. Nature, 2000, 404: 722-723. DOI:10.1038/35008145 |
| [2] |
司友斌, 王娟. 异化铁还原对土壤中重金属形态转化及其有效性影响[J]. 环境科学, 2015(9): 3533-3542. Si Youbin, Wang Juan. Influence of dissimilatory iron reduction on the speciation and bioavailability of heavy metals in soil[J]. Environmental Science, 2015(9): 3533-3542. |
| [3] |
Veeramani H, Alessi D S, Suvorova E I, et al. Products of abiotic U(Ⅵ) reduction by biogenic magnetite and vivianite[J]. Geochimica et Cosmochimica Acta, 2013, 75: 2512-2528. |
| [4] |
Amstaetter K, Borch T, Larese-Casanova P, et al. Redox transformation of arsenic by Fe(Ⅱ)-activated goethite (alpha-FeOOH)[J]. Environmental Science & Technology, 2010, 44(1): 102-108. |
| [5] |
Si Y B, Zou Y, Liu X H, et al. Mercury methylation coupled to iron reduction by dissimilatory iron-reducing bacteria[J]. Chemosphere, 2015, 122: 206-212. DOI:10.1016/j.chemosphere.2014.11.054 |
| [6] |
Zhang J, Dong H, Zhao L, et al. Microbial reduction and precipitation of vanadium by mesophilic and thermophilic methanogens[J]. Chemical Geology, 2014, 370(4): 29-39. |
| [7] |
Wielinga B, Mizuba M M, Hansel C M, et al. Iron promoted reduction of chromate by dissimilatory iron-reducing bacteria[J]. Environmental Science & Technology, 2001, 35(3): 522-527. |
| [8] |
Xu F, Teng M, Lian Z, et al. Chromium isotopic fractionation during Cr(Ⅵ) reduction by Bacillus. sp. under aerobic conditions[J]. Chemosphere, 2015, 130: 46-51. DOI:10.1016/j.chemosphere.2015.02.033 |
| [9] |
Wang Q, Huang L, Pan Y, et al. Impact of Fe(Ⅲ) as an effective electron-shuttle mediator for enhanced Cr(Ⅵ) reduction in microbial fuel cells:Reduction of diffusional resistances and cathode overpotentials[J]. Journal of hazardous materials, 2016, 321: 896-906. |
| [10] |
杜艳影, 刘小红, 李劲, 等. Shewanella oneidensis MR-1对Cr(Ⅵ)的还原及其影响因素[J]. 中国环境科学, 2018, 38(7): 342-347. Du Yanying, Liu Xiaohong, Li Jin, et al. Reduction of Cr (Ⅵ) by Shewanella oneidensis MR-1 and its influencing factors[J]. China Environmental Science, 2018, 38(7): 342-347. |
| [11] |
生贺, 于锦秋, 刘登峰, 等. 乳化植物油强化地下水中Cr(Ⅵ)的生物地球化学还原研究[J]. 中国环境科学, 2015, 35(6): 1693-1699. Sheng He, Yu Jinqiu, Liu Dengfeng, et al. Biogeochemical Cr(Ⅵ) reduction in groundwater enhanced by emulsified vegetable oil[J]. China Environmental Science, 2015, 35(6): 1693-1699. DOI:10.3969/j.issn.1000-6923.2015.06.011 |
| [12] |
Peng L, Liu Y, Gao S H, et al. Assessing chromate reduction by dissimilatory iron reducing bacteria using mathematical modeling[J]. Chemosphere, 2015, 139: 334-339. DOI:10.1016/j.chemosphere.2015.06.090 |
| [13] |
Xu F, Teng M, Lian Z, et al. Chromium isotopic fractionation during Cr(Ⅵ) reduction by Bacillus. sp. under aerobic conditions[J]. Chemosphere, 2015, 130: 46-51. DOI:10.1016/j.chemosphere.2015.02.033 |
| [14] |
曲胜路, 杨茹君, 苏函, 等. 海洋中Fe(Ⅱ)的行为及微生物参与下的过程研究概述[J]. 海洋科学, 2017, 41(10): 139-148. Qu Shenglu, Yang Rujun, Su Han, et al. A review of the behavior and microbial activity of Fe(Ⅱ) in seawater[J]. Marine Sciences, 2017, 41(10): 139-148. DOI:10.11759/hykx20170428001 |
| [15] |
刘洪艳, 王红玉, 谢丽霞, 等. 海洋沉积物中一株铁还原细菌分离及Fe(Ⅲ)还原性质[J]. 海洋科学, 2016, 40(3): 65-70. Liu Hongyan, Wang Hongyu, Xie Lixia, et al. Isolation and characterization of a Fe (Ⅲ)-reducing bacterium Klebsiella sp. KB52 from the marine sediment[J]. Marine Sciences, 2016, 40(3): 65-70. |
| [16] |
Liu H Y, Wang G C. Microbial Fe (Ⅲ) reduction and hydrogen production by a transposon-mutagenized strain of Pantoea agglomerans, BH18[J]. Energy, 2015, 81: 691-695. DOI:10.1016/j.energy.2015.01.014 |
| [17] |
张洪霞, 郑世玲, 魏文超, 等. 水分条件对滨海芦苇湿地土壤微生物多样性的影响[J]. 海洋科学, 2017, 41(5): 144-152. Zhang Hongxia, Zheng Shiling, Wei Wenchao, et al. Effects of water conditions on the diversity of soil microbial communities in the coastal reed wetlands[J]. Marine Sciences, 2017, 41(5): 144-152. |
| [18] |
马晨, 杨贵芹, 陆琴, 等. Fontibacter sp. SgZ-2厌氧腐殖质/Fe(Ⅲ)还原特性及电子传递机制研究[J]. 环境科学, 2014, 35(9): 3522-3529. Ma Chen, Yang Guiqin, Lu Qin, et al. Anaerobic reduction of humus/Fe(Ⅲ) and electron transport mechanism of Fontibacter sp. SgZ-2[J]. Environmental Science, 2014, 35(9): 3522-3529. |
| [19] |
覃海华, 忻宏蔚, 刘洪艳. 不同电子受体下铁还原细菌异化还原Fe(Ⅲ)性质及菌群特征[J]. 生态学杂志, 2018, 37(6): 1759-1764. Qin Haihua, Xin Hongwei, Liu Hongyan. Characteristics of Fe(Ⅲ) reduction and microbial community by Fe(Ⅲ) reducing bacteria using different donor acceptors[J]. Chinese Journal of Ecology, 2018, 37(6): 1759-1764. |
| [20] |
Wang X J, Yang J, Chen X P, et al. Phylogenetic diversity of dissimilatory ferric iron reducers in paddy soil of Hunan, South China[J]. Journal of Soils and Sediments, 2009, 9(6): 568-577. DOI:10.1007/s11368-009-0113-x |
| [21] |
伍迪, 陈晓明, 肖伟, 等. 粘质沙雷氏菌对U(Ⅵ)、Co(Ⅱ)、Cr(Ⅵ)的耐受性研究[J]. 安全与环境工程, 2017, 24(2): 53-57. Wu Di, Chen Xiaoming, Xiao Wei, et al. Tolerance of Serratia marcescens to U(Ⅵ)、Co(Ⅱ) and Cr(Ⅵ)[J]. Safety and Environmental Engineering, 2017, 24(2): 53-57. |
| [22] |
吴鹏.海洋沉积物腐殖质还原菌的分离鉴定及其对Cr(Ⅵ)的还原性能[D].暨南大学, 2010. Wu Peng. Isolation and identification of humic-reducing bacteria in marine sediment and its application in Cr(Ⅵ) reduction[D]. Jinan University, 2010. |
| [23] |
Wielinga B, Mizuba M M, Hansel C M, et al. Iron promoted reduction of chromate by dissimilatory iron-reducing bacteria[J]. Environmental Science Technology, 2001, 35: 522-527. DOI:10.1021/es001457b |
| [24] |
Liu C, Zachara J M, Gorby Y A, et al. Microbial reduction of Fe (Ⅲ) and sorption/precipitation of Fe (Ⅱ) on Shewanella putrefaciens strain CN32[J]. Environmental Science Technology, 2001, 35: 1385-1393. DOI:10.1021/es0015139 |
| [25] |
Watts M P, Coker V S, Thomas S A R A, et al. Effective treatment of alkaline Cr(Ⅵ) contaminated leachate using a novel Pd-bionanocatalyst:Impact of electron donor and aqueous geochemistry[J]. Applied Catalysis B-Environmental, 2015, 170-171: 162-172. DOI:10.1016/j.apcatb.2015.01.017 |
 2019, Vol. 43
2019, Vol. 43

