中国海洋湖沼学会主办。
文章信息
- 张芳, 李超伦, 孙松, 魏皓, 王彦涛. 2017.
- ZHANG Fang, LI Chao-Lun, SUN Song, WEI Hao, WANG Yan-Tao. 2017.
- 水母灾害的形成机理、监测预测及防控技术研究进展
- PROGRESS ON STUDYING JELLYFISH BLOOM, AND THE MONITORING AND CONTROL
- 海洋与湖沼, 48(6): 1187-1195
- Oceanologia et Limnologia Sinica, 48(6): 1187-1195.
- http://dx.doi.org/10.11693/hyhz20171000258
-
文章历史
- 收稿日期:2017-10-12
- 收修改稿日期:2017-10-18
2. 海洋国家实验室海洋生态与环境科学功能实验室 青岛 266071;
3. 中国科学院海洋研究所 山东胶州湾海洋生态系统国家野外科学观测研究站 青岛 266071;
4. 中国科学院大学 北京 100049;
5. 天津大学海洋科学与技术学院 天津 300072
2. Laboratory for Marine Ecology and Environmental Science, National Laboratory for Marine Science and Technology, Qingdao 266071, China;
3. Jiaozhou Bay Marine Ecosystem Research Station, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China;
5. School of Marine Science and Technology, Tianjin University, Tianjin 300072, China
在过去的30年间, 人们发现胶质类生物特别是水母类在全球生产力较高的海域出现了数量增多或者暴发的现象(Arai, 2001; Lynam et al, 2005; Purcell et al, 2005, 2007; 张芳等, 2009)。水母的持续暴发会破坏近海生态系统的正常结构和功能, 从而对近海生态系统的退化和演变产生重要影响, 因此水母增多或暴发被认为是一种由于海洋动物暴发而形成的非常严重的全球性生态灾害(孙松等, 2012)。与其他海域类似, 我国近海生态系统出现不稳定状态, 已经导致一系列的生态灾害, 水母暴发所导致的灾害是除赤潮之外的最严重的海洋生态灾害, 已经对我国的海洋生态环境安全造成严重威胁。水母数量增加是由于全球气候变化和人类活动共同作用下海洋生态系统演变的一个综合反应, 是全球生态系统演变的指示(孙松, 2012; Condon et al, 2013; 孙松等, 2014)。因此中国科学院战略性先导科技专项项目“热带西太平洋海洋系统物质能量交换及其影响”中的一个重点任务就是对外海影响下的黄东海的生态灾害进行研究。项目的目标之一就是要探明黑潮输入与黄、东海生态灾害发生的关系, 预测和分析黑潮输入影响下的黄、东海生态灾害的演变趋势, 其中水母灾害的形成机理及其预测和防控是重要的研究内容之一。研究水母生态灾害的机理和趋势与研究我国近海生态系统的演变趋势和机理的过程是相辅相成的, 是对我国海洋生态灾害和生态系统演变研究的重要组成部分, 从水母灾害发生机理的角度更能深入分析黑潮及其变异对中国近海生态系统的影响。
水母数量增多或暴发不但会破坏所在的海洋生态系统, 还会对暴发区域的经济和社会造成巨大威胁, 例如世界上的很多核电站、火力发电站、海水淡化厂和滨海化工厂都受到过水母暴发的影响。水母的暴发也迫使很多海水浴场和滨海游乐设施关闭, 给旅游业造成严重影响。因此我们不仅亟需在科学上阐明水母灾害发生的重要过程和机制, 而且在技术上亟需研发水母灾害监测预警系统和防灾减灾技术体系, 以提升我国海洋水母灾害应对能力和海洋环境安全保障能力。本文综述了水母灾害的形成机理、监测及防控技术的国内外研究进展, 为丰富我国在海洋生态系统动态变化和海洋生态灾害研究方面的理论和技术提供支撑, 对提高我国在海洋生态环境研究基础和应用领域的整体研究水平和国际地位具有重要意义。
1 水母灾害的形成机理追溯全球水母暴发问题的研究历程, 自20世纪60年代特别是20世纪90年代末到现在, 全球海洋生态学家一直致力于不同水母旺发海域水母暴发问题的研究, 水母暴发问题涉及暴发的原因与暴发后的生态学效应, 研究内容和理论发展由浅入深, 取得了飞跃式发展。在开展暴发原因与机理的研究方面, 从一开始研究暴发水母个体和种群水平上的基本的显现规律、生物量描述到研究水母种群对气候变化、鱼类资源变动及人类活动的响应; 在生活史角度研究暴发机理的研究方面, 从一开始的重点研究看得见的浮游水母体阶段转变为重点研究看不见的底栖水螅体阶段; 从个体生长、种群变动研究到生态系统演变水平上研究和解析水母暴发原因, 即从暴发海域的富营养化程度、浮游植物、浮游动物生物量的变动来分析水母暴发的原因(孙松, 2012)。近来, 水母生态学家开始重新评估和理解水母暴发的事件(Graham et al, 2014), 以往的观点认为水母暴发会对社会、经济、生态等造成不利影响, 在对水母暴发进行重新评估后认为水母的数量增加将与人类的福祉联系起来。
我国水母暴发机理的研究紧跟国际前沿, 甚至处于领跑地位。在刚刚完成以基础研究为主的国家重点基础研究发展计划(973计划)“中国近海水母暴发的关键过程、机理及生态环境效应”项目(水母973项目), 取得了前瞻性研究进展。该项目紧紧抓住影响灾害水母暴发的无性世代(底栖阶段)的关键过程及机理, 对灾害水母的暴发原因进行了深入研究, 例如2012年《海洋与湖沼》第43卷刊出了中国水母计划取得的进展, 以及在Hydrobiologia杂志2015年第754卷刊出的中国水母计划的文章集刊(Sun et al, 2015a)。事实上, 在对其无性世代的生活史策略研究结果中, 发现了环境条件(温度、盐度、饵料等)的变化对无性生活史策略的改变起着至关重要的作用。而在已有的有性世代的研究中, 主要围绕致灾水母种类的自然生活史, 研究了其水母体种群在黄东海的发源地、种群增长过程中的时空分布格局(Zhang et al, 2012; Sun et al, 2015b)。虽然对沙海蜇有性世代研究中水母体的生物量、时空分布机制的研究较为深刻, 但在诠释近年来沙海蜇数量年际变化的原因时, 除了已有的从无性世代的水螅体的存活、繁殖、被捕食及碟状体的产出量、死亡率等方面对环境条件的响应探讨数量变动的机制外(Feng et al, 2015; Sun et al, 2015b), 需要加强其他无性生活史阶段的关键过程, 例如控制浮浪幼虫通过变态附着后发育为新螅状体的过程及变态率等, 也要加强其有性世代的水母体的生长与繁殖策略的研究。
2 水母的监测和预警技术在全球研究水母暴发原因的同时, 也开展了对致灾水母种群数量监测与预警技术的探索与研究。世界上对大型水母采集、定量与行为研究的技术多种多样。从传统的网具、简单的声学的方法、光学或者成像系统的方法开始(表 1), 到近年来的利用弹出式存储传输标签、超声波脉冲发射器、可视化成像系统、粒子追踪测速的声学方法以及其他电子标签等技术对水母进行实时的垂直分布、游泳速度等生活习性进行研究。例如, Honda等(2009)利用弹出式存储传输标签和超声波脉冲发射器对沙海蜇的研究发现, 水母游泳的深度主要和海区的水文结构有关, 并且夜间所处深度显著大于白天。光周期、饵料生物的生活习性、生物自身的昼夜节律、海区的水文条件哪个因素起决定性作用尚不明确。Fossette等(2016)探讨了几种电子标签技术在水母类生活习性及生态学研究的可行性, 认为电子标签技术是水母实时监测的有效技术。Bi等(2013)利用浮游生物可视化成像系统在切萨皮克湾对栉水母的研究发现, 栉水母在高温低盐水团中出现的频次更高, 这套系统亦可以用于钵水母幼体的长时间序列的连续观测。Lee等(2010)利用粒子追踪测速的声学方法对沙海蜇垂直分布和游泳速度进行了研究, 为构建沙海蜇在东亚海域的迁移模型提供了基础数据。
| 采样原理 | 详细说明与举例 | 采用相应的采样工具描述水母丰度/生物量的文献 |
| 网具 | 浮游生物网(Bongo net, 太平洋网) | Barz et al, 2007 |
| IKMT网(Isaacs-Kidd midwater trawl) | ||
| 斜拖网(Oblique multinet haul) | ||
| 底拖网(Bottom trawl) | Brodeur et al, 1999, 2002 | |
| Nordic 264 rope trawl | Suchman et al, 2005 | |
| 声学 | Acoustical approach | Purcell et al, 2000 |
| 光学或成像系统 | CPR (Continuous Plankton Recorder) | Attrill et al, 2007 |
| OPC (Optical Plankton Counter) | 无相关文献(被认为不适合研究大型水母) | |
| laser OPC | ||
| VPR (Video Plankton Recorder) | —— | |
| 相机和扫描仪(direct-imaging system)如: Silhouette Camera, Ichthyoplankton Recorder | Kasuya et al, 2001 | |
| Scuba diving | Hamner et al, 1994; Costello et al, 1998 | |
| Manned submersibles | Youngbluth, 1985 | |
| ROV (remotely operated vehicle) AUV (autonomous underwater vehicle) | Raskoff, 2001; Silguero et al, 2000 | |
| Jellycam, video camera system | Graham et al, 2003 |
目前对大型水母的丰度/生物量估计的方法并没有统一, 人们普遍认为对大型水母的定量是一件困难的事情, 普遍存在的问题是大型水母的含水量大, 体积大, 以及斑块分布, 这些问题都会导致生物量的估计不准(Hamner et al, 1975, Omori et al, 1982; Graham et al, 2003)。在使用传统的网具, 声学的方法, 以及光学或成像系统的方法中, 成像系统的方法应用相对较多。传统的通常用于浮游生物定量的拖网方法, 以及通常用于评估渔业资源底拖网的调查方法, 在用于评估水母种群的生物量和丰度时, 虽然在某种程度上是半定量的方法, 但是由于水母丰度历史数据多采用该方法, 因此把这种方法作为定量生物量的相对指标进行年际变化的比较是具有实践意义的。采用网具比如底拖网调查的方法有可能导致生物量或丰度低估。原因之一是网具的网口宽度在可变的水的压力下会发生变化, 这种变化使渔网很难定量, 其二是水母的垂直和水平的斑块分布。比如Barz等(2007)报道北海南部的水母主要分布在5—25m, 在垂直方向上并非均匀分布。作者所在课题组在我国黄东海通常的调查过程中也发现在许多站位的表层或次表层出现大量的水母, 日本海南部的沙海蜇主要聚集于40m层以上的水层(Honda et al, 2009)。其三, 网具的类型, 中层网或底拖网, 不能完全把除网具所设定的目标水层以外的水母全部收入囊中, 这时候就需要对捕捉效率或者捕获率进行估计。
除了传统网具的水母监测定量方法外, 在船甲板上目测计数定量大型水母丰度的方法也为很多科学家所用(Pitt et al, 2014)。广岛大学的Uye教授课题组从2006年开始每年搭载从日本海的周边城市至黄东海周边城市的客船, 对黄东海及日本海的表层大型水母的分布及丰度进行目测计数, 用此方法来预测日本海水母的丰度状况。目测计数的方法优点是简单易操作, 省钱省力, 缺点是只能观测水体表面或上层水体内水母的丰度, 而海水表层水母的出现情况受天气、水文条件、水母的垂直移动的行为等条件的影响, 因此用这种方法定量监测有一定的误差。杨东方等(2014)分析了近年来新技术(水下摄像、声呐成像和航空影像)在水母监测方法中的应用, 并比较了各种监测方法的优缺点, 为全面了解水母监测方法做了有益的补充。水下摄像技术的监测方法优点在于分辨率高、能够反映水母的运动行为, 且水母的时空分布、移动过程和行为表现都可以通过水下摄像进行记录, 其缺点是视野有限。近年来水下摄像技术在发展过程中也不断完善, 分辨率及所监测的范围也不断扩大。声呐成像的监测方法优点在于监测范围广、可以同时监测水母的水平和垂直分布、在浑浊或昏暗水体中也可以监测等优点, 其缺点是分辨率低, 无法进行种属的判别、无法反映水母的运动行为等。近年来正在研发声学和光学影像相结合的监测方法定量水母。而航空影像的监测技术, 在水体表层或近表层, 可以观察大型水母的分布状况、运动过程和行为表现。航空影像监测的另一个优点是不需要接触水体, 惊扰这些水母, 就可以完成这些观察的过程。
以上方法基本上是对于水母体的监测方法, 对于水母早期幼体的监测, 特别是对水母的受精卵、浮浪幼虫、螅状体、碟状体等微小个体的监测比较困难, 传统方法主要通过网具或采水采集样品, 然后在显微镜下根据形态特征进行分类鉴定计数, 但由于水母的早期幼体个体小, 显微镜观察难以鉴别种类, 近年来正在发展分子生物学生物标记技术对水母早期幼体进行识别。例如, 对海月水母进行早期监测的分子生物学方法正在逐渐建立和完善。王建艳等(2013)通过选用特殊的分子标记, 设计特异性引物建立海月水母的分子探针检测方法, 可以对大量网采样品或附着在基质上的样品直接进行检测, 快捷方便, 但目前这种方法只限于对海月水母的定性以及半定量研究, 如果结合实时荧光定量PCR技术可望建立一种对海月水母快速定性定量分析的新方法, 从而为研究海月水母早期生长阶段的行为特征提供新的技术手段。Liu等(2016)也报道了用特异性强, 敏感的环介导等温扩增的方法对霞水母的几个发育阶段进行快速检测。笔者课题组正在采用定量PCR、核糖体/线粒体基因PCR扩增子高通量测序(meta barcoding)、FISH等分子生物学技术与潜水原位观测、样方调查、培养实验等基础生物学手段相结合, 研发和建立完善可靠的适用于水母微小个体的检测方法, 已经取得了初步结果。除此之外, 用Scuba-diving、水下机器人等研究手段, 搜寻和监测大型水母的水螅体野外栖息地, 对已发现的水螅体栖息地, 监测水螅体种群动态季节及年际变化也是本课题组正在采用的水母监测手段。
综上所述, 对于监测手段的选择来说, 可以根据监测目标的要求、监测指标、监测海域、监测范围的大小来选择不同的监测水母的方法。既需要结合新的科学技术方法又同时采用传统的方法对水母进行综合监测, 例如, 日本渔业信息中心(Japan Fisheries Information Centre, JAFIC)利用海洋调查、船舶监测、飞机监测、渔民反馈等多种手段, 即时获取监测海域大型水母分布情况, 经过汇总和分析, 通过网络、传真、移动电话等形式进行可视化的水母短期预报。
Gershwin等(2014)基于蛰伤记录和天气情况, 研究发现大堡礁箱水母的暴发和东南信风关系密切, 沿岸风的次日蛰伤事件增多, 为制定浴场管理策略, 发布预警信息, 减少蛰伤事件提供了指导。吴玲娟等(2016)围绕大型水母的迁移规律、溯源研究、数值模拟的方法综述了国内外对大型水母迁移规律和灾害监测预警技术研究进展, 认为在水母的监测预警技术方面, 需加强和完善水母漂移聚集机理的研究, 为进一步监测预警技术的发展做基础。
事实上, 对于东亚水域暴发的沙海蜇来说, 对水母漂移聚集的机理已经展开了研究, 例如Moon等基于ROMS (Regional Ocean Modeling System)模型, 未考虑潮汐运动, 利用拉格朗日粒子跟踪实验追溯日本海沙海蜇来源, 认为日本海暴发的水母可能的源地之一为长江口, 而且水母的分布受中国东海到日本海之间的风应力及沿岸流的影响较大(Moon et al, 2010)。罗晓凡等基于含潮汐过程的POM模式气候态模拟, 并考虑质点垂直运动得出的结果与Moon不同的结果:济州岛沿岸质点几乎全部穿过朝鲜/对马海峡进入日本海, 其他释放区质点主要在黄海潮汐锋区和长江口以南沿岸锋聚集(罗晓凡等, 2012)。张海彦等未考虑水母自身运动, 采用拉格朗日粒子方法追溯其运动路径及可能源地, 并结合水母运动路径和种类分布特征综合分析了夏季青岛外海大型水母的潜在源头(张海彦等, 2012)。在其他海域, Berline等(2013)考虑0—300m垂直迁移, 利用拉格朗日粒子跟踪模型建立了法国利古里亚海夜光游水母高分辨率的模式, 模拟水母的运动, 指出北向流和海面风场是是影响水母向近岸漂移的主要因素。
3 水母灾害的防控及应急处置技术自水母数量增长甚至暴发对全球暴发海域的社会、经济及生态造成严重经济损失以来, 国内外对水母的防控技术和措施相继发展, 从最初的网具拦截、船舶打捞到近年来的工程设施拦截疏导、高压水枪清除、气泡和超声波驱赶等新技术的研发和应用, 各自有不同的优势。这些防控技术的应用有一定的海域适应性、服务功能适应性以及水母种类适应性。例如, 韩国近年来利用高压水枪在韩国大量暴发海月水母的施华湖等海域对海月水母的水螅体进行清除, 成为成功防控水母暴发的典范(图 1)。这种处置方法为水母灾害从源头控制提供了新的思路。虽然这种使用高压水枪的技术清除水螅体的方法去除率高, 可以使用于任何海域, 但是使用这种防控技术的基本前提是必须找到致灾水母水螅体的集中附着地, 这样才能高效去除水母的早期幼体阶段, 将其在暴发之前扼杀在摇篮里, 而不能继续生长繁殖。然而寻找自然水域中的水螅体并不是简单的事情, 需要利用足够的潜水员在特定时期的周密调查才能实现, 具有一定的风险性。另外该方法潜在的缺点是使用高压水枪的喷射, 可能会相应地破坏水螅体所在的底栖生态环境, 因此使用此方法防控水母暴发需要有效权衡利弊, 以求防控成效的利益最大化。在日本渔民进行渔业生产时, 为排除水母暴发时期定置渔网中的大型水母造成的渔网堵塞, 作业困难, 他们将定置网具进行了排除水母的改进, 例如增加导流网的网格尺寸, 安装分流网以及分离网来有效排除水母, 从而保证了定置网中渔获物的正常获取, 这种网具的缺点是造价昂贵, 极大增加了渔民的捕鱼成本(图 2)。
 |
| 图 1 韩国应用高压水枪对海月水母进行防控 Fig. 1 Eliminating polyps of moon jellyfish by high-pressurewater gun in Korea 注:引自蔡振豪第十三届中日韩水母会议 |
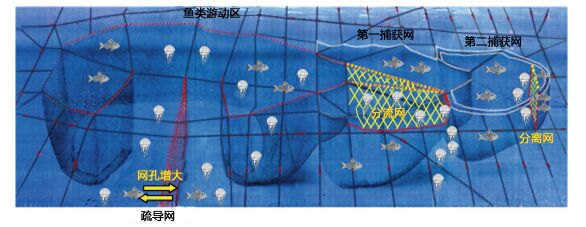 |
| 图 2 经改装后(1.增加导流网的网孔, 2.安装分流网, 3.安装分离网)可排除水母的日本传统定置网(图引自Pitt et al, 2014, 部分重新画图) Fig. 2 Schematic representation of a traditional set net modified to exclude large-sized jellyfish medusa by (1) enlargement of mesh size of the leading nets, (2) installation of bypass nets, and (3) installation of a partition net (Pitt et al, 2014) |
另外, 如果水母暴发事件发生在热电厂或核电厂等有冷却水需求的工业设施海域, 可能会造成取水口的过滤网堵塞。在这些厂的取水口海域, 人们根据海域的地形, 水文特征情况采用了不同的疏导、拦截、驱赶等方式预防水母聚集, 也正在研发水母聚集后的应急处置措施。例如瑞典某电厂在取水区海底设置空气配管, 利用海底气泡技术将水母体从海底吹起, 从配管中喷出发泡空气, 抑制水母流入(图 3)。在日本某发电厂取水口海域, 有采用在船上加载一种涡旋产生装置, 使得船在水母聚集海域航行时产生水流涡旋以达到对水母体有效驱逐的效果。另外, 在日本的一些发电厂的取水口海域采取了增加防范水母的工程设施(图 4), 例如设置了“防水母流入网”来防止水母流入取水槽, 同时安装了摄像设备, 超声波传感器等水母监视系统, 通过观测, 早期发现水母来袭状况, 以便及时做应急处置。另外, 也可定置分散网使水母集群分散开来, 抑制流入速度。如果水母最终被清理到陆地上, 那么将获取的水母打碎, 使其凝集沉淀及离心脱水, 利用把固体成分从水中分离出来的减容法和用水母分解酵素进行水化处理的方法将其处理, 尽量降低处理成本(片冈一成, 2014)。在水母应急处置设备方面, 除了传统的船舶捕捞的方法, 我国学者游奎正在研发一种专门针对水母类暴发的高效自动化吸捕装置(游奎等, 2013), 这种装置设计的理念是在水下快速高效地将聚集在一起的高密度的水母切丝, 然后抽吸到船上进行处理的方法, 这种装置目前已经在岸基平台实验成功, 如果在海上实验成功将是应急处置技术的一大贡献。另外, Kim等研发了智能机器人对表层水母进行自动清除(Kim et al, 2016)。
 |
| 图 3 用气泡法将水母浮起来(引自加拿大广播电视台) Fig. 3 Floating jellyfish by making bubbles (from Canada broadcast) |
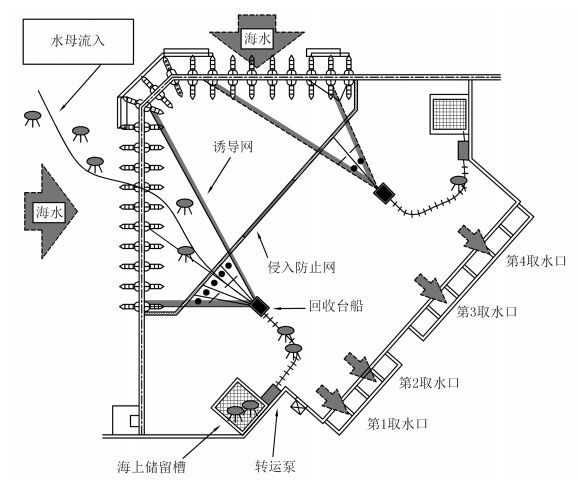 |
| 图 4 日本某发电厂水母海上处理系统示意图(引自片冈一成, 2014, 重新画图) Fig. 4 Schematic of on-the-sea jellyfish removal facilities at the intake of a power plant in Japan |
另外, 除了物理方法对水母进行有效防控, 国际国内尚在研究和探讨化学的方法, 例如生物提取物防污涂层抑制水螅体附着以及探讨用微生物菌株的方法防止水螅体附着, 探讨用生物学的方法, 提高天敌生物的数量来控制水螅体的数量, 或者探讨资源化利用的可能性, 但是目前仍在研究和探索当中, 实际应用的实例并未见报道。在我国国家海洋局立项的海洋公益性项目“典型海域水母灾害监测预警技术业务化应用与示范研究”(2010—2014)中水母的监测预警方面有一些进展。例如, 柳岩等(2017)提出了几种简单的大型水母灾害处置方法, 包括用“海鞘清”杀灭水母体, 网具拦截及用搅碎装置对水母进行搅碎, 但仍处于理论概念设计阶段, 清除效率及真正的海试并未见报道。
4 总结与展望我国水母灾害研究起步于本世纪初, 随着水母973项目、国家自然科学基金、国家公益性项目以及其他企业部门有关水母研究项目的实施, 在主要致灾水母时空分布、生活史策略、环境调控、数值模拟、灾害暴发机制及生态效应等研究方面取得显著进展, 紧跟国际前沿, 部分处于领跑地位。虽然国际上水母灾害的监测预测及防控技术有一些进展, 但是因为我国在水母预警、防控和应急技术方面尚处于起步阶段, 尚缺少我们适用的有效的监测预警技术手段, 应急处置主要依赖于网具物理隔离, 尚无针对工业设施取水区等重要水域灾害应对技术体系, 目前还不能满足防灾减灾的需求。因此, 在我国进一步系统揭示我国近海水母灾害暴发机制和演变趋势, 研发灾害监测预警和评估防控技术, 形成系统化、标准化、业务化的水母灾害防控应对技术体系是提高灾害防控能力、保障海洋环境安全的必然需求。
展望未来, 在我国十三五规划贯彻落实海洋强国战略部署的前提下, 随着新一批国家重点研发计划及企业部门项目的实施, 结合国家海洋环境安全保障平台的建立, 在多种生态灾害包括水母灾害的监测、预测和防控方面, 有望研发一些适用于我国特定海域中新技术革新的水母监测防控技术, 例如应用于水母体的声光电原理的综合在线监测技术、针对水母早期幼体的环境DNA监测技术, 可望结合适应于特殊海域的预警预测模型, 在确立水母灾害风险等级划分标准和评估方法的前提下, 建立物理、生物生态原理的防控方案, 高效自动的应急处置方法为一体的综合防控体系, 并将其集成到综合信息管理平台为国家决策服务, 将是未来对水母灾害有效监测和防控的必然趋势。
| 王建艳, 甄毓, 王国善, 等, 2013. 基于mt-16S rDNA和mt-COI基因的海月水母分子生物学鉴定方法和检测技术. 应用生态学报, 24(3): 847–852 |
| 孙松, 2012. 水母暴发研究所面临的挑战. 地球科学进展, 27(3): 257–261 |
| 孙松, 于志刚, 李超伦, 等, 2012. 黄、东海水母暴发机理及其生态环境效应研究进展. 海洋与湖沼, 43(3): 401–405 DOI:10.11693/hyhz201203001001 |
| 孙松, 孙晓霞, 2014. 海洋生物功能群变动与生态系统演变. 地球科学进展, 29(7): 854–858 |
| 杨东方, 崔文林, 张洪亮, 等, 2014. 新技术在水母监测中的应用. 海洋开发与管理, 31(4): 38–41 |
| 吴玲娟, 高松, 白涛, 2016. 大型水母迁移规律和灾害监测预警技术研究进展. 生态学报, 36(10): 3103–3107 |
| 张芳, 孙松, 李超伦, 2009. 海洋水母类生态学研究进展. 自然科学进展, 19(2): 121–130 |
| 张海彦, 赵亮, 魏皓, 2012. 青岛外海夏季水母路径溯源研究. 海洋与湖沼, 43(3): 662–668 DOI:10.11693/hyhz201203038038 |
| 罗晓凡, 魏皓, 王玉衡, 2012. 黄、东海水母质点追踪影响因素分析. 海洋与湖沼, 43(3): 635–642 DOI:10.11693/hyhz201203034034 |
| 柳岩, 宋伦, 宋永刚, 等, 2017. 大型水母灾害应急处置技术研究. 河北渔业,(2): 6–10 |
| 游奎, 迟旭朋, 马彩华等, 2013. 一种专门针对水母类胶体状水生生物的高效自动化吸捕装置: 中国, 201310192373. 9. 2013-05-14 |
| 片冈一成, 2014. 火力核能发电技术协会编, 发电站海水设备的污损对策手册. 恒星社厚生阁出版社, 1-356 |
| Arai M N, 2001. Pelagic coelenterates and eutrophication:a review. Hydrobiologia, 69-87 |
| Attrill M J, Wright J, Edwards M, 2007. Climate-related increases in jellyfish frequency suggest a more gelatinous future for the North Sea. Limnology and Oceanography, 52(1): 480–485 DOI:10.4319/lo.2007.52.1.0480 |
| Barz K, Hirche H J, 2007. Abundance, distribution and prey composition of Scyphomedusae in the southern North Sea. Marine Biology, 151(3): 1021–1033 DOI:10.1007/s00227-006-0545-4 |
| Berline L, Zakardjian B, Molcard A, et al, 2013. Modeling jellyfish Pelagia noctiluca transport and stranding in the Ligurian Sea. Marine Pollution Bulletin, 70(1-2): 90–99 DOI:10.1016/j.marpolbul.2013.02.016 |
| Bi H S, Cook S, Yu H, et al, 2013. Deployment of an imaging system to investigate fine-scale spatial distribution of early life stages of the ctenophore Mnemiopsis leidyi in Chesapeake Bay. Journal of Plankton Research, 35(2): 270–280 DOI:10.1093/plankt/fbs094 |
| Brodeur R D, Mills C E, Overland J E, et al, 1999. Evidence for a substantial increase in gelatinous zooplankton in the Bering Sea, with possible links to climate change. Fish Oceanography, 8(4): 296–306 DOI:10.1046/j.1365-2419.1999.00115.x |
| Brodeur R D, Sugisaki H, Hunt Jr G L, 2002. Increases in jellyfish biomass in the Bering Sea:implications for the ecosystem. Marine Ecology Progress Series, 233: 89–103 DOI:10.3354/meps233089 |
| Condon R, Duarte C M, Pitt K A, et al, 2013. Recurrent jellyfish blooms are a consequence of global oscillations. Proceedings of the National Academy of Sciences of the United States of America, 110(3): 1000–1005 DOI:10.1073/pnas.1210920110 |
| Costello J H, Klos E, Ford M D, 1998. In situ time budgets of the Scyphomedusae Aurelia aurita, Cyanea sp. , and Chrysaora quinquecirrha. Journal of Plankton Research, 20(2): 383–391 DOI:10.1093/plankt/20.2.383 |
| Feng S, Zhang F, Sun S, et al, 2015. Effects of duration at low temperature on asexual reproduction in polyps of the scyphozoan Nemopilema nomurai (Scyphozoa:Rhizostomeae). Hydrobiologia, 754(1): 97–111 DOI:10.1007/s10750-015-2173-9 |
| Fossette S, Katija K, Goldbogen J A, et al, 2016. How to tag a jellyfish? A methodological review and guidelines to successful jellyfish tagging. Journal of Plankton Research, 38(6): 1347–1363 |
| Gershwin L, Condie S A, Mansbridge J V, et al, 2014. Dangerous jellyfish blooms are predictable. Journal of the Royal Society Interface, 11(96): 20131168 DOI:10.1098/rsif.2013.1168 |
| Graham W M, Gelcich S, Robinson K L, et al, 2014. Linking human well-being and jellyfish:ecosystem services, impacts, and societ al responses. Frontiers in Ecology and the Environment, 12(9): 515–523 DOI:10.1890/130298 |
| Graham W M, Martin D L, Felder D L, et al, 2003. Ecological and economic implications of a tropical jellyfish invader in the Gulf of Mexico. Biology Invasions, 5(1-2): 53–69 |
| Hamner W M, Hamner P P, Strand S W, 1994. Sun-compass migration by Aurelia aurita (Scyphozoa):population retention and reproduction in Saanich Inlet, British Columbia. Marine Biology, 119(3): 347–356 DOI:10.1007/BF00347531 |
| Hamner W M, Madin L P, Alldredge A L, et al, 1975. Underwater observations of gelatinous zooplankton:sampling problems, feeding biology, and behavior. Limnology and Oceanography, 20(6): 907–917 DOI:10.4319/lo.1975.20.6.0907 |
| Honda N, Watanabe T, Matsushita Y, 2009. Swimming depths of the giant jellyfish Nemopilema nomurai investigated using pop-up archival transmitting tags and ultrasonic pingers. Fisheries Science, 75(4): 947–956 DOI:10.1007/s12562-009-0114-0 |
| Kasuya T, Ishimaru T, Murano M, 2001. In situ measurement of the lobate ctenophore Bolinopsis Mikado (Moser) abundance by the video recording system. Journal of Oceanography, 57(1): 115–118 DOI:10.1023/A:1011104400114 |
| Kim H, Koo J, Kim D, et al, 2016. Image-based monitoring of jellyfish using deep learning architecture. IEEE Sensors Journal, 16(8): 2215–2216 DOI:10.1109/JSEN.2016.2517823 |
| Lee K, Bae B S, Kim I O, et al, 2010. Measurement of swimming speed of giant jellyfish Nemopilema nomurai using acoustics and visualization analysis. Fisheries Science, 76(6): 893–899 DOI:10.1007/s12562-010-0294-7 |
| Liu Z Y, Dong Z J, Liu D Y, 2016. Development of a rapid assay to detect the jellyfish Cyanea nozakii using a loop-mediated isothermal amplification method. Mitochondrial DNA Part A, 27(4): 2318–2322 |
| Lynam C P, Hay S J, Brierley A S, 2005. Jellyfish abundance and climatic variation:contrasting responses in oceanographically distinct regions of the North Sea, and possible implications for fisheries. Journal of Marine Biological Association of the United Kingdom, 85(3): 435–450 DOI:10.1017/S0025315405011380 |
| Moon J H, Pang I C, Yang J Y, et al, 2010. Behavior of the giant jellyfish Nemopilema nomurai in the East China Sea and East/Japan Sea during the summer of 2005:a numerical model approach using a particle-tracking experiment. Journal of Marine Systems, 80(1-2): 101–114 DOI:10.1016/j.jmarsys.2009.10.015 |
| Omori M, Hamner W M, 1982. Patchy distribution of zooplankton:behavior, population assessment and sampling problems. Marine Biology, 72(2): 193–200 DOI:10.1007/BF00396920 |
| Pitt K A, Lucas C H, 2014. Jellyfish Blooms. Netherlands: Springer, 1-308 |
| Purcell J E, Brown E D, Stokesbury K D E, et al, 2000. Aggregations of the jellyfish Aurelia labiata:abundance, distribution, association with age-0 walleye pollock, and behaviors promoting aggregation in Prince William Sound, Alaska, USA. Marine Ecology Progress Series, 195: 145–158 DOI:10.3354/meps195145 |
| Purcell J E, Decker M B, 2005. Effects of climate on relative predation by scyphomedusae and ctenophores on copepods in Chesapeake Bay during 1987-2000. Limnology and Oceanography, 50(1): 376–387 DOI:10.4319/lo.2005.50.1.0376 |
| Purcell J E, Uye S I, Lo W T, 2007. Anthropogenic causes of jellyfish blooms and their direct consequences for humans:a review. Marine Ecology Progress Series, 350: 153–174 DOI:10.3354/meps07093 |
| Raskoff K A, 2001. The impact of El Niño events on populations of mesopelagic hydromedusae. Hydrobiologia, 451(1-3): 121–129 |
| Silguero J M B, Robison B H, 2000. Seasonal abundance and vertical distribution of mesopelagic calycophoran siphonophores in Monterey Bay, CA. Journal of Plankton Research, 22(6): 1139–1153 DOI:10.1093/plankt/22.6.1139 |
| Suchman C L, Brodeur R D, 2005. Abundance and distribution of large medusae in surface waters of the northern California Current. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 52(1-2): 51–72 DOI:10.1016/j.dsr2.2004.09.017 |
| Sun S, Sun X X, Jenkinson I R, 2015a. Special issue on giant jellyfish blooms and climate change. Hydrobiologia, 754: 1–214 DOI:10.1007/s10750-015-2320-3 |
| Sun S, Zhang F, Li C L, et al, 2015b. Breeding places, population dynamics, and distribution of the giant jellyfish Nemopilema nomurai (Scyphozoa:Rhizostomeae) in the Yellow Sea and the East China Sea. Hydrobiologia, 754(1): 59–74 DOI:10.1007/s10750-015-2266-5 |
| Zhang F, Sun S, Jin X S, et al, 2012. Associations of large jellyfish distributions with temperature and salinity in the Yellow Sea and East China Sea. Hydrobiologia, 690(1): 81–96 DOI:10.1007/s10750-012-1057-5 |
 2017, Vol. 48
2017, Vol. 48


