中国海洋湖沼学会主办。
文章信息
- 牛春格, 杨程, 申屠琰, 郑晓静, 王志铮. 2019.
- NIU Chun-Ge, YANG Cheng, SHEN Tu-Yan, ZHENG Xiao-Jing, WANG Zhi-Zheng. 2019.
- 氨氮急性攻毒对水产经济动物棘胸蛙(Paa spinosa)蝌蚪死亡率、排氨率、耗氧率及窒息点的影响
- ACUTE EFFECT OF AMMONIA TOXICITY ATTACK ON MORTALITY, AMMONIA EXCRETION RATE, OXYGEN CONSUMPTION AND SUFFOCATION POINT ON PAA SPINOSA TADPOLES IN AQUATIC ECONOMY
- 海洋与湖沼, 50(1): 188-196
- Oceanologia et Limnologia Sinica, 50(1): 188-196.
- http://dx.doi.org/10.11693/hyhz20180500109
-
文章历史
- 收稿日期:2018-05-08
- 收修改稿日期:2018-06-11
2. 宁波市海洋与渔业研究院 宁波 315000;
3. 余姚市水产技术推广中心 余姚 315040
2. Ningbo Marine and Fisheries Research Institute, Ningbo 315000, China;
3. Yuyao Aquatic Technology extension Center, Yuyao 315040, China
棘胸蛙(Paa spinosa)系广泛分布于我国南方丘陵山区的特有大型名贵食用蛙, 属对生存环境相对湿度要求很高的山溪型蛙种, 尤以变态初期的幼蛙为甚。受此限制, 目前棘胸蛙养殖场均建于溪流长年较为充沛的山区, 以模拟栖息地自然条件开展人工流水养殖。由此, 破解棘胸蛙平原集约化养殖技术壁垒, 以打破区域限制, 扩大养殖规模, 增进养殖产能与效益, 切实满足棘胸蛙平民化消费的需求, 已成为促进该蛙人工养殖转型升级和提质增效的重要途径。针对棘胸蛙蝌蚪生长周期长, 养殖密度高, 变态能耗大, 以及饲喂后淀粉类残饵极易在水中腐败变质的实际, 探究该蛙蝌蚪人工养殖所需的适宜生态环境条件, 进而构建相应的养殖水质保障技术体系, 已成为当前实施该蛙蝌蚪平原集约化养殖面临的重要产业命题之一。氨氮既是评价水体富营养化程度的重要理化指标, 也是水产养殖生产过程中必检的水质指标(中华人民共和国农业部, 2001)。因此, 探析该蛙蝌蚪对氨氮的耐受性能, 以及氨氮对该蛙蝌蚪的毒害过程与机制, 无疑对于指导该蛙蝌蚪集约化安全养殖具有重要应用价值和现实意义。但目前国内外有关该蛙蝌蚪对水质理化因子的耐受与响应特征研究, 仅涉及水温对其表型特征(陈雯等, 2010)、生长发育与变态(章海鑫等, 2014; 赵蒙蒙等, 2014; 陶志英等, 2015)以及生理生态(杨程等, 2016; 朱卫东等, 2016; 黄贞胜, 2016)等的影响, 而有关氨氮对该蛙蝌蚪急性致毒效应的研究则迄今尚未见报道。鉴于此, 本文作者参考王志铮等(2013)和邹李昶等(2015)的研究方法, 以氨氮对该蛙蝌蚪的急性毒性研究为基础, 通过进一步探析氨氮对其机体能量代谢的影响特征, 较精确地定义了其氨氮安全质量浓度范围, 以期为该蛙蝌蚪的科学养殖和环境污染事故的侦查与评估提供科学依据。
1 材料与方法 1.1 材料 1.1.1 实验用水试验水源为经48h自然曝气的自来水, 水温(24±0.2)℃、DO (7.30±0.01)mg/L、pH 7.30±0.01, 水质完全符合《NY 5051-2001无公害食品淡水养殖用水水质》(中华人民共和国农业部, 2001)要求。实验时, 用NH4Cl (AR级, 国药集团化学试剂有限公司出品)配置相应氨氮质量浓度的试验用水, 现配现用。
1.1.2 供试蝌蚪系购自浙江省余姚市陆埠镇石门村下鲁石蛙养殖场的同生群个体。运至浙江海洋大学水产安全养殖实验室后, 即刻停食暂养于若干规格为80cm×50cm×42cm的白色塑料箱(实际容积75L)内, 暂养期间及时捞除死亡个体, 日换水1次, 换水率为100%。经为期2d暂养, 彻底排空体内粪便后, 选取其中肢体完整、体色相近、反应灵敏、游动活泼的健康个体作为供试对象, 具体规格为体长(1.932± 0.204)cm、体质量(1.386±0.055)g。
1.2 实验方法 1.2.1 氨氮对蝌蚪的急性攻毒实验经预实验, 获取氨氮质量浓度实验范围后, 按等差间距依次设置100、120、140、160、180、200、220、240mg/L等8个实验梯度, 以白色平底塑料园盆为实验容器单元(直径32cm, 实验实际容积为4L), 于静水停食条件下开展氨氮对蝌蚪的急性攻毒实验, 每个实验梯度均设3个重复, 每个实验容器单元内各放供试蝌蚪12ind.。实验期间, 以蝌蚪沉入实验容器底部, 并用玻璃棒反复触碰无任何反应作为死亡评判标准, 连续观察供试蝌蚪活动情况, 及时捞除并解剖死亡个体, 每24h更换1次实验液(换液率为100%)并统计累计死亡率。
1.2.2 氨氮急性攻毒对蝌蚪排氨率、耗氧率和窒息点的影响实验根据上述氨氮对蝌蚪急性攻毒实验所得结果, 应用SC=0.1×96h LC50 (Sprague, 1971)获取氨氮安全质量浓度估算值14.7mg/L后, 按等差间距依次设置0(对照组)、2.45、4.90、7.35、9.80、12.25、14.70、17.15、19.60mg/L等9个实验梯度, 以液体石蜡(AR级, 国药集团化学试剂有限公司出品)作为呼吸室绝氧材料, 在绝氧层厚度均为1cm, 实验起始时刻均为凌晨2:00条件下开展氨氮急性攻毒对蝌蚪排氨率、耗氧率和窒息点的影响实验, 供试蝌蚪均于对应氨氮质量浓度的呼吸室内适应2h后开始实验。实验期间, 水样溶解氧和氨氮质量浓度测定方法完全同朱卫东等(2016)。
排氨率和耗氧率测定, 均以刻度为1000mL的锥形瓶为呼吸室(实验实际容积800mL), 每一实验梯度均设3个重复, 每个重复各放蝌蚪10ind., 以24h为实验周期, 每隔4h用移液管自呼吸室底部吸取15mL水样, 并测定其溶解氧和氨氮质量浓度。实验结束时刻, 用定性滤纸吸净供试蝌蚪体表水分后, 用FA1004型电子天平(上海舜宇横平科学仪器有限公司生产, 精度为0.1mg)逐一称量各呼吸室内供试蝌蚪的总质量, 并计算蝌蚪的排氨率(NR)、耗氧率(OR)和氧氮比(O:N)。
窒息点测定, 以刻度为250mL的锥形瓶(实验实际容积100mL)为呼吸室, 每一实验梯度均设3个重复, 每个重复各放入供试蝌蚪6ind., 窒息点的定义为供试蝌蚪死亡50%时呼吸室水中的溶解氧含量。
1.3 数据处理根据氨氮对蝌蚪急性攻毒实验所获数据, 借助SPSS17.0软件建立不同观察时段累计死亡概率单位(y)与氨氮质量浓度(x)间的直线回归方程, 并在分别计算蝌蚪24h、48h、72h、96h LC50值的基础上, 采用药物毒性蓄积程度系数MAC(王志铮等, 2007)来分析实验蝌蚪对氨氮的蓄积与降减动态。昼夜间蝌蚪排氨率、耗氧率的统计时段分别为6:00—18:00和18:00至翌日6:00, 排氨率、耗氧率、氧氮比和窒息点组间差异的显著性检验均采用LSD多重比较法(P < 0.05为显著水平, P < 0.01为极显著水平)。
2 结果 2.1 中毒症状观察发现, 实验初期供试蝌蚪游动速率有随氨氮攻毒质量浓度增加而显著提高的迹象, 表现出较为明显的运动避毒行为特征。随攻毒实验的延续, 供试蝌蚪的运动避毒行为能力亦有随氨氮攻毒质量浓度的提高而呈明显下降的趋势。随中毒程度提高, 供试蝌蚪运动能力逐渐丧失, 背部体表肤色也渐由正常状态的黑灰色转为灰白色, 尤以尾部皮肤变化最为明显, 并陆续沉入实验容器底部直至表露死亡。解剖濒死蝌蚪, 可明显见其肝脏由正常状态的暗红色转为中毒后的乳黄色。综上可知, 氨氮中毒可引起供试蝌蚪运动能力的丧失, 以及背部体表皮肤和肝脏的色变。
2.2 死亡率由图 1可见, 虽供试蝌蚪的累计死亡率均随氨氮质量浓度增加和攻毒时间延长而提高, 但其致死率陡度总体上却均有随氨氮质量浓度增加和攻毒时间延长而呈逐渐下降的趋势, 主要表现为同一氨氮质量浓度实验组内, 以及不同氨氮质量浓度实验组间攻毒0—48h时段内的蝌蚪死亡率陡度均明显大于48—96h时段, 表明48h为本研究所设氨氮实验质量浓度范围内, 蝌蚪累计致死率陡度明显下降的分水岭。
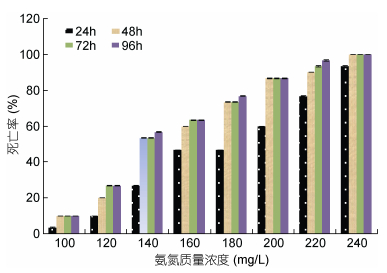 |
| 图 1 氨氮急性攻毒下棘胸蛙蝌蚪的死亡率 Fig. 1 The mortality of P. spinosa tadpoles under acute toxicity attack of ammonia |
整理图 1所示数据得表 1。由表 1可见, 氨氮对蝌蚪的急性毒性具明显的剂量-时间效应, 其24h、48h、72h、96h的LC50分别为177.5、151.7、148.6和146.8mg/L; 采用SC=0.1×96h LC50 (Sprague, 1971)估算其氨氮安全质量浓度, 估值为14.7mg/L; 经计算, 其24—48h、48—72h、72—96h时段的毒物蓄积程度系数(MAC)依次为84.04%、10.1%和5.86%, 均为正值, 表明实验期间供试蝌蚪虽一直处于以毒效蓄积为主导的氨氮急性攻毒状态, 但其死亡高峰却出现于氨氮攻毒48h内。
| 时间(h) | 死亡概率单位-质量浓度回归方程 | R2 | df | F | Sig | LC50值及95%置信区间(mg/L) | MAC(%) |
| 24 | y=0.0211x+1.2556 | 0.9671 | 7 | 176.24 | 0.000 | 177.5(175.5—179.5) | — |
| 48 | y=0.0219x+1.6772 | 0.9739 | 7 | 223.96 | 0.000 | 151.7 (149.7—153.7) | 84.04 |
| 72 | y=0.0219x+1.7458 | 0.9832 | 7 | 352.11 | 0.000 | 148.6(146.6—150.6) | 10.1 |
| 96 | y=0.0225x+1.6977 | 0.9785 | 7 | 273.16 | 0.000 | 146.8(144.7—148.9) | 5.86 |
由图 2可见, 氨氮急性胁迫下蝌蚪的时段及昼夜排氨率变动特征主要表现为: (1)蝌蚪昼均、夜均、日均及各时段排氨率均有随氨氮质量浓度增加呈阶梯式稳步下降的趋势, 其中时段排氨率与对照组均无显著差异(P > 0.05)的氨氮质量浓度上限为9.80mg/L, 而与对照组昼均、夜均和日均排氨率均无显著差异的则仅为氨氮质量浓度2.45mg/L实验组(P > 0.05); (2)各实验组的排氨率均呈夜均 > 日均 > 昼均(P < 0.05), 且时段排氨率均以22:00—翌日2:00为最大(P < 0.05), 2:00—6:00和14:00—18:00时段为最小(P < 0.05)。综上可知, 尽管本研究所涉各实验组的排氨时段节律和昼夜节律均未因氨氮急性胁迫而发生根本性改变, 但蝌蚪表露正常排氨的氨氮质量浓度临界范围则仅为2.45—9.80mg/L, 表明氨氮对蝌蚪排氨率具较明显的剂量抑制效应。
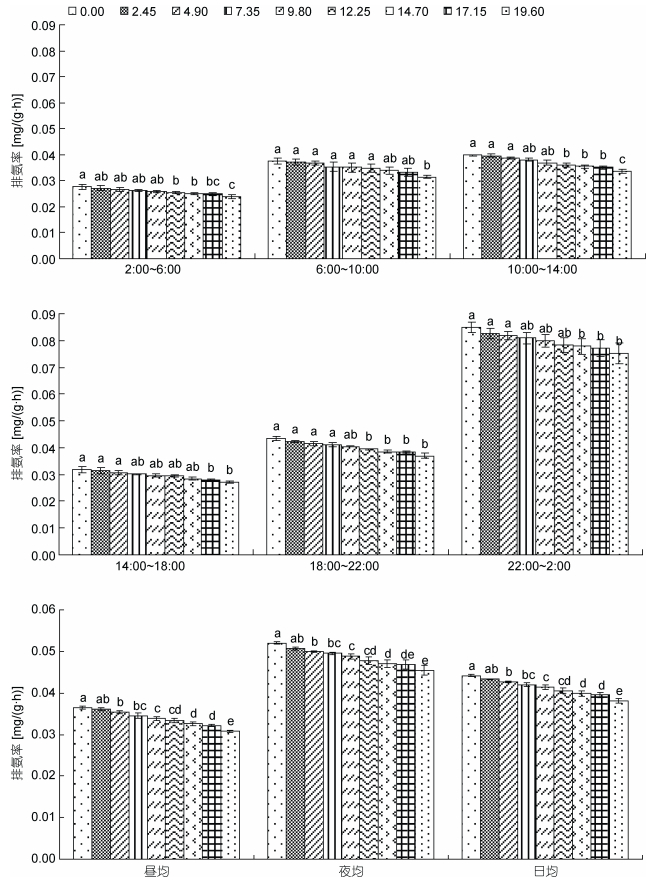 |
| 图 2 氨氮急性攻毒对棘胸蛙蝌蚪昼夜排氨节律的影响特征 Fig. 2 The feature of acute effects of ammonia toxicity attack on the circadian rhythm of day and night ammonia excretion of P. spinosa tadpoles |
由图 3可见, 氨氮急性胁迫下蝌蚪的时段及昼夜耗氧率变动特征主要表现为: (1)随氨氮质量浓度增加, 蝌蚪昼均、夜均、日均及除14:00—18:00以外的各时段耗氧率均呈“上升—稳定—下降”的变动特征, 且其峰值氨氮质量浓度范围均为4.90—7.35mg/L, 与对照组昼均、夜均和日均耗氧率无显著差异的仅为14.70mg/L实验组(P > 0.05), 且该实验组除6:00—10:00以外的各时段耗氧率也均与对照组无显著差异(P > 0.05); (2)各实验组耗氧率均呈夜均 > 日均 > 昼均(P < 0.05), 且其时段耗氧率均以22:00—翌日2:00为最大(P < 0.05), 2:00—6:00为最小(P < 0.05)。综上可知, 尽管本研究所涉各实验组的耗氧时段节律和昼夜节律均未因氨氮急性胁迫而发生根本性改变, 但蝌蚪表露正常耗氧率的临界氨氮质量浓度为14.70mg/L, 且氨氮质量浓度2.45—12.25mg/L范围内昼均、夜均和日均耗氧率均显著大于对照组(P > 0.05)的结果(图 3), 表明氨氮对蝌蚪耗氧率具较为明显的低毒兴奋效应。
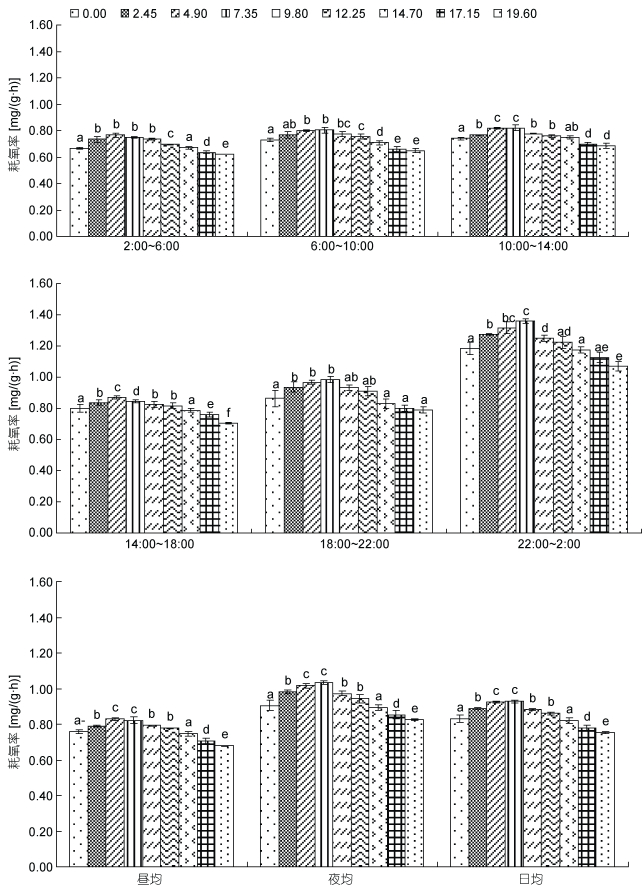 |
| 图 3 氨氮急性攻毒对棘胸蛙蝌蚪昼夜耗氧节律的影响特征 Fig. 3 The feature of acute effects of ammonia toxicity attack on the circadian rhythm of day and night oxygen consumption of P. spinosa tadpoles |
由图 4可见, 供试蝌蚪窒息点含氧量随氨氮质量浓度增加呈明显的先降后升趋势, 并分别于氨氮质量浓度4.90mg/L时达到谷低(P < 0.05), 9.80mg/L时与对照组持平(P > 0.05), 氨氮质量浓度12.25、14.70、17.15和19.60mg/L实验组的窒息点含氧量分别为对照组的1.17、1.35、1.53和1.64倍, 且均显著大于对照组(P < 0.05), 表明蝌蚪耐低氧能力以氨氮质量浓度4.90mg/L实验组为最强, 表露正常耐低氧能力的临界氨氮质量浓度为9.80mg/L, 即氨氮对蝌蚪耐低氧能力具明显的低毒兴奋效应。
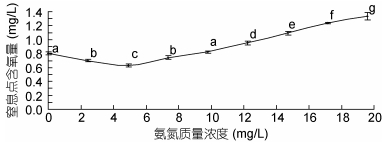 |
| 图 4 氨氮急性攻毒对棘胸蛙蝌蚪窒息点的影响 Fig. 4 The acute effects of ammonia toxicity attack on suffocation point of P. spinosa tadpoles |
计算图 2和图 3所得结果得图 5。由图 5可见, 实验期间供试蝌蚪的氧氮比(O:N)波动范围为18.87—25.34, 其变动特征主要表现为: (1)蝌蚪昼均、夜均及日均氧氮比(O:N)均以对照组为最低(P < 0.05); (2)蝌蚪昼均和日均氧氮比(O:N)随氨氮质量浓度增加均呈“上升—稳定—下降—再稳定”之趋势, 峰值氨氮质量浓度范围分别为4.90—14.70mg/L和4.90—9.80mg/L, 夜均氧氮比(O:N)呈先升后降趋势, 峰值氨氮质量浓度为7.35mg/L (P < 0.05); (3)除7.35mg/L实验组氧氮比(O:N)无昼夜差异(P > 0.05)外, 其余实验组均呈夜均 > 昼均(P < 0.05), 其中日均与夜均、昼均氧氮比(O:N)均具显著差异的仅为4.90、17.15和19.60mg/L实验组。
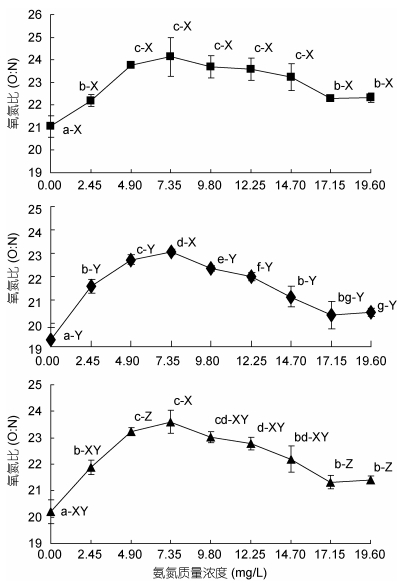 |
| 图 5 氨氮急性攻毒对棘胸蛙氧氮比昼夜节律的影响 Fig. 5 The acute effects of ammonia toxicity attack on circadian rhythm of day and night oxygen to nitrogen ratio of P. spinosa tadpoles 注: ■昼均(6:00—18:00), ◆夜均(18:00—翌日6:00), ▲日均 |
氨氮是两栖类蝌蚪和大多数鱼类的氨基酸代谢产物。因此, 两栖类蝌蚪和大多数鱼类可通过显著降低体内氨基酸代谢水平, 以有效规避源自体内外的氨毒影响。据报道, 当水环境氨氮处于较高水平时, 鱼类为应对氨毒侵害, 往往会采取降低自身产氨量, 以保持机体内稳态机制的耐氨策略(Lim et al, 2001; Ip et al, 2004a, b)。氧氮比(O:N)作为反映机体代谢底物利用状况的重要生理指标(Ikeda, 1974; Mayzaud, 1976; Buttle et al, 1996), 无疑可帮助我们通过分析目标动物受氨氮攻毒下蛋白质水解和氨基酸代谢水平的变化特征, 进而揭示其是否具有上述耐氨策略的可能性。按Mayzaud等(1988)根据O:N值确定代谢底物种类组成和比例划分的标准, 本研究所涉各实验组的昼均、夜均和日均O:N值均介于16—50之间, 且对照组昼均、夜均和日均氧氮比(O:N)均显著低于其它实验组的结果(图 5), 既表明氨氮攻毒并未能改变棘胸蛙蝌蚪代谢底物以蛋白质为主的特征, 也揭示了棘胸蛙蝌蚪在氨氮攻毒下确实存在通过增强脂肪动员, 抑制蛋白质水解和氨基酸代谢水平, 主动减少体内产氨量, 以有效稀释血氨浓度, 尽可能规避氨毒影响的耐氨策略。与此同时, 本研究中棘胸蛙蝌蚪排氨率随氨氮攻毒质量浓度上升呈阶梯式下降的结果(图 2), 与泥鳅、黄鳝受氨氮胁迫下体组织中氨蓄积量明显高于氨排泄量的情形(Chew et al, 2001, 2005; Tsui et al, 2002; Tay et al, 2003)类似, 均印证了张云龙等(2017)认为上述耐氨策略仅当体内氨氮的蓄积速率明显大于排泄速率时才会启动的观点。当然, 本研究中棘胸蛙蝌蚪表露正常排氨和耗氧的临界氨氮质量浓度均为14.70mg/L (图 2, 图 3), 以及昼均、夜均和日均O:N值随氨氮攻毒质量浓度增加均呈先升后降(图 5)的结果, 则进一步表明上述耐氨策略具较为明显的局限性, 即过高的氨氮攻毒质量浓度将明显影响上述耐氨策略的实施效率。蝌蚪变态发育需要充足的能量储备, 故氨氮亚慢性胁迫下虎纹蛙蝌蚪变态发育时长随氨氮攻毒质量浓度升高而显著延长的现象(黄艳, 2015), 无疑较直观地注释了这种以增加脂肪消耗为代价的耐氨策略, 必将会影响进而干扰蝌蚪正常发育进程的事实。另, MAC值所示棘胸蛙蝌蚪氨氮蓄积高峰时段为24—48h(表 1)的结果, 也指示我们在棘胸蛙蝌蚪养殖过程中应密切关注水体中氨氮质量浓度的变化。
肝脏作为脊椎动物的能量代谢中枢、解毒中心和氧气消耗的主要器官(Otto et al, 1996), 代谢底物中脂肪含量占比的增加, 势必导致肝脏需氧量的明显上升。研究表明, 皮肤是无尾类蝌蚪的主要供氧器官, 其供氧贡献率约占机体总耗氧量的60%(Burggren et al, 1982); 蝌蚪受低氧胁迫时, 往往会呈现皮肤变薄、毛细血管增多, 并产生水—血屏障的变化特征(Burggren et al, 1983; Jia et al, 1997)。故, 本研究中棘胸蛙蝌蚪耗氧率和窒息点含氧量随氨氮攻毒质量浓度增加分别呈先升后降和先降后升趋势的结果(图 3, 图 4), 既表明低质量浓度的氨氮可借助上述耐氨策略, 通过扩张皮肤毛细血管网, 大幅提升皮肤供氧效率, 显著提高供试蝌蚪的耐低氧能力和肝脏的脂肪氧化代谢水平, 表现出较为明显的低毒兴奋效应, 也揭示了高质量浓度的氨氮会导致蝌蚪陷入皮肤供氧效率与肝脏脂肪氧化代谢水平同步下降的“由表及里”和“表里互通”的恶性循环之中, 从而使上述耐氨策略的实施效果大打折扣。无疑, 本研究急性攻毒实验观察所示的蝌蚪背部皮肤和肝脏色变中毒症状, 系皮肤供氧能力和肝脏解毒作用不堪承受上述恶性循环导致的结果。据此, 可推定蝌蚪皮肤和肝脏为氨氮攻毒的主要靶器官。
3.2 关于棘胸蛙蝌蚪耐氨能力及其安全质量浓度的探讨96h LC50是评价水生动物耐毒能力强弱的重要指标。据报道, 以泥鳅、大鳞副泥鳅、黄鳝为代表的气呼吸型鱼类较其他鱼类往往具更强的耐氨毒能力(Ip et al, 2004b; 郝小凤等, 2012; 张云龙等, 2017)。棘胸蛙蝌蚪和虎斑蛙蝌蚪均以皮肤呼吸为主导, 两者的氨氮96h LC50值分别为146.8mg/L (表 1)和151.15mg/L (黄艳, 2015), 均与泥鳅的氨氮96h LC50值164.41mg/L (郝小凤等, 2012)相近, 表明供氧方式的多元化更有助于气呼吸型水生动物在氨氮急性胁迫下通过及时调整代谢底物组成比例, 降低氨基酸代谢水平, 从而达到有效提升耐氨能力的目的。这就为我们从棘胸蛙蝌蚪耗氧率和窒息点的变化特征来精准评价其氨氮安全质量浓度提供了有力的证据支持。
由图 3、图 4所示, 棘胸蛙蝌蚪对氨氮的低毒兴奋效应, 及其耗氧率和窒息点的氨氮质量浓度安全临界上限分别为14.70mg/L和9.80mg/L的结果, 表明棘胸蛙蝌蚪的耐低氧能力较肝脏脂肪氧化代谢水平在表征耐氨毒敏感性上具更为重要的生理生态重要性, 即棘胸蛙蝌蚪窒息点低毒兴奋效应的终止, 将预示着其皮肤供氧效率因不堪肝脏脂肪氧化代谢需氧量的进一步增大而出现逆转。邹李昶等(2015)等认为, 因96h LC50值具相应的置信区间, 故借助SC=0.1× 96h LC50 (Sprague, 1971)估算所得的SC值也应具上、下限。鉴于氨氮急性攻毒实验所得的棘胸蛙蝌蚪安全质量浓度估算值, 与氨氮急性胁迫下棘胸蛙蝌蚪的耗氧率安全临界上限均为14.70mg/L的结果(表 1, 图 3), 本研究将氨氮质量浓度14.70mg/L设为棘胸蛙蝌蚪耐受氨氮急性胁迫的安全质量浓度上限, 而将氨氮急性胁迫下棘胸蛙蝌蚪窒息点的安全临界上限9.80mg/L, 定义为棘胸蛙蝌蚪耐受氨氮急性胁迫的安全质量浓度下限。
4 结论棘胸蛙蝌蚪皮肤和肝脏是氨氮攻毒的主要靶器官。氨氮对棘胸蛙蝌蚪的急性毒性作用具明显的剂量-时间效应, 其毒性时段蓄积程度系数MAC值以24—48h时段为最大。
棘胸蛙蝌蚪对氨氮急性攻毒具较为明显运动避毒特征。氨氮对棘胸蛙蝌蚪的排氨率具较明显的剂量抑制效应, 对耗氧率和窒息点则均具较为明显的低毒兴奋效应。
受氨氮急性攻毒, 棘胸蛙蝌蚪具有通过增强脂肪动员, 抑制蛋白质水解和氨基酸代谢水平, 主动减少体内产氨量, 以尽可能规避氨毒影响的耐氨策略。
在水温(24±0.2)℃、DO(7.30±0.01)mg/L、pH 7.30± 0.01条件下, 棘胸蛙蝌蚪[体长(1.932±0.204)cm, 体质量(1.386±0.055)g]的氨氮96h LC50值为146.8mg/L, 其表露正常排氨和耗氧的临界氨氮质量浓度均为14.70mg/L, 表露正常耐低氧能力的临界氨氮质量浓度为9.80mg/L。经分析, 认定其氨氮安全质量浓度范围为9.80—14.70mg/L。
| 中华人民共和国农业部, 2001. NY 5051-2001无公害食品淡水养殖用水水质. 北京: 中国农业出版社, 1-5 |
| 王志铮, 申屠琰, 熊威, 2007. 4种消毒剂对麦瑞加拉鲮鱼幼鱼的急性毒性研究. 海洋水产研究, 28(3): 92–97 |
| 王志铮, 任夙艺, 赵晶, 等, 2013. Zn2+对日本沼虾(Macrobrachium nipponensis)的急性致毒效应. 海洋与湖沼, 44(1): 235–240 |
| 朱卫东, 任夙艺, 申屠琰, 等, 2016. 水温对棘胸蛙(Paa spinosa)蝌蚪行为及尾部皮肤和肝脏相关功能酶活力的影响. 海洋与湖沼, 47(1): 245–252 |
| 张云龙, 张海龙, 王凌宇, 等, 2017. 氨氮对鱼类毒性的影响因子及气呼吸型鱼类耐氨策略. 水生生物学报, 41(5): 1157–1168 |
| 杨程, 刘哲宇, 朱卫东, 等, 2016. 水温对水产经济动物棘胸蛙(Paa spinosa)蝌蚪耗氧率、窒息点和排氨率的影响. 海洋与湖沼, 47(6): 1233–1240 |
| 邹李昶, 任夙艺, 王志铮, 等, 2015. 氨氮急性胁迫对日本沼虾(Macrobrachium nipponensis)死亡率、耗氧率及窒息点的影响. 海洋与湖沼, 46(1): 206–211 |
| 陈雯, 俞宝根, 郑荣泉, 等, 2010. 温度对棘胸蛙胚胎发育及蝌蚪表型特征的影响. 贵州农业科学, 38(1): 108–110 DOI:10.3969/j.issn.1001-3601.2010.01.033 |
| 赵蒙蒙, 郑荣泉, 宋婷婷, 等, 2014. 饲料营养水平和温度对棘胸蛙蝌蚪变态发育的影响. 广东农业科学, 41(20): 119–122 DOI:10.3969/j.issn.1004-874X.2014.20.026 |
| 郝小凤, 刘洋, 凌去非, 2012. 氨氮对泥鳅的急性毒性及对其肝、鳃组织超微结构的影响. 水生态学杂志, 33(5): 101–107 |
| 陶志英, 马保新, 余智杰, 等, 2015. 环境因子对棘胸蛙蝌蚪生长发育的影响. 湖南农业科学,(2): 55–56, 59 |
| 章海鑫, 余智杰, 马保新, 等, 2014. 不同饲养环境因子水平对棘胸蛙蝌蚪变态的影响. 贵州农业科学, 42(12): 180–182 DOI:10.3969/j.issn.1001-3601.2014.12.043 |
| 黄艳, 2015.氨氮胁迫对虎纹蛙蝌蚪及成体的毒性研究.金华: 浙江师范大学硕士学位论文, 12-24 |
| 黄贞胜, 2016. 高温胁迫对棘胸蛙蝌蚪抗氧化酶活力的影响. 渔业研究, 38(6): 445–452 |
| Burggren W, Mwalukoma A, 1983. Respiration during chronic hypoxia and hyperoxia in larval and adult bullfrogs (Rana catesbeiana) I. Morphological responses of lungs, skin and gills. Journal of Experimental Biology, 105(l): 191–203 |
| Burggren W W, West N H, 1982. Changing respiratory importance of gills, lungs and skin during metamorphosis in the bullfrog rana catesbeiana. Respiratory Physiology, 47(2): 151–164 DOI:10.1016/0034-5687(82)90108-6 |
| Buttle L G, Uglow R F, Cowx I G, 1996. The effect of emersion and handling on the nitrogen excretion rates of Clarias gariepinus. Journal of Fish Biology, 49(4): 693–701 |
| Chew S F, Gan J, Ip Y K, 2005. Nitrogen metabolism and excretion in the swamp eel, Monopterus albus, during 6 or 40 days of estivation in mud. Physiological and Biochemical Zoology, 78(4): 620–629 DOI:10.1086/430233 |
| Chew S F, Jin Y, Ip Y K, 2001. The loach Misgurnus anguillicaudatus reduces amino acid catabolism and accumulates alanine and glutamine during aerial exposure. Physiological and Biochemical Zoology, 74(2): 226–237 DOI:10.1086/319663 |
| Lim C B, Chew S F, Anderson P M, et al, 2001. Reduction in the rates of protein and amino acid catabolism to slow down the accumulation of endogenous ammonia:A strategy potentially adopted by mudskippers (Periophthalmodon schlosseri and Boleophthalmus boddaerti) during aerial exposure in constant darkness. Journal of Experimental Biology, 204(9): 1605–1614 |
| Ikeda T, 1974. Nutritional ecology of marine zooplankton. Memoirs of the Faculty of Fisheries, Hokkaido University, 22(1): 1–97 |
| Ip Y K, Lim C K, Lee S M L, et al, 2004a. Postprandial increases in nitrogenous excretion and urea synthesis in the giant mudskipper Periophthalmodon schlosseri. Journal of Experimental Biology, 207(17): 3015–3023 DOI:10.1242/jeb.01137 |
| Ip Y K, Tay A S L, Lee K H, et al, 2004b. Strategies for surviving high concentrations of environmental ammonia in the swamp eel Monopterus albus.. Physiological and Biochemical Zoology, 77(3): 390–405 DOI:10.1086/383510 |
| Jia X X, Burggren W W, 1997. Developmental Changes in chemoreceptive control of gill ventilation in larval bullfrogs (Rana catesbeiana) I. Reflex ventilatory responses to ambient hyperoxia, hypoxia and NaCN. Journal of Experimental Biology, 200(16): 2229–2236 |
| Mayzaud P, 1976. Respiration and nitrogen excretion of zooplankton. IV. The influence of starvation on the metabolism and the biochemical composition of some species. Marine Biology, 37(1): 47–58 |
| Mayzaud P, Conover R J, 1988. O:N atomic ratio as a tool to describe zooplankton metabolism. Marine Ecology Progress Series, 45(3): 289–302 |
| Otto D M E, Moon T W, 1996. Endogenous antioxidant systems of two teleost fish, the rainbow trout and the black bullhead, and the effect of age. Fish Physiology and Biochemistry, 15(4): 349–358 DOI:10.1007/BF02112362 |
| Sprague J B, 1971. Measurement of pollutant toxicity to fish-Ⅲ. Sublethal effects and "safe" concentrations. Water Research, 5(6): 245–266 DOI:10.1016/0043-1354(71)90171-0 |
| Tay A S L, Chew S F, IpY K, 2003. The swamp eel Monopterus albus reduces endogenous ammonia production and detoxifies ammonia to glutamine during 144h of aerial exposure. Journal of Experimental Biology, 206(14): 2473–2486 DOI:10.1242/jeb.00464 |
| Tsui T K N, Randall D J, Chew S F, et al, 2002. Accumulation of ammonia in the body and NH3 volatilization from alkaline regions of the body surface during ammonia loading and exposure to air in the weather loah Misgurnus anguillicaudatus. Journal of Experimental Biology, 205(5): 651–659 |
 2019, Vol. 50
2019, Vol. 50


