中国海洋湖沼学会主办。
文章信息
- 蔡佳宸, 耿慧霞, 孔凡洲, 张清春, 张波, 颜天. 2019.
- CAI Jia-Chen, GENG Hui-Xia, KONG Fan-Zhou, ZHANG Qing-Chun, ZHANG Bo, YAN Tian. 2019.
- 铜藻金潮对浒苔绿潮和几种赤潮原因种生长影响的模拟研究
- SIMULATION STUDY ON THE EFFECT OF SARGASSUM HORNERI ON OTHER HARMFUL BLOOM CAUSATIVE SPECIES
- 海洋与湖沼, 50(5): 1050-1058
- Oceanologia et Limnologia Sinica, 50(5): 1050-1058.
- http://dx.doi.org/10.11693/hyhz20190100028
文章历史
-
收稿日期:2019-01-29
收修改稿日期:2019-03-08
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
有害藻华(harmful algal bloom, HAB)是一种近海常见的灾害性生态异常现象, 常见的有害藻华现象不仅包括由微藻形成的赤潮(red tide)和褐潮(brown tide)等, 也包括由大型藻类形成的绿潮(green tide)和金潮(golden tide)等(于仁成等, 2016)。在世界许多沿海地区都有有害藻华现象的出现, 近年来, 随着我国近岸海域富营养化程度的加剧, 我国沿海赤潮的发生频率不断增加, 规模不断扩大, 新的赤潮生物种不断出现, 有毒赤潮种比例上升, 有害赤潮危害性日益增加(周名江等, 2001), 赤潮灾害给海洋生态环境、公众健康和海洋经济造成了重大损害。
就大型藻藻华而言, 在法国沿海和中国青岛沿岸发生的绿潮灾害尤为严重, 而在南加勒比和非洲沿岸发生的金潮灾害也同样十分严重(Sissini et al, 2017), 大型藻藻华现象在世界范围内呈现明显上升的趋势(Smetacek et al, 2013), 需要引起足够的重视。近年来由马尾藻属(Sargassum)褐藻等形成的金潮在中国沿海频繁发生, 其原因种为铜藻(Sargassum horneri)(陈军等, 2016)。2016年底至2017年春夏, 金潮入侵了江苏苏北浅滩紫菜养殖区, 大量的铜藻在紫菜养殖筏架、绠绳上堆积, 侵占了紫菜的生长空间, 对紫菜养殖行业造成了严重的经济损失, 同时苏北浅滩是黄海浒苔(Ulva prolifera)绿潮的源头(Liu et al, 2012; Zhou et al, 2015), 金潮的入侵对浒苔的生长空间会造成影响, 堆积的铜藻腐烂分解, 又会对相关海域生态环境造成次生危害。2017年夏季, 黄海海域35°N断面发生了1次米氏凯伦藻(Karenia mikimotoi)赤潮和1次赤潮异弯藻(Heterosigma akashiwo)赤潮, 而在此断面西部有绿潮出现, 断面东部也有金潮发生, 金潮、绿潮和赤潮三者分布区域存在重叠(孔凡洲等, 2018)。已有许多研究表明, 大型绿藻、褐藻等能够分泌化感物质抑制微藻生长(王仁君等, 2006; 孙颖颖等, 2010)。但也有研究表明, 大型藻类的分解会促进赤潮藻类的生长(Valiela et al, 1997), 而目前关于铜藻对大型藻浒苔以及对赤潮微藻类的影响效应, 还没有得到明确的认识, 亟待开展相关研究。
我国黄海海域连年发生大面积的有害藻华灾害, 既有大型藻藻华也有微藻藻华, 对近海生态系统造成了极大的危害, 而藻类作为海洋中重要的初级生产者, 对海洋生态系统平衡的维持具有十分重要的作用, 为模拟金潮对绿潮和赤潮原因种生长的影响, 本研究选取了金潮原因种——铜藻、绿潮原因种——浒苔和五种赤潮原因种微藻——中肋骨条藻(Skeletonema costatum)、链状亚历山大藻(Alexandrium catenella)、东海原甲藻(Prorocentrum donghaiense)、米氏凯伦藻和赤潮异弯藻, 在实验室内控制条件, 模拟研究了铜藻腐烂液和培养液对浒苔微观繁殖体萌发和幼苗生长及几种赤潮微藻生长的影响, 以期探明金潮暴发期和衰亡期对绿潮和赤潮发生过程的影响, 从而为全面评价金潮的生态效应提供一定的科学依据。
1 材料与方法 1.1 实验材料 1.1.1 实验用藻来源及培养实验所用铜藻采自黄海海域(123°16′37″E, 32°35′44″N), 采集到的铜藻样品带回实验室后, 用灭菌海水反复冲洗3—4次, 去除杂藻和泥沙等附着物, 充气培养于盛有3L PESI培养基的玻璃烧瓶内, 温度(20±1)℃, 盐度20—30, 光暗比14:10, 光照强度50μmol/(m2·s), 每2—3d更换培养基, 待其生长状态良好后用于实验。
实验所用浒苔取自苏北浅滩海域, 实验室内传代培养, 培养基为f/2-Si培养基, 温度(20±1)℃, 盐度30±1, 光暗比14:10, 光照强度50μmol/(m2·s), 同时添加1mg/L GeO2和1‰的维生素H。
实验用微藻来源见表 1, 培养基为f//2培养基, 培养温度为(18±1)℃, 光暗比14:10, 盐度30±1, 光照强度50μmol/(m2·s)。藻类培养用海水均取自青岛汇泉湾太平角, 沉淀沙滤后经0.45μm混合纤维滤膜过滤, 高温煮沸灭菌。选择处于指数生长期微藻, 在显微镜下计数后用于实验。
| 实验用藻 | 分离地点 |
| 中肋骨条藻(Skeletonema costatum) | 分离自中国东海海域 |
| 链状亚历山大藻(Alexandrium catenella) | 分离自中国东海海域 |
| 东海原甲藻(Prorocentrum donghaiense) | 分离自中国东海海域 |
| 米氏凯伦藻(Karenia mikimotoi) | 分离自福建苏澳 |
| 赤潮异弯藻(Heterosigma akashiwo) | 分离自青岛胶州湾 |
将采集到的铜藻样品, 用灭菌海水冲洗干净后, 放于密闭锥形瓶中腐烂分解, 基于现场调研结果, 金潮暴发时, 铜藻生物量随季节和水域环境等条件而不同, 大部分海域铜藻生物量介于1—50t/km2之间(孔凡洲等, 2018)。故将铜藻腐烂液浓度梯度设置为10、20和40g/L, 将锥形瓶放于培养箱中, 温度为20℃, 黑暗厌氧条件下, 15d后, 移除腐烂铜藻, 将腐烂液经高温灭菌的混合纤维滤膜(孔径0.45μm)过滤后, 获得铜藻腐烂液。
将生长状态良好的铜藻新鲜藻体在PESI培养液中培养, 铜藻培养液浓度梯度设置为5和10g/L, 3d后, 移去铜藻组织, 将培养液经高温灭菌的混合纤维滤膜(孔径0.45μm)过滤, 获得铜藻培养液。
1.1.3 浒苔微观繁殖体的获得采用断裂的方法诱导浒苔释放微观繁殖体(刘青等, 2015), 将收集的浒苔微观繁殖体液摇匀, 用于显微计数, 并迅速进行实验。
1.2 实验方法 1.2.1 铜藻腐烂液对浒苔微观繁殖体萌发的影响实验将新鲜释放的浒苔微观繁殖体(104cells/mL)接种于一次性培养皿, 内装30mL f/2培养液。实验组分别加入10、20和40g/L的铜藻腐烂液10mL, 对照组加入10mL灭菌海水, 避光培养24h, 以保证浒苔微观繁殖体的随机固着, 24h后恢复光照培养, 便于微观繁殖体萌发。培养条件与浒苔培养条件相同, 待培养皿中浒苔微观繁殖体萌发后, 在解剖镜下计数各组浒苔萌发数。
1.2.2 铜藻腐烂液对浒苔幼苗生长的影响实验将萌发5d的浒苔幼苗接种于f/2培养液中, 实验组加入不同浓度的铜藻腐烂液(浓度分别为10、20和40g/L), 对照组加入等量的灭菌海水, 放于培养箱中培养, 培养条件与浒苔培养条件相同, 实验周期15d, 分别在第0、5、10和15d对浒苔幼苗称重、记录, 并更换对照组和实验组培养液。
1.2.3 铜藻腐烂液对赤潮微藻生长的影响实验将指数生长期的各组微藻接种于50mL锥形瓶(内含40mL f/2培养液)中, 加入的铜藻腐烂液浓度分别为10、20和40g/L, 每个处理设置3个重复, 培养条件与微藻培养条件相同, 实验周期为12d, 每隔一天从每个培养瓶取样1mL, 用Lugol’s试剂固定后, 在显微镜下计数, 测定藻细胞密度。同时, 取样后向对照组中加入1mL 40倍f/2培养液, 实验组加入1mL营养重新加富的铜藻腐烂液, 以维持培养液体积恒定。
1.2.4 铜藻培养液对浒苔微观繁殖体萌发的影响实验将新鲜释放的浒苔微观繁殖体(104cells/mL)接种于一次性培养皿, 内装40mL f/2培养液。加入的铜藻培养液浓度分别设置为5和10g/L, 每个培养皿设置3个重复, 避光培养24h, 以保证浒苔微观繁殖体的随机固着, 24h后恢复光照培养便于微观繁殖体萌发, 培养条件与浒苔培养条件相同, 待培养皿中浒苔微观繁殖体萌发后, 在解剖镜下计数各组浒苔萌发数。
1.2.5 铜藻培养液对浒苔幼苗生长的影响实验将萌发5d的浒苔幼苗接种于f/2培养液中, 实验组加入不同浓度的铜藻培养液(浓度分别为5和10g/L), 对照组加入等量的灭菌海水, 放于培养箱中培养, 培养条件与浒苔培养条件相同, 实验周期15d, 分别在第0、5、10和15d对浒苔幼苗称重、记录, 并更换对照组和实验组培养液。
1.2.6 铜藻培养液对赤潮微藻生长的影响实验将五种指数期微藻接种于铜藻培养液中, 培养液浓度分别设置为5和10g/L, 每个处理组设置3个重复, 培养条件与微藻培养条件相同, 取样计数方法与1.2.3所述方法相同。
1.3 数据处理实验数据采用Origin 2017做图, IBM SPSS Statistics 24统计软件进行样本检验分析, 所得数据均以平均值±标准误表示(n=3), 并进行单因素方差分析(ANOVA, analysis of variance), 多重比较实验组与对照组之间的差异性, P < 0.05被认为差异显著, P < 0.01则认为是差异极显著。
微藻生长速率计算公式为: K =(ln Nt-ln N0)/t; 微藻生长抑制率计算公式为: I =(ln Nt/N0)×100%;式中, Nt为t时间时实验组藻细胞密度(cells/mL); N0为对照组藻细胞密度(cells/mL); t为时间(刘青等, 2015)。
2 结果与分析 2.1 铜藻腐烂液对浒苔微观繁殖体萌发的影响从图 1可以看出, 在铜藻腐烂液的作用下, 实验组浒苔微观繁殖体萌发数较对照组低, 与对照组相比, 中低浓度组(20和10g/L)的萌发率分别为87.5%和86.7%;当腐烂液浓度达到40g/L时, 萌发率仅为54.2%, 抑制效应显著(P < 0.05)。可见高浓度铜藻腐烂液能够显著抑制浒苔微观繁殖体的萌发, 而较低浓度的铜藻腐烂液影响效应较小。
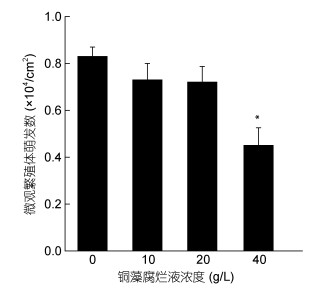 |
| 图 1 不同浓度铜藻腐烂液对浒苔微观繁殖体萌发的影响 Fig. 1 Effects of the liquid of decomposed Sargassum horneri at different concentrations on U. prolifera gametes 注: *表示差异显著, P < 0.05; **表示差异极显著, P < 0.01 |
由图 2可以看出, 实验组浒苔幼苗与对照组相比, 中低浓度组(20和10g/L)腐烂液对浒苔幼苗表现出一定的促生作用, 而高浓度组(40g/L)组则表现出一定的抑制效应, 但并不显著(P > 0.05), 实验期间浒苔幼苗无明显增重。
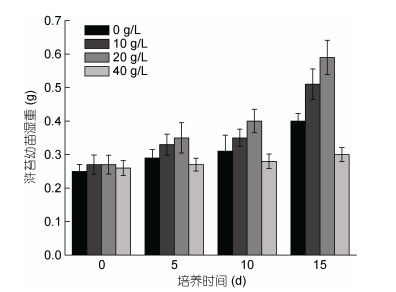 |
| 图 2 不同浓度铜藻腐烂液对浒苔幼苗生长的影响 Fig. 2 Effects of the liquid of decomposed S. horneri at different concentrations on the growth of U. prolifera seedling |
图 3实验结果表明, 不同浓度的铜藻腐烂液对五种赤潮微藻的生长均造成了一定的影响, 其中受影响最大的是米氏凯伦藻, 高浓度铜藻腐烂液(40g/L)在实验的第6d对米氏凯伦藻表现出致死效应, 中等浓度实验组(20g/L)米氏凯伦藻在实验期间生长停滞, 并在实验后期呈现降低的趋势, 低浓度腐烂液(10g/L)作用下米氏凯伦藻的生长受到显著抑制(P < 0.05);高浓度铜藻腐烂液(40g/L)在第12d对东海原甲藻的抑制率能达到65.9%, 中低浓度(20和10g/L)腐烂液的影响并不显著(P > 0.05);高浓度铜藻腐烂液(40g/L)在第12d对中肋骨条藻的抑制率能达到41.1%, 中低浓度(20和10g/L)腐烂液的影响不显著(P > 0.05);而所有实验浓度的铜藻腐烂液对链状亚历山大藻和赤潮异弯藻的生长影响均不显著(P > 0.05)。
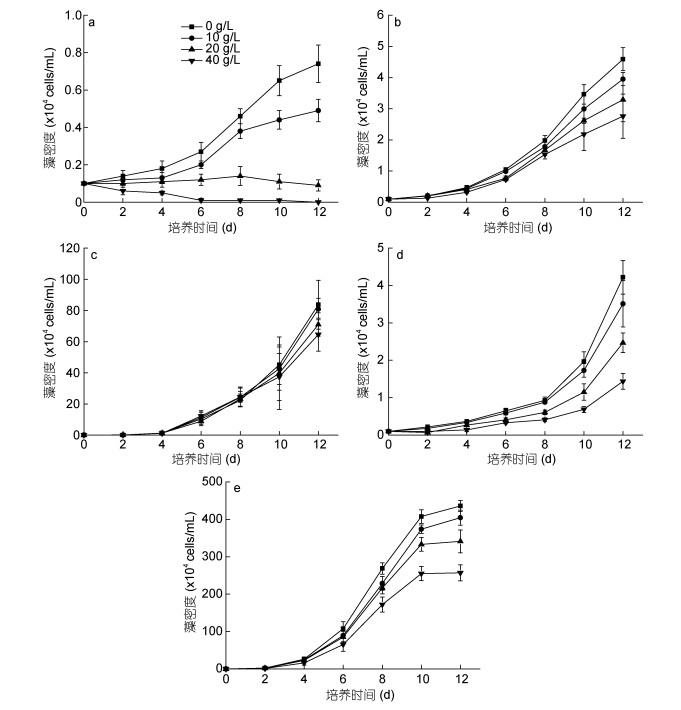 |
| 图 3 不同浓度铜藻腐烂液对五种赤潮微藻生长的影响 Fig. 3 Effects of the liquid of decomposed S. horneri at different concentrations on the growth of five species of red tide microalgae 注: a:米氏凯伦藻; b:链状亚历山大藻; c:赤潮异弯藻; d:东海原甲藻; e:中肋骨条藻 |
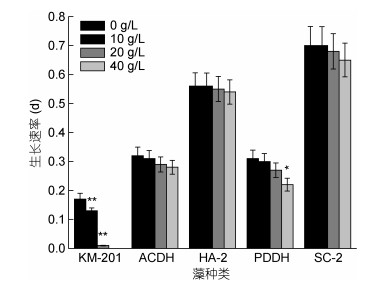 |
| 图 4 不同浓度铜藻腐烂液作用下五种赤潮微藻的生长速率 Fig. 4 The growth rates of five species of red tide microalgae in the liquid of decomposed S. horneri at different concentrations |
在不同浓度铜藻腐烂液作用下, 对比五种赤潮微藻的生长速率, 可以发现, 20g/L的铜藻腐烂液对米氏凯伦藻生长速率的影响极显著(P < 0.01); 40g/L的腐烂液对东海原甲藻的生长速率影响显著(P < 0.05);链状亚历山大藻、赤潮异弯藻和中肋骨条藻受到的影响较小, 不显著。
2.4 铜藻培养液对浒苔微观繁殖体萌发的影响图 5结果表明, 铜藻培养液会影响浒苔微观繁殖体的萌发, 高浓度组(10g/L)的铜藻培养液对浒苔微观繁殖体萌发的抑制显著(P < 0.05), 其浒苔微观繁殖体的萌发率为70.4%;而低浓度组(5g/L)的影响效应不显著(P > 0.05)。
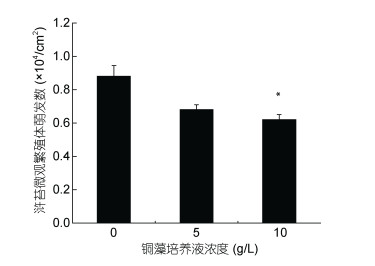 |
| 图 5 不同浓度铜藻培养液对浒苔微观繁殖体萌发的影响 Fig. 5 Effects of S. horneri culture medium at different concentrations on U. prolifera gametes |
从图 6可以发现, 实验组浒苔幼苗与对照组相比, 低浓度培养液(5g/L)对浒苔幼苗表现出一定的促生作用, 而高浓度组(10g/L)组则表现出一定程度的抑制, 与对照组相比, 在第15d的抑制率为22.2%, 实验期间浒苔幼苗增重程度较小, 抑制效应不显著(P > 0.05)。
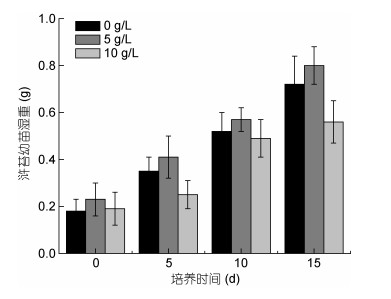 |
| 图 6 不同浓度铜藻培养液对浒苔幼苗生长的影响 Fig. 6 Effects of S. horneri culture medium at different concentrations on the growth of U. prolifera seedling |
从图 7实验结果能够看出, 不同浓度的铜藻培养液对五种赤潮微藻的生长均造成一定程度的影响, 其中受影响最大的是米氏凯伦藻, 在实验期间, 高浓度(10g/L)组米氏凯伦藻生长处于停滞状态, 实验期间没有明显的生长, 对米氏凯伦藻生长的抑制率在第12d时能达到92.9%, 而低浓度(5g/L)组米氏凯伦藻的生长也受铜藻培养液影响显著(P < 0.05), 第12d的抑制率能达到40.5%;东海原甲藻和中肋骨条藻在低浓度培养液(5g/L)条件下受到的影响较小, 高浓度(10g/L)实验组也受到抑制, 但抑制效应并不显著(P > 0.05);链状亚历山大藻和赤潮异弯藻的生长在实验期间与对照组相比, 生长差异不显著(P > 0.05)。
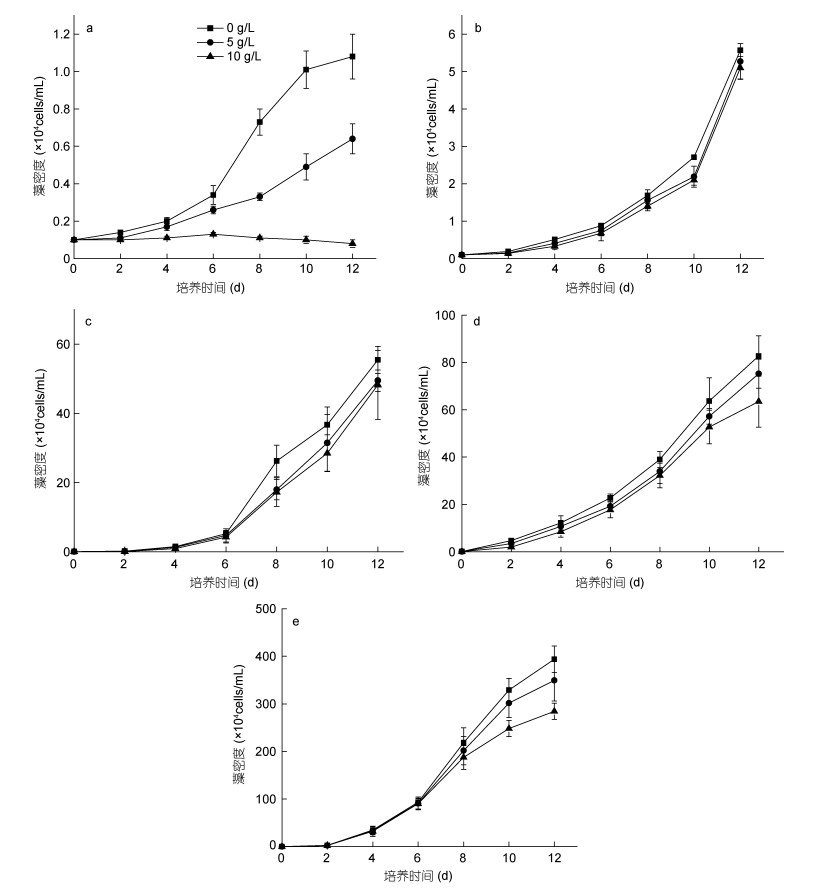 |
| 图 7 不同浓度铜藻培养液对五种赤潮微藻生长的影响 Fig. 7 Effects of S. horneri culture medium at different concentrations on the growth of five species of red tide microalgae 注: a:米氏凯伦藻; b:链状亚历山大藻; c:赤潮异弯藻; d:东海原甲藻; e:中肋骨条藻 |
在不同浓度铜藻培养液的作用下, 对比五种赤潮微藻的生长速率, 可以发现, 浓度为5g/L的铜藻培养液就能够对米氏凯伦藻的生长速率造成显著影响(P < 0.05), 浓度为10g/L的铜藻培养液能够极显著抑制米氏凯伦藻的生长(P < 0.01);铜藻培养液对其他四种赤潮微藻生长速率的影响不显著。
3 讨论 3.1 金潮的暴发和衰亡过程金潮是由漂浮状态的马尾藻属褐藻暴发性增殖生长引起的生态灾害现象(Smetaceket al, 2013), 从其发生过程对生态环境的影响效应来看, 影响最大的是暴发过程和衰亡过程。
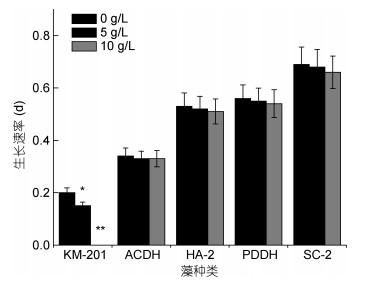 |
| 图 8 不同浓度铜藻培养液作用下五种赤潮微藻的生长速率 Fig. 8 The growth rates of five species of red tide microalgae in S. horneri culture medium at different concentrations |
金潮暴发期, 大量的漂浮铜藻会覆盖大面积海域, 通过遮光削弱其他藻类的光合作用, 进而对其他藻类的生长产生影响; 此外藻华种藻类与其他藻类同属于海洋生态系统中的初级生产者, 大型藻与大型藻之间, 大型藻与微藻之间又会存在不同程度的营养竞争, 大型藻在与微藻的竞争中可能会获得更多的光照和营养盐, 铜藻在与其他藻类的竞争过程中, 也可能会对其他藻类生长也会造成影响。
在金潮衰亡阶段, 铜藻又会由于环境条件的变化腐烂分解, 对生态环境造成严重的影响。首先, 会对水体环境造成严重的危害:一方面, 铜藻腐烂分解过程中会大量消耗水体中的溶解氧, 导致水体中缺氧现象的出现; 藻类进入衰亡期后, 植物残体腐烂分解产生的有毒物质也容易造成水体环境的污染(杨清心, 1998)。另一方面, 形成藻华的大型藻类生长时会持续不断地摄取大量营养物质(Pedersen et al, 1997), 当铜藻腐烂分解时, 藻体内有机物质大部分会以有机态形式释放到水体中, 从而向周围水域中带来大量的营养盐等物质, 导致水体浮游生态系统发生变化; 此外, 进入衰亡期的铜藻, 又会在浅滩和沿岸等地堆积, 危害浅滩养殖和沿岸的生态环境。这些过程对其他生物都有直接的影响和危害, 严重时甚至会危害海洋生态安全。
3.2 金潮对绿潮发生过程的主要影响前期研究表明绿潮发生的生态学过程主要包括苏北浅滩微观繁殖体阶段、浅滩养殖筏架附生阶段、附生绿藻入海过程、苏北浅滩漂浮阶段和南黄海大规模漂浮阶段(Zhou et al, 2015)。因此, 浒苔微观繁殖体附着和萌发生长阶段是每年绿潮早起形成的重要环节。2017年南黄海金潮灾害暴发时, 大量的铜藻入侵苏北浅滩紫菜筏架区, 筏架设施被严重损坏, 现场研究发现大量的铜藻在筏架上缠绕(颜天等, 2018), 从空间上减少了浒苔微观繁殖体的附着量, 且铜藻大量堆积的同时又伴随不同程度的腐败, 本研究表明铜藻的腐败过程也会进一步影响浒苔微观繁殖体的附着和幼苗的生长, 从而在绿潮早期生成阶段, 对绿潮的规模造成影响; 另外在南黄海某些海域, 铜藻与浒苔共同漂浮, 铜藻和浒苔同属大型藻类, 其生态位相似, 藻类之间除进行营养竞争外, 本研究表明在营养盐充足的条件下, 铜藻活体还会影响浒苔幼苗的生长, 进而在绿潮的发展阶段造成影响。因此, 金潮暴发并入侵苏北浅滩成为2017年南黄海浒苔的整体发生规模显著降低的重要原因之一。
3.3 金潮对赤潮发生过程的主要影响2017年南黄海35°N断面金潮和赤潮灾害分布区域存在交叉重叠的现象, 铜藻与赤潮微藻处于同一海域, 藻类之间相互竞争光照和营养盐, 当光照和营养盐充足时, 大型海藻还能向环境中释放化感物质, 对赤潮微藻具有明显的生化抑制效应(Jeong et al, 2000)。大量的实验结果以及自然界的研究表明, 海洋中普遍存在相生相克作用, Hedĕnec等(2014)的研究发现, 大型海藻分泌的相生相克类化合物能够抑制其他藻类的生长; 王仁君等(2006)报道了鼠尾藻(Surgassum thunbergii)对赤潮异弯藻和中肋骨条藻生长的抑制作用; Jin等(2003)研究了大型绿藻孔石莼(Ulva pertusa)对赤潮异弯藻和塔玛亚历山大藻(Alexandrium tanarense)的克生效应。本实验中选取的五种赤潮原因种微藻分别代表甲藻、硅藻和针胞藻, 从实验结果来看, 铜藻活体会产生某种化感物质影响赤潮微藻的生长, 从而对赤潮的发生造成影响, 但影响程度并不相同, 这可能与赤潮微藻对化感物质的敏感性有关; Suikkanen等(2004)指出同一种藻类的培养液对不同藻类的敏感性不同, 其敏感性取决于对其所接触的化感物质的敏感性, 因此, 暴发期的金潮会对不同种赤潮的发生产生不同的影响。
而当金潮进入衰亡期阶段后, 铜藻腐烂分解, 向周围水体带来大量的营养盐等物质。一般来讲, 甲藻能够利用铵氮生长, 但高浓度的铵氮会抑制甲藻的生长, 甚至表现出毒害作用(Leong et al, 2004); 也有研究表明, 脂肪酸类物质也能够抑制微藻类的生长(Suzuki et al, 1996)。本实验中米氏凯伦藻受到的抑制作用最为显著, 其次受抑制较大的是东海原甲藻, 这个结果与以往研究结果一致, 但具体原因值得进一步的探究。有研究表明赤潮异弯藻对铵氮的耐受能力较强, 甚至可以利用铵氮进行生长(Herndon et al, 2007)。本实验中赤潮异弯藻的耐受能力最强, 实验组藻密度与对照组相差不大, 甚至优于对照组, 这一结果与王超(2010)发现赤潮异弯藻会受到浒苔腐烂液的刺激相一致。本研究中链状亚历山大藻和中肋骨条藻对金潮的响应介于米氏凯伦藻和赤潮异弯藻之间, 但也均受到不同程度的影响。因此, 衰亡期的金潮也会对不同种赤潮产生不同的影响。
4 结论本研究发现我国黄海海域发生的金潮灾害, 其原因种铜藻与绿潮原因种浒苔以及几种赤潮原因种微藻之间, 可能存在相互作用和相互影响, 无论是在金潮暴发初期还是衰亡堆积末期, 均会对绿潮和赤潮的发生过程造成影响。
于仁成, 刘东艳. 2016. 我国近海藻华灾害现状、演变趋势与应对策略. 中国科学院院刊, 31(10): 1167-1174 |
王超, 2010.浒苔(Ulva prolifera)绿潮危害效应与机制的基础研究.青岛: 中国科学院研究生院(海洋研究所)博士学位论文, 51-52 http://cdmd.cnki.com.cn/Article/CDMD-80068-2010147161.htm
|
王仁君, 唐学玺, 冯蕾, 等. 2006. 鼠尾藻对赤潮异弯藻和中肋骨条藻的抑制作用. 应用生态学报, 17(12): 2421-2425 DOI:10.3321/j.issn:1001-9332.2006.12.038 |
孔凡洲, 姜鹏, 魏传杰, 等. 2018. 2017年春、夏季黄海35°N共发的绿潮、金潮和赤潮. 海洋与湖沼, 49(5): 1021-1030 |
刘青, 颜天, 周名江, 等. 2015. 早期发育浒苔对2株常见赤潮藻的化感效应. 海洋科学进展, 33(4): 529-536 DOI:10.3969/j.issn.1671-6647.2015.04.011 |
孙颖颖, 刘筱潇, 王长海. 2010. 浒苔提取物对4种赤潮微藻生长的抑制作用. 环境科学, 31(6): 1662-1669 |
杨清心. 1998. 东太湖水生植被的生态功能及调节机制. 湖泊科学, 10(1): 67-72 |
陈军, 王寅初, 余秋瑢, 等. 2016. 绿潮暴发期间我国青岛漂浮铜藻的分子鉴定. 生物学杂志, 33(1): 39-42 |
周名江, 朱明远, 张经. 2001. 中国赤潮的发生趋势和研究进展. 生命科学, 13(2): 53-59 |
颜天, 于仁成, 周名江, 等. 2018. 黄海海域大规模绿潮成因与应对策略--"鳌山计划"研究进展. 海洋与湖沼, 49(5): 950-958 |
Heděnec P, Novotný D, Ust'ak S et al, 2014. Allelopathic effect of new introduced biofuel crops on the soil biota: A comparative study. European Journal of Soil Biology, 63: 14-20 DOI:10.1016/j.ejsobi.2014.05.002 |
Herndon J, Cochlan W P, 2007. Nitrogen utilization by the raphidophyte Heterosigma akashiwo: Growth and uptake kinetics in laboratory cultures. Harmful Algae, 6(2): 260-270 DOI:10.1016/j.hal.2006.08.006 |
Jeong J H, Jin H J, Sohn C H et al, 2000. Algicidal activity of the seaweed Corallina pilulifera against red tide microalgae. Journal of Applied Phycology, 12(1): 37-43 DOI:10.1023/A:1008139129057 |
Jin Q, Dong S L, 2003. Comparative studies on the allelopathic effects of two different strains of Ulva pertusa on Heterosigma akashiwo and Alexandrium tamarense. Journal of Experimental Marine Biology and Ecology, 293(1): 41-55 DOI:10.1016/S0022-0981(03)00214-4 |
Leong S C Y, Taguchi S, 2004. Response of the dinoflagellate Alexandrium tamarense to a range of nitrogen sources and concentrations: growth rate, chemical carbon and nitrogen, and pigments. Hydrobiologia, 515(1-3): 215-224 DOI:10.1023/B:HYDR.0000027331.49819.a4 |
Liu F, Pang S J, Zhao X B et al, 2012. Quantitative, molecular and growth analyses of Ulva microscopic propagules in the coastal sediment of Jiangsu province where green tides initially occurred. Marine Environmental Research, 74: 56-63 DOI:10.1016/j.marenvres.2011.12.004 |
Pedersen M F, Borum J, 1997. Nutrient control of estuarine macroalgae: Growth strategy and the balance between nitrogen requirements and uptake. Marine Ecology Progress Series, 161: 155-163 DOI:10.3354/meps161155 |
Sissini M N, de Barros Barreto M B B, Széchy M T M et al, 2017. The floating Sargassum (Phaeophyceae) of the South Atlantic Ocean-likely scenarios. Phycologia, 56(3): 321-328 DOI:10.2216/16-92.1 |
Smetacek V, Zingone A, 2013. Green and golden seaweed tides on the rise. Nature, 504(7478): 84-88 DOI:10.1038/nature12860 |
Suikkanen S, Fistarol G O, Granéli E, 2004. Allelopathic effects of the Baltic cyanobacteria Nodularia spumdigena, Aphanizomenon flos-aquae and Anabaena lemmermannii on algal monocultures. Journal of Experimental Marine Biology and Ecology, 308(1): 85-101 DOI:10.1016/j.jembe.2004.02.012 |
Suzuki M, Wakana I, Denboh T et al, 1996. An allelopathic polyunsaturated fatty acid from red algae. Phytochemistry, 43(1): 63-65 |
Valiela I, McClelland J, Hauxwell J et al, 1997. Macroalgal blooms in shallow estuaries: Controls and ecophysiological and ecosystem consequences. Limnology and Oceanography, 42(5): 1105-1118 |
Zhou M J, Liu D Y, Anderson D M et al, 2015. Introduction to the Special Issue on green tides in the Yellow Sea. Estuarine, Coastal and Shelf Science, 163: 3-8 DOI:10.1016/j.ecss.2015.06.023 |
 2019, Vol. 50
2019, Vol. 50


