中国海洋湖沼学会主办。
文章信息
- 管晨, 郝雅, 侯承宗, 唐学玺, 王影. 2021.
- GUAN Chen, HAO Ya, HOU Cheng-Zong, TANG Xue-Xi, WANG Ying. 2021.
- 绿潮迁移过程中环境要素与浒苔藻体生物学特征的相关性分析
- CORRELATION ANALYSIS OF ENVIRONMENTAL FACTORS AND BIOLOGICAL CHARACTERISTICS OF ULVA PROLIFERA DURING GREEN TIDES DRIFTING
- 海洋与湖沼, 52(1): 114-122
- Oceanologia et Limnologia Sinica, 52(1): 114-122.
- http://dx.doi.org/10.11693/hyhz20200400110
文章历史
-
收稿日期:2020-04-06
收修改稿日期:2020-05-25
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237
2. Marine ecology and Environmental Science Laboratory, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China
绿潮(green tide)是一种常见的有害藻华(HABs), 主要由石莼属(Ulva)等海藻的过度生长引起(Fletcher, 1996; Anderson et al, 2002)。绿潮的暴发多与当地水体富营养化有关, 其暴发严重威胁当地的水产养殖和旅游业, 造成巨大的经济损失(Sun et al, 2008)。目前, 黄海已成为世界上绿潮规模最大的地区。黄海绿潮的主要优势种为浒苔(Ulva prolifera) (张晓雯等, 2008; 丁兰平等, 2009; Gao et al, 2013)。自2007年开始, 我国黄海海域均出现大规模绿潮。目前最为科学家们广泛接受的观点为黄海南部的苏北浅滩筏架养殖区是黄海浒苔绿潮的起源地。每年4月中旬至5月初, 浒苔藻体脱离固着基, 形成小块漂浮浒苔并出现在黄海南部江苏沿海, 在风场和海流的作用下逐渐向北漂浮迁移, 生物量迅速增加; 在5月下旬, 聚集的漂浮浒苔形成大面积绿藻斑块; 6月中旬, 漂浮浒苔逐渐在山东半岛堆积; 7月浒苔生物量达到最大后开始下降, 并最终消亡于山东半岛海域(Hu et al, 2010; Liu et al, 2013; Wang et al, 2015)。
南黄海海域环境复杂多变, 尤其是营养盐的浓度变化剧烈(王俊杰等, 2018)。黄海冷水团、黄海暖流等海流显著影响南黄海营养盐的来源、分布和输运(Wei et al, 2016)。射阳河、灌河、长江等河流输入的氮和磷为南黄海海域绿潮的暴发提供了物质基础(马洪瑞等, 2010)。南黄海营养盐的分布通常呈现出由近岸到远海逐渐降低的趋势, 其中在苏北近岸海域呈现出了较高的氮、磷含量(高嵩等, 2012)。南黄海海州湾附近的35°N断面是南黄海最长的断面。35°N北部海水透明度增加, 营养盐含量较低, 而35°N南部海域营养盐含量丰富。在南黄海, 春、夏季水温上升, 温、盐跃层的出现使得水体稳定性增加, 营养盐含量呈现上层低、下层高的趋势, 环境条件适宜, 有利于绿潮的发展(韦钦胜等, 2012)。有研究表明, 在35°N断面附近, 漂浮浒苔生物量具有明显增加的特征(孔凡洲等, 2018)。
与其他大型海藻相比, 浒苔生态幅较宽, 具有广盐、广温等较强适应环境的特征。浒苔对海水温度、盐度和光照强度的适应范围分别为10—30℃、7.2—53.5和1000—10000 lx; 最适范围分别为15—25℃、20.2—26.9和5000—6000 lx (吴洪喜等, 2000)。浒苔具有较强的适应环境的能力, 其生物学特征受到环境变化的影响。在正常盐度条件下, 低温降低了浒苔的生长, 高温显著降低了浒苔的最大光化学量子产量Fv/Fm; 相对于温度变化, 盐度变化对浒苔Fv/Fm影响不显著(刘榆莎等, 2016)。在营养盐丰富的环境中, 浒苔吸收营养盐的能力显著高于其他多数海藻, 浒苔也可以迅速吸收多种形式的营养盐, 而随着环境中营养盐含量的增加, 浒苔藻体可以迅速吸收并储存大量的营养盐用于藻体快速生长(吴晓文等, 2010)。温度、光照和盐度均可以影响浒苔硝态氮的吸收能力, 在20℃时, 浒苔吸收硝态氮的速率最大, 盐度与浒苔硝态氮的吸收呈正相关; 在低光条件下, 浒苔对硝态氮的吸收速率较低, 随着环境中营养盐含量的增大, 浒苔吸收硝态氮的速率显著增加(丛珊珊, 2011)。不同温度、盐度和光照强度可以影响浒苔孢子和配子的萌发和放散(王浩东等, 2012)。浒苔孢子囊的形成与光合活性有关(Gao et al, 2010)。通过对南黄海浒苔孢子囊形成的情况进行了研究, 发现在江苏沿海海域, 浒苔藻体呈现出较好的生理状态, 但呈现出较少的孢子囊, 而随着浒苔向北漂浮迁移, 藻体生理活性下降, 孢子囊形成比例升高(郑阵兵等, 2018)。
前期针对浒苔绿潮形成的环境驱动机制进行了大量的研究工作, 在暴发海区富营养化对浒苔绿潮形成的驱动作用已形成统一的共识(高嵩等, 2012; Wang et al, 2015; 白雨等, 2019)。浒苔具有很强的环境可塑性, 其自身存在诸多可以适应环境变化的生物学特征, 如光合活性的改变、营养盐吸收的改变、形态改变等。在浒苔绿潮暴发过程中, 尤其是数百公里的迁移过程中, 浒苔藻体时刻面临生态要素剧烈变化的影响。浒苔藻体的环境可塑性是否与生态要素存在相关性关系还需进一步明确。本文通过现场调查的方式探究了绿潮迁移过程中环境要素与浒苔藻体生物学特征的相关性以期甄别驱动浒苔绿潮形成的主要环境因子, 为阐明为什么黄海会暴发大规模浒苔绿潮提供理论依据。
1 材料与方法 1.1 站位布设与样品采集浒苔样品采集于2018年5月25—30日, 根据监测数据此时黄海绿潮从江苏近岸到青岛近岸呈长条状斑块分布, 早期迁移斑块已抵近青岛近岸, 但还未集聚(国家海洋局北海预报中心)。采集范围在(34.0°—36.0°N, 120.0°—121.5°E), 共设6条断面进行大面站调查, 其中断面A、B和C位于海州湾南部(SH), 断面D、E和F位于海州湾北部(NH), 采样站位如图 1所示。采集不同站位的绿藻, 通过无菌海水反复冲洗藻体, 同时用刷子清洗藻体表面并去除泥沙等杂物。随机挑选浒苔样品, 现场测量叶绿素荧光参数、NRA和生殖分配率。
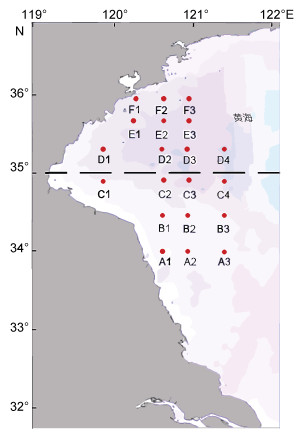 |
| 图 1 浒苔采样站位点 Fig. 1 Map of sample collecting stations |
温度、光照、盐度等环境参数在每天同一时段(10:00—11:00)进行测量。温度和盐度使用温盐深仪(conductivity–temperature–depth profiler, CTD, Seabird 25, Sea-Bird, USA)测量。光照强度使用照度计(TES1335, 泰仕电子工业有限公司, 中国台湾)测量(单位: lx), 然后依据Thimijan (Thimijan et al, 1983)所述方法将光照强度转化为400—700 nm的光合可利用辐照[photosynthetically active radiation, PAR, 单位: μmol photons/(m2·s)]。水样经过GF/C膜(Whatman, US)过滤, 储存于-80℃, 全自动连续流动分析仪(AutoAnalyzer3, Seal Analytical, Germany)测量溶解无机氮(DIN)和磷酸盐(PO43--P), DIN和PO43--P的测定方法参照《海洋监测规范》(GB17378. 4—2007)。
1.3 浒苔暴发海域藻体光合特征测定采用Dual-PAM-100荧光仪(Walz, Germany)测定浒苔样品的光合活性。实验开始前, 预先设置好仪器程序, 将浒苔暗适应20分钟。测定光合诱导曲线并记录Fv/Fm和Y(Ⅱ)。Fv/Fm表示光系统Ⅱ (PSII)在藻类中的最大光化学量子产量(其中Fv是黑暗中最大可变叶绿素荧光, Fm是黑暗中最大叶绿素荧光), Y(Ⅱ)表示光系统Ⅱ (PSII)的实际光化学量子产量。各种参数均重复5次, 每次测量在同处理的不同藻体上进行, 叶绿素荧光参数计算的基本步骤按照Wang等(2012)和Heinz Walz GmbH操作手册进行。
1.4 浒苔暴发海域藻体硝酸还原酶活性的测定硝酸还原酶活性(Nitrate reductase activity, NRA)的测定按照Young等的方法(Young et al, 2005)。称取采集的浒苔样本于研钵中研磨并添加提取液聚乙烯吡咯烷酮和1 mmol/L二硫苏糖醇的磷酸缓冲液, 在4℃条件下5000 r/min离心5 min后, 加入0.1 mol/L的KNO3溶液和NADH溶液, 混匀后再25℃水浴30 min, 随后加入醋酸锌和乙醇终止反应, 最后用萘乙二胺显色法在显色15 min后再540 nm的波长测定吸光值。NRA单位为μmol/L NO2-/(mg·h)。
1.5 浒苔暴发海域藻体生殖特征测定清洁后的浒苔悬浮于放有无菌海水样品盘中。将浒苔剪为1 mm×1 mm左右大小放置于载玻片上, 用光学显微镜RVL-100-G (ECHO, USA)观察细胞并统计含有孢子或配子的生殖细胞和营养细胞数。生殖分配率(RA)=生殖细胞数/营养细胞数计算(Wang et al, 2019)。
1.6 数据处理与分析本章所提供的数据以平均值±标准差(mean ± SD)表示。数据统计分析使用IBM SPSSStatistics22 (SPSS Inc, USA)中的独立样本T检验(Student’s t-test)和单因素方差分析(one-way ANOVA)进行, 显著性水平设置为0.05。其中P值小于0.05表明差异具有统计学意义, P < 0.05认为差异显著, P < 0.01认为差异极显著。数据首先采用Levene检验数据的方差齐性(homogeneity), 数据正态性(normality)使用Shapiro-Wilk检验。当组间方差不齐时, 采用Dunnett’s T3对数据进行计算, 其他情况下采用Duncan post-hoc test进行处理。使用Origin软件(OriginLab, USA)和Arcgis软件(Esri, USA)作图。冗余分析(RDA)使用Canoco 5作图。
2 结果与分析 2.1 海水表层部分环境要素测量分别对6个断面的海水表层的温度、盐度、光照强度、DIN、PO43--P进行了测量, 图 2所示, 在浒苔绿潮漂浮迁移所经过的海域中, 温度和光照強度总体呈现南高北低、盐度北高南低的特征。DIN和PO43--P在A1、B1和C1时最高, 总体呈现南高北低和近岸高, 远海低的特征。通过对调查海域海水表层环境要素的测量发现, 35°N断面附近的环境要素有较为明显的变化。表 1所示, SH海水表层的温度、盐度、光照强度、DIN和PO43--P分别为(21.76±0.24)℃、(30.75±0.48)、(394.29±17.18) μmol photons/(m2·s)、(17.43±5.62) μmol/L和(0.27±0.09) μmol/L。NH海水表层的温度、盐度、光照强度、DIN和PO43--P分别为(20.72±0.39)℃、(31.18±0.54)、(355.11±59.9) μmol photons/(m2·s)、(5.16±0.63) μmol/L和(0.10±0.02) μmol/L。SH海水表层的温度、DIN和PO43--P都显著高于NH海水表层(Student’s t-test, P < 0.05), SH和NH海水表层的盐度和光照强度没有显著差异(Student’s t-test, P > 0.05)。
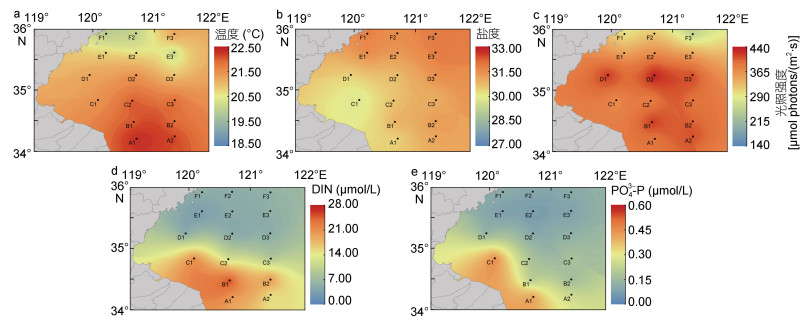 |
| 图 2 浒苔迁移过程中海水表层部分环境要素 Fig. 2 Environmental factors in surface during the Ulva prolifera drifting |
| 海域 | 温度(℃) | 盐度 | 光照强度[μmol photons/(m2·s)] | DIN (µmol/L) | PO43--P (µmol/L) |
| SH | 21.76±0.24a | 30.75±0.48a | 394.29±17.18a | 17.43±5.62a | 0.27±0.09a |
| NH | 20.72±0.39b | 31.18±0.54a | 355.11±59.92a | 5.16±0.63b | 0.10±0.02b |
| 注:同一列中不同上标字母表示数值之间有显著差异(P < 0.05), 相同上标字母表示无显著差异(P > 0.05) | |||||
通过对采集的浒苔藻体进行光合活性的测定, 藻体Fv/Fm和Y(Ⅱ)的变化如图 3所示, 浒苔藻体Fv/Fm和Y(Ⅱ)总体呈现南高北低的特征。断面A、B和C分布的浒苔藻体的Fv/Fm显著高于断面D、E和F的浒苔(图 3a, one-way ANOVA, P < 0.05)。断面A、B和C浒苔藻体的Fv/Fm值在0.55—0.7之间, 表明漂浮初期浒苔藻体的光合活性较好, 而断面D、E和F藻体的Fv/Fm值在0.45—0.60之间, 表明漂浮一段距离后浒苔藻体光合活性较差, 受胁迫程度相对较高。浒苔藻体Y(Ⅱ)呈现出与Fv/Fm相似的趋势。图 3表明, 断面A、B和C藻体Y(Ⅱ)值在0.4—0.55之间, 而断面D、E和F藻体的Y(Ⅱ)值在0.25—0.5之间, 表明NH海域的浒苔藻体的实际光合活性较差。在同一断面上, 不同站位的Fv/Fm和Y(Ⅱ)值呈近岸高, 远海低的特征, 但站点间无显著差异。表明同一纬度、不同经度的浒苔光合活性存在差异, 整体趋势与营养盐浓度变化趋势类似。在向北迁移过程中, 浒苔藻体Fv/Fm和Y(Ⅱ)总体呈现下降趋势。SH海域浒苔的Fv/Fm和Y(Ⅱ)显著高于NH浒苔(图 3c和3d, Student’s t-test, P < 0.05), 在SH, 藻体Fv/Fm和Y(Ⅱ)的平均值分别为0.63和0.52, 而在NH, 藻体Fv/Fm和Y(Ⅱ)的平均值分别为0.48和0.39。
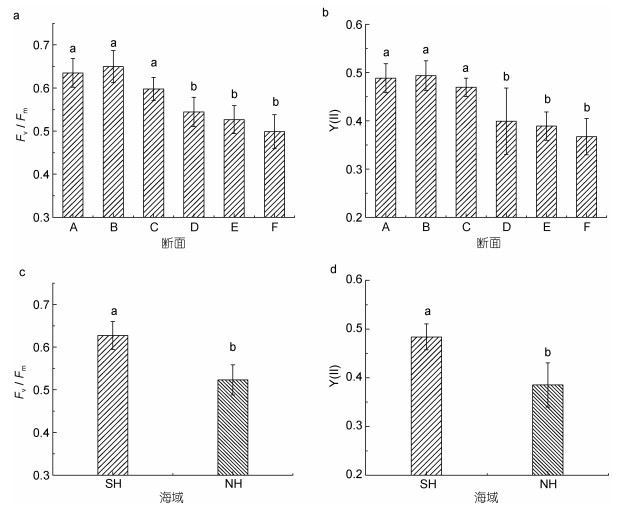 |
| 图 3 浒苔迁移过程中藻体的光合参数 Fig. 3 Photosynthetic parameters of Ulva prolifera during drifting 注: a.不同断面藻体的Fv/Fm值; b.不同断面藻体的Y(Ⅱ)值; c. SH和NH藻体的Fv/Fm值; d. SH和NH藻体的Y(Ⅱ)值 |
通过测定不同断面浒苔藻体的NRA, 可以反映藻体对硝态氮的吸收和代谢水平。图 4表明, 断面A和B的浒苔藻体NRA显著高于断面D、E和F的藻体(图 4a, one-way ANOVA, P < 0.05), 而断面C浒苔藻体的NRA与其他断面浒苔NRA的变化均不显著。浒苔NRA总体呈现南高北低的特征, SH海域浒苔藻体NRA显著高于NH藻体(图 4b, Student’s t-test, P < 0.05)。在SH, 藻体NRA的平均值为2.29 μmol/L NO2-/(mg·h), 而在NH, 藻体Fv/Fm和Y(Ⅱ)的平均值为0.66 μmol/L NO2-/(mg·h)。
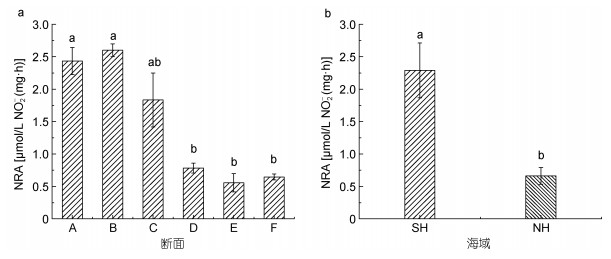 |
| 图 4 浒苔迁移过程中藻体的NRA的测定 Fig. 4 NRA of Ulva prolifera during the drifting 注: a.不同断面藻体的NRA值; b. SH和NH藻体的NRA值; 单位: μmol/L NO2-/(mg·h) |
本次实验统计了断面A、B、C、D、E和F漂浮浒苔的生殖分配率。结果表明, 浒苔藻体形成的生殖细胞数目呈先上升, 后下降的趋势, 在断面B时生殖分配率最低, 断面D时生殖分配率最高。断面D的浒苔藻体生殖细胞数目显著高于断面B浒苔藻体生殖细胞数目(图 5a, one-way ANOVA, P < 0.05), 而其他断面之间均无显著性变化。浒苔藻体生殖分配率整体呈现上升趋势, SH海域藻体生殖分配率显著低于NH藻体(图 5b, Student’s t-test, P < 0.05)。在SH, 藻体生殖分配率的平均值为27%, 而在NH, 藻体生殖分配率平均值为38%。
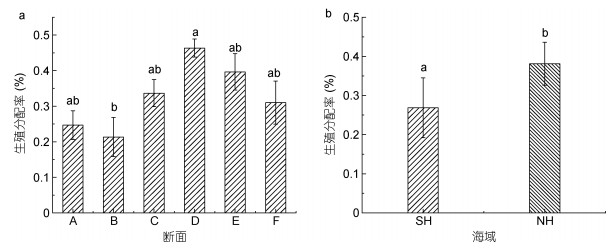 |
| 图 5 浒苔迁移过程中藻体的生殖分配率 Fig. 5 RA of Ulva prolifera during drifting 注: a.不同断面藻体的生殖分配率; b. SH和NH藻体的生殖分配率 |
图 6显示了不同断面浒苔的生理参数与环境要素的RDA分析图, 参与RDA分析的环境要素有温度、光照强度、盐度、DIN和PO43--P, 参与PCA分析的生物学特征有Fv/Fm、Y(Ⅱ)、NRA和生殖分配率。环境要素对浒苔生物学特征的总解释度为85.4%, DIN、温度、PO43--P、盐度和光照强度的解释度分别为80.1%、72.1%、61.0%、49.0%、26.1%和25.5%, 说明DIN是驱动浒苔生物学特征改变的主要环境要素。表 2显示了SH和NH海域的环境要素与浒苔藻体的生理和生殖参数的相关性分析结果, 具体说明如下:
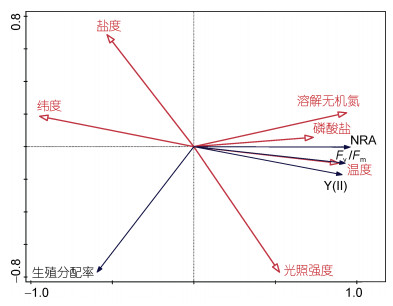 |
| 图 6 海州湾南部和北部海域浒苔的生理参数与环境要素的RDA分析图 Fig. 6 Redundancy analysis (RDA) of Ulva prolifera samples and physiological parameters and environmental factors |
| DIN | 纬度 | 温度 | 光照强度 | PO43--P | 盐度 | Fv/Fm | Y(Ⅱ) | NRA | RA | |
| DIN | 1 | -0.819** | 0.726** | 0.366 | 0.703** | -0.379 | 0.853** | 0.814** | 0.897** | -0.717** |
| 纬度 | 1 | -0.912** | -0.702** | -0.626** | 0.516* | -0.946** | -0.895** | -0.906** | 0.420 | |
| 温度 | 1 | 0.553* | 0.554* | -0.473 | 0.824** | 0.853** | 0.852** | -0.451* | ||
| 光照强度 | 1 | 0.173 | -0.653** | 0.655** | 0.633** | 0.506* | -0.275 | |||
| PO43--P | 1 | -0.583* | 0.589* | 0.594* | 0.702* | -0.467 | ||||
| 盐度 | 1 | -0.468 | -0.597* | -0.513* | -0.220 | |||||
| Fv/Fm | 1 | 0.923** | 0.920** | -0.443 | ||||||
| Y(Ⅱ) | 1 | 0.905** | -0.408 | |||||||
| NRA | 1 | -0.542* | ||||||||
| RA | 1 | |||||||||
| 注: *表示P < 0.05; **表示P < 0.01。 | ||||||||||
(1) SH和NH海域DIN与纬度呈极显著负相关(R =-0.819, P < 0.01), 说明浒苔绿潮向北迁移过程中海水表层的DIN逐渐降低; DIN与温度和PO43--P呈极显著正相关(P < 0.01), DIN与光照强度和盐度的相关性不显著(P > 0.05);温度、光照强度和PO43--P与纬度呈极显著负相关(P < 0.01), 温度与光照强度呈现出显著正相关(P < 0.05), 与PO43--P呈显著正相关(P < 0.05), 盐度与纬度呈显著正相关(P < 0.05), 说明纬度越高, 温度、光照强度和PO43--P越低, 盐度越高。
(2) SH和NH海域DIN与浒苔Fv/Fm (R=0.853)和Y(Ⅱ) (R=0.814)呈极显著正相关(P < 0.01), 结果表明海水表层DIN浓度越高, 浒苔的光合作用效率越高。藻体Fv/Fm和Y(Ⅱ)与纬度呈极显著负相关(P < 0.01), 与温度和光照强度呈极显著正相关(P < 0.01), 与PO43--P呈显著正相关(P < 0.05), 而盐度与Fv/Fm相关度不显著(P > 0.05), 与Y(Ⅱ)呈显著负相关(P < 0.05)。
(3) SH和NH海域DIN与浒苔NRA呈极显著正相关(R=0.897, P < 0.01), 表明海水表层DIN浓度越高, NRA越高; 藻体NRA与纬度呈极显著负相关(P < 0.01), 与温度呈极显著正相关(P < 0.01), 与PO43--P和光照强度呈显著正相关(P < 0.05), 与盐度呈显著负相关(P < 0.05)。NRA与Fv/Fm和Y(Ⅱ)呈极显著正相关(P < 0.01)。
(4) SH和NH海域DIN与浒苔生殖分配率呈极显著负相关(R=-0.717, P < 0.01), 表明海水表层DIN浓度越高, 生殖分配率越低。藻体生殖分配率与温度和NRA呈显著负相关(P < 0.05), 与纬度、光照强度、PO43--P和盐度相关性不显著(P > 0.05)。
3 讨论黄海浒苔绿潮是一种典型的跨区域海洋生态灾害, 在其长距离迁移过程中, 经历复杂的生态学过程, 受多种环境要素驱动(Wang et al, 2015; Liu et al, 2016)。本文分析了浒苔绿潮迁移路径上温度、光照强度、盐度、DIN、PO43--P等环境要素与浒苔藻体光合活性、NRA及生殖分配率之间的相互关系, 探究了环境要素与浒苔光合、营养盐吸收和生殖等关键生物学特征的相关性, 为最终阐明为什么黄海会暴发大规模浒苔绿潮提供了理论依据。
浒苔绿潮迁移海区温度、盐度、营养盐等环境要素变化显著, 盐度略有升高且变化不显著。江苏近岸海域主要受到苏北沿岸流、黄海冷水团、黄海暖流和长江冲淡水等海流的影响, 苏北近岸海域营养盐处于较高浓度(Wei et al, 2016)。因此, 苏北近岸海域营养盐高值区与低盐区相对应, 营养盐浓度整体呈现为南高北低, 近岸高, 远海低的趋势, 盐度整体呈现南低北高的趋势。王俊杰等(2018)测量了苏北海域海水表层营养盐浓度, 发现6—8月DIN浓度上升至28 µmol/L以上, PO43--P浓度上升至0.6 µmol/L以上。在夏季, 海水表层受热增温, 随着纬度的升高, 温度和光照强度逐渐降低, 白雨等(2019)对2008—2017年绿潮密集区域海水表层温度和光照强度分析也得出了类似的结果。
光合作用是植物能量的来源之一, 也是植物重要的生理过程。叶绿素荧光可以反映浒苔藻体的生理状态以及对环境的适应能力。本文发现, 浒苔在向北漂移过程中, 浒苔的光合活性略有上升, 随后显著下降。光合作用与DIN呈极显著正相关, 与PO43--P呈显著正相关, 高浓度的DIN对浒苔光合活性的影响高于PO43--P。浒苔生长过程中会消耗大量的营养盐, 相比磷, 浒苔对氮的需求更高(吴晓文等, 2010)。环境中氮浓度的变化对浒苔有较大的影响, 而磷对浒苔的影响不如氮明显。在缺乏磷的条件下, 浒苔光合作用受到的影响较小(Villares et al, 2004)。温度可以影响浒苔的光合活性。过高或过低的温度均不利于正常的光合活性(张涛等, 2017)。本文发现, 温度对浒苔藻体光合活性的影响呈极显著正相关, 表明浒苔向北迁移, 纬度升高, 温度降低, 与光合作用相关的酶活性可能下降, 抑制了浒苔的光合活性。光照强度是影响浒苔体内叶绿素a、b含量的重要因素, 较弱的光照显著抑制浒苔藻体的生长和酶反应速率(丛珊珊, 2011)。随着纬度的升高, 光照强度整体呈现下降趋势, 光合活性降低浒苔藻体捕获的光能下降。盐度与浒苔藻体的Y(Ⅱ)值呈显著负相关, 表明在漂浮过程中, 浒苔光合作用对盐度的变化也较为敏感。
硝酸还原酶是硝态氮转化为可利用氨氮的限速酶, 对氮同化起到主要调控。而硝酸还原酶容易受到外在因素影响。NRA直接影响植物对环境中硝态氮的利用, 影响植物的生长。表 2的相关性分析结果表明, DIN、温度、PO43--P、盐度和光照对NRA按影响大小排列的顺序为DIN > 温度 > PO43--P > 盐度 > 光照。硝酸还原酶是一种底物诱导酶, 其活性受到环境中的氮、磷浓度尤其是硝态氮的影响。NRA会随着氮磷比或氮浓度的升高而增大(王金花, 2008)。环境中温度和光照强度也可以影响NRA的大小。硝酸还原酶是一种蛋白质, 对温度的变化较为敏感, 温度过高或过低均不利于硝酸还原酶保持较高活性(陈月红, 2015)。光照强度可以通过光合磷酸化调控ATP, 影响浒苔营养盐的吸收, 从而影响NRA。
生殖分配是植物生活史的核心组成部分, 不同的生殖分配通常反映了植物在自然选择下的不同策略(Reekie et al, 2005)。生殖分配率的变化对浒苔适应环境变化起着关键作用。在本实验中, 生殖分配率结果表明在向北漂浮过程中, 浒苔藻体逐渐形成生殖细胞, 并释放孢子或配子, 为生物量的快速积累提供可能。DIN对浒苔的生殖分配率的影响极显著, 温度与生殖分配率呈显著负相关, 而PO43--P、盐度和光照强度对浒苔生殖分配率的影响未达到显著水平。温度可以影响浒苔孢子/配子的放散和萌发。浒苔孢子/配子放散的最适温度为25℃, 浒苔孢子/配子萌发的最适温度为20℃ (韩红宾等, 2015)。浒苔在向北迁移过程中, 环境温度逐渐降低, 接近藻体孢子/配子萌发的最适温度, 促进了生殖分配率的升高。浒苔在盐度为10的条件下对配子的放散有极显著影响, 在40盐度的条件下对孢子的放散有显著影响(王浩东等, 2012)。盐度对浒苔藻体生殖分配率无显著的影响, 本文推测, 在向北漂浮迁移过程中, 盐度通过影响浒苔光合作用间接影响藻体生殖细胞的形成, 且浒苔主要放散的为孢子。
浒苔绿潮迁移过程中, 相比温度、盐度、光照强度和PO43--P含量等环境要素, 环境中DIN含量的变化显著影响浒苔藻体的生物学特征。在SH海域(断面A、B和C) Fv/Fm值显著高于NH海域(断面D、E和F)浒苔藻体的Fv/Fm值, 表明SH海域浒苔具有更强的光合作用能力, 而NH海域浒苔处于胁迫状态。DIN是海藻最易吸收的营养盐, 也是海水中的主要氮源, 其主要组成部分为硝态氮。浒苔对硝态氮和PO43--P的吸收是主动吸收, 需要较高的光合作用提供能量吸收和储存营养盐。SH海域营养盐浓度显著高于NH海域, 浒苔Fv/Fm和Y(Ⅱ)与NRA呈极显著正相关, 浒苔光合作用产生能量用于吸收环境中的硝态氮并通过促进硝酸还原酶还原为亚硝酸盐, 最终还原为氨氮被藻体利用, 而在NH海域浒苔藻体的NRA显著降低, 可能是受到环境中DIN浓度下降的影响。SH海域生殖分配率显著低于NH海域浒苔藻体的生殖分配率, 表明浒苔光合作用所产生的能量从吸收营养盐转变为生殖细胞的形成, 降低了吸收营养盐的能力。
4 结论浒苔绿潮向北迁移过程中, 海水表层温度、DIN和PO43--P浓度显著降低, 浒苔藻体光合活性和NRA逐渐下降, 而生殖分配率逐渐上升。环境要素的变化影响浒苔生物学特征。浒苔藻体光合活性与DIN、温度和光照强度呈极显著正相关, 与PO43--P呈显著正相关, 与盐度呈显著负相关; 藻体NRA与DIN和温度呈极显著正相关, 与光照强度和PO43--P呈显著正相关, 与盐度呈显著负相关; 生殖分配率与DIN呈极显著负相关, 与温度呈显著负相关。浒苔漂浮过程中, 浒苔藻体光合活性、营养盐吸收等生物学特征对环境中DIN的变化响应最敏感, 因此DIN是驱动浒苔生理特征改变的主要因子。其他环境要素对浒苔藻体的影响程度大小依次为温度、PO43--P、盐度和光照强度。绿潮漂浮迁移过程中环境要素的变化直接影响了浒苔的生长与生殖。
丁兰平, 栾日孝. 2009. 浒苔(Enteromorpha prolifera)的分类鉴定、生境习性及分布. 海洋与湖沼, 40(1): 68-71 DOI:10.3321/j.issn:0029-814X.2009.01.011 |
马洪瑞, 陈聚法, 崔毅, 等. 2010. 灌河和射阳河水质状况分析及主要污染物入海量估算. 渔业科学进展, 31(3): 92-99 DOI:10.3969/j.issn.1000-7075.2010.03.013 |
王金花, 2008.氮磷营养盐对东海典型浮游植物生长及硝酸还原酶活性的影响.青岛: 中国海洋大学硕士学位论文, 43
|
王俊杰, 于志刚, 韦钦胜, 等. 2018. 2017年春、夏季南黄海西部营养盐的分布特征及其与浒苔暴发的关系. 海洋与湖沼, 49(5): 1045-1053 |
王浩东, 姚雪, 池姗, 等. 2012. 中国南黄海浒苔种群世代结构与生殖条件分析. 中国海洋大学学报, 42(11): 46-53 |
韦钦胜, 王保栋. 2012. 南黄海冷水团海域及西部近岸区表层沉积物中碳、氮、磷的分布特征及其生态学指示意义. 环境科学学报, 32(7): 1697-1707 |
孔凡洲, 姜鹏, 魏传杰, 等. 2018. 2017年春、夏季黄海35°N共发的绿潮、金潮和赤潮. 海洋与湖沼, 49(5): 1021-1030 |
白雨, 赵亮, 刘境舟. 2019. 生态因子在黄海绿潮生消过程中的作用. 海洋学报, 41(8): 97-105 |
丛珊珊, 2011.环境因子对浒苔(Enteromorpha prolifera)生长、生存状态和营养吸收影响的实验研究.青岛: 中国海洋大学硕士学位论文, 6
|
刘榆莎, 王东, 徐晓婷, 等. 2016. 温度和盐度对浒苔生长和光合生理特性的影响. 水生生物学报, 40(6): 1227-1233 |
吴洪喜, 徐爱光, 吴美宁. 2000. 浒苔实验生态的初步研究. 浙江海洋学院学报(自然科学版), 19(3): 230-234 DOI:10.3969/j.issn.1008-830X.2000.03.007 |
吴晓文, 李瑞香, 徐宗军, 等. 2010. 营养盐对浒苔生长影响的围隔生态实验. 海洋科学进展, 28(4): 538-544 DOI:10.3969/j.issn.1671-6647.2010.04.015 |
张涛, 陶菊红, 朱建一, 等. 2017. 温度对南黄海定生绿藻光合生理影响的研究. 常熟理工学院学报, 31(4): 95-99 DOI:10.3969/j.issn.1008-2794.2017.04.022 |
张晓雯, 毛玉泽, 庄志猛, 等. 2008. 黄海绿潮浒苔的形态学观察及分子鉴定. 中国水产科学, 15(5): 822-829 DOI:10.3321/j.issn:1005-8737.2008.05.015 |
陈月红, 2015.温度、光照对浒苔生长及其硝酸还原酶活力的影响.青岛: 中国海洋大学硕士学位论文, 1
|
郑阵兵, 高山, 王广策. 2018. 2017年绿潮浒苔(Ulva prolifera)生理特征及孢子囊形成情况分析. 海洋与湖沼, 49(5): 999-1005 |
高嵩, 石晓勇, 王婷. 2012. 浒苔绿潮与苏北近岸海域营养盐浓度的关系研究. 环境科学, 33(7): 2204-2209 |
韩红宾, 韦章良, 霍元子, 等. 2015. 温度与光照强度对浒苔孢子/配子放散和萌发的影响. 海洋渔业, 37(6): 517-524 DOI:10.3969/j.issn.1004-2490.2015.06.006 |
Anderson D M, Glibert P M, Burkholder J M, 2002. Harmful algal blooms and eutrophication:nutrient sources, composition, and consequences. Estuaries, 25(4): 704-726 DOI:10.1007/BF02804901 |
Fletcher R L, 1996. The occurrence of "green tides"-a review. In: Schramm M, Nienhuis P H eds. Marine Benthic Vegetation. Berlin Heidelberg: Springer
|
Gao S, Chen X Y, Yi Q Q et al, 2010. A Strategy for the proliferation of Ulva prolifera, main causative species of green tides, with formation of sporangia by fragmentation. PLoS One, 5(1): e8571 DOI:10.1371/journal.pone.0008571 |
Gao S, Ma J H, Satoshi S et al, 2013. Molecular identification of dominant green tide algae in Yellow Sea China 2010, and their morphological characteristics. Ecological Science, 32(6): 703-710 |
Hu C M, Li D Q, Chen C S et al, 2010. On the recurrent Ulva prolifera blooms in the Yellow Sea and East China Sea. Journal of Geophysical Research:Oceans, 115(5): C05017 |
Liu D Y, Keesing J K, He P M et al, 2013. The world's largest macroalgal bloom in the Yellow Sea, China:formation and implications. Estuarine, Coastal and Shelf Science, 129: 2-10 DOI:10.1016/j.ecss.2013.05.021 |
Liu X Q, Wang Z L, Zhang X L, 2016. A review of the green tides in the Yellow Sea, China. Marine Environmental Research, 119: 189-196 DOI:10.1016/j.marenvres.2016.06.004 |
Reekie E G, Bazzaz F A, 2005. Reproductive Allocation in Plants. Amsterdam; Boston: Elsevier Academic Press, 1-247
|
Sun S, Wang F, Li C L et al, 2008. Emerging challenges:massive green algae blooms in the Yellow Sea. Nature Precedings |
Thimijan R W, Heins R D, 1983. Photometric, radiometric, and quantum light units of measure:a review of procedures for interconversion. Horticultural Science, 18(6): 818-822 |
Villares R, Carballeira A, 2004. Nutrient limitation in macroalgae (Ulva and Enteromorpha) from the Rías Baixas (NW Spain). Marine Ecology, 25(3): 225-243 DOI:10.1111/j.1439-0485.2004.00027.x |
Wang Y, Wang Y, Zhu L et al, 2012. Comparative studies on the ecophysiological differences of two green tide macroalgae under controlled laboratory conditions. PLoS One, 7(8): e38245 DOI:10.1371/journal.pone.0038245 |
Wang Z L, Xiao J, Fan S L et al, 2015. Who made the world's largest green tide in China?-an integrated study on the initiation and early development of the green tide in Yellow Sea. Limnology and Oceanography, 60(4): 1105-1117 DOI:10.1002/lno.10083 |
Wang M, Zhang H X, Tang X X, 2019. Biotic and abiotic conditions can change the reproductive allocation of Zostera marina inhabiting the Coastal Areas of North China. Journal of Ocean University of China, 18(2): 528-536 DOI:10.1007/s11802-019-3796-7 |
Wei Q S, Yu Z G, Wang B D et al, 2016. Coupling of the spatial-temporal distributions of nutrients and physical conditions in the southern Yellow Sea. Journal of Marine Systems, 156: 30-45 DOI:10.1016/j.jmarsys.2015.12.001 |
Young E B, Lavery P S, van Elven B et al, 2005. Nitrate reductase activity in macroalgae and its vertical distribution in macroalgal epiphytes of seagrasses. Marine Ecology Progress Series, 288: 103-114 DOI:10.3354/meps288103 |
 2021, Vol. 52
2021, Vol. 52


